一致性评价流程图-国产药品
仿制药质量一致性评价工作流程

Honeywell (Italy)
Sicor (global)
APS Berk (UK)
Novopharm (Canada)
Bayer Classics (France)
Bentley (Spain)
CoGenesys (technology)
1,500 1,000
500
Biocraft (US)
BioPharmaceuticals
仿制药质量一致性评价研讨会,2016.03.25-26,济南
疗效一致
(TherapeuticEquivalent)
辅料、释药原理、工艺等不同
BioPharmaceuticals
仿制药质量一致性评价研讨会,2016.03.25-26,济南
仿制药研发
仿制药研发
Art Science
仿制药制剂开发国际化趋势
“十二五”期间,全球将有130多个专利药物陆续专利到 期,总销售额在1000亿美元以上……“十二五”期间,获 得新药证书的原创药物达到30个以上,开发30个以上通用 名药物新品种,完成200个以上医药大品种的改造升 级……80家以上制剂企业通过欧美日等发达国家或 WHO 的GMP认证……制剂出口比重达到10%以上,200个以上 通用名药物制剂在欧美日等发达国家注册和销售。
the func&on of each excipient?
Do any excipients exceed IIG limits (IID) in the context of maximum daily
· FDA 辅料数据库 Check IID(FDA Inactive Ingredients Database) · 药物辅料相容性研究 DSC, TAM, TGA, high temp/humidity
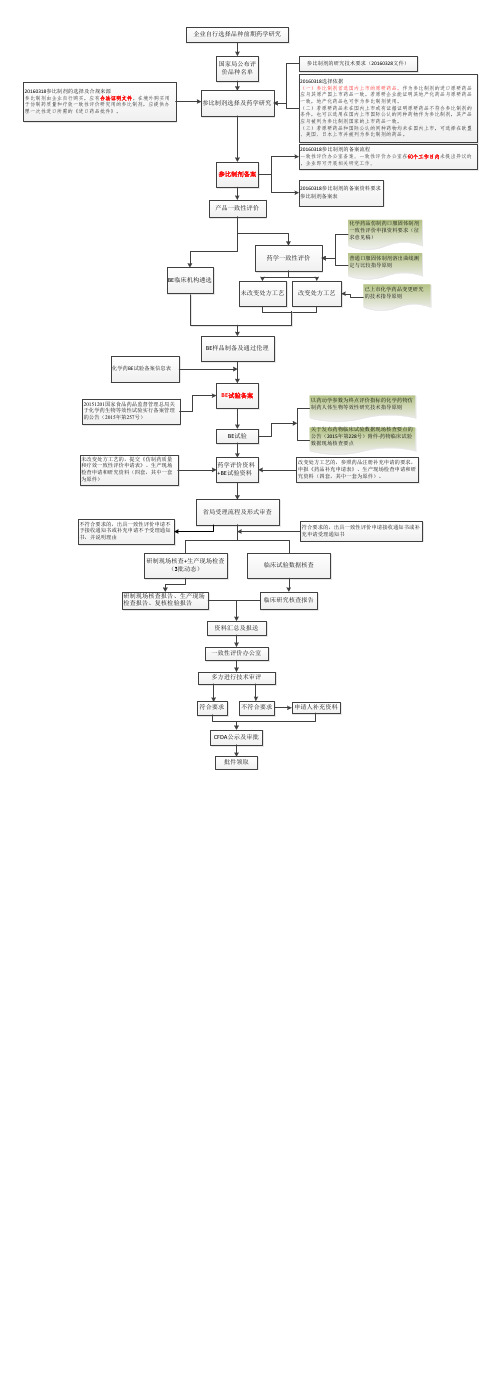
一致性评价申报与审批

申报与审批
在仿制药生产企业完成生物等效性试验后,一致性评价进入了第三步也是最后一个步骤,即向有关部门进行申报并最终取得一致性评价办公室的审批。
虽然最终的审批部门均为一致性评价办公室,但是在材料递交部门、审查、复核检验等方面却因仿制药的不同类型而有所不同:
”
国产仿制药品企业将一致性评价材料递交至省级食药监局,省级食药监局组织研制现场核查和生产现场检查,并由省级食药监局现场抽取连续生产的三批样品送指定的药品检验机构进行复核检验。
进口仿制药品企业将一致性评价材料递交至食药监总局行政服务受理和投诉举报中心(简称“受理和举报中心”),受理和举报中心仅进行形式审查,并通知企业送三批样品至指定的药品检验机构进行复核检验。
而对于在欧盟、美国或日本获准上市并在中国境内用同一条生产线生产上市的药品,企业将材料递交至受理和举报,但是由食药监总局药品审评中心对原境内、外上市申报资料进行审核,由食药监总局食品药品审核查验中心对生产现场进行检查。
食药监总局已经发布了承担首批一致性评价品种复核检验机构的名单,但是鉴于第一步和第二步实施的艰难与不确定,我们理解目前几乎还没有企业走到一致性评价的第三步。
虽然制度依然不完善、推行之时遇到的问题依然很多、2018年底完成289种仿制药品一致性评价的目标目前看来依然艰难,但是我们认为,仿制药一致性评价是必然的趋势,正如食药监总局的一位官员在接受采访时提到的:“我们进行仿制药一致性评价,是在补历史的课”。
一致性评价很可能会使得国内仿制药品市场重新洗牌,同时原研药企业也难以继续坐收因原来仿制药质量落差大而产生的溢价红利,这对于各类药品企业来说,既是机遇也是挑战。
为了把握机遇、迎接挑战,药企应该早作准备,未雨绸缪。
一致性评价流程图
未改变处方工艺的,提交《仿制药质量 和疗效一致性评价申请表》、生产现场 检查申请和研究资料(四套,其中一套 为原件)
药学评价资料 +BE试验资料
省局受理流程及形式审查
不符合要求的,出具一致性评价申请不 予接收通知书或补充申请不予受理通知 书,并说明理由 符合要求的,出具一致性评价申请接收通知书或补 充申请受理通知书
研制现场核查+生产现场检查 (3批动态)
临床试验数据核查
研制现场核查报告、生产现场 检查报告、复核检验报告
临床研究核查报告
资料汇总及报送
一致性评价办公室
多方进行技术审评
符合要求
不符合要求
申请人补充资料
CFDA公示及审批
批件领取
BE样品制备及通过伦理
化学药BE试验备案信息表
BE试验备案
20151201国家食品药品监督管理总局关 于化学药生物等效性试验实行备案管理 的公告(2015年第257号)
以药动学参数为终点评价指标的化学药物仿 制药人体生物等效性研究技术指导原则
BE试验
关于发布药物临床试验数据现场核查要点的 公告(2015年第228号)附件-药物临床试验 数据现场核查要点 改变处方工艺的,参照药品注册补充申请的要求, 申报《药品补充申请表》、生产现场检查申请和研 究资料(四套,其中一套为原件)。
参比制剂选择及药学研究
参比制剂备案
20160318参比制剂的备案资料要求 参比制剂备案表
产品一致性评价
化学药品仿制药口服固体制剂 一致性评价申报资料要求(征 求意见稿)
药学一致性评价
普通口服固体制剂溶出曲线测 定与比较指导原则
BE临床机构遴选 未改变处方工艺 改变处方工艺
1.仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)

附件1仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)一、适用范围国产仿制药,进口仿制药。
二、资料接收/受理部门由国家食品药品监督管理总局行政事项受理服务和投诉举报中心(简称总局受理和举报中心)接收/受理。
三、申报资料基本要求(一)申请表的整理1.种类与份数要求药品补充申请表三份,一份为原件。
2.依据《关于启用新版药品注册申请表报盘程序的公告》(国家食品药品监督管理总局公告2016年第182号)要求,申请表的填报须采用国家食品药品监督管理总局统一发布的填报软件,提交由新版《药品注册申请表报盘程序》生成的电子及纸质文件。
(确认所用版本为最新版〔以最新发布的公告为准〕,所生成的电子文件的格式应为RVT\MRT文件。
各页的数据核对码必须一致,并须与提交的电子申请表一致,所有页码应加盖各申请人或注册代理机构骑缝章。
)3.填写应当准确、完整、规范,不得手写或涂改,并应符合填表说明的要求。
(二)申报资料的整理1.申报资料一式三套,其中一套为原件,复印件应与原件内容保持完全一致。
每套装入相应的申请表。
2.每套资料装入独立的档案袋,档案袋使用足够强度牛皮纸,以免破损。
档案袋封面应注明:申请分类、药品名称、本袋所属第X套第X袋每套共X袋、原件/复印件、联系人、联系电话、手机、联系地址、邮政编码、申请人机构名称,并由申请人或注册代理机构逐袋加盖公章。
3.申报资料首页应为申报资料项目目录,目录中申报资料项目编号及项目名称均应参照《关于仿制药质量和疗效一致性评价工作有关事项的公告》(国家食品药品监督管理总局公告2017年第100号,以下简称2017年第100号公告)等有关公告通告中规定的要求提供。
4.套内各项申报资料应设独立封面,标明药品名称、资料项目编号、资料项目名称、研究单位及人员有关项目(如适用)、各申请机构名称(注册代理机构如适用)等。
右上角注明资料项目编号,并由申请机构或注册代理机构逐项加盖公章。
5.资料和文件统一使用A4规格纸张。
化学仿制药注射剂一致性评价启动核查检验PPT课件2020版

启动核查的基本考虑
考量因素
临床
药学
合规因素
1、新机构 或三年内无检查记 1、药品生产企业或研制机构三年内因真实
录的机构
性问题、重大不合规问题导致审评or注册核
2、三年内因真实性问题、重 查or监督检查不通过的
大GCP不合规问题导致审评 2、既往注册核查、监督检查发现真实性问
核查低风险等级
启动核查的基本考虑
合规风险升级
既往存在重 大不合规问 题,后续注 册核查仍存 在相关问题
连续两次注 册核查通过, 未发现重大 不合规问题
合规风险降级
启动核查的基本考虑
不启动情形
➢(一)对于仿制药上市许可申请,可不启动药理毒理学研究现场核查; ➢(二)对于无新增药学研究的注册申请,可不启动药学研制现场和生产
案例3
• 某企业申报品种为仿制药注射剂一致性评价品种,经查该企业3 年内多批次产品国家抽检不合格, 1、不合格产品为口服固体制剂,不合格项目为溶出度 2、不合格产品为注射剂,不合格项目为无菌
启动核查的基本考虑
品种风险 因素
C合o规n风te险nt T因it素le
核查高风险等级
核
核查中风险等级
查
比
例
启动核查的基本考虑
核查关注点
真实性
一致性
数据可靠 研制过程
性
合规性
启动检验的基本考虑
• 目的
评估申报药品标准的科学性、可行性、合理性
为上市后抽检作准备——实验室间重现性
评估现有工艺是否可以生产出合格的产品
• 分类
标准复核 样品检验 有因检验
• 法规要求
是
与国家标准完全一致 样品检验
药物一致性评价ppt课件

+ 临床基地参与一致性评价态度冷淡
22
仿制药替代原研药,目前时机尚未成熟我国仿制品质量与原研药尚存 差距
+ 生物等效与临床等效存在鸿沟 + 制备工艺、构型、辅料甚至包装储存等因素均可能影响药物疗效 + 仿制药疗效与安全性尚缺乏有力循证证据验证 + 未来随着多方面监管措施逐步完善,仿制药质量与安全性有所提升后,
20
2018年底前须完成仿制药一致性评价品种涉及诺华产品包括
+ 2018年底前须完成仿制药一致性评价品种目 录
品名+ (截至2016剂年型 3月5日) 规格
卡马西平
片剂
0.1 (我们0.2)
缬沙坦胶囊
胶囊
80MG
环孢素胶囊
胶囊(我们软胶囊) 已批准所有规格
21
+ BE试验资源
+ CFDA公告《关于药物临床试验数据自查 情况的公告》(2015年第172号)涉及承接 人体生物等效性试验和一期临床试验的82 家机构,仅53家临床试验机构表示可以承 担BE/一期临床试验。
+ 在上述定义的基础上,以药动学参数为终点评价指标的生物等效性研 究又可表述为:通过测定可获得的生物基质(如血液、血浆、血清) 中的药物浓度,取得药代动力学参数作为终点指标,藉此反映药物释 放并被吸收进入循环系统的速度和程度。通常采用药代动力学终点指 标Cmax和AUC进行评价。
+ 如果血液、血浆、血清等生物基质中的目标物质难以测定,也可通过 测定尿液中的药物浓度进行生物等效性研究。
12
研究对象
样本数 实验时间 优缺点
BE 健康者
18-24例 短期,少则几天 快速,片面
药物一致性评价的内容包括哪些,开展一致性评价研究有啥流程

药物一致性评价的内容包括哪些,开展一致性评价研究有啥流程药物一致性评价,即药品一致性研究,就是仿制药必须和原研药“管理一致性、中间过程一致性、质量标准一致性等全过程一致”的高标准要求。
《国家药品安全“十二五”规划》(下称“《规划》”)明确要求的未通过药品质量一致性评价的仿制药将不予再注册和注销其药品批准证明文件。
为啥要进行药物一致性评价仿制药和原研药、名牌药和小厂药、国产药和进口药,一样的药品,杂质的含量可能不一样,生物利用度不一样,副作用有差别,临床上的安全性和有效性自然就不同。
所以必须进行药物一致性研究,才能提高药品的安全性和有效性,保障人民用药安全、有效。
仿制药一致性评价的研究内容主要包括哪些在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。
包括处方、质量标准、晶型、粒度和杂质等主要药学指标比较研究,以及固体制剂溶出曲线的比较研究,以提高体内生物等效性试验的成功率,并为将药品特征溶出曲线列入相应的质量标准提供依据。
对符合《人体生物等效性试验豁免指导原则》(食品药品监管总局通告2016年第87号)的品种,由药品生产企业申报,一致性评价办公室组织审核后公布,允许该药品生产企业采取体外溶出试验的方法进行一致性评价。
对于开展生物等效性试验的品种,应根据《关于化学药生物等效性试验实行备案管理的公告》(食品药品监管总局公告2015年第257号)规定的程序备案,并按照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(食品药品监管总局通告2016年第61号)等的有关要求进行试验研究。
对无参比制剂需开展临床有效性试验的品种,区分两种情况处理:(1)如属于未改变处方、工艺的,应按一致性评价办公室的要求进行备案,并按照有关药品临床试验指导原则的相应要求开展试验研究;(2)如属于改变已批准处方、工艺的,按照《药品注册管理办法》补充申请有关要求开展试验研究。
一致性评价流程图 国产药品

是否一致 是
对比多条溶出曲线
否
变更原料来源或精制,调整处 方等
研 究 阶 段
h 是否一致
否
处方调整、二次开发
alt 是
elhe lth 是否需要BE W a 是
e 否
友康 Welh health 生产企业申报 维世 维世友康 友康 Wel 一致性评价办公室组织审核公布
联络临床基地、定BE方案、过伦理 否
BE备案(开展前30日前备案)
开展BE(必要时预BE)
世
BE是否等效
维
是
资料整理
否
省局形审,是否受理
省局临床研究核查
是
省局:研制现场核查、生产现场核 查,抽取三批样品送检
一致办指定药检所复检
形式审查意见、研制现场核查报告 、生产现场检查报告、境内临床研 究核查报告、复核检验结果及申报
资料,省局汇总初审
一致性评价流程图-有参比制剂的国产产品
筛选品种
准
备 阶
调研原研产品
段
总体规划,时间,费用,代理 参比制剂备案(60个工作日)
参比制剂选择顺序: 进口原研(国产原研要原研证明)>国内上市在 国外有参比制剂资质>国外有参比制剂资质
采购参比制剂,申请《进口药品批 件》,通关
处方、标准、晶型、粒度和杂质等
药学研究
审
评
阶
是
段
处方工艺是否变更否源自药品审评中心审评核查中心对临床研究 数据进行抽查
发现问题,通知核查 中心进行有因核查
必要时 申请人补充
一致办技术评审, 专家委员会审议
国家局审核
获得公告、《补充申请批件》 或不予批准
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药学研究
是否一致 是 对比多条溶出曲线
否
变更原料来源或精制,调整处 方等
lh
We
是否需要BE 否
ea lh We lh ea
否 否
是
lt lt
否 一致办指定药检所复检
h
BE是否等效
研 究 阶 段
是
ea
lt
是否一致
h
否
处方调整、二次开发
康
联络临床基地、定BE方案、过伦理
生产企业申报
世
友
康
维
ቤተ መጻሕፍቲ ባይዱ
BE备案(开展前30日前备案)
获得公告、《补充申请批件》 或不予批准
友
康
开展BE(必要时预BE)
是
We
h
世
一致性评价办公室组织审核公布
友
维
维
世
资料整理
省局形审,是否受理
是 省局临床研究核查 省局:研制现场核查、生产现场核 查,抽取三批样品送检
形式审查意见、研制现场核查报告 、生产现场检查报告、境内临床研 究核查报告、复核检验结果及申报 资料,省局汇总初审 审 评 阶 段
是
处方工艺是否变更
核查中心对临床研究 数据进行抽查 药品审评中心审评 发现问题,通知核查 中心进行有因核查 必要时 申请人补充 国家局审核 一致办技术评审, 专家委员会审议
一致性评价流程图-有参比制剂的国产产品
筛选品种 准 备 阶 段
调研原研产品
总体规划,时间,费用,代理
参比制剂选择顺序: 进口原研(国产原研要原研证明)>国内上市在 国外有参比制剂资质>国外有参比制剂资质
参比制剂备案(60个工作日)
采购参比制剂,申请《进口药品批 件》,通关
处方、标准、晶型、粒度和杂质等
