无机化学:电解质溶液
无机化学第五章 电解质溶液(学生内容)
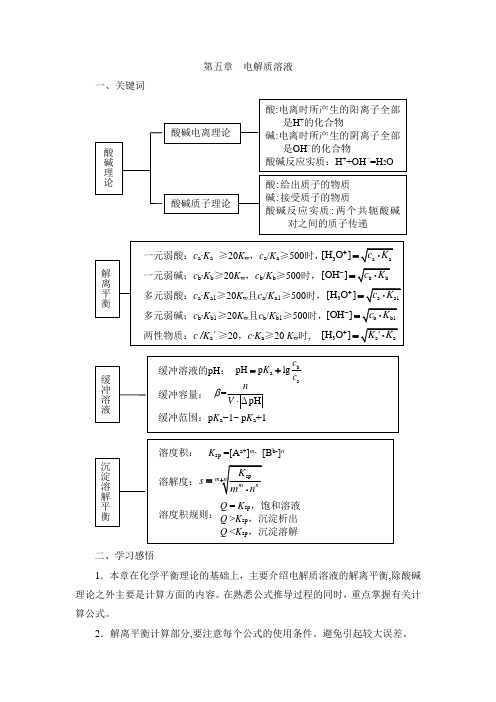
第五章电解质溶液一、关键词二、学习感悟1.本章在化学平衡理论的基础上,主要介绍电解质溶液的解离平衡,除酸碱理论之外主要是计算方面的内容。
在熟悉公式推导过程的同时,重点掌握有关计算公式。
2.解离平衡计算部分,要注意每个公式的使用条件。
避免引起较大误差。
3.本章的重点是弱电解质溶液和缓冲溶液的pH计算及难溶电解质溶度积规则的应用。
三、难点辅导1. 为什么任何物质的水溶液中都含有H3O+和OH−,而且在常温时,[H3O+]∙[OH−]=K w=1.0×10−14?无论是酸性还是碱性的物质,一旦与水形成溶液后,由于水发生的质子自递平衡中,会产生H3O+和OH−,所以任何物质的水溶液都含有H3O+和OH−。
在水溶液中,按照酸碱质子理论,酸会给出质子,碱会接受质子,这样必定会引起水的解离平衡发生移动,但水的解离平衡常数不会因平衡的移动发生改变,其解离平衡常数只与温度有关,在常温时,[H3O+]∙[OH−]=K w=1.0×10−14。
对酸性溶液来说,H3O+主要来自酸性物质(水的极少量解离可忽略),OH−则来自水的少量解离;对碱性溶液来说,OH−主要来自碱性物质(水的极少量解离可忽略),H3O+则来自水的少量解离。
2. 酸碱的强弱由哪些因素决定?酸碱的强弱首先取决于酸碱本身给出和接受质子的能力,其次取决于溶剂接受和给出质子的能力。
同一种物质在不同溶剂中的酸碱性不同,如HCl 在水中是强酸,在冰醋酸中是弱酸,这是因为水接受质子的能力比冰醋酸强;NH3在水中是弱碱,在冰醋酸中是强碱,冰醋酸给予质子的能力比水强的缘故。
所以在比较不同酸碱的强弱时,应在同一溶剂中进行,一般以水为溶剂比较其酸碱性的强弱,即比较在水溶液中的离解平衡常数K a或K b。
3. 缓冲溶液通常由一对共轭酸碱组成,那么HCl-NaCl这对共轭酸碱可组成缓冲溶液吗?为什么?缓冲溶液是由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分。
无机化学习题解答

《无机化学》习题解答第一章 溶液和胶体1. 求0.01㎏NaOH 、0.10㎏(2Ca 2+)、0.10㎏(21Na 2CO 3)的物质的量。
解:M (NaOH )= 40g·mol -1 M (2Ca 2+)= 80g·mol -1 M (21Na 2CO 3)= 53g·mol -1 它们的物质的量分别为()(NaOH)0.011000(NaOH) 0.25mol (NaOH)40m n M ⨯===()2+2+2+(2Ca )0.101000(2Ca ) 1.25mol (2Ca )80m n M ⨯=== ()2323231( Na CO )10.1010002( Na CO ) 1.89mol 1253( Na CO )2m n M ⨯===2. 将质量均为5.0g 的NaOH 和CaCl 2分别溶于水,配成500mL 溶液,试求两溶液的ρ(NaOH)、c (NaOH)、ρ(21CaCl 2)和c (21CaCl 2)。
解:M (NaOH )= 40g·mol -1 M (21CaCl 2)= 55.5g·mol -1()-1(NaOH) 5.0(NaOH)10.0g L 0.5m V ρ===⋅()-1(NaOH)10.0(NaOH)0.25mol L (NaOH)40c M ρ===⋅ ()2-121(CaCl )1 5.02(CaCl )10.0g L 20.5m V ρ===⋅ ()2-1221(CaCl )110.02(CaCl )0.18mol L 1255.5(CaCl )2c M ρ===⋅3. 溶液中KI 与KMnO 4反应,假如最终有0.508gI 2析出,以(KI +51KMnO 4)为基本单元,所消耗的反应物的物质的量是多少?解:题中的反应方程式为10KI + 2KMnO 4 +8H 2SO 4 = 5I 2 + 2MnSO 4 + 6K 2SO 4 + 8H 2O将上述反应方程式按题意变换为KI +51KMnO 4 +54H 2SO 4 =21I 2 +51MnSO 4 +53K 2SO 4 +54H 2O1mol 21moln (KI +51KMnO 4)mol 0.508254mol则所消耗的反应物的物质的量为n (KI +51KMnO 4)= 2×0.508254= 0.004(mol )4. 静脉注射用KCl 溶液的极限质量浓度为2.7g·L -1,如果在250 mL 葡萄糖溶液中加入1安瓿(10 mL)100 g·L -1KCl 溶液,所得混合溶液中KCl 的质量浓度是否超过了极限值?解:混合溶液中KCl 的质量浓度()-1(KCl)1000.010(KCl) 3.85g L 0.2500.010m V ρ⨯===⋅+ 所得混合溶液中KCl 的质量浓度超过了极限值。
电化学和四大化学的关系

电化学和四大化学的关系
电化学与四大化学(无机化学、有机化学、物理化学、分析化学)密切相关,它们之间有着紧密的关系。
在无机化学中,电解质溶液是非常重要的研究对象。
电化学方法如电位滴定法、电化学研究溶液中的反应机理等,都是无机化学中常用的实验手段。
有机化学中电化学也有着很广泛的应用,如电化学还原脱氧、电化学氧化反应等。
这些反应不仅可以合成高效的催化剂,而且可以制备出一些新型有机分子。
在物理化学中,电化学更是不可或缺的一部分。
电化学分析、电化学动力学等研究都是基于物理化学的理论基础。
分析化学中电化学也有着广泛的应用,如电化学分析、电解质计算等。
这些方法可以用于分析溶液中的化学成分,提高分析精度。
因此,电化学与四大化学的关系密切,它们相互促进、相互关联,推动了化学研究的不断发展。
- 1 -。
第1章 电解质溶液09-1

8
氯碱工业是仅次于硫酸和化肥的重要无机化学产业,已经有百 年的历史,但如何节约电能、热能、原料等措施都能对国民经 济产生巨大的推动作用。 人们在长期实践的基础上改善了许多电解工艺,比如1960 年出现的在Ti电极上镀Pt、Ir、RuO2代替石墨的电解槽,Ti的 重量只有铁的56%,强度超过铁,地壳总重量占0.44%, 储量充足,表面可形成TiO2耐腐蚀性好,表面涂贵金属的目的 是增加导电性,这种电极的优点是:
19
1600年,英国物理学家吉伯发现,不仅琥珀和煤玉 摩擦后能吸引轻小物体,而且相当多的物质经摩擦 后也都具有吸引轻小物体的性质,他注意到这些物 质经摩擦后并不具备磁石那种指南北的性质。为了 表明与磁性的不同,他采用琥珀的希腊字母拼音把 这种性质称为“电的”。吉伯在实验过程中制作了 第一只验电器,这是一根中心固定可转动的金属细 棒,当与摩擦过的琥珀靠近时,金属细棒可转动指 向琥珀。
7.贾梦秋,应用电化学,高等教育出版社,2004.
8.腾岛昭,电化学测定方法,北大出版社,1995.
3
绪言
1.从氯碱工业说起: 氯碱工业是大家比较熟悉的和重要的电化学工业,它 是以食盐为原料,将其水溶液进行电解,这样同时支取氯 气、氢气和烧碱(NaOH)。 氯气可以和氢气合成盐酸和制造漂白粉外,又是很多有机 产品的原料,如六六六.滴滴涕,聚氯乙烯(PVC)、有机 溶剂和中间产品的原料。 烧碱则大量用于化学工业.造纸.纺织、肥皂、冶金和石 油部门。
1833年法拉第根据多次实验结果归纳出了著名的法拉第定律, 为电化学的定量研究和电解工业奠定了基础.
1870年人们创造了发电机,电解才被广泛地应用于工业中
22
金属表面的精饰 电化学新能源的开发和利用
第八章 电解质溶液解答

第八章电解质溶液上一章下一章返回1.柯尔拉乌希经验公式适用条件和范围是什么?柯尔拉乌希离子独立运动定律的重要性何在?答:柯尔拉乌希经验公式:,适用于强电解质水溶液,浓度低于0.01mol·dm-3的稀溶液。
根据离子独立移动定律,可以从相关的强电解质的Λ∞来计算弱电解质的Λ∞。
或由离子电导数值计算出电解质的无限稀释时摩尔电导。
2.电导率与摩尔电导概念有何不同? 它们各与哪些因素有关?答:电导率κ是:两极面积各为1m2,并相距1m时,其间溶液所呈的电导;而摩尔电导是在相距1m的两电极间含有1mol溶质的溶液所呈的电导,摩尔电导用Λm表示Λm=κ/c,电导率κ与电解质本性有关,与温度有关,与电解质浓度有关;摩尔电导与电解质本性有关,与温度有关,与电解质浓度有关。
3.为什么用交流电桥测定溶液的电导? 为什么用1000H z(即c/s,周每秒)频率测定溶液的电导? 为什么在未知电阻的线路上并联一电容? 测准溶液电导的关键是什么?答:用交流电流测溶液的电导,可以避免电解作用而改变电极本性,并且可以消除电极的极化作用。
用1000Hz的交流频率可防止电极上的极化作用,并可用耳机检零。
并联电容是为了消除电导池的电容的影响。
测准电导的关键是在各接触点均接触的条件下,电桥平衡,正确检零。
4.当一定直流电通过一含有金属离子的溶液时,在阴极上析出金属的量正比于:(1) 金属的表面积; (2) 电解质溶液的浓度;(3) 通入的电量; (4) 电解质溶液中离子迁移的速度。
答:(3).5.在界面移动法测定离子迁移数的实验中,其结果是否正确,最关键是决定于:(1) 界面移动的清晰程度; (2) 外加电压的大小;(3) 阴、阳离子迁移速度是否相同; (3) 阴、阳离子的价数是否相同。
答:(1)6.电解质在水溶液中时,作为溶剂的水电离为 H+、OH-离子,为什么一般不考虑它们的迁移数?影响离子迁移数的主要因素是什么?答:因为水中H+与OH-的浓度甚低,K sp=10-14,其迁移数极小,不考虑不会影响测量结果。
《无机化学》习题册及答案

《无机化学》课程习题册及答案第二章电解质溶液一、是非题:(以“+”表示正确,“-”表示错误填入括号)1.根据质子理论,两性物质溶液的pH值与两性物质的浓度绝对无关()2.将0.10mol L-1的NaHCO3溶液加水稀释一倍,溶液的pH值基本不变()3.把pH=3与pH=5的酸溶液等体积混合,溶液的pH值为4 ()4.将HAc溶液稀释一倍,溶液中的[H+]就减少到原来的一半()5.在0.2 mol·L-1的HAc溶液20ml中加入适量NaCl,则可使HAc的解离度增加()6.在0.101⋅HAc溶液10ml中加入少量固体NaAc,则可使HAc的解离Lmol-度增加()7.将0.10mol L-1的NaAc溶液加水稀释一倍,溶液的pH值变小()8.将0.10mol L-1的HAc溶液加水稀释一倍,溶液的pH值变小()9.根据质子理论,H2O是两性物质()10.根据质子理论,HCO3-是两性物质()11. 两种一元弱酸,K a越大的越容易失去质子,酸性越强,在水溶液中的解离度也越大。
()12.弱酸溶液愈稀,解离度愈大,溶液的pH值便愈小。
()二、选择题:1.HAc在下列溶液中解离度最大的是()A.1 mol∙L-1 NaAc B.2 mol∙L-1 HCl C.纯水D.1 mol∙L-1 NaCl 2.下列物质中酸性最大的是()A.HCl B.HAc C.H2O D.NH33.从酸碱质子理论来看,下列物质中既是酸又是碱的是()A.H2O B.NH4+C.Ac-D.CO32- 4.欲使NH3·H2O的α和pH均上升,应在溶液中加入()A .少量水B .少量NaOH (s )C .少量NH 4 Cl (s )D .少量NaCl (s )5.下列物质中碱性最大的是 ( )A .NaOHB .Ac -C .H 2OD .NH 36.欲使HAc 的α和pH 均减小,应在溶液中加入 ( )A .少量水B .少量HClC .少量NaAc (s )D .少量NaCl (s )7. 下列物质都是共轭酸碱对除了 ( )A. HONO, NO 2-B. H 3O +, OH -C. CH 3NH 3+, CH 3NH 2D. HS -, S 2-E. C 6H 5COOH, C 6H 5COO -8. 氨水中加入NH 4Cl,氨水的解离度( ),解离常数( ),溶液的pH 值( )。
大专无机化学教案-电解质溶液和离子平衡

大专无机化学教案-电解质溶液和离子平衡一、教学目标:1. 理解电解质的概念及其分类。
2. 掌握电解质溶液的导电原理。
3. 理解离子平衡的定义及其在溶液中的重要性。
4. 学会使用离子平衡原理分析溶液的性质。
二、教学内容:1. 电解质的概念及分类电解质的定义强电解质与弱电解质盐类电解质和非盐类电解质2. 电解质溶液的导电原理自由移动离子的产生电流的形成及导电性判断电解质溶液的电导率三、教学重点与难点:1. 教学重点:电解质的概念及其分类。
电解质溶液的导电原理。
2. 教学难点:电解质溶液中离子平衡的判断及分析。
四、教学方法:1. 采用多媒体课件辅助教学,直观展示电解质溶液的导电过程。
2. 案例分析法,以具体电解质为例,分析其溶液的导电性质。
3. 互动讨论法,引导学生思考并解决电解质溶液中的实际问题。
五、教学准备:1. 教学课件及辅助材料。
2. 实验室仪器设备,如电导率仪等。
3. 相关案例及问题讨论。
六、教学过程:1. 引入新课:通过回顾上节课的内容,引导学生思考电解质溶液的导电性质及其应用。
2. 教学内容讲解:电解质的概念及其分类电解质溶液的导电原理离子平衡的定义及其重要性3. 案例分析:以具体电解质为例,分析其溶液的导电性质及离子平衡情况。
4. 课堂互动:引导学生思考并解决电解质溶液中的实际问题。
七、课后作业:1. 复习本节课的内容,重点掌握电解质的概念及其分类。
2. 练习判断不同电解质溶液的导电性质,分析其原因。
3. 思考并解答与离子平衡相关的问题。
八、教学评价:1. 课堂表现:观察学生在课堂上的参与程度、提问回答等情况,了解学生的学习状态。
2. 课后作业:检查学生完成的作业质量,评估其对课堂内容的掌握程度。
3. 小组讨论:评估学生在小组讨论中的表现,了解其对电解质溶液和离子平衡的理解和应用能力。
九、教学拓展:1. 电解质溶液的酸碱性及其调节原理。
2. 电解质溶液在工业中的应用,如电镀、电池制造等。
第6章 电解质溶液

课程名称:无机化学第六章电解质溶液6-1 水的解离与溶液的pH值6-1-1 酸碱的解离理论酸碱的解离理论1884年瑞典化学家阿仑尼乌斯(S.A.Arrhenius,1859~1927年)提出的酸碱理论认为:酸是在水溶液中解离产生的阳离子全部是氢离子(H+)①的化合物;碱是在水溶液中最离产生的阴离子全部是氢氧根离子(OH-)的化合物。
酸碱中和反应的实质就是H+和OH-结合为H2O的反应。
酸碱的相对强弱可以根据它们在水溶液中电离出H+或OH-程度的大小来衡量。
①水溶液中的氢离子实际上是质子(H+) 和水结合生成的H3O+离子及其水合离子,但书写时除非必须注明其物态,一般仍可简写为H+。
6-1-2 水的解离反应和溶液的pH值1. 水的解离反应用精密的电导仪测量,发现纯水有极微弱的导电能力。
其原因是水有微弱的解离,使纯水中存在极微量的H3O+和OH-。
经实验测知,298.15K时纯水中c(H+)和c(OH-)均为1.0×10-7mol·L-1。
研究揭示,在纯水或稀溶液中,存在着水的解离平衡:课程名称:无机化学H2O(1 ) H+(aq) + OH-(aq)而且 {c(H+)/cθ}{c(OH-)/cθ}=称为水的离子积。
与其它平衡常数一样,是温度的函数。
不同温度下水的离子积见表6-1。
表6-1 不同温度下水的离子积t/℃ 5 10 20 25 50 100/10-40.185 0.292 0.681 1.007 5.47 55.12. 溶液的酸碱性和pH溶液的酸碱性取决于溶液中c(H+)与c(OH-)的相对大小:酸性溶液c(H+) >1.0×10-7 mol·L-1 >c(OH-)纯水(或中性溶液) c(H+) =1.0×10-7 mol·L-1=c(OH-)碱性溶液c(H+) <1.0×10-7 mol·L-1<c(OH-)当溶液中c(H+)或c(OH-)小于1 mol·L-1时,用浓度直接表示溶液的酸碱性显得不方便, 可采用pH表示之: pH=-lg{c(H+)/cθ}根据;pH=-lg{·cθ/c(O H-)}则pH= p- p OH = 14 - p OH酸性溶液pH<7纯水(或中性溶液) pH=7碱性溶液pH>7[例6-1]比较下列溶液的pH值年月日x0404-08课程名称:无机化学(1) 0.10 mol·L -1的HOAc 溶液;(2) 纯水 ;(3) 0.10 mol·L -1 NH 3·H 2O 溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
= 0.45
2.德拜-休克尔极限稀释公式
lg 0.509 z z
I
活度系数 与离子强度I成反向关系 离子强度I取决于离子的浓度与电荷
第二节 酸碱理论
一、酸碱电离理论(阿累尼乌斯酸碱理论)
凡是在水中能解离出H+的物质是酸(acid), 能 解离出OH-的物质是碱(base)。 酸碱反应的实质是:H++OH-===H2O。
HAc
碱
H+ + Ac酸碱共轭关系
一种酸释放一个质子后形成其共轭碱, 一种碱结合一个质子后而形成其共轭酸 。 共轭酸比它的共轭碱多一个质子。
酸
碱
NH4+
H2SO3 HSO3-
H+ + NH3
H+ + HSO3H+ + SO32-
质子理论没有盐的概念,如Na2CO3,在电离理论中称为盐, 但酸碱质子理论则认为CO32-是碱,而Na+是非酸非碱物质。
局限性:
无法解释许多不含有H+和OH-也表现出酸碱性 不适用于非水体系或无溶剂体系 NH3(g)+HCl(g)
苯
NH4Cl(s)
二、酸碱质子理论
(一) 酸碱定义 凡能给出质子(H+)的物质称为酸 凡能接受质子(H+)的物质称为碱
明显进步: 着眼于反应 脱离了水的限制
酸碱的相互联系
如:
共轭酸碱对:
酸
酸碱反应的实质是两对共轭酸碱对之间的质子传递反应。 例如HAc在水溶液中是酸
HAc + H2O HAc H2 O + H +
H+
H 3O + H+ + AcH3 O +
+
Ac
-
酸碱半反应式
仅仅是酸碱共轭关系的表达形式,并不是一种实际反应式.
扩大酸碱反应的范围 如: 电离反应 中和 水解
HAc + H2O H2O + NH3 H3O+ + OHH2O + AcNH4+ + H2O
三、离子强度与离子活度系数的关系
1.离子强度I
离子强度表征离子间相互作用的强弱
1 2 2 I c1 z1 c2 z 2 2
c 某种离子的浓度 z 某种离子的电荷
例 计算把0.10mol· L-1K3[Fe(CN)6]溶液和0.10mol· L-1K2SO4溶液 等体积混合后的溶液的离子强度 。
解:等体积混合后,各物质浓度均减半: C( K3[Fe(CN)6])= C( K2SO4)= 0.050mol· L-1 C( K +)= 0.050×5=0.25mol· L-1 C( SO42-)= 0.050mol· L-1 C( [Fe(CN)6] 3-)= 0.050mol· L-1
1 I (0.25 1 0.05 (3) 2 0.05 (2) 2 ) 2
H3O+ + AcNH4+ + OHH2O + H2O HAc + OHH3O+ + NH3
酸碱反应在非水体系下也能进行: NH3(g)+HCl(g)
苯
NH4Cl(s)
(二) 酸碱的强弱
没有绝对的酸、碱,更没绝对的强酸、强碱
不仅与酸碱的本性有关,而且也与溶剂的性质密切相关
HNO3 + H2O H3O+ + NO3H2Ac+ + NO3HNO3为强酸 HNO3为弱酸
(%)
86
92
92
61
91
81
40
<100%
一、离子相互作用理论
1.强电解质在水中完全解离; 2.由于阴阳离子之间的相互作用,形成“离子氛”; 3. 离子氛的存在使得离子运动不完全自由。 + + + + + + + 阳离子“氛” 阴离子“氛” + + + + + + - - +
∴ 解离度 < 100% 称为表观解离度
(五)溶剂的拉平效应和区分效应
1.拉平效应
液氨是HCl和HAc的拉平溶剂
将不同强度的酸拉平到溶剂化质子水平的效应称为拉 平效应。具有拉平效应的溶剂称为拉平溶剂。 例如: HCl和HAc是两种强度显著不同的酸,但在液氨中 均表现出强酸性。
HCl + NH3
Cl- + NH4+
HAc + NH3
Ac- + NH4+
无机化学
电解质溶液
电解质溶液
第一节 第二节 强电解质溶液理论 酸碱理论
第三节
水溶液中的质子转移平衡及有关计算
第一节 强电解质溶液理论
根据定义,强电解质在水中完全解离, =100%
Байду номын сангаас
几种强电解质的表观解离度(0.10mol· L-1, 298K)
电解质 KCl HCl HNO3 H2SO4 NaOH Ba(OH)2 ZnSO4
二、离子的活度和活度系数
1. 活度():有效浓度
=c
2. 活度系数
c 实际浓度
活度系数
一般 <1
活度系数 的 大小主要取决于离子间的相互作用 (1)稀溶液中的离子浓度很小,活度接近浓度,即 ≈1。 (2)溶液中的中性分子也有活度和浓度的区别,通常把中性分 子的活度因子视为1。 (3)对于弱电解质溶液,因其离子浓度很小,一般可以把弱电 解质的活度因子也视为1。
由于NH3接受质子的能力强,上述两个反应向右进行得很 完全,以致HCl和HAc都被转变成同一种酸(氨合质子即铵 离子NH4+),即它们在液氨中统统被拉平到NH4+的强度水 平,故二者不存在强度上的差异。
K K
a b, conj.
H3O+ + BHB + OH -
[H ][B ] Ka [HB]
[HB][OH ] Kb [B- ]
w
[H ][B ] [HB ][OH ] [H ][OH ] K [HB] [B ]
K K
a
b, conj.
K
w
Ka与Kb成反比关系,反映了在共轭酸碱对中,酸的强度 大,其共轭碱的强度小,反之亦然。
Ka 称酸常数 Ka 越大,酸性越强
⒉ 碱的解离平衡常数Kb [HB ][OH ] B- + H2O HB + OH- K [ H O][B- ] 2 [HB][OH ] Kb称碱常数 Kb [B ] Kb 越大,碱性越强
(三) 共轭酸碱对的 Ka 和 Kb 的关系
HB + H2O B- + H2O
HNO3 + HAc
HNO3 + H2SO4
H2NO3+ + HSO4- HNO3为弱碱
在H2O中表现出来的相对强度
用解离平衡常数衡量。
1.酸的解离平衡常数Ka
HB + H2O H3O+ + B-
HB
H+ + B
[H3O ][B ] K [ H 2O][HB ]
[H ][B ] Ka [HB ]
