综述—试论述噬菌体溶菌机制的研究进展
噬菌体治疗细菌感染的研究新进展

噬菌体治疗细菌感染的研究新进展1. 引言1.1 噬菌体治疗的背景介绍噬菌体治疗是一种利用噬菌体(又称噬菌体、细菌病毒)来治疗细菌感染的新兴疗法。
噬菌体是一种能够感染细菌并在其内复制的病毒,可通过注射、喷雾或口服等方式送达感染部位,对细菌进行特异性攻击。
相较于传统抗生素,噬菌体治疗具有快速、高效、低耐药性等优势,极大地提升了治疗效果。
噬菌体治疗的历史可以追溯到上个世纪初,但由于抗生素的广泛应用和效果显著,噬菌体疗法逐渐被边缘化。
随着细菌耐药性的日益严重和抗生素疗法的限制,噬菌体治疗再次受到关注并被认为是一种潜在的替代疗法。
目前,噬菌体治疗在动物实验中显示出了很好的效果,但在临床应用中还存在许多挑战需要克服。
随着近年来对噬菌体治疗的深入研究和技术改进,人们对其在细菌感染治疗领域的应用前景充满期待。
【2000字】1.2 噬菌体在细菌感染治疗中的作用噬菌体在细菌感染治疗中扮演着重要的角色。
噬菌体是一种可以攻击并杀死特定细菌的病毒,在治疗细菌感染方面具有巨大潜力。
与抗生素不同,噬菌体可以高度特异性地选择性地杀死感染细菌,而不会对人体的有益菌群造成伤害,从而降低了治疗过程中的副作用和抗药性风险。
噬菌体还具有良好的生物相容性和生物分解性,能够通过口服、皮下注射等多种途径进入人体,并在感染部位选择性地繁殖和扩散,直接与目标细菌相互作用,有效清除感染灶。
由于噬菌体在细菌感染治疗中的高度特异性和效果显著,越来越多的研究者将目光投向了这一领域,希望通过进一步开发和利用噬菌体,为细菌感染患者带来更好的治疗效果。
噬菌体在细菌感染治疗中的作用机制清晰明了,具有很高的治疗潜力和广阔的应用前景,对于细菌感染的治疗有着重要意义。
随着进一步研究的开展和技术的不断创新,相信噬菌体治疗将在未来发展出更多的应用方法和新型治疗方案,为临床治疗带来新的突破和希望。
1.3 研究的背景和意义随着抗生素滥用和耐药菌株的不断增加,细菌感染已经成为全球公共卫生领域的重要挑战。
噬菌体及其研究进展
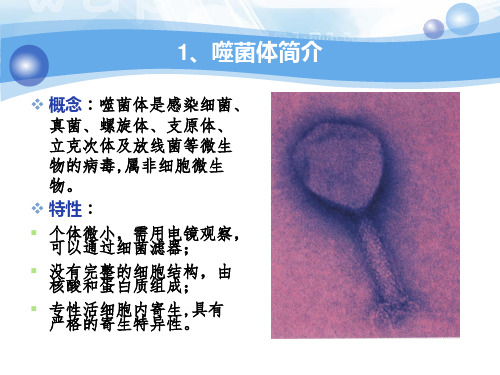
噬菌体颗粒在结构上有很 大差别,一般可分成三种 类型,即 无尾部结构的二十面体, 有尾部结构的二十面体和 线状体,迄今已知的噬菌 体大多数是有尾部结构的 二十面体。
头部
尾部
核酸:DNA或RNA,基因组大小为2-200kb,某些噬菌体基因 组中还含有异常碱基。 大多数为线状双链
DNA噬菌体
简介
A图只有细菌,荧光视野里不见任何发光物质;B图中只有荧光标记O-I噬菌体,视野 下偶尔可见少量圆点状的荧光物质,不见菌形;C图是荧光标记O-I噬菌体和沙门氏 菌混合,可见大量杆状物,少量点状物,极少数彗星状杆状物,将杆状物质与沙门氏菌 的革兰氏染色形态进行比较,两者一致。 由此可推知,C图中杆形物是侵有荧光噬菌体的沙门氏菌,点状物是标记的O-I噬菌 体,结合B图可知彗星状杆形物是即将裂解的宿主菌。
利用噬菌体展示技术制备抗体、模拟抗原表位,不仅绕过 了细胞融合,而且可以以单克隆抗体(McAb ) 或单链抗 体( ScFv)为靶分子筛选真菌毒素的模拟抗原表位,代 替真菌毒素的标准品,建立无毒 ELISA检测方法,保证实 验操作人员和相关研究人员的人身安全。 熊啸(2007 年)等选用抗黄曲霉毒素M1(antiAFM1,Aflatoxin M1,AFM1)单克隆抗体为筛选配基,从噬 菌体表面展示的随机 7 肽库中筛选出 AFM1 抗原的模拟表 位LTSFPRH 和MAPSSWR,为研制出安全无毒的 ELISA 试剂 盒奠定基础。
3、噬菌体在食品产业中的应用
食源性疾病病原的检测技术 作为食品添加剂 噬菌体展示技术检测真菌毒素
3.2作为食品添加剂
美国食品和药物管理局批准了一种由噬菌体病毒混合而成的产 品,主要用于杀灭肉制品中的李氏杆菌。这是美国首次批准将 病毒用作食品添加剂。 美药管局专家称,该产品在制备过程中可能留有残毒,但试验 表明,这些微量的残毒不会引起任何健康问题。该产品包含6 种噬菌体病毒,可在熟肉片和香肠等包装前喷洒在这些肉制品 上,有效杀灭多种李氏杆菌,预防由这些细菌引起的食物中毒。 产品中所包含的噬菌体只会攻击李氏杆菌,对人体和植物细胞 都不会产生影响。
219526332_噬菌体对人体肠道菌群和肠道炎症影响的研究进展

噬菌体对人体肠道菌群和肠道炎症影响的研究进展林翠翠① 【摘要】 肠道菌群数量庞大、种类繁多,是决定人体健康水平的重要微生物。
维持好肠道菌群的多样性与丰富性,能够在很大程度上避免肠道炎症等一系列疾病问题的发生。
本文探讨噬菌体对人体肠道菌群和肠道炎症的影响,纳众学者的相关研究为参照,综述肠道噬菌体对肠道菌群与肠道炎症的影响,并提出利用噬菌体调整肠道菌群的功能治疗肠道炎症,为未来肠道菌群调整与肠道炎症治疗指明新的方向,希望为读者在相关领域的研究与工作提供一些参考。
【关键词】 噬菌体 肠道菌群 肠道炎症 进展 doi:10.14033/ki.cfmr.2023.17.045 文献标识码 A 文章编号 1674-6805(2023)17-0180-05 Research Progress on the Effect of Phages on Human Intestinal Flora and Intestinal Inflammation/LIN Cuicui. //Chinese and Foreign Medical Research, 2023, 21(17): 180-184 [Abstract] The intestinal flora is large in number and variety, which is an important microorganism that determines the level of human health. Maintaining the diversity and abundance of intestinal flora can largely avoid the occurrence of a series of diseases such as intestinal inflammation. This article discusses the effects of phages on human intestinal flora and intestinal inflammation. Based on the relevant studies of many scholars, this article reviews the effects of intestinal phages on intestinal flora and intestinal inflammation, and proposes the use of phages to adjust the function of intestinal flora to treat intestinal inflammation, which provides a new direction for the regulation of intestinal flora and the treatment of intestinal inflammation in the future. We hope to provide some references for readers in the research and work in related fields. [Key words] Phages Intestinal flora Intestinal inflammation Progress First-author's address: Wuyishan Municipal Hospital, Wuyishan 354300, China 噬菌体是感染细菌、真菌、螺旋体、放线菌等微生物的病毒总称,靠寄生方式存活,其中部分会导致宿主菌发生裂解,因此被称为“噬菌体”[1]。
噬菌体治疗细菌性疾病的研究进展

《专业外语》课程论文噬菌体治疗细菌性疾病的研究进展摘要噬菌体在被发现之初已经被尝试用于治疗细菌性疾病,后来由于抗生素的出现使之渐渐淡化出人们的眼球,但是对于现今很多细菌都对抗生素有很强的耐药性甚至出现了具有多重耐药性的超级细菌,使得重新重视起噬菌体治疗细菌性疾病的作用。
本文主要综述了噬菌体对于治疗细菌性疾病的早期研究和最新进展。
关键词噬菌体裂解酶细菌性疾病细菌性感染是感染性疾病中比较常见的类型,如果缺乏及时有效的治疗,严重的话可以导致很高死亡率[1]。
例如每年由弯曲杆菌、沙门氏菌、O157大肠杆菌和单核细胞增多利斯特菌引起的食源性疾病就给人类带来巨大的经济损失和生命威胁。
在19世纪初Herelle发现噬菌体(bacteriophage,phage)[2,3]后,人们就曾经尝试采用噬菌体治疗细菌感染。
但自抗生素的出现后人们就渐渐的淡化噬菌体的研究而大量的进行有关抗生素的研究,进而大量使用抗生素作为治疗细菌感染的有效途径,在前期抗生素的确有非常好的治疗效果,然而随着抗生素使用的泛滥,细菌的耐药性问题日益加剧,新抗生素研发的速度远远低于耐药菌产生的速度。
由于新型抗生素的发现越来越困难,噬菌体治疗重新得到人们的重视,并且取得了一些不错的研究成果。
1 噬菌体及裂解酶的概况噬菌体( Bacteriophage,简称phage)又叫细菌病毒,是一种可以侵入细菌细胞内,通过酶的用破坏细胞壁,使细菌裂解从而将其杀灭的病毒。
噬菌体分为烈性噬菌体和温和性噬菌体,前者可在敏感宿主菌内增殖并使之裂解,亦称为毒性噬菌体(virulent phage)。
噬菌体裂解酶( Lysin或Endolysin)是双链DNA噬菌体所特有的、在病毒复制晚期合成的一类胞壁质水解酶。
多数噬菌体具有编码3种细胞壁水解酶的基因,分别为裂解酶、酰胺酶和内肽酶,其中酰胺酶是国内外研究比较多的一种裂解酶。
裂解酶的高亲和性与种属特异性的细胞壁糖基有关,而后者常常是细菌存活的必要成分。
噬菌体研究与应用的前沿成果

噬菌体研究与应用的前沿成果随着生物学研究的不断深入,噬菌体作为一种广泛存在于自然界并具有研究和应用价值的生物,受到了越来越多的关注。
在过去的二十年里,关于噬菌体的研究和应用已经取得了许多重大的突破和成就,这些进展不仅对于医学领域有着重要的意义,对于食品工业和环境保护等领域也具有重要的应用价值。
本文旨在介绍噬菌体研究与应用的前沿成果,以期能够让读者了解噬菌体的神奇之处,并在未来的应用中发挥更大的作用。
一、噬菌体研究的历史与现状噬菌体是一种能够感染和破坏细菌的病毒,属于噬菌体科,是一种特殊的病原体。
噬菌体最早被发现于1915年,当时被称为“微生物病原体”,随后又被称为“细菌噬咬器”和“噬菌体”等。
在过去的一个世纪里,随着科学技术的不断发展,对噬菌体的研究逐渐深入,目前已经形成了一整套完善的研究和应用体系。
目前,噬菌体的研究主要分为三个领域:基础研究、应用研究和工程研究。
基础研究主要关注噬菌体的生物学特性、进化历史、感染机理等方面;应用研究主要关注噬菌体在各种领域中的应用,例如医学、食品工业、环境保护等;工程研究则主要关注如何通过人工手段改变噬菌体的性质,优化其应用效果。
二、噬菌体在医学领域中的应用噬菌体作为一种可以选择性灭菌的生物,在医学领域中具有非常广泛的应用价值。
近年来,围绕着噬菌体的应用在医学领域中进行了大量的实验和研究,并取得了许多重要的成果。
1.临床应用在临床应用方面,噬菌体可以作为一种独特的抗菌药物针对细菌感染进行治疗。
相比于传统的抗生素,噬菌体有以下几个优势:(1)选择性强:噬菌体只针对特定的细菌进行感染和杀灭,而不会对其他微生物和宿主产生影响。
(2)生物安全性高:噬菌体是一种天然存在于自然界中的生物,对人体具有很好的生物相容性和安全性。
(3)适应性强:由于细菌的变异和抵抗,传统抗生素出现耐药性是一个难以避免的问题;而噬菌体具有较强的适应性,不会因为细菌的变异而失去杀灭作用。
在临床应用中,最常见的是采用噬菌体针对难治性细菌感染进行治疗,例如病毒性感冒病毒、肺炎链球菌等。
噬菌体治疗细菌感染的研究新进展

噬菌体治疗细菌感染的研究新进展噬菌体治疗的原理是利用噬菌体感染细菌并破坏其细胞壁,最终导致细菌死亡。
相比传统抗生素,噬菌体的疗效更加针对性,不仅可以杀灭特定的细菌,而且不会影响人体的正常菌群,减少了对人体的不良影响。
噬菌体治疗在治疗耐药细菌感染、慢性感染等方面具有独特的优势。
近年来的研究表明,噬菌体治疗在耐药细菌感染方面取得了一些突破。
随着抗生素的过度使用和滥用,一些细菌已经产生了对抗生素的耐药性,导致传统抗生素难以对其产生疗效。
而噬菌体治疗能够通过感染并杀死这些耐药细菌,为治疗这些感染提供了一种新的选择。
在一些临床实验中,噬菌体治疗已经显示出了对耐甲氧西林金黄色葡萄球菌、产生了广泛耐药的肠球菌等耐药细菌产生了显著的治疗效果。
噬菌体治疗在慢性感染的治疗方面也表现出了潜在的优势。
一些慢性感染,特别是由生物膜包裹的感染,对抗生素具有一定的耐受性,难以完全清除。
而噬菌体能够穿透生物膜、感染细菌并破坏其细胞壁,因此可能在这些慢性感染的治疗中发挥重要作用。
已有的研究表明,噬菌体治疗可以有效清除生物膜内的细菌,为慢性感染的治疗提供了新的思路。
基因编辑技术的发展也为噬菌体治疗的进一步优化提供了可能。
通过基因编辑技术,可以对噬菌体进行改造,使其具有更强的感染能力,更广泛的杀菌谱,从而提高其治疗效果。
基因编辑技术还可以使噬菌体更加安全、稳定,减少其在治疗中可能出现的风险。
基因编辑技术的应用为噬菌体治疗的进一步研究和应用提供了新的动力。
临床研究也为噬菌体治疗的应用提供了一些实质性的进展。
一些临床试验已经证实了噬菌体治疗的安全性和有效性,为其在临床上的应用奠定了基础。
一些初步的临床试验结果也表明,噬菌体治疗在一些特定的感染治疗中具有潜在的优势,例如在创面感染、肺部感染、尿路感染等方面。
这些临床研究结果为噬菌体治疗的进一步推广提供了重要的支持。
噬菌体治疗细菌感染在近年来取得了一些新的进展,特别是在耐药细菌感染和慢性感染的治疗方面表现出了潜在的优势。
噬菌体治疗细菌感染的研究新进展

噬菌体治疗细菌感染的研究新进展噬菌体是一种侵染细菌的病毒,并利用细菌细胞内的代谢机制和遗传物质进行复制和传播。
它们是自然界中普遍存在的病毒,在污水、土壤和动植物体内均可寻获。
因为噬菌体仅感染特定的细菌,不会对人体和其他微生物产生危害,因此被认为是一种潜在的治疗细菌感染的天然药物。
在最新的研究中,科学家们发现,通过利用噬菌体可以实现精准靶向和高效清除致病菌的效果,对于传统抗生素难以治愈的细菌感染具有重要意义。
噬菌体还具有以下几个优点:噬菌体在细菌中的复制导致细菌破裂释放新的噬菌体,这使得治疗过程中其浓度会逐渐增加,从而增强了治疗效果。
噬菌体对于抗生素耐药菌株也具有一定的杀灭效果,这为治疗耐药菌株感染提供了新的途径。
噬菌体在人体内并不产生毒性或过敏反应,对人体组织几乎没有损害,因此被认为是一种安全的治疗方法。
在动物模型上的研究表明,噬菌体对于多种细菌感染具有很好的疗效。
在小鼠体内注射噬菌素后,可以观察到明显的治疗效果,而且其疗效不会因为细菌的耐药性而受到影响。
一些临床试验也表明,噬菌体在治疗一些顽固性感染病例中也取得了一定程度的成功。
这些初步实验证明了噬菌体治疗的潜力和可行性,为其未来在临床上的应用提供了有力的支持。
虽然噬菌体治疗在实验室和动物模型中取得了一定的成功,但在临床实践中仍面临一些挑战和限制。
噬菌体的生产和纯化工艺较为复杂,生产成本较高,并且对噬菌体的稳定性和储存条件有较高的要求,这限制了其规模化生产和应用。
因为噬菌体是一种生命体,其生物学特性和相互作用机制较为复杂,因此其安全性和治疗效果仍需要进一步的评估和确认。
由于噬菌体具有明显的靶向性,因此需要根据患者的具体细菌感染情况进行精准的治疗选择,这为临床应用带来了一定的难度。
为了克服这些限制,科学家们正在积极开展相关研究,并探索噬菌体治疗在临床中的应用前景。
针对噬菌体生产的技术难题,科研人员正在寻求进一步改进生产和纯化工艺,以降低生产成本和提高产量。
噬菌体与细菌互作的分子和生理学机制研究

噬菌体与细菌互作的分子和生理学机制研究近年来,噬菌体与细菌的互作研究引起了科学界的广泛关注。
噬菌体是一种寄生在细菌中的病毒,能够迅速感染并破坏细菌。
噬菌体与细菌的相互作用涉及到一系列的分子和生理学机制,这些机制与细菌的生长、代谢和免疫反应密切相关。
一、噬菌体感染机制噬菌体感染细菌的机制被称为噬菌作用。
噬菌体通过识别特定的细菌受体结构,与细菌表面发生相互作用,导致噬菌体DNA进入细胞内,并利用细菌的代谢系统进行自我复制和扩增。
最后,噬菌体释放和溶解细胞壁,从而释放新的噬菌体颗粒。
噬菌体感染的过程牵涉到噬菌体的外壳蛋白和细菌宿主表面的相互作用。
在噬菌体感染前,噬菌体的尾部与结构特异性的受体相互作用,从而引发噬菌体的进一步吸附。
然后,噬菌体的尾部针尾结构通过扭曲肌动蛋白的机制刺穿细菌细胞膜,准确地将噬菌体DNA输送进细胞质内。
为了避免宿主免疫系统的攻击,一些噬菌体会利用一种领先的抗氧化剂——多胺-1,5-二羧酸作为保护机制,来抵御宿主免疫系统的攻击。
二、细菌抵御噬菌体的防御机制细菌为了保护自身不受噬菌体感染的进攻,也演化出了自身的抵御机制。
细菌的最常见的防御机制包括:限制性修饰、修饰酶、CRISPR-Cas系统和呼吸暴发等。
限制性修饰是一种把许多类型的外来DNA分解的酶。
修饰酶能将DNA的单部位改造掉,从而防止噬菌体DNA进入细胞内。
CRISPR-Cas系统是一种新型的防御机制,可以识别并剪切噬菌体的DNA,从而有效抵御噬菌体的感染,并且可以形成免疫记忆,通常包括CRISPR-Cas I,II和III三类。
呼吸爆发是一种能够破坏细胞壁的防御机制,细菌会产生一些有毒物质来杀死噬菌体。
三、噬菌体与细菌互作的分子机制研究作为一种功能强大的生物工具,噬菌体与细菌的互作研究可以深入揭示这些分子机制,加深我们对生命活动的理解。
目前,噬菌体与细菌的分子机制研究主要集中在三个方面:宿主受体的特异性、噬菌体的进化和抗药性的请求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
试论述噬菌体溶菌机制的研究进展姓名:caohaichuan 学号:专业:微生物学摘要:噬菌体(bacteriophage,简称phage)主要通过抑制宿主细胞细胞壁的合成导致宿主菌溶解及通过溶解酶作用破坏宿主细胞壁,以大肠杆菌单链RNA噬菌体Qβ,真菌线状单链DNA(ssDNA)微小病毒φX174噬菌体和单链DNA噬菌体MS2及大肠杆菌λ噬菌体为例,分别论述噬菌体的两种溶菌机制。
λ噬菌体S和R基因分别编码穿孔素(holin)和内溶素(endolysin),形成穿孔素-内溶素(holin-endolysin)系统达到溶解宿主菌的目的。
进一步揭示该系统溶解基因的协调作用及相关基因的调控机制。
关键词:噬菌体;溶解酶;细胞壁;穿孔素;内溶素噬菌体是感染细菌、真菌、放线菌或螺旋体等微生物的病毒的总称,因部分能引起宿主菌裂解,故称为噬菌体。
它在宿主菌内可高效复制,迅速地形成数百个子代噬菌体颗粒,每一个子代颗粒具备相同的侵袭、繁殖能力,重复4个感染周期后,一个噬菌体颗粒可杀灭数10 亿个细菌,这是噬菌体极具特色的一种生物学特性。
其溶菌机制主要包括两个方面,一个是通过抑制宿主细胞细胞壁的合成导致宿主菌溶解;另外一个方面是通过溶解酶作用导致宿主细胞壁的破坏。
这两个方面都能够有效的进行破坏宿主菌细胞壁的合成,从而达到溶菌的目的。
基于噬菌体溶菌机制,在治疗细菌感染、消毒以及反生物武器等领域具有良好应用前景,本文从以下几个方面综述其最新研究进展。
1. 噬菌体溶菌机制的研究噬菌体包括两种类型,温和噬菌体和烈性噬菌体。
其中具有溶菌作用的是烈性噬菌体,亦称毒性噬菌体。
噬菌体对其宿主菌的溶解是由专一溶解基因编码的特异性蛋白或噬菌体自身蛋白介导的溶解系统统一完成的,这一溶解系统具有一套完整、精密的调节机制和控制体系,而且其作用基质多集中宿主菌的细胞壁上,噬菌体蛋白通过不同的途径影响和破坏宿主菌胞壁质的生物合成及正常结构,从而导致噬菌体宿主菌细胞损伤、死亡。
烈性噬菌体成功吸附宿主菌后,就开始穿入溶菌过程,因其结构和基因控制的不同而显示出不同的溶菌机制。
1.1.通过抑制宿主细胞细胞壁的合成导致宿主菌溶解该机制实际上是小基因组噬菌体的溶菌机制。
缺乏溶壁酶的小基因组噬菌体利用多肽在不同阶段抑制宿主菌的胞壁质合成酶,从而在不同阶段溶解宿主菌。
例如大肠杆菌单链RNA噬菌体Qβ没有独立的溶解基因,主要利用衣壳蛋白A2参与宿主菌的溶解。
A2蛋白是一种多功能的单拷贝蛋白质, 有吸附性菌毛、保护噬菌体RNA抵抗外部核糖核酸酶( RNA酶)、溶解宿主菌的作用。
A2蛋白抑制宿主菌胞壁质生物合成关键步骤的催化剂MurA,通过靶向正常细胞胞壁生物合成途径中的不同阶段的酶而导致新合成的肽聚糖降解,从而逐渐使宿主细胞溶解。
此外,真菌线状单链DNA(ssDNA)微小病毒φX174噬菌体只含有10个基因,其溶菌机制是产生单一的溶解蛋白E。
蛋白E由必须基因D编码,有91个包含在+1区的密码子读框中,可有效抑制肽聚糖合成酶Mra Y[1],Mra Y是介导肽聚糖合成中最初的脂质联合的催化剂。
研究表明,E蛋白还可以抑制特殊的肽聚糖前体物质二氨基庚酸进入细胞壁[2],从而抑制真菌细胞壁的合成,可代替抗生素抑制真菌细胞。
类似的还有单链DNA噬菌体MS2,该噬菌体只含有4个基因,其中溶解基因L重叠在宿主菌表膜,而且在+1区复制,编码一个75个氨基酸的膜蛋白介导宿主菌的溶解。
1.2.通过溶解酶作用导致宿主细胞壁的破坏除了丝状噬菌体以外(丝状噬菌体并不裂解宿主菌,而是以分泌形式扩增噬菌体病毒颗粒) ,几乎所有的噬菌体都是通过引起宿主细胞溶解来结束它们的感染周期的[3]。
其中双链DNA噬菌体的溶菌方式就是利用溶壁酶溶解、破坏其宿主菌的细胞壁而达到裂解细菌的目的。
溶壁酶可以打开细胞壁上各种分子的共价键使细胞壁水解,从而杀死细菌。
通过对大肠杆菌的λ噬菌体研究发现,λ噬菌体具有4个溶解基因,包括S、R、R Z和R Z1 ,它们积聚在单一晚期基因启动子pR’溶解片夹下游的重叠簇中[4]。
然而,λ噬菌体的4个溶解基因中只有S和R是宿主细胞溶解所必需的,S和R编码的穿孔素和内溶素两种蛋白能够直接导致宿主菌的溶解[5]。
而R Z和R Z1只有当外膜被毫克分子浓度的二价阳离子固定后才具溶解作用。
基因S编码的产物为穿孔素,其作用是在细胞膜脂质双分子层上形成跨膜“孔洞”,使基因R产生的酶可以穿过细胞膜,到达细胞壁,达到降解细胞壁的目的[6]。
基因R编码产物为内溶素,是一种可溶解的细胞质糖基转移酶,也是一种能够水解细胞壁的溶壁酶,这种可溶性蛋白能破坏3类不同的肽聚糖多聚体的共价键,具有溶壁活性[7]。
在宿主菌内,S或R单一作用时,对宿主菌无明显溶菌功效,只有基因S和基因R协同作用时,才能够作用于肽聚糖,破坏细胞壁,是宿主菌溶解,即穿孔素-内溶素系统。
λ噬菌体就是利用穿孔素-内溶素系统溶解宿主菌的。
2. 穿孔素-内溶素系统穿孔素-内溶素系统能够破坏宿主菌细胞壁,达到溶菌目的,但是,由于内溶素缺少一个单一序列,因此内溶素必须与S基因协同作用,才能作用于肽聚糖[3]。
穿孔素-内溶素系统溶菌机制主要是从宿主菌内部发挥溶菌作用,噬菌体进侵入细菌体内,依赖宿主菌的蛋白质等物质合成大量的子代噬菌体,同时释放大量的穿孔素和内溶素。
然而大部分内溶素因缺少信号肽序列,从而无法穿过细胞膜,所以内溶素需要依靠穿孔素,才能穿过细胞膜,到达细胞壁。
但是,在革兰氏阳性菌中,由于其细胞壁肽聚糖层没有外膜的保护,内溶素可以从外部直接作用于细胞壁的肽聚糖层,从而不依赖穿孔素,就能直接溶解细菌。
2.1.穿孔素穿孔素是由基因S编码的,基因S是由一个含有107个密码子组成的开放阅读框(open reading frame,0RF),其显著特征就是具有双起始基序特征,能够编码2个具有对抗功能的内膜蛋白,S105和S107[8]。
S105含有105个氨基酸,具有跨膜结构,并发挥穿孔素作用,在脂质双分子层上形成“孔洞”,以便保证内溶素能够顺利通过细胞膜,作用于细胞壁。
S107是一种抗穿孔素,可特异性抑制穿孔素的功能[4]。
当穿孔素作用于细胞膜时,S107能够调节S105功能,防止过早形成跨膜“孔洞”。
2.2.内溶素所有的双链DNA噬菌体编码至少一种胞壁水解酶,即内溶素,在λ噬菌体中,内溶素是R基因编码的产物。
研究证明,内溶素具有两个功能域,细胞壁结合域(CBDs)和酶活性域(EADs)[10]。
内溶素紧紧的结合到细胞壁的肽聚糖层上的残基上,使细胞溶解。
然而,酶活性域依靠酶的催化机制裂解细菌肽聚糖层的特定位点,破坏肽聚糖层结构。
来自Mathias Schmelcher等人[10]的研究,发现两种假单胞菌噬菌体溶菌素KZ144和EL188对革兰氏阴性菌具有溶解作用,并具有一个N-端CBD和一个C-端EAD的结构元件。
其中,KZ144的N-端可以非常紧密的结合到绿脓假单胞菌的细胞壁上并且能够识别其他革兰氏阴性菌的肽聚糖,破坏肽聚糖层,裂解细胞壁。
然而,最近几年的研究主要来是针对酶的活性域进行的,来进一步揭示内溶素的溶菌机制。
噬菌体内溶素至少有4种不同的胞壁水解酶活性,包括糖苷转移酶,溶菌酶,酰胺酶和肽链内切酶。
内溶素在穿孔素的协调下,沿着跨膜“孔洞”穿过细胞膜作用于细胞壁,其中,糖苷转移酶和溶菌酶攻击细胞壁上糖苷键连接的氨基糖;酰胺酶和肽链内切酶攻击寡肽交联链的氨基化合物和肽键[11]。
从而破坏细胞壁,溶解宿主菌,同时释放大量的子代噬菌体颗粒。
在革兰氏阳性菌中,由于其细胞壁肽聚糖层没有外膜包裹,当内溶素从外部作用时,其能够进入到肽聚糖层并破坏这些微生物体。
因此,噬菌体产生的内溶素具有与抗生素一样的效果,很大程度上避免了耐药性。
然而,在革兰氏阴性菌中,由于肽聚糖层有一层外膜保护,内溶素无法自行穿过外膜到达细胞壁。
因此,对于革兰氏阴性菌来说,内溶素的溶菌机制是较为复杂的。
3.小结大肠杆菌单链RNA噬菌体Qβ,真菌线状单链DNA(ssDNA)微小病毒φX174噬菌体,单链DNA噬菌体MS2及大肠杆菌λ噬菌体通过不同的溶菌机制特异性识别不同的宿主菌,作用于肽聚糖,从而破坏宿主菌细胞壁,达到溶菌目的。
噬菌体对宿主菌的溶解是由专一的溶解基因编码的特异性蛋白或噬菌体自身蛋白介导的溶解系统共同完成的,调控机制通过协调作用,有效、准确地完成溶菌过程。
噬菌体具有严格的宿主专一性,这就使得其在特异性杀伤宿主菌方面具有很大优势。
在疾病治疗上,噬菌体与抗生素相比较,噬菌体不仅能够有效地控制疾病发生,而且还能有效避免病原体的耐药性,这是抗生素所不能比拟的。
噬菌体通过抑制细胞壁的合成或者通过溶壁酶作用来达到溶菌目的,从分子水平上进行研究,主要是由一些溶菌基因编码的特异性蛋白协同作用,这些溶解基因编码的蛋白可以通过某一特定机制作用于细胞膜和细胞壁上,在文章前面提到的两种溶解基因S和R就是如此的,基因S编码的蛋白穿孔素通过作用于细胞膜使其形成跨膜“孔洞”,从而使内溶素(基因R编码的蛋白)能够更好的穿过细胞膜并作用于细胞壁的肽聚糖层,最终溶解宿主菌。
基因S编码两个具有对抗作用的内膜蛋白,S105和S107,S105蛋白的作用是引导内溶素穿过细胞膜,而S107的作用则是调节S105蛋白出现的时间,防止穿孔素过早的形成跨膜“孔洞”,保证精确地调节穿孔素-内溶素系统,并有效溶解宿主菌。
由于噬菌体具有严格的宿主专一性,只能对特定的病原体产生作用,噬菌谱较窄。
随着对噬菌体分子结构和基因功能的深入了解,对其溶菌机制的认识将会更加深入和明确,以便解决噬菌体噬菌谱较窄以及探索噬菌体溶菌机制的共同途径等问题。
为了实现噬菌体在抗治疗细菌感染、消毒和反生物武器及解决抗生素耐药性等方面的广泛应用,我们必须探索一种新型的,噬菌谱较广的溶菌机制。
噬菌体溶菌机制的深入研究具有重大意义及广阔的应用前景,更是我们今后研究的方向。
参考文献[1]F. SANGER, G. M. AIR, B. G. BARRELL, et al. Nucleotide sequence ofBacteriophage φX174 DNA[J]. Nature,1977,265:687-695.[2]Thomas G, Bernhardt, Ing-Nang Wang, et al. A protein antibiotic in thephage Qβ virion : diversity in lysis targets[J]. Science, 2001, 292:2326-2329.[3]徐焰.噬菌体溶菌机制研究进展[J].重庆医学,2003,32(1):106-108.[4]Angelika G,David L,Smith,et al. Dimerization between the holin andholin inhibitor of phageλ[J]. J Bacteriol.,2000,182(21):6075-6081.[5]Wang IN, Smith DL, Young R, et al. HOLINS: the protein clocks ofbacteriophage infections[J]. Annu. Rev. Microbiol., 2000, 54:799-825.[6]S. Tanaka, W. M. Clemons Jr. Minimal requirements for inhibition ofMraY by lysis protein E from bacteriophage φX174[J]. MolecularMicrobiology, 2012,85(5):975-985.[7]Michael D, Young R. Holins kill without warning[J].Proc Natl Acad SciUSA, 2001, 98(16):9348-9352.[8]Angelika G, Udo Bläsi, Young R. Genetic and biochemical analysis ofdimer and oligomer interactions of the λ S holin[J]. J Bacteriol., 2000, 182(21):6082-6090.[10]Mathias Schmelcher,David M Donovan,Martin J Loessner.Bacteriophageendolysins as novel antimicrobials[J]. Future Microbiol,2012, 7(10):1147-1171.[11]Young R. Bacteriophage lysis: mechanism and regulation[J]. Microbiol.Rev.,1992,56:430-481.。
