第4章_电极及电极
玻璃工业窑炉 第四章电熔窑第四节电极选型与布置

•多用在小型电熔窑上。 •板状电极损坏时可由它代替。 •能产生强烈对流,热量集中在与电极 相接触耐材,易造成耐材损坏。
4.4.4水冷套 (1)水冷套的作用
由于金属钼的耐热性能特别好,可经受 2600℃的温度,属难熔金属。但它的氧化性能在 温度600℃以上明显加剧,因此,为了保护钼电 极,使其不致很快被氧化,必须采用电极水冷却 装置,否则会影响整个熔炉的正常运转,严重时 将迫使电熔窑停产。
•缺点:当防氧化措施不当时易损坏且更换 困难。池底侵蚀严重时有漏料危险。
•全电熔窑不采用。
③板状电极:
•紧贴布置侧墙上,使电流密度和热量分 布都较匀,电极侵蚀较小,适合硼玻璃 熔制及不希望有强烈对流的部位。如流 液洞、供料道上,能在小区域内均匀加 热,不使耐材过分侵蚀,
•缺点:运行间不能更换。
④塞状电极
缺点:只用于具有还原能力的玻璃,易 使玻璃着色(棕色),接触电阻大,允 许电流密度0.1~0.3A/ cm2,电极直径较 大(150~200mm)。
石墨电极通常水平安装在液面下25mm 处左右,玻璃中金属氧化物着色剂会被 还原成金属,沉淀在电极上,或产生碳 化物,改变玻璃色泽。因此,不能用于 熔制硼玻璃、彩色玻璃和铅玻璃。
③二氧化锡电极
•具有抗氧化作用的陶瓷材料,除用于熔 制 铅 玻 璃 , 还 可 熔 制 含 As2O3 、 CoO 、 Fe2O3的玻璃。
•块 状 ( 砖 块 ) 或 粗 棒 状 ( 12mm ) , 密 度6.8 kg/cm3,耐急热急冷性好,但抗拉 强度低。
•氧化锡电导体具有负的特性,在400℃时 电 阻 率 为 0.8~1.2Ω·cm,1000℃ 为 0.0025~0.0045Ω·cm,因此,须在高温下 向电极供电。
第四章 氧化还原与电极电势 (1)

φ( AgCl/Ag) =φ(AgCl/Ag) - 0.0592 lg c (Cl-)
NO3- + H2 O + 2e-
2OH- + NO2-
(NO3-/NO2-)
=
(NO3-/NO2-
)
+
0.0592 lg 2
c(NO3- ) c(NO2- )c2 (OH )
[例] 将锌片浸入含有0.01mol/L或4.0 mol/L的Zn2+溶液中,
• 金属(电极极板)与溶液之间的界面用 “│”分开; • 同一相中的不同物质之间,以及电极中的其它相界面用 “ , ”分开; • 当气体或液体不能直接和普通导线相连时,应以不活泼 的惰性导体(如铂或石墨)作电极板起导电作用; • 纯气体、液体和固体,应标出其物理状态并紧靠电极板; • 溶液注明浓度,若为气体应标注分压(单位kPa)。
解: 还原反应: Cl2 + 2e- = 2Cl氧化反应: Fe2+- e- = Fe3+
正极 负极
电极组成: 正极: Cl-(c3) |Cl2(100kPa), Pt 电池符号: 负极: Fe3+(c2), Fe2+(c1) | Pt
(-)Pt | Fe3+(c2), Fe2+(c1) ||Cl-(c3) |Cl2(100kPa), Pt(+)
三、影响电极电势的因素
(一) 能斯特方程式(Nernst equation)
任意电极反应 aOx + ne- bRed
RT ca (Ox)
(Ox/Red) = (Ox/Red) +
R:8.314 J·mo1-1·K-1
nF
ln cb (Red)
第四章第三节《电解池》

(2)溶液中所含阴离子:OH—、Cl—, 放电顺序:Cl— > OH— 阳 极:2Cl— -2e— = Cl2 ↑
电解
总反应: 2NaCl + 2H2O = 2NaOH + H2 ↑+ Cl2 ↑
【思考13】分析电解反应(用惰性电极时) 的一般思路是什么?
小结1:分析电解反应(用惰性电极时) 的一般思路:
如NaCl
如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型
如Na2SO4、H2SO4 、NaOH
巩固练习
1、电极反应方程式及电解总反应方程式的书写 (惰性电极,溶液): H2SO4 HCl NaOH K2SO4 CuCl2 CuSO4 NaCl KMnO4 2、用石墨作电极电解CuCl2、NaCl的混合溶液 时,阴极析出的物质是_____;阳极产物是 _____。 3、两极都用银片作电极电解AgNO3溶液时,阳 极的产物是____;阴极的产物是____。
e- 阳极 C
CuCl2溶液
【思考4】如何书写电解池电极方程式?
- e 阴极:Cu2++2e-=Cu 还原反应 阴极 阳极:2Cl -2e =Cl2 ↑ 氧化反应 C 总反应式:CuCl2 电解 Cu+Cl2 ↑
e-
阳极 C
阴离子失去电子而阳离子得到 电子的过程叫放电。 CuCl 溶液 2 通式: 阴极:氧化剂+ne- = 还原产物 阳极:还原剂-ne- = 氧化产物 总电解反应式:阴阳极反应式相加所得的式子 (考虑电子守恒)
阴极:4H+ + 4e— = 2H2 ↑
阳极:4OH— -4e— =2H2O + O2 ↑ 总反应:2H2O = 2H2↑ + O2 ↑ 【思考12】在电解氯化铜溶液的装置中,若把电解 质换成氯化钠,其结果又如何呢?写出电极反应。
第四章电催化与电催化电极

在电极表面上,由另一个H3O+ 离子在吸附氢原子的位置上 放电,从而直接生成氢分子,并从电极表面上脱附下来:
MH+H3O+ +e→H2+H2O+M (酸性介质) MH+H2O+e→H2+M+OH - (中性或碱性介质)
㈡析氢机理
⒈迟缓放电理论: 电化学反应是整个析氢反应过程的控制步骤。
能催化电极反应的或者说对电极反应起加速作用 的物质称为电催化剂。
2、电催化的本质:
通过改变电极表面修饰物(或表面状态)或溶液相中的修 饰物,大范围的改变反应的电极电势与反应速率,使电极除具 有电子传递功能外,还能促进和选择电化学反应.
3、电催化反应的共性
反应过程包含两个以上的连续步骤,且在电极表面生成化学 吸附中间产物。许多由离子生成分子或使分子降解的电极反 应都属于此类反应。分成两类:
吸附机理分为两类:
2.反应物首先在电极上进行解离式或缔合式化学吸附,随后 吸附中间物或吸附反应物进行电子传递或表面化学反应。
例如甲酸的电化学氧化:
HC 2 M O M O H H M COOH
M H M H e
M CO M O C 2 H O H e 或
HCOOH M M CO H2O M H2O M OH H e M CO M OHCO2 H e
目前已知的电催化剂主要为过渡金属及其化合物。
设计关键:选择过渡金属中心原子
特点:过渡金属的原子结构中都含有空余的d轨道和未成对 的d电子,通过催化剂与反应物的接触,催化剂空余d轨道上 将形成各种特征的吸附键,达到分子活化的目的,从而降低了 复杂反应的活化能。
主要为含有Ti, Ir, Pt, Ni, Ru等金属或合金及其氧化物。如 RuO2/Ti电极, RuO2-TiO2电极, Pt/Ti电极,Pt/GC电极
高二化学选修4课件:第4章 电化学基础

预习全程设计
第
一
节
名师全程导学
原
电
案例全程导航
池
训练全程跟踪
原电池及其工作原理 1.概念
把 化学 能转化为 电 能的装置.
Hale Waihona Puke 2.实验探究实验 现象
两个 Zn棒逐渐变 细 ,Cu棒逐渐变粗
烧杯中
外线路中
电流表指针 偏转
两个半 左烧杯
Zn-2e-===Zn2+
反应 右烧杯
Cu2++2e-===Cu
(5)根据反应现象判断.电极溶解的一极是负极.有固体 析出或有气体放出的一极是正极.
2.电极反应式的书写 (1)分清负极发生氧化反应,一般是本身被氧化,正极发
生还原反应,一般是电解质中的阳离子得电子. (2)看清电解质,电极反应中生成的离子能否存在. (3)注意得失电子守恒.
[特别关注] 原电池的电极类型不仅跟电极材料有关,还与电解
1.构成原电池电极的材料必须是活动性不同的两种金
属
()
提示:错误.只要能导电,非金属如石墨也可以作
原电池的正极材料,也有一些金属氧化物能够用于
作原电池的正极.
2.电池工作时,负极材料必须失电子被氧化 ( ) 提示:错误.有些燃料电池是利用燃烧的反应设计 而成的,如氢氧燃料电池、甲烷燃料电池等,都是 被燃烧物在负极处发生氧化反应,而负极材料并不 消耗.
烧过程(能量转换化仅30%多),有利于节约能源.
上述列举的化学电源与Cu-Zn(H2SO4)原电池的原理是 否相同? 提示:原理相同,都是设置特定装置,将自发进行的氧 化还原反应中转移的电子,通过外电路从负极流向正极, 从而产生电流.
1.任何电池,电量耗完后都可以充电使它恢复能量( ) 提示:错误.只有二次电池(可逆电池)才可以充电,不 可逆电池则不能充电.
大学化学第4章 电化学原理及应用

4
Ⅱ条件
任何自发进行的氧化还原(oxidation-reduction) 反应,只要设计适当,都可以设计成原电池用 以产生电流。
Ⅲ构成
将Zn浸入CuSO4溶液中 (△rGm =-271kJ/mol<0)。 可知反应能够自发发生,但不能形成电流。 原因:设计不合理。 但如果设计合理可以形成电流,A.Volta电池
法拉第
(Michael Faraday 1791-1867)
英国物理学家、化学家,也是著名的自学成才的科学家。出生在一 个贫苦铁匠家庭。仅上过几年小学,13岁时便在一家书店里当学徒。 在 此读到许多科学书籍。在送报、装订等工作之余,自学化学和电 学,并动手做简单的实验,验证书上的内容。利用业余时间听自然 哲学讲演,因而受到了自然科学的基础教育。1813年3月由戴维举荐 到皇家研究所任实验室助手。这是法拉第一生的转折点,从此他踏 上了献身科学研究的道路。同年10月戴维到欧洲大陆作科学考察, 讲学,法拉第作为他的秘书、助手随同前往。历时一年半,先后经 过法国、瑞士、意大利、德国、比利时、荷兰等国,结识了安培、 盖.吕萨克等著名学者。沿途法拉第协助戴维做了许多化学实验,这 大大丰富了他的科学知识,增长了实验才干,为他后来开展独立的 科学研究奠定了基础。1824年1月当选皇家学会会员,1825年2月任 皇家研究所实验室主任,1833----1862任皇家研究所化学教授。1846 年荣获伦福德奖章和皇家勋章。1867年8月25日逝世。
5
eA -Zn +Cu
Zn2+ SO42-
KCl饱 和溶液 胶冻
Cu2+ SO42-
铜-锌原电池
6
Ⅳ原电池的图示(cell diagram)表示 1负极(anode)写左边,正极(cathode)写右边;
电化学原理-第四章-电极过程概述

c 平 c
阳极极化时,
a a 平
⑵极化值
实际遇到的电极体系,在没有电流通过时,并不都 是可逆电极。在电流为零时,测得的电极电位可能是可 逆电极的平衡电应,也可能是不可逆电极的稳定电位。 因而,又往往把电极在没有电流通过时的电位统称为静 止电位。把有电流通过时的电极电位(极化电位)与静止 电位的差值称为极化值。
为此,对一个具体的电极过程.可以考虑按照以下四个
方面去进行研究。
1.
弄清电极反应的历程。也就是整个电极反应过程包括哪 些单元岁骤,这些单元步骤是以什么方式(串联还是并 联)组合的,及其组合顺序。
2.
找出电极过程的速度控制步骤。混和控制时,可以不只
有一个控制步骤。
3.
测定控制步骤的动力学参数。当电极过程处于稳态时,
化学反应(电池反应)过程至少包含阳极反应过程、 阴极反应过程和反应物质在溶液中的传递过程(液 相传质过程)等三部分。
ce
c
a
阴极:cathode
c
a
阳极:anode
ae
电极的极化:有电流通过电极 时,电极电位偏离平衡电位( 或稳定电位)的现象。 阴极极化:电极电位偏离平衡 电位向负移 阳极极化:电极电位偏离平衡 电位向正移 过电位:在一定电位下,电极 电位与平衡电位的差值
j净 j j逆
* *
* 为控制步骤的逆向反应绝对速度。由上式可知 式中 j逆
j净 j*逆
其它非控制步骤,比如电子转移步骤的绝对反应
速度为
(还原反应)和 j (氧化反应),由于 j 和 j 均比 j* 大得多,所以也比 j净 大得多。然而,对于
j
第4章 氧化还原反应与电化学习题
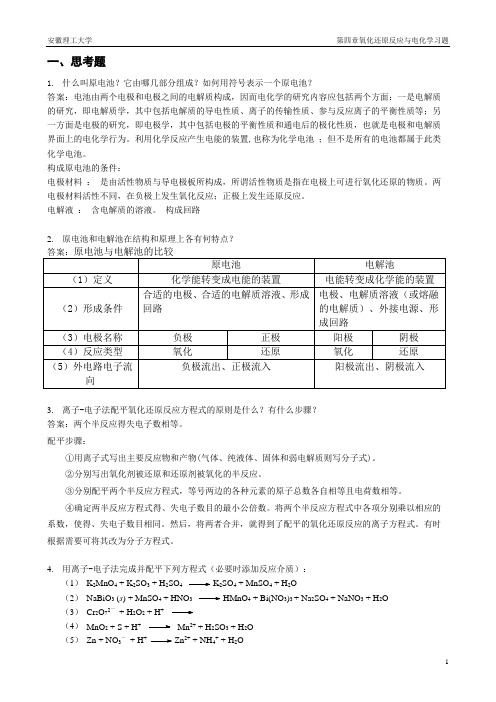
一、思考题1.什么叫原电池?它由哪几部分组成?如何用符号表示一个原电池?答案:电池由两个电极和电极之间的电解质构成,因而电化学的研究内容应包括两个方面:一是电解质的研究,即电解质学,其中包括电解质的导电性质、离子的传输性质、参与反应离子的平衡性质等;另一方面是电极的研究,即电极学,其中包括电极的平衡性质和通电后的极化性质,也就是电极和电解质界面上的电化学行为。
利用化学反应产生电能的装置,也称为化学电池;但不是所有的电池都属于此类化学电池。
构成原电池的条件:电极材料:是由活性物质与导电极板所构成,所谓活性物质是指在电极上可进行氧化还原的物质。
两电极材料活性不同,在负极上发生氧化反应;正极上发生还原反应。
电解液:含电解质的溶液。
构成回路2.原电池和电解池在结构和原理上各有何特点?3.离子-电子法配平氧化还原反应方程式的原则是什么?有什么步骤?答案:两个半反应得失电子数相等。
配平步骤:①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素的原子总数各自相等且电荷数相等。
④确定两半反应方程式得、失电子数目的最小公倍数。
将两个半反应方程式中各项分别乘以相应的系数,使得、失电子数目相同。
然后,将两者合并,就得到了配平的氧化还原反应的离子方程式。
有时根据需要可将其改为分子方程式。
4.用离子-电子法完成并配平下列方程式(必要时添加反应介质):(1)K2MnO4 + K2SO3 + H2SO4 K2SO4 + MnSO4 + H2O(2)NaBiO3 (s) + MnSO4 + HNO3 HMnO4 + Bi(NO3)3 + Na2SO4 + NaNO3 + H2O(3)Cr2O72—+ H2O2 + H+(4)MnO2 + S + H+Mn2+ + H2SO3 + H2O(5)Zn + NO3-+ H+Zn2+ + NH4+ + H2O(6) Ag + NO 3-+ H +Ag + + NO + H 2O(7) Al + NO 3-+ OH -+ H 2O [Al(OH)4]-+ NH 35. 如何用图示表示原电池? 答案:原电池符号(电池图示):书写原电池符号的规则:①负极“-”在左边,正极“+”在右边,盐桥用“‖”表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3)电导率 • 由于电催化剂是反应物和产物的电荷转 移反应活性位,并作为电子传输途径将电 子送至集流体,因此电催化剂必须具有良 好的导电性能。如果电催化剂本身的导电 性能差,必须用导电性良好的材料如石墨 等作载体。 • 另外,还应考虑资源、成本和加工性能 等因素。
•
4.3碳和石墨电极
碳和石墨是电化学工工业广泛应用的非 金属电极材料,既可作阴极、阳极材料, 又可作点催化剂载体、电极导电组分或骨 架、集流体,电解质溶液包括水溶液和熔 融电解质。 • 优点:1)导电和导热性好;2)耐蚀性 较好;3)容易加工各种形态(块、粉末、 纤维)和不同形状的电极;4)原料丰富、 价格低廉。 • 缺点:1)机械强度低、易磨损;2)在 一定条件下氧化损耗。
• 3)气体穿越双电层过程 • 该过程是指溶解气体穿过双电层(静止的 电解质溶液)到达电极表面的过程,在这 个过程中,扩散是气体的唯一传质方式。 • • 在上述三个过程中,一般第三个过程,即 扩散过程最慢,为气体传质过程的控制步 骤。
•
目前,已经在工业上广泛应用的气体扩 散电极包括防水型(憎水型)电极、双层 多孔型(培根型)、隔膜型和亲水型等。 • 1)防水型电极 • 为了使气体扩散电极能够形成足够的薄 液膜,即电极具有较多的三相界面,比较 有效的方法是采用防水型(憎水型、疏水 型)气体扩散电极。
• 对于反应机理相同的电极反应,可以用交 换电流密度和极化过电位值的大小来衡量 反应的催化活性。 • 交换电流密度越大,电极的催化活性越大; • 过电位越小,电极的催化活性越大。
• 氢-氧燃料电池,在应用中一般要求电池的工 作电流密度大于200mA/cm2,电池的工作电 压高于0.75V,0.15W/cm2。 • 由于阴极上氧气的还原过程具有很高的电化 学极化(高过电位),采用铂电极可以满足 上述要求。 • 如:电动汽车的功率为60kW,电极面积应为 40m2。
几种碳和石墨制品的孔隙率和密度
材料 真密度/g.cm-3 假密度/g.cm-3 孔隙率/%
石墨阳极
2.20~2.23
1.60~1.70
20~30
预焙阳极
2.03ቤተ መጻሕፍቲ ባይዱ2.05
1.50~1.58
底块碳
1.85~1.90
14~22
阳极糊
2.03~2.05
1.40~1.45
28~32
不同碳和石墨材料的电阻率
第4章 电极及电极材料
4.1 三相多孔电极 电化学工程中涉及气体的电化学反应,对于气 体电极反应,采用多孔电极,可以扩大接触面积, 减小反应电流密度,同时缩短传质路径,也可以减 小扩散的影响,此时电化学步骤成为控制步骤。 当电化学步骤成为控制步骤时,电极材料对电 极反应速率和选择性有明显的影响,如: 1)析氢速率,铂电极上比汞电极上快109倍; 2)吸氧速率,锡电极上比金电极上高107倍。 这种差异反映了电极对特定反应的催化作用, 由此可见催化剂在电化学反应过程中的重要性。
• 制备单分子层的主要方法有: • 共价键合法; • 吸附法; • 欠电位沉积法 (Under-Potential-Deposition , UPD,如:在熔盐或有机溶剂中,锂在铝电极上 沉积,由于铝锂的合金化作用,使得锂更容易还 原,还原电位正移)) • LB(Langmuir-Blodgett)膜法; • SA(Self-Assembling)膜法等。
• • • • •
多分子层修饰电极的制备方法主要有: 聚合物薄膜法; 欠电位沉积法; 气相沉积法等。 而用作修饰电极的基体材料包括金属、碳 和半导体等。
• 4.2.1电催化的作用 • 电催化剂对于反应速度非常缓慢的电极反 应过程尤为重要,它可以改变电极反应过 程机理(途径),降低电极反应的活化能 (表观活化能),提高电池的能量转化效 率。
• 若采用普通的电极,要想获得200mA/cm2 的输出电流,电池的输出远小于0.5V。 • 电池的电压效率和电池输出功率将损失 40%左右。 • 铂就是氧电极的有效催化剂。
• • •
• • •
•
4.2.2电催化剂的性能要求 1)稳定性 在电化学反应工程的特定工作环境中,电催化 剂具有良好的稳定性,如: 对于酸性电解质溶液,应具有耐酸腐蚀性能; 碱性电解质溶液,应具有耐碱腐蚀性能; 抗一氧化碳中毒,铂极易被一氧化碳中毒(通 过吸附),10ppm一氧化碳都能使铂催化剂中毒, 用铂-钯合金提高抗一氧化碳中毒性能; 对于高温燃料电池,应具有抗高温氧化性和腐 蚀性能。
• 对于孔径细小的微孔,由于附加压力大于 气体压力,微孔中的液体无法被气体取代, 或气体不能进入,这种作用的结果就形成 了与双层多孔电极相类似的三相反应区。 • 对于亲水型气体扩散电极的润湿程度或液 孔与气孔的分布,主要取决于气体压力和 微孔内的毛细力之差。 • 一般来说,在半径大的微孔中充满气体, 在半径较小的微孔中充满液体。
5.0~6.0×103
4.5~5.0×103
5.0~8.0×103
•
无定形碳在350℃发生明显氧化,石墨 则在450℃才明显氧化,反应速率与碳材料 的结构和气压有关。 • 除强氧化性介质(浓硫酸、浓硝酸、铬 酸、王水)及盐作用外,在一般的电解液 中是稳定的。 • 表层氧化成一氧化碳、二氧化碳,膨胀、 剥离; • 溶液的酸度、碳材料的特点都对石墨电 极的阳极腐有影响,但是一般较弱。
• 2)电催化活性 • 可以用电极反应的交换电流密度和过电 位衡量催化剂的电催化活性,电极反应的 交换电流密度越高,电催化剂的本征活性 越高。 • 电催化剂的活性与催化剂的晶格缺陷 (如空位、缝隙、位错晶界等)以及其表 面上化学物质的种类、电子结构、配位数 和局部对称性等有关,电催化剂对反应物 中的转化和利用率有影响。
三相(S-L-G)多孔电极过程,就是在 电化学反应过程中,气体在电极上发生氧 化或还原反应,当这种气体反应成为电极 上的主要反应或不可避免的副反应时,就 称该电极为三相多孔电极过程,或称为气 体扩散电极。 燃料电池中的氢电极和氧电极,金属-空 气电池的空气电极,其活性物质是气体, 气体电极反应为主要反应。 而在其它水溶液电化学反应过程中中, 氢气和氧气的电极反应就是不可避免的副 反应,如:电沉积铬、镍、锌等的析氢过 程等。
碳和石墨电极在电化学工业中的应用
生产过程或反应器 氯碱工业 应用 阳极
有机电解合成
水电解 无机电解合成 铝电解 熔盐电解(镁、钠)
阳极、阴极
阳极、阴极、电催化剂载体 固定床或流化床电极 阳极、电解槽内衬 阳极
低温燃料电池
锂非水溶液电池 锂离子电池 金属-空气电池
电催化剂载体、电催化剂、双极板
阴极的导电骨架 负极导电骨架 空气(正极)电极
•
• 电催化作用(Electrocatalysis)是在电场作 用下实现的,因此,它比普通非均相催化 过程更复杂。 • 电催化作用实际上是在一定过电位下,电 极反应速度随电极催化剂的改变而变化的 现象。
•
催化电极的表面修饰物(电催化剂), 可以是分子、原子、化合物和聚合物等。 按照电极表面上修饰物的微观结构的尺度 分为单分子层或多分子层,也可以是两者 的组合。 • 电极表面的修饰方法根据催化剂类型、 功能和基底电极材料的性质以及要求不同 而定。
材料 电阻率 /cm.Ω a轴 3.9×10-5 碳纤维 材料 Celanese PAN fiber ,GY-70 Vnion Carbide pitch fiber ,TP 4104B 电阻率/cm.Ω
5.0×10-4
C轴 石墨 多晶
1.0×10-2
2.0×10-4
8×10-4
玻璃碳
3.0~8.0×10-4
4.2催化电极
催化电极是指在电场的作用下,能促进 或抑制在电极上发生的电子转移反应,而 本身并不改变的那类电极,这种加速或抑 制电极反应的作用称为电催化作用。 • 催化电极通常是用化学方法等对其表面 进行修饰而实现的,所以催化电极又称为 化学修饰电极。 • 用于修饰电极的物质称为电催化剂,电 催化剂是催化电极的核心。 • 通常电催化剂可以是电极材料本身,也 可以是电极的一部分。
• 电极工作时,细孔层中充满电解质溶液, 而粗孔层中充满气体。 • 在压力为0.05~3.0MPa气体的作用下,在 粗孔和细孔层的交界处建立起弯液面薄液 膜。 • 燃料电池中的培根型电极就是这种双层结 构的气体扩散电极。
• •
3)隔膜电极 隔膜电极由催化剂微粒与氟树脂粘接剂 混合调成糊状,经过碾压成电极片。将这 种电极与微孔隔膜(如石棉隔膜)结合组 成微孔隔膜燃料电池。所用隔膜的孔径比 催化剂的孔径更小,于是加入的电解质溶 液首先被隔膜吸收,然后润湿催化剂层。
热解 铜
1.0~1.8×1 0-2 1.7×10-5
乙炔黑 铂
4.1×10-2 1.0×10-5
几种碳和石墨制品的机械、物理性能
材料 石墨阳极 各种碳块 预焙阳极 阳极糊 抗压强度 /kg.cm-2 250~350 350~450 350~450 250~350 抗弯强度 /kg.cm-2 185~220 电阻率/cm.Ω 6.0~9.0×104
• •
2)双层多孔型电极(培根型电极) 双层多孔型电极:由金属镍粉或羰基镍 粉、催化剂和成孔剂(如碳酸铵、碳酸氢 铵等)混合后,在模具中加压成型,再经 过高温烧结而成。这是一种不同孔径的双 层电极,粗孔层靠近气体一侧,气孔的平 均孔径为几十微,细孔层则靠近电解质溶 液,气孔的平均孔径为2~3um,粗孔径层 比细孔径层厚得多。
流体电池
水处理
阳极、阴极、电催化剂载体、集流体、双 极板
阳极、阴极等
碳和石墨电极在有机电解合成中的应用实例
反应 原料 苯胺 乙醇 乙烯 呋喃 葡萄糖 电解质 盐酸 盐酸 氯化钠(PH=10.6) 甲醇/溴化钠或溴化铵 水/溴化钠/碳酸钙 甲醇/高氯酸锂/碳酸氢钠 水/氯化钠/溴化钠 氨、氯化钠/或甲铵/氯化锂 主要产物 苯胺黑、四氯苯醌 氯醛 环氧乙烷、二氯化乙烯 二甲氧二氢呋喃 葡萄糖酸钙
