蛋白质一级结构决定高级结构
科学故事1.一级结构决定高级结构

科学故事:一级结构决定高级结构蛋白质的高级结构由其一级结构决定的学说最初由Christian B. Anfinsen于1954年提出。
在1950年之前,Anfinsen一直从事蛋白质结构方面的研究。
在进入美国国立卫生研究所(NIH)以后,继续从事这方面的研究。
当时他最想知道的是:一个蛋白质是如何折叠成它独特的三维构象的?需不需要其他酶的帮助?蛋白质为什么要采取特定的构象?Christian B.Anfinsen然而,要想了解蛋白质的折叠过程,首先需要建立一种方法能够测量或评估蛋白质的构象,其次还需要找到一种手段用以检测折叠过程。
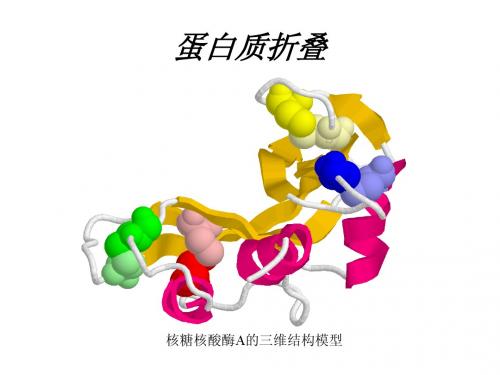
Anfinsen以牛胰核糖核酸酶(ribonuclease)为研究对象轻而易举地解决了第一个问题(实际上选用此酶的部分原因是当时的芝加哥肉类加工公司能够为他的实验室随时提供足够的原材料),因为核糖核酸酶催化RNA的水解,其酶活性完全取决于其特定的三维构象,于是酶活性成为测量这种蛋白质采取何种构象的一种方法。
但要观测折叠过程既可以从一个新合成的尚没有折叠的蛋白质开始,也可以在体外将一个已折叠好的蛋白质去折叠(unfold),然后再观察它的再折叠(refold)过程。
Anfinsen选择了后一种途径。
事实上,这种酶特别适合用后一种途径进行研究,首先因为二硫键是决定其分子形状的主要因素。
另外,此酶是一种单纯蛋白质,只有124个氨基酸残基组成,含有4个二硫键,而且其活性很容易通过测定水解RNA释放出来的核苷酸量来测定。
Anfinsen和两个博士后Michael Sela、Fred White在研究中发现,使用高浓度的巯基试剂——β- 巯基乙醇(β- mercaptoethanol)可将二硫键还原成自由的巯基,如果再加入尿素,进一步破坏已被还原的核糖核酸酶分子内部的次级键,则该酶将去折叠转变成无任何活性的无规卷曲。
对还原的核糖核酸酶的物理性质进行分析的结果清楚地表明了它的确采取的是无规卷曲的形状。
蛋白质的一二三四结构

一、蛋白质的一级结构蛋白质的一级结构(primary structure)就是蛋白质多肽链中氨基酸残基的排列顺序(sequence),也是蛋白质最基本的结构。
它是由基因上遗传密码的排列顺序所决定的。
各种氨基酸按遗传密码的顺序,通过肽键连接起来,成为多肽链,故肽键是蛋白质结构中的主键。
迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。
蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物学活性,决定每一种蛋白质的生物学活性的结构特点,首先在于其肽链的氨基酸序列,由于组成蛋白质的20种氨基酸各具特殊的侧链,侧链基团的理化性质和空间排布各不相同,当它们按照不同的序列关系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子。
二、蛋白质的空间结构蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空间结构。
蛋白质的生物学活性和理化性质主要决定于空间结构的完整,因此仅仅测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生物学活性和理化性质。
例如球状蛋白质(多见于血浆中的白蛋白、球蛋白、血红蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等),前者溶于水,后者不溶于水,显而易见,此种性质不能仅用蛋白质的一级结构的氨基酸排列顺序来解释。
蛋白质的空间结构就是指蛋白质的二级、三级和四级结构。
(一)蛋白质的二级结构蛋白质的二级结构(secondary structure)是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
1.肽键平面(或称酰胺平面,amide plane)。
Pauling等人对一些简单的肽及氨基酸的酰胺等进行了X线衍射分析,得出图1-2所示结构,从一个肽键的周围来看,得知:(1)中的C-N键长0.132nm,比相邻的N-C单键(0.147nm)短,而较一般C=N双键(0.128nm)长,可见,肽键中-C-N-键的性质介于单、双键之间,具有部分双键的性质,因而不能旋转,这就将固定在一个平面之内。
第三章课用蛋白质结构与功能的关系

蛋白质的理化性质
The Physical and Chemical Characters of Protein
一、蛋白质具有两性电离的性质
蛋白质分子除两端的氨基和羧基可解离外, 氨基酸残基侧链中某些基团,在一定的溶液pH条 件下都可解离成带负电荷或正电荷的基团。
蛋白质的等电点( isoelectric point, pI) 当蛋白质溶液处于某一pH时,蛋白质解离成
蛋白质沉淀:在一定条件下,蛋白疏水侧链暴露在外,肽链融会相互 缠绕继而聚集,因而从溶液中析出。变性的蛋白质易于沉淀,有时蛋 白质发生沉淀,但并不变性。
▪ 常用沉淀方法 : ⒈盐析法(salt-out):中性盐(硫酸胺、硫酸钠和氯化钠)使蛋白质脱
去水化层而聚集沉淀。 ⒉有机溶剂沉淀: 甲醛、乙醇、丙酮,引起蛋白质脱去水化层,降低介
PrPc α-螺旋
PrPsc β-折叠
正常
疯牛病
▪老年痴呆症,又称阿尔茨海默 病 (Alzheimer's disease,AD) 是发生在老 年期及老年前期的一种原发性退行性脑 病,其特征性病理变化为大脑皮层萎缩, 并伴有β-淀粉样蛋白沉积,神经原纤维 缠结 ,记忆性神经元数目大量减少,以 及老年斑的形成。
第三章
蛋白质结构与功能的关系
The Relation of Structure and Function of Protein
一、蛋白质一级结构是高级结构与功能的基础
(一)一级结构是空间构象的基础
二
硫
键
牛核糖核酸酶 的一级结构
20世纪60年代初,美国科学家C.Anfinsen进行牛胰核糖核酸酶 的变性和复性实验,提出了蛋白质一级结构决定空间结构的 命题。
蛋白质结构与功能(3)

1)胰岛素原的激活:蛋白激酶切下C肽 胰岛素Insulin首先合成108个氨基酸的前胰岛素原 (pre-proinsulin),随即切去N-端的24个氨基酸信号 肽,形成84个氨基酸的胰岛素原(proinsulin),形成 正确的二硫键,在包装分泌时,A、B链之间的33个氨基 酸C肽残基被切除,才形成胰岛素。人工合成的胰岛素, A、B链分别合成后,等比例混合后就有活性。
• ④肌红蛋白与血红蛋白均能与O2结合,但在 此过程中直接与O2作用的蛋白质部分只占少 数(HisF8、HisE7及血红素)。但整个蛋白 质的结构保证了HisF8和HisE7这两个His残基 以及血红素在蛋白质中所处的位置,从而也保 证了功能部分的活性结构。同时,蛋白质的结 构也保护了亚铁血红素在结合氧的过程中不被 氧化成失去结合能力的高铁血红素。由此可见, 蛋白质的结构保证了蛋白质功能的完成。
肌红蛋白Myoglobin(Mb)结构与功能
肌红蛋白:是哺乳动物细胞主要 是肌细胞贮存和分配氧的蛋白质。 肌红蛋白是由一条多肽链和一个 辅基血红素(原卟啉IX 和Fe的 络合物)组成,除去血红素的脱 辅基肌红蛋白称珠蛋白 (globin),它和血红蛋白的亚 基在氨基酸序列上有明显的同源 性,构象和功能也相似,由8个 α-螺旋组成。
免疫球蛋白的结构与功能
1、 抗原与抗体
★抗原是指进入异体机体后,能致敏淋巴细胞产生特异抗体,
并能与抗体发生特异结合的物质(主要有蛋白质、核酸及其
它高分子化合物)。 ★抗原性包括免疫原性和抗原特异性。
★免疫原性是指诱导特异免疫反应的能力。
★抗原特异性是指与抗体特异结合的能力。 ★抗原决定簇:抗原性由抗原分子表面特殊的化学基团决定 (一级结构或空间结构),这种决定或控制抗原性的化学基 团称抗原决定簇。
第一篇 蛋白质的结构与功能-蛋白质III
PrPc与PrPsc在构象上的主要差别:(1)PrPc;(2)PrPsc
分子伴侣催化蛋白质的折叠
GroEL/GroES复合物的三维结构模式图
PDI的作用机制
PPI催化的反应
与蛋白质错误折叠相关的疾病
阿尔茨海默氏病(Alzheimer's disease,AD) 帕金森氏病(Parkinson's disease,PD) 海绵状脑病(spongiform encephalopathy,SE)
蛋白质折叠的“滑雪”模型
体内蛋白质折叠的不同途径
分子伴侣
帮助体内球状蛋白折叠的一类蛋白质 最常见的分子伴侣有两大类:热激蛋白70类家族 (HSP70类)和伴侣素(chaperonin)家族。 HSP70类分子伴侣通过与部分折叠的蛋白质的疏
水区域的临时结合而促进蛋白质的正确折叠。 伴侣素则形成大的桶状结构容纳部分折叠的蛋白 质完成折叠。一旦蛋白质折叠好,分子伴侣即被 释放,然后再参与另一个新生蛋白质的折叠。
Levinthal氏悖论
假定一个由100个氨基酸残基组成的蛋白质,其每 一个氨基酸残基有2个构象,那么,这个蛋白质的 总构象数目是2100=1.27×1030。再假定此蛋白质为 了寻找总能量最低的构象状态,其每尝试一次构 象耗时10-13秒,则将所有可能的构象都尝试完成 需要的时间是:(10-13)(1.27×1030)=1.27×1017秒= 4×109 年!
nsen实验
牛胰核糖核酸酶的变性和复性实验
体外蛋白质折叠历程
三个阶段的反应: (1)启动—快速地形成局部二级结构,即折叠核。此过程 是可逆的; (2)折叠核协同聚合成结构域; (3)结构域经熔球态(molten globule)中间体最终形成具 有完整三维结构的蛋白质。熔球态中间体被认为是疏水塌 陷(hydrophobic collapse)的结果,这样的状态含有某些 二级结构,但还没有形成正确的三级结构。其形成受疏水 侧链的快速包埋驱动。
生化组习题(配答案) (1)

生化测试一 氨基酸一、填空题1.氨基酸的结构通式为 。
2.氨基酸在等电点时,主要以 兼性/两性 离子形式存在,在pH>pI 的溶液中,大部分以 阴离子形式存在,在pH<pI 的溶液中,大部分以 阳 离子形式存在。
3.生理条件下(pH7.0左右),蛋白质分子中的 Arg 侧链和 Lys 侧链几乎完全带正电荷,但His 侧链带部分正电荷。
4.测定蛋白质紫外吸收的波长,一般在 280nm ,主要由于蛋白质中存在着 Phe 、Trp 、Tyr 氨基酸残基侧链基团。
5.皮肤遇茚三酮试剂变成 蓝紫 色,是因为皮肤中含有 蛋白质(氨基酸)所致。
6.Lys 的pk 1(α—COOH )=2.18,pk 2(α—3H N +)=8.95,pk 3(ε—3H N +)=10.53,其pI 为 9.74。
在pH=5.0的溶液中电泳,Lys 向 负 极移动。
7.Henderson —Hasselbalch 方程为pH=pKa+lg[质子受体]/ [质子受体]。
8.实验室常用的甲醛滴定是利用氨基酸的氨基与中性甲醛反应,然后用碱(NaOH )来滴定 上放出的 NH 3+/氨基。
9.一个带负电荷的氨基酸可牢固地结合到阴离子交换树脂上,因此需要一种比原来缓冲液pH 值 小 和离子强度 高 的缓冲液,才能将此氨基酸洗脱下来。
10.用 N-溴代琥珀酰亚胺 试剂可区分丙氨酸和色氨酸。
二、选择题1.区分极性氨基酸和非极性氨基酸是根据 (C )A. 所含的羧基和氨基的极性B. 所含氨基和羧基的数目C. 所含的R 基团为极性或非极性D. 脂肪族氨基酸为极性氨基2.下列哪一种氨基酸不属于人体必需氨基酸 (D )A. 亮氨酸B. 异亮氨酸C. 苯丙氨酸D. 酪氨酸3.下列哪一组氨基酸为酸性氨基酸: (D )A. 精氨酸,赖氨酸B. 谷氨酸,谷氨酰胺C. 组氨酸,精氨酸D. 谷氨酸,天冬氨酸4.含硫的必需氨基酸是 (B )A. 半胱氨酸B. 蛋氨酸C. 苏氨酸D. 亮氨酸5.芳香族必需氨基酸包括 (D )A. 蛋氨酸B. 酪氨酸C. 亮氨酸D. 苯丙氨酸6.含四个氮原子的氨基酸是 (B )A. 赖氨酸B. 精氨酸C. 酪氨酸D. 色氨酸7.蛋白质中不存在的氨基酸是下列中的哪一种?(D )A. 赖氨酸B. 羟赖氨酸C. 酪氨酸D.鸟氨酸8.在蛋白质中不是L-氨基酸的是(B )A. 苏氨酸B. 甘氨酸C. 半胱氨酸D. 谷氨酰胺9.谷氨酸的PK 值为2.19, 4.25, 9.76; 赖氨酸的PK 值为2.18, 8.95, 10.53; 则它们的PI 值分别为(B )A. 2.19和10.53B. 3.22和9.74C. 6.96和5.56D. 5.93和6.3610.从赖氨酸中分离出谷氨酸的可能性最小的方法是(D )A. 纸层析B. 阳离子交换层析C. 电泳D. 葡萄糖凝胶过滤11.用于确定多肽中N-末端氨基酸的是(C )A. Sanger 试剂B. Edman 试剂C. 两者均可D. 两者均不可12.有一蛋白质水解物,在PH6时,用阳离子交换柱层析,第一个被洗脱的氨基酸是(C )A. Val (PI5.96)B. Lys (PI9.74)C. Asp (PI2.77)D. Arg (PI10.76)13.下列那种氨基酸属于非编码氨基酸?(D)A. 脯氨酸B. 精氨酸C. 酪氨酸D. 羟赖氨酸14.可使二硫键氧化断裂的试剂是(C)A. 尿素B. 巯基乙醇C. 过甲酸D. SDS15.没有旋光性的氨基酸是(C)A. AlaB. ProC. GlyD. Glu16. Sanger试剂是(B)A.苯异硫氰酸酯B. 2,4—二硝基氟苯C. 丹磺酰氯D.β-巯基乙醇17.酶分子可逆共价修饰进行的磷酸化作用主要发生在哪一个氨基酸上(B)A. AlaB. SerC. GluD. Lys18.当含有Ala,Asp,Leu,Arg的混合物在pH3.9条件下进行电泳时,哪一种氨基酸移向正极(+)(B)A. AlaB. AspC. LeuD. Arg19.下列哪种氨基酸溶液不使平面偏振光发生偏转(B)A. ProB. GlyC. LeuD. Lys20.对哺乳动物来说,下列哪种氨基酸是非必需氨基酸(C)A. PheB. LysC. TyrD. Met21.一个谷氨酸溶液,用5ml的1M的NaOH来滴定,溶液中的PH从1.0上升到7.0,下列数据中哪一个接近于该溶液中所含谷氨酸的毫摩尔数为(B)A. 1.5B. 3.0C. 6.0D. 1222.下列AA中含氮量最高的是(A)A. ArgB.HisC.GlnD. Lys23.下列在280nm具有最大光吸收的基团是(A)A.色氨酸的吲哚环B.酪氨酸的酚环C.苯丙氨酸的苯环D.半胱氨酸的硫原子24.在生理pH值条件下,具有缓冲作用的氨基酸残基是(C)A. TyrB. TrpC. HisD. Lys25.下列关于离子交换树脂的叙述哪一个是不正确的?(D)A.是人工合成的不溶于水的高分子聚合物B.阴离子交换树脂可交换的离子是阴离子C.有阳离子交换树脂和阴离子交换树脂两类D.阳离子交换树脂可交换的离子是阴离子26.下列哪种氨基酸可使肽链之间形成共价交联结构(D)A.MetB. SerC. GluD. Cys27.下列氨基酸中哪个含有吲哚环?(C)A.MetB. TyrC. TrpD. His三、名词解释1. α-氨基酸:是含有氨基的羧酸,氨基连接在α-碳上。
八 举例说明蛋白质结构与功能的关系

• 一、1、蛋白质一级结构决定高级结构,高级结构决定生 物功能。
• 2、在不同种属之间,有些AA发生变化,不影响他的生物 功能,例如,胰岛素的种属差异十分明显,但不同种属间 分离得到的胰岛素具有相同的将血糖作用,不同种属间胰 岛素的一级结构稍有不同,但功能相同,主要是不同种属 间具有20个不变AA残基构成的保守区决定的。
• 4、总之,蛋白质一级结构中各AA贡献不同,不变残基在 蛋白质高级结构和功能上起重要作用,可变残基发生改变, 不引起功能变化。不变残基在功能上起作用,可变残基在 蛋白质进化上起重要作用。
• 二、1、蛋白质高级结构与功能的高度统一,结构决定功 能。
• 例如血红蛋白的变构效应。血红蛋白由4个亚基组成,2个 a亚基,2个b亚基,分子中的a亚基对氧的亲和力比b亚基 大,能首先与第一个氧结合,导致a亚基构象发生变化, 进而引起相邻的b亚基的构象也发生变化,增强b亚基对 氧的亲和力。由于导致整个血红蛋白分子构象发生改变, 与氧的结合能力大大加强,在肺部充分利用氧,使氧分压 不致过高,在血液流经组织内时,当第一个氧放出后,其 余三个氧很快放出,供组织利用氧。
• 此外,还包括细胞色素C,肌红蛋白,血红蛋白等一级结 构稍有不同,功能相似。
ห้องสมุดไป่ตู้
• 3、在不同种属之间,由于基因突变,有些AA发生微观变 化就引起功能的明显变化。例如,人的镰刀状红细胞贫血 病和地中海贫血病。人的血红蛋白B链中第6位Glu被Val代 替,由一个AA的变化,导致红细胞呈镰刀状,降低运氧能 力一起细胞形态和功能的变化。
• 由于氧气与血红蛋白亚基结合导致整个分子构象发生变化, 提高运氧能力。
蛋白质的高级结构

蛋白质的高级结构1 . 氨基酸等电点:氨基酸分子净电荷为零时溶液的 PH 值称为等电点。
2. 肽键:氨基酸之间脱水后形成的共价键。
肽键的结构与性质:具有部分双键性质的肽键不能自由旋转,参与肽键形成的6个原子共处于一个平面--肽平面(Cα1,C,O,N,H,Cα2)与Cα相连的两个单键可以置于旋转,由此产生两个旋转角(Cα-N小写,Cα-C大写,拉式作图)多为反式,X-Pro除外N带部分正电荷,O带部分负电荷3.蛋白质的一级结构:是指蛋白质肽链中氨基酸的序列,它们之间以肽键相连,有的还有二硫键。
蛋白质的一级结构是最基本的结构,决定了蛋白质的高级结构。
4. 构型:指不对称碳上相连的各原子/取代基的空间排布(D/L型)--构型改变涉及共价键5. 构象:在相同构型的化合物中,与碳原子相连的各原子/取代基在单键旋转时形成的空间排布蛋白质的构象:肽键具有部分双键性质,不能自由旋转;氨基酸残基侧链还有空间位阻和静电效应6. a-螺旋: a-螺旋是蛋白质中最常见、含量最丰富的二级结构。
由多肽主链盘绕形成。
每圈螺旋包括 3.6 个氨基酸残基,螺距 0.54nm,每个 aa 沿轴上升 0.1 5nm。
a-螺旋中氨基酸残基的侧链伸向外侧。
相邻螺圈之间形成链内氢键,氢键的趋向几乎与螺旋轴平行。
•肽链中的肽平面绕Cα相继旋转一定角度形成α-螺旋,并盘绕前进•3.6个aa螺旋上升一圈;间距0.54nm•右手螺旋,每个氨基酸残基的N-H都与前面第四个残基C=O形成氢键(13个原子)•侧链:o遇到Pro就会被中断而拐弯(亚氨基酸,不能充当氢键供体,刚性的环)o Gly上只有两个H,两个单键旋转自由度很大,螺旋稳定性大大降低o带相同电荷的氨基酸残基连续出现时,稳定性降低o N端为酸性,C端为碱性可以中和N端为正,C端为负的偶极矩的影响;还可以是N与磷酸基团结合,C端与金属离子结合(不重要)7. B-折叠:在相邻肽链主链上的-NH 和 C=O 之间形成有规则的氢键的多肽链构象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单链。 含有8个半胱氨酸组成的4个二硫键:
a
测定蛋白质一级结构的应用
• 推测蛋白质高级结构。蛋白质的一级结构可通过 多种方法测定。由于二十种氨基酸在几种二级结 构中出现的频率是不同的.进而求出每一种氨基酸 的构象参数,可以由此预测蛋白质的二级结构。 我们进一步从肽键的统计分析出发,指出二肽和 三肽的关联频率和二级结构间的相关性,利用二 肽和三肽构象参数进行预测,正确率可达90%。 但是蛋白质折叠是相当复杂的。且肽链在体外折 叠与比在生物体内折叠慢。到现在为止,我们仍 然不能根据一个蛋白质的一级结构推断出它的三 维结构。
a
思考练习
1.下列能正确表示蛋白质分子由简到繁的结 构层次的一组是( ) ①氨基酸 ②C、H、O、N等化学元素 ③氨 基酸分子相互结合 ④多肽 ⑤肽链 ⑥形成 具有一定空间结构的蛋白质分子 A.①②③ ④⑤⑥ B.②①④③⑥⑤ C.②①④③ ⑤⑥ D.②①③④⑤⑥ 答案:D
a
超二级结构
• 超二级结构:相邻的二级结构元件组合在 一起,彼此相互作用,形成有规则,在空 间上能辨认的二级结构组合或二级结构串 ,充当三级结构的构件,称为超二级结构 。
• 主要作用力:疏水作用对维系超二级结构 的稳定有很大贡献。
a
蛋白质结构与功能的关系
• 蛋白质的结构是蛋白质功能的基础,有什 么样的结构则对应什么样的功能,正是蛋 白质结构的多样性导致了其功能的多样性 。 所以说,蛋白质的结构决定其功能,而蛋 白质的功能是其结构的体现。 一级结构与空间结构对维持蛋白质的生物 学活性均有重要的作用。
蛋白质的内部。
a
疏水作用、离子键、氢键、范德华力(如图)。
a
蛋白质的四级结构
• 四级结构:蛋白质分子中各个亚基的空间排布以及亚基接 触部位的布局和相互作用。
• 蛋白质的亚基(subunit):蛋白质分子中具有独立三级结 构的多肽链。
• 含有四级结构的蛋白质分子具有复杂的生物学功能,但是, 单独的亚基一般没有生物学功能或功能不完整。
(Mb)三级结构。
a
蛋白质三级结构的形成与稳定主要靠次级键
• 1.氢键:多肽链主链之间、主链与极性侧链之间、极性侧链之间都 可形成氢键。
• 2.二硫键 • 3.离子键又称盐键:是由蛋白质带正电荷的基团和带负电荷的基团
形成。 • 4.疏水基相互作用又称疏水键:是由缬氨酸、亮氨酸、异亮氨酸、
苯丙氨酸等非极性疏水侧链之间的吸引力,形成的疏水区。 • 5.蛋白质三级结构中疏水键的数量最多(最主要),且往往居于球状
a
测定蛋白质一级结构的应用
• 推测蛋白质功能。蛋白质分子中关键活性 部位氨基酸残基的改变,会影响其生理功 能,甚至造成分子病。例如镰状细胞贫血, 就是由于血红蛋白分子中两个β亚基第6位 正常的谷氨酸变异成了缬氨酸,从酸性氨 基酸换成了中性支链氨基酸,降低了血红 蛋白在红细胞中的溶解度,使它在红细胞 中随血流至氧分压低的外周毛细血管时, 容易凝聚并沉淀析出,从而造成红细胞破 裂溶血和运氧功能的低下。
a
测定蛋白质一级结构的应用
• 研究生物进化。不同生物体的同源蛋白质 一级结构在氨基酸组成和顺序上不同,存 在种属差异。同源蛋白质一级结构的差异 可反映种属间的亲缘关系,但不影响其生 物学功能。
a
蛋白质的一级结构如何决定高级结 构?
• 一级结构也就是氨基酸序列,像是一些碱 性氨基酸或是带电荷氨基酸会对蛋白质的 二级结构产生决定性的作用,比如脯氨酸 经常出现在肽链的折叠处。这样下来组成 蛋白一级结构的氨基酸间形成像氢键、二 硫键这样的次级键,导致了蛋白二级结构 的形成,如α折叠等。三级结构又是由二级 结构所决定的,多个二级结构形成结构域 ,而四级结构又是由几个三级结构组成的 ,所以说蛋白质的一级结构决定了高级结 构。
一级结构对高级结 构的影响
生工1班:于墨然、王哲 李贤达、李静阳 陈研、尚星宇
制作人:陈研
a
蛋白质的结构层次
蛋
一级结构
白 质
二级结构
的
超二级结构
结
三级结构
构
层
四级结构
次 a
蛋白质一级结构
蛋白质的一级结构(primary structure) 蛋白质分子中各种氨基酸的排列顺序。 1969年国际纯化学与应用化学联合会(IUPAC)的规定 。 氨基酸序列
一级结构的主要化学键是肽键,有些还包括二硫键 (-S-S-)。
因共价键的键能大,故蛋白质的一级结构稳定性较强。
a
牛胰岛素的一级结构
注:数字表示半胱氨酸的编号。 a
人胰岛素的一级结构
a
a
蛋白质的二级结构
二级结构:是指多肽链主链盘旋 、折叠形成的主链构象(某一肽 段的局部空间结构)。 主要作用力:二级结构除了肽键 还有以氢键为主的弱作用力,它 的螺旋主要由氢键维持。
a
蛋白质一级结构与功能的关系
• 一级结构是构象的基础,构象决定蛋白质的功能。 • 对于维持蛋白质功能区的特定构象,一级结构中某些氨基酸残基是必
需的。 • 如果这些必需的氨基酸残基发生改变,蛋白质特定构象即被破坏,蛋
白质的生物学活性也会丧失。因此,一级结构是空间结构的基础。 • 蛋白质空间构象被破坏以后,只要一级结构没有破坏,就有可能恢复
• 蛋白质四级结构是建立在三级结构基础上的,单体蛋白质 甚至不存在四级结构。因此蛋白质四级结构的形成仍然由 一级结构决定。
a
a
a
注意
• 蛋白质的空间结构(高级结构)只有三种 :二级结构、三级结构和四级结构。 并不 是所有的蛋白质都具有四级结构,只有多 亚基蛋白才具有四级结构。所有的蛋白质 都具有一级结构、二级结构和三级结构。 蛋白质的高级结构根本上还是决定于蛋白 质的一级结构。 另外,蛋白质在二级结构 的基础上还会形成超二级结构。
a
蛋白质二级结构的基本形式(分子模型)
• α-螺旋(α-helix)——最常见、含量最丰富的二级结构 • 以肽平面为单位、以α碳为转折形成的稳固的右手螺旋。
a
β-折叠(β-pleated sheet)
• β-折叠是蛋白质肽链主链的肽平面折叠呈锯齿状。又称β-片层结构。
a
蛋白质的三级结构
• 指整条肽链中全部氨基酸残基的相对空间位置; • 即整条肽链所有原子在三维空间的排布位置。下图为肌红蛋白的
