第2课时-气体摩尔体积(知识点归纳及例题解析)
气体摩尔体积-第二讲

气体摩尔体积四、气体摩尔体积1、定义:单位物质的量(即1 mol)的气体具有的体积。
在标准状况下,1mol的任何气体所占的体积都约是22.4L,这个体积叫做标准状况下气体的摩尔体积。
符号:Vm单位:L·mol-1理解:(1)它只适用于气体(单一或混合气体都可以)。
(2)标准状况下(0 ℃,1.01×105Pa)。
(3)在标况下,气体的物质的量为1mol时,体积都约为22.4L。
(4)谈论气体体积时,必须要说明温度和压强,否则没有意义举例:分别计算:1 mol 氧气和氢气的体积。
密度H2 = 0.0899 g / L 密度O2 = 1.429 g / L1 mol Fe、Al、H2O、H2SO4的体积。
密度分别为:7.86 、2.70 、0.998 、1.83单位:g / cm32、影响体积的因素:(1)粒子数目(2)粒子间的距离(3)粒子本身大小五、阿伏加德罗定律和推论1、定义:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子数。
表达式:P1/P2 = N1/N2 = n1/n22、推论:对于任何气体( PV=nRT ,气态方程)①在同温同压下气体体积V与物质的量n之间的关系为:V1:V2=n1:n2②在同温同压同体积时其质量m、式量M、密度d之间的关系为:m1:m2=M1:M1=d1:d2=D(D表示相对密度)③在同温同体积时其压强P与物质的量n之间的关系为:P1:P2=n1:n2④在同温同压同质量时其体积V与式量M之间的关系为:V1:V2=M2:M1气体摩尔体积习题一、选择题1.对1mol H2O的说法正确的是()A 含有6.02×1023个氢分子B 含有6.02×2×1023个氢元素C 质量为18gD 氢原子与氧原子的物质的量之比为2:12.跟2.8g N2含有相同分子数的下列物质是()A 16g氧气B 0.1mol甲烷分子C 1.8g水D 3.01×1022个磷酸分子3.下列数量的物质中,含原子数最多的是()A 标准状况下11.2升CO2B 0.2mol NH3C 13.5g 水D 6.02×1023个Ar 原子4.同温同压下,下列气体的密度最大的是( )A F 2B Cl 2C HClD CO 25.下列叙述正确的是( )A 1mol 任何气体的体积都约为22.4LB 48g O 3和1.5mol O 2所含氧原子数相等C 17g OH - 和19g H 3O + 所含电子数相等D 28g 氮气所含原子数为阿伏加德罗常数6.下列说法正确的是( )A 三氧化硫的摩尔质量是80gB 氧原子的质量就是氧的相对原子质量C 氖的摩尔质量在数值上等于它的原子量D 1mol 氩气和1mol 氟气具有相同的质子数7.在标准状况下,下列物质占体积最大的是( )A 98g H 2SO 4B 6.02×1023个氮分子C 44.8L HClD 6g 氢气8.在标准状况下, 如果2.8升氧气含有n 个氧分子,则阿伏加德罗常数为( )A 8nB 16n C 16n D 8n 9.在标准状况下,1升某气体的质量为1.25g , 则该气体可能是( )A H 2B N 2C COD CO 210.1升甲气体和2升乙气体恰好完全化合生成2升丙气体(同温同压下测定),若丙气体的分子式为YX 2,则甲和乙的分子式依次是( )A Y 2与X 2B XY 和X 2C X 2和YXD YX 与Y 211.同温同压下某瓶充满O 2时重116g ,充满CO 2时重122g ,充满某气体时重132g ,则该未知气体的分子量为( )A 28B 64C 32D 4412.两个体积相同的容器,一个盛NO ,另一个盛N 2和O 2,在同温同压下,两容器内的气体一定具有相同的( )A 原子总数B 质子总数C 分子总数D 质量二、填空题13.0.5mol H2SO4的质量是g,含个分子,含mol氧原子,能和mol NaOH完全反应,该硫酸所含氢元素的质量与mol H3PO4或g HCl中所含氢元素的质量相同.14.质量相等的SO2和SO3,物质的量之比为,硫原子的原子个数之比为,氧原子的原子个数之比为.15.12.8g氧气与L(标准状况)的CO气体所含氧原子数相同,与mol SO2所含的分子数相同.。
新教材课标版高中化学教师用书232第二课时气体摩尔体积

第二课时气体摩尔体积学习目标:1.了解气体摩尔体积的含义和应用。
2.能运用气体摩尔体积进行简单计算。
1.分别计算在一定条件下,1 mol不同物质的体积分析表中的数据,能得出结论:(1)相同条件下1_mol固体、液体的体积差别较大。
(2)相同条件下,1_mol气体的体积近似相等,在标准状况下约为_L。
2.气体摩尔体积(1)定义:单位物质的量的气体所占有的体积。
符号:V m,单位L·mol-1(或L/mol)。
(2)计算公式:V m=V n。
(3)影响气体摩尔体积的因素:气体摩尔体积的数值取决于气体所处的温度和压强。
(4)标准状况下(即0℃、101_kPa),气体摩尔体积约为_L·mol-1。
3.阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同数目的粒子。
1.判断正误(正确的打“√”,错误的打“×”)(1)标准状况下,1 mol任何物质的体积都约是22.4 L()(2)标准状况下,1 mol H2和N2的混合气体的体积约为22.4 L()(3)1 mol CO和1 mol O2所含分子数相同,体积也相同()(4)22.4 L N2含阿伏加德罗常数个氮分子()(5)同温同压下,同体积的NH3、SO2、CH4三种气体中,质量最大的是SO2()[答案](1)×(2)√(3)×(4)×(5)√2.下列说法正确的是()A.在标准状况下,1 mol水的体积是22.4 LB.1 mol氢气所占的体积一定是22.4 LC.标准状况下,×1023个Cu原子所占有的体积约是22.4 LD.标准状况下,28 g N2与CO的混合气体,体积为22.4 L[解析]A项中的水、C项中的Cu均不是气体,而气体摩尔体积只适用于气体;B项未指明温度、压强;D项中N2和CO的摩尔质量均为28 g·mol-1,则其体积V=n·V m=mM·V m=28 g28 g·mol-1×22.4L·mol-1=22.4 L,D正确。
高中化学 1.3.2 气体摩尔体积(探究导学课型) 鲁科版必修1

二、气体体积的影响因素与阿伏加德罗定律
1.在一定的温度和压强下,1 mol任何气体的体积都基本相等吗? 提示:物质的体积主要决定于微粒的多少、微粒的大小、微粒之 间的距离。对于固体和液体,由于微粒间的距离很小,1 mol物 质的体积主要决定于微粒的大小。对于气体来说,常温、常压下, 分子的平均距离比分子直径大得多,分子的体积可以忽略不计, 即与气体的分子种类无关,故1 mol气体的体积决定于气体分子 间的距离,而分子间的距离主要由温度和压强决定,所以在一定 的温度和压强下,1 mol任何气体的体积都基本相等。
阿伏加德罗定律的两个核心与四个常用推论 (1)两个核心。 ①适用对象:单一气体或混合气体。 ②“三同”定“一等”:只有在同温、同压、同体积的条件下, 才有分子数相等这一结论。
(2)四个常用推论。
①同温、同压→气体的体积与物质的量成正比
→ V1 n1 ;
V2 n2
②同温、同压→气体的密度与摩尔质量成正比 → 1 M 1 ;
摩
m3·mol-1。
尔 体
计算公式:V m
V n
。
积 影响因素:温度和压强。
标准状况下(即0 ℃,101kPa),气体摩尔体
积约为22.4 L·mol-1。
二、决定物质体积的因素 1.气体体积的决定因素 常温常压下,分子之间的平均距离比分子直径_大__得多,所以 1 mol气体体积的大小主要取决于__分__子__之__间__的__平__均__距__离__的大 小。 2.不同气体的气体摩尔体积相同的原因 1 mol任何气体所含有的_分__子__数__相同,在相同状况下,分子 之间的_平__均__距__离___相同,所以它们的体积相同。
【典题训练】 下列叙述正确的是( ) A.1.5 mol O2的体积是33.6 L B.在标准状况下,2 mol H2的体积是44.8 L C.不同的气体,若体积不同,则它们所含的分子数也不同 D.气体摩尔体积指1 mol任何气体所占的体积约为22.4 L
高中化学专题1物质的分类及计量第二单元第二课时气体摩尔体积基础练含解析苏教版1

第二课时气体摩尔体积必备知识基础练知识点一气体摩尔体积1.下列说法正确的是()A.1 mol固体或液体的体积主要由微粒间距离决定B.1 mol气体的体积主要由微粒的大小决定C.O2的气体摩尔体积约为22。
4 L·mol-1D.气体微粒间的距离受温度、压强影响大,固体或液体微粒间的距离受温度、压强影响小2.(多选)下列说法正确的是()A.1 mol任何气体的气体摩尔体积都约为22。
4 L·mol-1 B.25 ℃、101 kPa下,相同体积的H2和O2具有相同的分子数C.1 mol气体的体积为22。
4 L,则该气体不一定处于标准状况下D.2 mol CO2的体积约为44.8 L3.下列说法正确的是()A.22。
4 L任何气体的物质的量均为1 molB.0.2 mol H2和0.8 mol CO2组成的混合物气体在标准状况下的体积约为22.4 LC.标准状况下,1 mol任何物质的体积必定是22.4 L D.22。
4 L CO2和18 g H2O所含的分子数相等4.如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为()A.22.0 L·mol-1B.22.4 L·mol-1C.22.8 L·mol-1D.23。
2 L·mol-1知识点二阿伏加德罗定律5。
如图所示,相同状况下,分别用氯化氢和四种混合气体吹出体积相等的五个气球.A、B、C、D四个气球中所含原子数与氯化氢气球中所含原子数一定相等的是()A。
B.C。
D.6.在同温同压下,在A容器的氯气和B容器的氨气中,若它们所含的原子数相等,则这两个容器的体积比是()A.2:1 B.1:2C.2:3 D.1:37.下列两种气体的分子数一定相等的是()A.质量相等、密度不等的N2和C2H4B.等压等体积的N2和CO2C.等温等体积的O2和N2D.不同体积等密度的CO和C2H48.(多选)同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是()A.物质的量比为16:11B.分子数比为16:11C.原子数比为11:16D.体积比为11:16关键能力综合练一、选择题:每小题只有一个选项符合题意。
《气体摩尔体积》知识总结

第二节化学计量在实验中的应用
第2课时气体摩尔体积
知识点一:气体摩尔体积的理解
1. 定义:在一定温度和压强下,单位物质的量的气体所占有的体积。
2. 公式:V m =V/n
3. 单位:L/mol (L·mol-1) 和m3/mol (m3·mol-1)
4. 影响因素:温度和压强
【要点提示】
在标准状况下(0℃、 1.01×105 Pa),1mol任何气体所占的体积都约是22.4L。
知识点二:物质体积大小的影响因素
1.固体、液体、气体体积大小的影响因素
因素1mol固、液体1mol气体
粒子个数相同相同
粒子大小物质不同,大小不同
决定性因素物质不同,大小不同(直径约0.4nm)
粒子间距很小(对体积影响很小)较大(约4nm)决定性因素结论相同条件下体积不同相同条件下体积相同
2. 影响气体分子间平均距离的因素
(1)升高温度,气体分子间平均距离增大,气体体积增大。
(2)压强增大,气体分子间平均距离减小,气体体积减小
(3)气体分子间平均距离与分子种类基本无关。
【要点提示】
同一条件下,气体分子间平均距离几乎相等
知识点三:阿伏加德罗定律及推论
1. 同温、同压下,相同体积的任何气体具有相同数目的分子数(相同物质的量)
2. 四同定律的推论:(三同定一同)
①同T、P,V1: V2 = n1 : n2 = N1 : N2
②同T、V,P1: P2 = n1 : n2 = N1 : N2
③同T、n,P1: P2 = V2 : V1 反比
④同T、P,ρ1: ρ2 = M1 : M2
3. n、V m(气体)、N、m之间的换算关系。
高一化学 《气体摩尔体积》知识点详解

虾对市爱抚阳光实验学校第二节 气体摩尔体积课指南1.在了解气体的体积与温度和压强有密切关系的根底上,理解气体摩尔体积的概念.2.掌握有关气体摩尔体积的计算.3.通过气体摩尔体积和有关计算的学习,培养分析、推理、归纳、总结的能力. 本节:气体摩尔体积的概念和有关气体摩尔体积的计算. 本节难点:气体摩尔体积的概念及其推论的用. 教材解读 精华要义1.物质的体积、密度和质量之间的关系物质的质量跟它的体积的比叫做这种物质的密度,即物质在单位体积中所含的质量,叫做该物质的密度.2.计算1mol 不同固态物质和液态物质的体积(见下表)物质 1 mol 该物质的质量密度 1 mol 的物质所具有的体积Fe 56g g/cm 3(20℃) cm 3Al 27g g/cm 3(20℃) 10cm 3 Pb 207g 1g/cm 3(20℃) 1cm 3 H 2O 18g 1g/cm 3(4℃) 18cm 3 H 2SO 498g3g/cm 3(20℃)5cm 33.归纳1mol 不同固态物质和液态物质体积的特点并分析其形成差异的主要原因Ⅰ对于固态物质和液态物质来说,1 mol 不同物质的体积一般是不同的(如图3-2所示).Ⅱ决物质的体积大小有三大因素. (1)物质粒子数的多少.(2)物质粒子之间距离的大小. (3)物质粒子的大小(直径为d). Ⅲ形成差异的主要原因.构成液态、固态物质的粒子间的距离是很小的,在粒子数相同的条件下,固态、液态物质的体积主要决于原子、分子或离子本身的大小;由于构成不同,物质的原子、分子或离子的大小也是不同的,所以它们1 mol 的体积也就有所不同(如图 3-3所示).知识详解知识点1 气体摩尔体积(、难点)Ⅰ决气体体积大小的主要因素(1)决气体所含有的分子数〔或气体的物质的量〕.在一温度,一压强下,气体中所含的分子数目〔或物质的量〕越多,气体的体积就越大.(2)分子的直径和分子之间的距离.一般来说,气体分子的直径约为0.4 nm ,而分子之间的距离那么约为4 nm ,即分子之间的距离约是分子直径的10倍.因此,当分子数目相同时,气体体积的大小主要决于气体分子之间的距离,而不是分子本身体积的大小(如图3-4所示).思维拓展 如图3-5与图3-6所示,讨论气体分子之间的距离受哪些因素的影响?是怎样影响的?受温度和压强的影响。
第2课时气体摩尔体积(复习知识点归纳及例题解析)
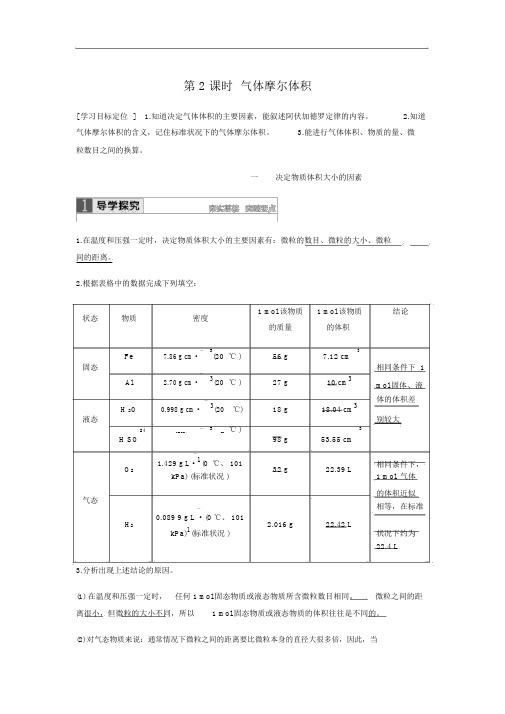
第 2 课时 气体摩尔体积[ 学习目标定位 ] 1.知道决定气体体积的主要因素,能叙述阿伏加德罗定律的内容。
2.知道气体摩尔体积的含义,记住标准状况下的气体摩尔体积。
3.能进行气体体积、物质的量、微粒数目之间的换算。
一决定物质体积大小的因素1.在温度和压强一定时,决定物质体积大小的主要因素有:微粒的数目、微粒的大小、微粒 间的距离。
2.根据表格中的数据完成下列填空:状态物质密度1 mol 该物质1 mol 该物质结论的质量的体积Fe-3℃ )56 g7.12 cm 37.86 g cm · (20固态相同条件下 1Al -3(20 ℃ )27 g10 cm 32.70 g cm ·mol 固体、液H 2O-3(20 ℃)18 g18.04 cm 3体的体积差0.998 g cm ·液态别较大24- 3℃ )31.83 g cm ·(2098 g53.55 cmH SO-相同条件下,O 21.429 g L ·1(0 ℃、 10132 g22.39 LkPa) (标准状况 )1 mol 气体 气态的体积近似相等,在标准-H 20.089 9 g L ·(0 ℃、 1012.016 g22.42 LkPa)1(标准状况 )状况下约为22.4 L3.分析出现上述结论的原因。
(1) 在温度和压强一定时, 任何 1 mol 固态物质或液态物质所含微粒数目相同。
微粒之间的距离很小,但微粒的大小不同,所以1 mol 固态物质或液态物质的体积往往是不同的。
(2) 对气态物质来说:通常情况下微粒之间的距离要比微粒本身的直径大很多倍,因此,当微粒数相同时,气态物质体积的大小则主要取决于气体微粒间的距离。
(3)温度和压强会较大程度地影响气体体积,当压强一定时,升高温度则微粒之间的距离变大,气体体积增大。
反之,体积缩小 (即通常所说的热胀冷缩 );当温度一定时增大压强,微粒之间的距离减小,气体体积缩小。
高一化学知识点解读:气体摩尔体积

第二节气体摩尔体积1.物质的体积、密度和质量之间的关系ρ(B)= )()(B V B M 2.计算1 mol 不同固体和液体物质的体积(请按表计算)物质1 mol 该物质的质量密度1 mol 物质所具有的体积Fe56 g7.8 g ·cm -3(20℃)7.2 cm 3Al27 g2.7 g ·cm -3(20℃)10 cm 3Pb207 g11.3 g ·cm -3(20℃)18.3 cm 3H 2O18 g1 g ·cm -3(4℃)18 cm 3H 2SO 498 g1.83 g ·cm -3(20℃)53.6 cm 33.归纳1 mol 不同固体和液体物质体积的特点并分析其主要原因对于固体和液体物质来说,1 mol 不同物质的体积是不同的。
决定物质体积大小的主要因素有三个:(1)微粒数的多少;(2)微粒间的距离;(3)微粒本身的大小。
构成液态、固态物质的微粒间的距离是很小的,在微粒数相同的条件下,固液态物质的体积主要决定于原子、分子或离子本身的大小。
由于构成不同物质的原子、分子或离子的大小是不同的,所以它们1 mol 的体积也就有所不同。
这就像100粒大米、100个乒乓球、100个足球分别堆放在一起,它们的总体积差别甚大一样。
课本知识导学运用课本知识诠解重要提示(1)影响物质体积的因素:决定物质体积的因素有三方面: ⎪⎩⎪⎨⎧---L D N 粒子间距粒子大小粒子数目摩尔体积是指1mol 任何物质所占有的体积,各取1mol 固态、液态、气态三种状态的物质,则影响它们体积的只有后两个因素,哪一个是主要的呢?(参照书本固体、液体、气体分子之间距离比较示意图)由固体、液体很难被压缩这一事实可知:构成固体、液体的粒子之间的距离远小于离子本身的大小,故决定1mol 固体和液体物质体积的主要因素是粒子的大小,不同物质的粒子大小不一样,所以1mol 固体和液体物质的体积应各不相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2课时气体摩尔体积[学习目标定位] 1.知道决定气体体积的主要因素,能叙述阿伏加德罗定律的内容。
2.知道气体摩尔体积的含义,记住标准状况下的气体摩尔体积。
3.能进行气体体积、物质的量、微粒数目之间的换算。
一决定物质体积大小的因素1.在温度和压强一定时,决定物质体积大小的主要因素有:微粒的数目、微粒的大小、微粒间的距离。
2.根据表格中的数据完成下列填空:(1)在温度和压强一定时,任何1 固态物质或液态物质所含微粒数目相同。
微粒之间的距离很小,但微粒的大小不同,所以1 固态物质或液态物质的体积往往是不同的。
(2)对气态物质来说:通常情况下微粒之间的距离要比微粒本身的直径大很多倍,因此,当微粒数相同时,气态物质体积的大小则主要取决于气体微粒间的距离。
(3)温度和压强会较大程度地影响气体体积,当压强一定时,升高温度则微粒之间的距离变大,气体体积增大。
反之,体积缩小(即通常所说的热胀冷缩);当温度一定时增大压强,微粒之间的距离减小,气体体积缩小。
(4)在温度和压强一定时,微粒间的距离近似相等,因此,在相同温度和压强下,任何具有相同微粒数的气体都具有大致相同的体积。
归纳总结1.物质体积大小的影响因素2.粒子数目相同物质的体积关系1.同温同压下,若两种气体所占体积不同,其主要原因是( )A.气体分子的大小不同B.气体分子间平均距离不同C.气体的物质的量不同D.气体的摩尔质量不同答案C二气体摩尔体积1.气体摩尔体积是单位物质的量的气体所占的体积,符号是,常用的单位是L·-1。
标准状况下,气体摩尔体积约为22.4 L·-1。
对于气体摩尔体积的理解,应注意以下几点:(1)气体摩尔体积的适用范围是气态物质。
在标准状况下,1 气体所占的体积约是22.4 L。
(2)气体的体积与温度、压强有关。
相同温度下,单位物质的量的气体压强越小,气体体积越大;相同压强下,单位物质的量的气体温度越高,气体体积越大。
(3)气体摩尔体积不仅适用于纯气体,也适用于混合气体。
如0.3 H2与0.7 O2的混合气在标准状况下的体积约为22.4 L。
(4)1 气体在非标准状况下的体积,可能是22.4 L,也可能不是22.4 L。
2.标准状况下,气体摩尔体积的有关计算①气体的物质的量n=;②气体的摩尔质量M=·ρ=22.4ρg·-1;③气体的分子数N=n·=·;④气体的质量m=n·M=·M g。
归纳总结1.标准状况下的气体摩尔体积2.计算公式n===(标准状况)2.下列叙述正确的是( )A.1 任何气体的体积都为22.4 LB.1 任何物质在标准状况下所占的体积都为22.4 LC.标准状况下,1 水所占的体积是22.4 LD.标准状况下,22.4 L任何气体的物质的量都是1答案D解析A中没有指明该物质所处的状况,即温度、压强,错误;B中没有指明该物质的状态,错误;C中水在标准状况下不是气体,错误;D中是对气体摩尔体积概念的应用,正确。
3.设代表阿伏加德罗常数,下列说法正确的是( )A.在常温常压下,11.2 L 2含有的分子数为 0.5B.在常温常压下,1 氦气含有的原子数为C.32 g氧气含原子数为个O2的质量只有在标准状况下才是32 g答案B解析在A中,标准状况下,11.2 L 2含有的分子数为0.5,而题中为常温常压,故A错误;B中氦气为单原子分子,1 氦气含有原子数目为,B正确;C中O2的摩尔质量为32 g·-1,且O2为双原子分子,所以32 g O2含原子数为×2=2,C错误;个O2的质量为32 g,与状态无关,与外界条件无关,D错误。
理解感悟在有关阿伏加德罗常数的正误判断题目中,常考查标准状况下的气体摩尔体积,常见问题如下:(1)忽视外界条件是标准状况,如常温常压下,1 H2的体积不是22.4 L。
(2)忽视研究对象是气体,如标准状况下H2O、酒精、3等不是气体。
(3)将1 气体的体积与气体摩尔体积的单位混淆,前者单位为L,后者单位为L·-1。
三阿伏加德罗定律1.判断下列说法的正误,正确的划“√”,错误的划“×”(1)标准状况下,1 任何气体的体积都约是22.4 L(√)(2)同温同压下,1 (含有相同的粒子数)任何气体的体积相同(√)(3)同温同压下,相同体积的任何气体含有相同数目的分子数(√)(4)标准状况下,16 g氧气与2 g氢气的体积比是1∶2(√) 2.实验探究气体的体积与物质的量的关系(1)下图为电解水的实验装置。
图中A试管中收集到的气体是H2,B试管中收集到的气体是O2,二者的体积比是2∶1。
(2)物质的量比与气体体积比的关系若有1.8 g H2O电解,产生H2的质量为0.2 g,物质的量为0.1 ;产生O2的质量为1.6 g,物质的量为0.05 ;二者物质的量之比为2∶1。
(3)实验结论①在同温同压下,气体的物质的量比等于体积比。
②在同温同压下,1 的不同气体,其体积相同。
归纳总结阿伏加德罗定律(1)阿伏加德罗定律:相同温度相同压强下,相同体积的任何气体都含有相同数目的粒子(分子)。
(2)相同条件下的气体,同体积时,分子数相同;反之,分子数相同时,体积也相同;气体的体积比等于分子数比(或物质的量比)。
4.下列说法不正确的有( )个氧分子与个氢分子的质量比等于16∶1B.标准状况下,22.4 L以任意比混合的氢气和一氧化碳混合物所含原子数为2C.标准状况下,0.5个H2O分子所占体积约为11.2 LD.16 g O2和O3的混合物中共含有个氧原子答案C解析分子数相同时,质量比等于相对分子质量比,(O2)∶(H2)=32∶2=16∶1,A项对;阿伏加德罗定律也适用于混合气体,B项中含1 分子,所以H2与共含2 原子,对;C项中H2O不是气体,错;D项,O2、O3都是由氧原子组成的,质量相同时,必含相同的原子数,16 g O是1 氧原子,所以D项对。
5.两个体积相同的密闭容器,一个盛有氯化氢,另一个盛有H2和2的混合气体,在同温同压下,两个容器内的气体一定具有相同的( )①质量②密度③分子总数④原子总数A.①②B.②④C.③④D.①③答案C解析同温同压下两个容器体积相同,则所含的分子数相同,又因、H2、2都是双原子分子,故原子总数也相同,质量、密度不一定相同。
6.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )A.两种气体的物质的量相等2比O3的质量小C.两种气体的分子数目相等D.两种气体的氧原子数目相等答案D解析由题意知O2与O3的质量相等,所以其物质的量之比等于其摩尔质量的反比。
即:n(O2)∶n(O3)=M(O3)∶M(O2)=3∶2,A不对;B项二者的质量相等,B不对;C项两种气体的分子数目N(O2)∶N(O3)=n(O2)∶n(O3)=3∶2,C 不对;D项两种气体的氧原子数目为N(O2)∶N(O3)=[n(O2)×2]∶[n(O3)×3]=6∶6相等,故D对。
1.阿伏加德罗定律可适用于任何气体(纯净的或是互不反应的混合气体),但不适用于液体或固体。
2.同温、同压、同体积、同分子数称为“四同”,四“同”共同存在,相互制约,只要有三个“同”成立,第四个“同”就必定成立,在实际应用中往往是知道三“同”而求导另一“同”。
3.标准状况下气体的摩尔体积是阿伏加德罗定律的特例,与m、N、V之间的换算关系是n===。
1.下列有关气体体积叙述正确的是( )A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由其物质的量的多少决定C.气体摩尔体积是指1 任何气体所占的体积约为22.4 LD.不同的气体,若体积不等,则它们所含的分子数一定不等答案B解析气体的体积在温度、压强一定时,体积与其物质的量成正比;当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离,而不是分子本身体积的大小,所以A、D错误,B正确;非标准状况下气体摩尔体积不一定为22.4 L·-1,C错误。
2.下列说法正确的是( )A.1 任何气体的体积都约是22.4 LB.20 ℃、1.01×105时,同体积的O2和2含有相同数目的分子数C.1 气态物质,当体积为22.4 L时,该气体一定处于标准状况D.2 任何气体体积都约为44.8 L答案B解析A中缺少标准状况的条件;B中根据阿伏加德罗定律,同温同压下,同体积的任何气体都含有相同数目的分子数,故B正确;C中,1 气态物质在非标准状况时,体积也有可能等于22.4 L;D中缺少标准状况条件。
3.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )A.体积相等时密度相等B.原子数相等时具有的中子数相等C.体积相等时具有的电子数相等D.质量相等时具有的质子数相等答案C解析依据阿伏加德罗定律:在同温同压下的两种气体体积相同,分子数相同,而和N2分子所含电子数相同,C项正确;同温同压同体积条件下密度之比等于摩尔质量之比,12C18O的摩尔质量为30 g·-1,14N2的摩尔质量为28 g·-1,A项错误;1个12C18O分子中所含中子数为16,1个14N2分子中所含中子数为14,B项错误;12C18O和14Nn=,m相同、M不同,n不2分子中所含质子数相同,同,故等质量的两种气体所具有的质子数不同,D项错误。
4.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·-1。
若阿伏加德罗常数用表示,则:(1)该气体的物质的量为。
(2)该气体所含原子总数为个。
(3)该气体在标准状况下的体积为 L。
(4)该气体在标准状况下的密度为g·L-1。
(5)该气体一个分子的质量为 g。
答案(1) (2) (3) (4)(5)解析(1)由n=可求。
(2)由物质的量可求得该气体的分子数,进一步可求得原子数。
(3)由V=可求得该气体在标准状况下的体积。
(4)由质量和已求得的标准状况下的体积可求得密度,也可以由M=·ρ求得密度。
(5)由摩尔质量为M g·-1,知每一个分子的质量为 g。
5.相同条件下,同质量的X、Y两种气体,相对分子质量分别为A、B;则:(1)X与Y的体积比为,分子个数比为,密度比为。
(2)相同条件下的X、Y两种气体体积相同,则X与Y的质量比为,物质的量比为。
(3)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为;混合气体中甲烷的体积为;一氧化碳的质量为。
答案(1)B∶A B∶A A∶B(2)A∶B1∶1(3)19 g·-1 6.72 L 2.8 g解析(1)二者的摩尔质量之比为A∶B,等质量时物质的量之比为B∶A,由阿伏加德罗定律可推出体积之比和分子数之比均为B∶A,密度之比为A∶B。
