理综练习
2023年南通丘班理综模拟测卷

2023年南通丘班理综模拟测卷南通市某中学2023年丘班理综模拟测卷第一部分:选择题1. 下面哪个选项中的物质可被人类利用来发电?A. 煤炭B. 铁矿石C. 石油D. 硅矿石2. 水是一种普遍存在的溶剂,以下哪种情况会使水的溶液发生酸性变化?A. 加入氢氧化钠溶液B. 加入碳酸钠溶液C. 加入盐酸溶液D. 加入氯化钙溶液3. 下列哪个选项是细胞迁移的原因?A. 细胞分裂失控B. 细胞受损或老化C. 细胞分泌特殊信号物质D. 细胞与其周围环境的粘附力改变4. 突变对生物进化具有重要作用,以下哪个选项不是突变所带来的影响?A. 使个体适应环境,提高生存竞争力B. 造成生物功能的改变C. 导致遗传物质的完全丧失D. 产生新的遗传特征第二部分:填空题1. 我国有世界上最大的核电站,位于___城。
2. 生物体内的新陈代谢过程中,能够提供能量的是___。
3. 地球上最深的海沟是___海沟。
4. 鸟类通过_____来感知空间位置。
5. 电流的单位是___。
第三部分:简答题1. 根据你的理解,解释什么是生态平衡,并举一个例子。
2. 简述RNA的结构和功能。
3. 请列举三种常见的化学反应类型。
第四部分:应用题某公司为了减少废气的排放,决定对工厂的燃烧设备进行改造,改用天然气代替煤炭。
假设工厂每年消耗的煤炭量为1000吨,煤炭燃烧释放的二氧化硫浓度为0.02%,每吨煤炭产生的二氧化硫量为500kg。
请回答以下问题:1. 改用天然气后,工厂每年能减少多少二氧化硫排放量?2. 如果每吨天然气燃烧后产生的二氧化硫浓度为0.005%,请计算工厂每年使用的天然气量。
注意:本模拟测卷仅供参考和练习使用,不作为正式考试成绩。
请自觉遵守考试纪律,独立完成试题。
北京市海淀区2025届高三理综5月期末练习二模试题

北京市海淀区2025届高三理综5月期末练习(二模)试题可能用到的相对原子质量:H l C 12 N 14 0 16 K 39 Mn 55第一部分(选择题共120分)本部分共20道小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
1.下列各细胞结构与其功能对应不正确的是A.细胞膜:限制物质进出细胞 B.核糖体:合成蛋白质的场所C.线粒体:将丙酮酸彻底分解 D.溶酶体:加工并分泌蛋白质2.探讨者得到B基因突变、P基因突变和B、P基因双突变小鼠,持续在肯定剂量紫外线照耀条件下培育上述三组小鼠,一段时间后统计小鼠皮肤上黑色素瘤(一种皮肤癌)的数目,得到如图所示结果。
下列相关叙述,不正确的是A.皮肤上的黑色素瘤细胞增殖失去了限制B.黑色素瘤的发生可能是紫外线损伤DNA所致C.仅P基因突变会导致小鼠产生大量黑色素瘤D.多基因突变效应叠加会增加黑色素瘤产生的数目3.花样滑冰运动员在冰面上进行竞赛的过程中,身体正在发生的反应有A.神经与肌肉协调协作完成高难度动作 B.寒冷干脆刺激下丘脑产生兴奋C.垂体合成并分泌抗利尿激素 D.血液中肾上腺素浓度持续降低4.橘小实蝇为害多种水果和蔬菜。
在治理虫害时,农业技术员先运用性引诱剂诱杀雄性成虫,再释放不育雄性成虫,使其与田间雌虫交配,产下不能孵化的卵,最终引入它的天敌——寄生蜂,进一步歼灭橘小实蝇。
下列相关分析,正确的是A.应运用标记重捕法估算橘小实蝇的种群密度 B.运用性引诱剂不会破坏橘小实蝇的性别比例 C.释放不育雄性成虫会降低橘小实蝇的诞生率 D.引入的寄生蜂和橘小实蝇形成互利共生关系5.为提高大都对磷元素的汲取实力,探讨人员利用杆菌转化法将水稻的耐低磷基因OsPTF 转移到大豆植株中,下图为重组Ti质粒上T-DNA的序列结构示意图。
下列相关叙述不正确的是A.以水稻RNA为模板通过逆转录及PCR扩增可获得大量OsPTF基因B.RNA聚合酶与启动子I识别并结合后,启动抗除草剂基因的转录C.可通过含除草剂的选择培育基筛选含有目的的基因大豆愈伤组织D.用EcoRI、BamHI双酶切重组Ti质粒后,经电泳分别至少得到两条带6.港珠澳大桥被称为“现代世界新七大奇迹”之一,涵盖了当今世界岛隧桥多项尖端科技,化工行业在这座雄伟的“超级工程”中发挥了巨大作用。
北京市朝阳区高三年级第一次综合练习理综

北京市朝阳区高三年级第一次综合练习理科综合试卷2014.3第一部分(选择题共120分)1.下列有关真核细胞的叙述中,正确的是A.核糖体是蛋白质的“装配机器”,由蛋白质和mRNA组成B.醋酸洋红进入细胞使染色体着色,体现了膜的选择透过性C.衰老细胞内染色质的收缩会影响遗传信息的表达D.原癌基因和抑癌基因的表达会导致正常细胞发生癌变2.在细胞和生物体的生命活动中,不.可能发生的是A.DNA→RNA→氨基酸B.内质网膜→囊泡膜→高尔基体膜C.性激素→下丘脑,性激素→垂体D.生长素→果实发育,生长素→发芽3.用3H标记蚕豆根尖分生区细胞的DNA分子双链,再将这些细胞转入含秋水仙素但不含3H的普通培养基中培养。
若秋水仙素对细胞连续发挥作用,则相关叙述不.正确的是A.秋水仙素可抑制纺锤体的形成,但不影响着丝点的正常分裂B.通过对细胞中不含单体时的染色体计数,可推测DNA复制的次数C.通过检测DNA链上3H标记出现的情况,可推测DNA的复制方式D.细胞中DNA第二次复制完成时,每条染色体的单体均带有3H标记4.下列关于生产措施或生活现象的分析,错误..的是A.零度以上低温贮存果蔬,可降低呼吸酶活性,减少有机物的分解B.提倡慢跑,可防止因肌细胞无氧呼吸积累乳酸而导致的酸胀乏力C.若H7N9禽流感病毒侵入人体,机体的T细胞会合成并分泌淋巴因子D.由于亚硝酸盐含量先减少后增加,故应在其含量增加前尽快食用泡菜5.黄花刺茄是具有很强的耐贫瘠和耐干旱特性的草本植物,原产北美洲,我国于1981年首次发现该物种入侵,目前已在多省区有分布,对本地物种造成危害。
以下叙述正确的是A.黄花刺茄可以增加入侵地的物种多样性,提高生态系统的生态功能B.荒地、路边、弃耕地、过度放牧的草地,黄花刺茄可取得优势地位C.控制黄花刺茄的方法主要有化学防治和人为铲除,化学防治最好D.导致黄花刺茄在入侵地呈J型疯长的主要原因是其基因发生了突变6. 当身处贴有下列标志的环境时,行为不正确...的是7. 已知:下列说法不正确...的是A. ①和②变化过程中都会放出热量B. 氯原子吸引电子的能力强于钠原子和氢原子C. ①和②中的氯原子均得到1个电子达到8电子稳定结构D. NaCl中含有离子键,HCl中含有共价键8. 综合下图判断,下列叙述不正确...的是A. Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + CuB. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生9. 下列解释事实的方程式不准确...的是A. 氨水使湿润的红色石蕊试纸变蓝:NH3·H2O NH4+ + OH-B. 工业上用过量的NaOH溶液吸收SO2:SO2 + OH- == HSO3-C. 用烧碱溶液清洗铝表面的氧化膜:2OH- + Al2O3 = 2AlO2- + H2OD. 用石灰乳吸收泄漏的氯气:2Ca(OH)2 + 2Cl2== CaCl2 + Ca(ClO)2 + 2H2O10.下列实验事实不能用...平衡移动原理解释的是11. 右图为实验室制取乙炔并验证其性质的装置图。
高考理综化学大题训练二综合实验设计

综合实验设计、探究与评价全国卷高考题1.(15分)(2017 新课标Ⅱ-28)水中溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:Ⅰ.取样、氧的固定:用溶解氧瓶采集水样.记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI )混合,反应生成MnO(OH) 2,实现氧的固定.Ⅱ.酸化,滴定:将固氧后的水样酸化,MnO(OH) 2被I —还原为Mn 2+,在暗处静置5min,然后用标准Na 2S 2O 3溶液滴定生成的I 2(2S 2O 32—+I 2=2I —+S 4O 62—). 回答下列问题:(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是 . (2)“氧的固定”中发生反应的化学方程式为 .(3)Na 2S 2O 3溶液不稳定,使用前需标定.配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和 ;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除 及二氧化碳.(4)取水样经固氧、酸化后,用a mol L ﹣1Na 2S 2O 3溶液滴定,以淀粉溶液作指示剂,终点现象为 ;若消耗Na 2S 2O 3溶液的体积为b mL,则水样中溶解氧的含量为 mg L ﹣1. (5)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏 .(填“高”或“低”)2.(15分)(2017 新课标Ⅰ-26)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知:333333NH H BO NH H BO +===⋅;333433NH H BO HCl NH Cl H BO ⋅+===+ 回答下列问题:(1)a 的作用是 .(2)b 中放入少量碎瓷片的目的是 .f 的名称是 .(3)清洗仪器:g 中加蒸馏水;打开1k ,关闭23k k 、,加热b ,蒸气充满管路;停止加热,关闭1k g ,中蒸馏水倒吸进入c ,原因是 ;打开2k 放掉水,重复操作2~3次.(4)仪器清洗后,g 中加入硼酸(33H BO )和指示剂.铵盐试样由d 注入e ,随后注入氢氧化钠溶液,用蒸馏水冲洗d ,关闭3k d ,中保留少量水.打开1k ,加热b ,使水蒸气进入e .①d 中保留少量水的目的是 .②e 中主要反应的离子方程式为 ,e 采用中空双层玻璃瓶的作用是 . (5)取某甘氨酸(252C H NO )样品m 克进行测定,滴定g 中吸收液时消耗浓度为1mol L c -⋅的盐酸mL V ,则样品中氮的质量分数为 %,样品的纯度≤ %.3.(15分)(2017 新课标Ⅲ-27)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO Cr 2O 3,还含有硅、铝等杂质.制备流程如图所示: 回答下列问题:(1)步骤①的主要反应为: FeO Cr 2O 3+Na 2CO 3+NaNO 3Na 2CrO 4+Fe 2O 3+CO 2+NaNO 2 . 上述反应配平后FeO Cr 2O 3与NaNO 3的系数比为 .该步骤不能使用陶瓷容器,原因是 .(2)滤渣1中含量最多的金属元素是 ,滤渣2的主要成分是 及含硅杂质.(3)步骤④调滤液2的pH 使之变 (填“大”或“小”),原因是 (用离子方程式表示).(4)有关物质的溶解度如图所示.向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K 2Cr 2O 7固体.冷却到 (填标号)得到的K 2Cr 2O 7固体产品最多. ℃ ℃ ℃℃步骤⑤的反应类型是 .(5)某工厂用m 1 kg 铬铁矿粉(含Cr 2O 3 40%)制备K 2Cr 2O 7,最终得到产品 m 2 kg,产率为 ×100%.4.(2016·新课标全国卷Ⅰ)氮的氧化物(NO x )是大气污染物之一,工业上在一定温度和催化剂条件下用NH 3将NO x 还原生成N 2.某同学在实验室中对NH 3与NO x 反应进行了探究.回答下列问题: (1)氨气的制备①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________.②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示). (2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.5、2016新课标2卷某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成L的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________.(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为_______.(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______.(4)丙组同学取10 LKI溶液,加入LFeCl3溶液混合.分别取2mL此溶液于3 支试管中进行如下实验:①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;②第二只试管中加入1滴K3溶液,生成蓝色沉淀:③第三支试管中加入1滴KSCN溶液,溶液变红.实验②检验的离子是_____(填离子符号);实验①和③说明:在I- 过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______.(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成.产生气泡的原因是______;生成沉淀的原因是______(用平衡移动原理解释).6、2016新课标3卷过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂.以下是一种制备过氧化钙的实验方法.回答下列问题:(一)碳酸钙的制备(1)步骤①加入氨水的目的是_______.小火煮沸的作用是使沉淀颗粒长大,有利于____.(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号).a.漏斗末端颈尖未紧靠烧杯壁b.玻璃棒用作引流c.将滤纸湿润,使其紧贴漏斗壁d.滤纸边缘高出漏斗e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度(二)过氧化钙的制备(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”).将溶液煮沸,趁热过滤.将溶液煮沸的作用是___________.(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________.(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______.(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是______,产品的缺点是_______.7、(2015·新课标全国卷Ⅰ)草酸(乙二酸)存在于自然界的植物中,其K1=×10 ̄2,K2=×10 ̄5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解.回答下列问题:(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物.装置C中可观察到的现象是,由此可知草酸晶体分解的产物中有.装置B的主要作用是.(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.①乙组同学的实验装置中,依次连接的合理顺序为A、B、.装置H反应管中盛有的物质是.②能证明草酸晶体分解产物中有CO的现象是.(3)设计实验证明:①草酸的酸性比碳酸的强.②草酸为二元酸.8、(2015·新课标全国卷Ⅱ)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂.回答下列问题:(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为.(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图过程制备ClO2:①电解时发生反应的化学方程式为.②溶液X中大量存在的阴离子有.③除去ClO2中的NH3可选用的试剂是(填标号).a.水b.碱石灰c.浓硫酸d.饱和食盐水(3)用如图装置可以测定混合气中ClO2的含量:Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;Ⅲ.将一定量的混合气体通入锥形瓶中吸收;Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;Ⅴ.用0 mol·L ̄1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2SO32−2I2 ̄+SO62−),指示剂显示终点时共用去 mL硫代硫酸钠溶液.在此过程中:4①锥形瓶内ClO2与碘化钾反应的离子方程式为.②玻璃液封装置的作用是.③V中加入的指示剂通常为,滴定至终点的现象是.④测得混合气中ClO2的质量为g.(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是(填标号).a.明矾b.碘化钾c.盐酸d.硫酸亚铁9、(2014·新课标全国卷Ⅰ)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:实验步骤:在A中加入 g异戊醇、 g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50 min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯 g.回答下列问题:(1)仪器B的名称是.(2)在洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是.(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号).a.直接将乙酸异戊酯从分液漏斗的上口倒出b.直接将乙酸异戊酯从分液漏斗的下口放出c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出(4)本实验中加入过量乙酸的目的是.(5)实验中加入少量无水MgSO4的目的是.(6)在蒸馏操作中,仪器选择及安装都正确的是(填标号).(7)本实验的产率是(填标号).% % % %(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏(填“高”或“低”),其原因是.10、2014全国II卷28(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为测定其组成,进行如下实验.①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c 2 mol·L —1NaOH 标准溶液滴定过剩的HC l,到终点时消耗V 2mLNaOH 溶液.②氯的测定:准确称取样品X,配成溶液后用AgNO 3标准溶液滴定,K 2CrO 4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag 2CrO 4为砖红色). 回答下列问题:(1)装置中安全管的作用原理是 .(2)用NaOH 标准溶液滴定过剩的HCl 时,应使用 式滴定管,可使用的指示剂为 .(3)样品中氨的质量分数表达式为 .(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”).(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c (Ag +)=×10—5 mol·L —1,c (CrO 42—)为 mol·L —1.(已知:K sp (Ag 2CrO 4)=×10—12) (6)经测定,样品X 中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为 ,制备X 的化学方程式为 ;X 的制备过程中温度不能过高的原因是 . 跟踪练习1.(13分)(2017 北京-26)TiCl 4是由钛精矿(主要成分为TiO 2)制备钛(Ti )的重要中间产物,制备纯TiCl 4的流程示意图如下: 资料:TiCl 4及所含杂质氯化物的性质化合物 SiCl 4 TiCl 4 AlCl 3 FeCl 3 MgCl 2 沸点/℃ 58 136 181(升华)316 1412 熔点/℃ ﹣69 25 193304714 在TiCl 4中的溶解性互溶﹣微溶难溶(1)氯化过程:TiO 2与Cl 2难以直接反应,加碳生成CO 和CO 2可使反应得以进行. 已知:TiO 2(s) +2Cl 2(g)=TiCl 4(g)+O 2(g) △H 1=+mol ﹣12C(s) + O 2(g)=2CO(g) △H 2=﹣mol ﹣1 ①沸腾炉中加碳氯化生成TiCl 4(g )和CO (g )的热化学方程式: .②氯化过程中CO 和CO 2可以相互转化,根据如图判断:CO 2生成CO 反应的△H 0(填“>”“<”或“=”),判断依据: .③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是 .④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有.(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4.示意图如下:物质a是 ,T2应控制在 . 2.(12分)(2017 江苏-16)铝是应用广泛的金属.以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:注:SiO2在“碱溶”时转化为铝硅酸钠沉淀.(1)“碱溶”时生成偏铝酸钠的离子方程式为 .(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”).(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是.(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示.阳极的电极反应式为,阴极产生的物质A的化学式为.(5)铝粉在1000℃时可与N2反应制备AlN.在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 .3.(15分)(2017 江苏-19)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略).已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO═2NaCl+NaClO3②AgCl可溶于氨水:AgCl+2NH3H2OAg(NH3)2++Cl﹣+2H2O③常温时 N2H4H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:4Ag(NH3)2++N2H4H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为.(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,该反应的化学方程式为 . HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 .(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 .(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3H2O反应外(该条件下NaClO3与NH3H2O不反应),还因为.(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:(实验中须使用的试剂有:2mol L﹣1水合肼溶液,1mol L﹣1H2SO4).4、(18分)(2017 天津-9)用沉淀滴定法快速测定NaI等碘化物溶液中c(I﹣),实验过程包括准备标准溶液和滴定待测溶液.Ⅰ准备标准溶液a.准确称取AgNO3基准物()后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用. b.配制并标定100mL L﹣1 NH4SCN标准溶液,备用.Ⅱ滴定的主要步骤a.取待测NaI溶液于锥形瓶中.b.加入 L﹣1 AgNO3溶液(过量),使I﹣完全转化为AgI沉淀.c.加入NH4Fe(SO4)2溶液作指示剂.d.用L﹣1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.e.重复上述操作两次.三次测定数据如下表:实验序号123消耗NH4SCN标准溶液体积/mLf.数据处理回答下列问题:(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 .(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 .(3)滴定应在pH<的条件下进行,其原因是 .(4)b和c两步操作是否可以颠倒,说明理由.(5)所消耗的NH4SCN标准溶液平均体积为 mL,测得c(I﹣) = mol L﹣1.(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为.(7)判断下列操作对c(I﹣)测定结果的影响(填“偏高”、“偏低”或“无影响”)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果.②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果.5、工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行以下探究活动:探究一:(1)将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .(2)另取铁钉放入一定量浓硫酸中加热,充分反应后得到溶液X并收集到干燥气体Y.①甲同学认为X中可能含有Fe3+和Fe2+.若要确认其中的Fe2+,应选用 (填序号).a.KSCN溶液 b.铁氰化钾溶液 c.盐酸②乙同学取448 mL(标准状况)气体Y通入足量溴水中,发生反应的离子方程式为 ,充分反应后,加入足量BaCI2溶液,经适当操作后得干燥固体 g.可推知气体Y中SO2的体积分数为 .探究二:据探究一所测SO2的体积分数,丙同学认为气体Y中可能还含有CO2和Q气体,因此设计了下列实验装置(图中夹持仪器省略,实验前已将装置中空气排尽)进一步探究.(3)装置A中的现象是 ,其作用是 .(4)为判断CO2是否存在,需将装置M添加在 .(填序号);a.A之前 b.A~B之间 c.B~C之间 d.C~D之间若存在CO2,则产生CO2气体的反应中氧化剂与还原剂的物质的量之比为 .(5)若C中固体变红,D中固体变蓝,则Q是 (填化学式),产生该气体的原因是 .(6)若某气体可能由CO2、SO2、H2中的一种或多种组成,经测定其中氧的质量分数为50%,则该气体的组成可能为 (填序号).、SO2 c.H2、CO2、SO2、CO2、H2。
高考理综化学实验大题练习汇编

化学实验大题练习21.(16分)某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液。
请完成对反应物剩余情况的探究。
(1)提出合理假设:假设1:FeSO4有剩余;假设2:NaClO有剩余;假设3:______________________________________。
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液。
此澄清溶液中肯定含有的金属阳离子是________________________。
(3)设计后续实验方案验证假设,在答题卡上写出实验步骤以及预期现象和结论。
限选..实验试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液、紫色石蕊溶液。
2.Ⅰ.已知溶液导电性与其中离子浓度有定量关系。
某兴趣小组设计了以下装置和方法测定空气中SO2含量。
你认为可行的操作是________________(填序号)Ⅱ.Fe2+、SO32-和I-都具有还原性。
为了比较其还原性强弱,进行以下探究并回答:(1)已知:①还原性:SO32-> Fe2+;②FeSO3难溶于水。
(2)在(1)的基础上,完成下列假设。
假设1,还原性:I->SO32-> Fe2+;假设2,还原性:SO32-> I- >Fe2+;假设2,还原性: ______________________。
(3)实验探究:现对假设2进行探究。
完成实验步骤以及预期的现象和结论。
限选以下试剂:0.1mol/L Na 2SO 3、0.1mol/L KI 、0.1mol/L FeCl 3、10%KSCN 、新制饱3.某同学想通过下图装置(夹持装置已略去)实验,探究SO 2与Na 2O 2反应的产物。
Ⅰ.如何检验反应中是否有O 2生成。
Ⅱ.装置D 除起了防止空气中的水蒸气和二氧化碳进入C 装置与Na 2O 2反应作用外,还可以 。
2019高考理综物理试题练习(有答案)

2019高考理综物理试题练习(有答案)伟人所达到并保持着的高度,并不是一飞就到的,而是他们在同伴们都睡着的时候,一步步艰辛地向上攀爬着。
下面是小编为大家收集的2019高考理综物理试题练习(有答案)。
希望可以帮助大家。
一、单项选择题(共16分,每小题2分。
每小题只有一个正确选项。
1、卢瑟福通过对α粒子散射实验结果的分析,提出了原子内部存在(A)电子 (B)中子 (C)质子 (D)原子核2、一束单色光由空气进入水中,则该光在空气和水中传播时(A)速度相同,波长相同 (B)速度不同,波长相同(C)速度相同,频率相同 (D)速度不同,频率相同3、各种不同频率范围的电磁波按频率由大到小的排列顺序是(A)γ射线、紫外线、可见光、红外线(B)γ射线、红外线、紫外线、可见光(C)紫外线、可见光、红外线、γ射线(D)红外线、可见光、紫外线、γ射线4、如图,顶端固定着小球的直杆固定在小车上,当小车向右做匀加速运动时,球所受合外力的方向沿图中的(A)OA方向 (B)OB方向(C)OC方向 (D)OD方向5、磁铁在线圈中心上方开始运动时,线圈中产生如图方向的感应电流,则磁铁(A)向上运动(B)向下运动(C)向左运动(D)向右运动6、放射性元素A经过2次α衰变和1次β 衰变后生成一新元素B,则元素B在元素周期表中的位置较元素A的位置向前移动了(A)1位(B)2位(C)3位(D)4位7、在今年上海的某活动中引入了全国首个户外风洞飞行体验装置,体验者在风力作用下漂浮在半空。
若减小风力,体验者在加速下落过程中(A)失重且机械能增加(B)失重且机械能减少(C)超重且机械能增加(D)超重且机械能减少8、如图,一束电子沿z轴正向流动,则在图中y轴上A点的磁场方向是(A)+x方向(B)-x方向(C)+y方向(D)-y方向二、单项选择题(共24分,每小题3分。
每小题只有一个正确选项。
)9、在双缝干涉实验中,屏上出现了明暗相间的条纹,则(A)中间条纹间距较两侧更宽(B)不同色光形成的条纹完全重合(C)双缝间距离越大条纹间距离也越大(D)遮住一条缝后屏上仍有明暗相间的条纹10、研究放射性元素射线性质的实验装置如图所示。
理综第13题离子共存推断选择题综合练习
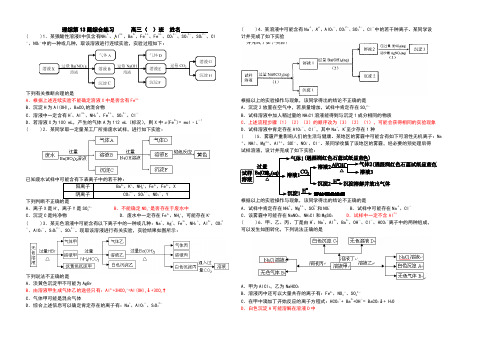
理综第13题综合练习 高三( )班姓名( )1.某强酸性溶液X 中仅含有NH 4+、Al 3+、Ba 2+、Fe 2+、Fe 3+、CO 32-、SO 32-、SO 42-、Cl -、NO 3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是A .根据上述连续实验不能确定溶液X 中是否含有Fe 3+B .沉淀H 为Al(OH)3、BaCO 3的混合物C .溶液中一定含有H +、Al 3+、NH 4+、Fe 2+、SO 42-、Cl -D .若溶液X 为100 mL ,产生的气体A 为112 mL (标况),则X 中c (Fe 2+)= mol·L -1( )2.某同学取一定量某工厂所排废水试样,进行如下实验:已知废水试样中可能含有下表离子中的若干种:阳离子 Ba 2+、K +、NH 4+、Fe 2+、Fe 3+、X 阴离子CO 32-、SO 32-、NO 3-、Y下列判断不正确的是A .离子X 是H +,离子Y 是SO 42-B .不能确定NO 3-是否存在于废水中C .沉淀C 是纯净物D .废水中一定存在Fe 2+、NH 4+,可能存在K +( )3.某无色溶液中可能含有以下离子中的一种或几种:Na +、Ag +、Fe 3+、NH 4 +、Al 3+、CO 32-、AlO 2-、S 2O 32-、SO 42-。
现取该溶液进行有关实验,实验结果如图所示:下列说法不正确的是A .淡黄色沉淀甲不可能为AgBrB .由溶液甲生成气体乙的途径只有:Al 3++3HCO 3-=Al(OH)3↓+3CO 2↑ C .气体甲可能是混合气体D .综合上述信息可以确定肯定存在的离子有:Na +、AlO 2-、S 2O 32-( )4.某溶液中可能含有Na +、K +、AlO 2-、CO 32-、SO 32-、Cl -中的若干种离子。
某同学设计并完成了如下实验根据以上的实验操作与现象,该同学得出的结论不正确的是A .沉淀2放置在空气中,若质量增加,试样中肯定存在SO 32-B .试样溶液中加人稍过量的NH 4C1溶液能得到与沉淀1成分相同的物质C .上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象D .试样溶液中肯定存在A1O 2-、Cl -,其中Na +、K +至少存在1种( )5.雾霾严重影响人们的生活与健康。
北京市东城区2022届高三理综下学期综合练习(一)(物理部分)(2022东城一模)

北京市东城区2022届高三理综下学期综合练习(一)(物理部分)(2022东城一模)13.治疗肿瘤的放射源发出的射线必须满足两个条件:①放射线具有较强的穿透力,以辐射到体内的肿瘤处;②在较长时间内具有相对稳定的辐射强度。
表中给出的四种放射性同位素,根据上述两个条件,适合用于治疗肿瘤的放射源是 A .钋210 B .锝99 C .钴60 D .锶9014.已知单色光a 照射一金属板时,金属板上有光电子逸出;单色光b 照射同一金属板时,金属板上没有光电子逸出。
现让光束a 和b 沿相同的方向从空气进入水中,如图所示,则可判断A .光束a 的频率小于光束b 的频率B .光束a 的折射角小于光束b 的折射角C .光束a 在水中的速率大于光束b 在水中的速率D .同时增大两束光的入射角i ,光束a 先发生全反射15.如图甲所示,在材质均匀的圆形薄电阻片上,挖出一个偏心小圆孔。
在彼此垂直的直径AB 和CD 两端引出四个电极A 、B 、C 、D 。
先后分别将A 、B 或C 、D 接在电压恒为U 的电路上,如图乙和图丙所示。
比较两种接法中电阻片的热功率大小,应有A .两种接法电阻片热功率一样大B .接在AB 两端电阻片热功率大C .接在CD 两端电阻片热功率大 D .无法比较图乙图丙图甲16.物理小组用自己设计的位移传感器来探究滑块的简谐运动,其工作原理如图a 所示,滑块M 在导轨上平移时,带动滑动变阻器的滑片G ρπ3G ρπ43G π34Gπ 2 C3a 3a 2a 1,托盘及砝码的质量为m 2。
①下列说法正确的是 。
A .长木板C 必须保持水平B .实验时应先释放小车后接通电源C .实验中m 2应远小于m 1D .作a -11m 图像便于行出加速度与质量关系 ②实验时,某同学由于疏忽,遗漏了平衡摩擦力这一步骤,他测量得到的a —F 图像,可能是图2中的图线 。
选填“甲、乙、丙” ③图3为某次实验得到的纸带,纸带上标出了所选的四个计数点之间的距离,相邻计数点间还有四个点没有画出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三理科综合测试生物卷
一、选择题:
1.下列关于生物体内无机盐的相关说法正确的是
A.碘元素摄取不足可引起甲亢、地方性甲状腺肿等疾病
B.细胞吸收无机盐离子的速率主要取决于膜内外离子的浓度差
C.植物体内含有镁元素的类胡萝卜素和叶绿素都可吸收蓝紫光
D.神经细胞内外K+分布不均衡是产生和维持静息电位的主要原因
2.自然界中的生物多种多样,繁殖后代的方式也多种多样,如①细菌的二分裂增殖,②酵母菌的出芽生殖,③某些植物(如马铃薯)的营养生殖,④由蜂王产生雄蜂的孤雌生殖,⑤由亲本形成精子、卵细胞并结合成为受精卵,再由受精卵发育成为新的个体的有性生殖等。
上述几种由亲代产生子代的生殖过程中,会出现基因重组的是
A.①⑤ B.④⑤ C.①②④ D.②④⑤
3.小麦种子吸水萌发时的呼吸作用过程可分为如图所示的4个阶段。
下列相关说法正确的是
A.第1、2阶段,种子呼吸作用消耗的O2量高于CO2的产生量
B.第3阶段种子吸收水分的主要方式是渗透作用
C.第3阶段,胚根长出,种子的干重将增加
D.从第1阶段到第3阶段,种子胚细胞中的有机物种类将减少
4.盐酸是一种常见的化学试剂,也广泛用于生物学实验,以下涉及盐酸的实验或过程说法正确的是A.“观察DNA和RNA在细胞中的分布”的实验中8%的盐酸作用后要用蒸馏水冲洗涂片
B.“探究酶活性受PH的影响”的实验中盐酸的作用是用于控制无关变量
C.“低温诱导染色体数目变化”的实验中,可尽量延长用盐酸和酒精处理的时间使解离更充分D.促胰液素的发现过程中稀盐酸的作用是促使胰腺产生促胰液素
5.下列关于植物激素及其调节叙述不合理的是
A.生长素的生理作用具有两重性
B.在植物体内,生长素的运输存在极性运输和非极性运输
C.除吲哚乙酸外,吲哚丁酸、苯乙酸、2,4-D等植物激素也具有促进生长的效应
D.在植物的生长发育过程中,几乎所有生命活动都受到植物激素的调节
6.松土是我国农业生产中一项传统的耕作措施。
但过度松土除了增加农业生产的成本,还可能带来一些环境问题,下列说法不合理的是
A.松土可以增加土壤透气性,促进作物根细胞对土壤有机物的吸收
B.松土利于土壤中枯枝落叶、动物遗体等有机物的分解,从而利于作物生长
C.松土容易造成水土流失,可能成为沙尘暴的一种诱发因素
D.松土促进了土壤微生物的有氧呼吸,增加了二氧化碳的排放,可加剧温室效应
二、非选择题:
30.甲状腺激素是由甲状腺细胞分泌的一种氨基酸衍生物类激素,碘是甲状腺激素的重要组成元素。
回答下列有关问题:
(1)甲状腺激素之所以能发挥调节作用,是由于它与靶细胞结合后,能使靶细胞发生变化。
激素调节除了作用于靶器官、靶细胞外,还具有的特点是。
(2)缺碘会导致血浆中甲状腺激素的含量远低于正常水平,但是
激素的含量却高于正常水平。
幼年时缺乏甲状腺激素、生长激素均会导致患者身材矮小,从这个角度看,这两种激素之间存在作用。
(3)正常人在温暖环境下容易发困,而在较冷的环境下不易打盹,其原因是。
- 1 -
- 2 -
31.洪湖是湖北省第一大淡水湖,面积400km²,环境优美,资源丰富,是国家级自然保护区。
假设
在该湖泊中存在食物链:浮游植物→鲢鱼→乌鳢。
回答下列问题:
(1)经调查发现鲢鱼种群的环境容纳量为20000尾,环境容纳量是指。
当鲢鱼的种群密度为 尾/km 2
时,其种群增长速率最快。
(2)近些年,由于过度围垦、养殖、污水排放等原因,洪湖生态系统遭到严重破坏。
经保护治理后
在较短时间内又迅速恢复到原状,从生态系统的结构分析,原因是 。
(3)鳙鱼主要以浮游生物为食,将鳙鱼鱼苗以一定比例投放到洪湖,一年后发现鲢鱼的种群密度明
显下降,引起该变化的原因是 。
若后代的表现型及比例为 , 则染色体片段缺失会导致雌配子致死。
若后代的表现型及比例为 , 则染色体片段缺失会导致雄配子致死。
37.[生物——选修1:生物技术实践] (15分)
常见的酿酒酵母只能利用葡萄糖而不能利用木糖来进行酒精发酵,而自然界中某些酵母菌能利用酶A 分解木糖产生酒精。
请分析回答下列问题:
(1)在制备含琼脂的培养基和倒平板的过程中,下列选项需要的是__ __(填序号)。
①酒精灯 ②接种环 ③高压蒸汽灭菌锅 ④培养皿
(2)将自然界收集的酵母菌菌株转接到仅以__ __为碳源的培养基中,__ __(填“有氧”或“无氧”)条件下培养一周后,有些酵母菌死亡,说明这些酵母菌不能利用木糖发酵。
(3)将搜集到的酵母菌放入培养液中扩大培养后,用稀释涂布平板法计算每克样品中的菌株数的公式为(C÷V)×M ,其中C 代表__ __。
对于需要长期保存的菌种,可以采用__ __的方法。
(4)纯化后的酶A 可以用电泳法检测其分子量大小。
在相同条件下,带电荷相同的蛋白质电泳速度越快,说明__ __。
(5)生产上常将酶A 固定化以反复利用。
部分操作如下:将酶A 固定在__ __(填“溶于水”或“不溶于水”)的载体上,将其装入反应柱内后,需用蒸馏水充分洗涤固定化酶柱,以除去未吸附的酶A 。
一般来说,酶不适合采用__ __法固定化。
38.[生物——选修3:现代生物科技专题](15分)
“四位一体”(人居—种植—养殖—沼气)生态农业是我国北方典型的生态农业模式,它以沼气为纽带, 将养猪、养鸭、种植农作物、养蘑菇、沼气工程等多个生产过程有机地结合起来,成为一种高效良性的循环,生态效益得到了良性发展。
如下图是该系统物质循环的示意图,请分析回答下列问题:
(1)生态工程建设的目的就是遵循自然界__ __的规律,充分发挥资源的生产潜力,
防止环境污染,达到经济效益和生态效益的同步发展。
与传统工程相比较,生态工程是一类 __ _的工程体系。
(2)该生态系统中的生产者主要是__ __。
动物粪便中的臭味主要来自氨,在沼气池中,经过
__ __(填生物名称)的作用,可以形成硝酸盐被植物吸收利用。
(3)该生态农业模式的建立要考虑环境承载力,处理好生物与环境的协调与平衡,体现了生态工程的__ __原理。
该生态农业模式的建立不但要考虑到自然生态系统的规律,还要考虑到经济与社会等系统的影响力,这体现了生态工程的__ __原理。
(4)这种生产模式对环境的污染小,因为生产一种产品时产生的有机废物变成了__ __。
与普通的农业生态系统相比,“四位一体”生态农业具有更大的产出投入比的原因主要是 __ __。
- 3 -
30.
31.(8分,每空2分)
(1)在环境条件不受破坏的情况下,一定空间中所能维持的种群最大数量 25 (2)该生态系统的动植物种类较少(组分少),营养结构简单(食物链、食物网简单) (3)鲢鱼和鳙鱼在食物上存在竞争关系
37.(1) ①③④ (2)木糖 无氧
(3)某一稀释度下平板上生长的平均菌落数 甘油管藏。
(4)其分子量越小 (5)不溶于水 包埋
38.(1)物质循环 少消耗、多效益、可持续 (2)农作物 硝化细菌
(3)协调与平衡 整体性
(4) 生产另一种产品的原料(或另一种产品的投入)
秸秆、人畜粪便中的能量被多级利用(或充分利用了废弃物中的能量)
30.
31.(8分,每空2分)
(1)在环境条件不受破坏的情况下,一定空间中所能维持的种群最大数量 25 (2)该生态系统的动植物种类较少(组分少),营养结构简单(食物链、食物网简单) (3)鲢鱼和鳙鱼在食物上存在竞争关系
37.(1) ①③④ (2)木糖 无氧
(3)某一稀释度下平板上生长的平均菌落数 甘油管藏。
(4)其分子量越小 (5)不溶于水 包埋
38.(1)物质循环 少消耗、多效益、可持续 (2)农作物 硝化细菌
(3)协调与平衡 整体性
(4) 生产另一种产品的原料(或另一种产品的投入)
秸秆、人畜粪便中的能量被多级利用(或充分利用了废弃物中的能量)。
