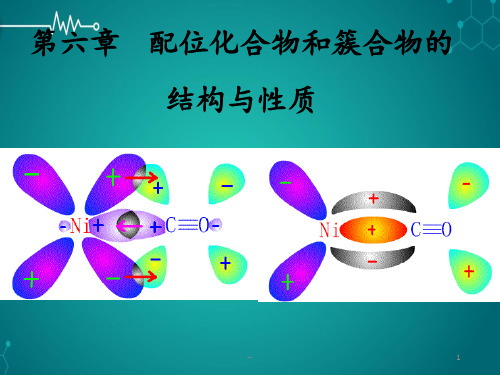
第六章 配合物结构gai
合集下载
配合物结构

2 Eeg + 3Et2 g = 0 ∴ Eeg Et2 g = 10 Dg
那
Eeg = 6 Dg Et2 g = 4 Dg
3、正四面体场的作用:配体从四面体的四个顶点接近中心离子
L
L
一种 d xy , d yz , d zx
L
L L
指向四面体棱的中点,
L
受一定斥力,能量有所 上升;
L
L
d xy , d yz , d zx
2+ 4
[Fe ( H 2O )6 ] ,[Fe ( CN )6 ]
Q Fe2+ : kk 3d 6 , p = 19150cm 1 H 2O = 10400cm 1 , CN = 33000cm 1 ∴ H 2O < p ,
[Fe ( H 2O )6 ]2+ 中Fe2+的 d电子排布
eg 2 t2 g 3+1
正八面体
dsp , d sp L 杂化
一般,共价配合物多是低自旋态。如 [Fe(CN)6]3-等
晶体场理论(CFT) §6-2 晶体场理论(CFT)
M
n+与L n-的作用是L n-形成的力场对M n+的作用,使M n+
的d轨道分裂, d电子重排。
一、中心离子 轨道能级的分裂: 中心离子d轨道能级的分裂 中心离子 轨道能级的分裂: 1、球对称场的作用:5个d轨道受到的作用是相同的,轨道整 体能量上升,但不发生分裂。 Es
依光谱序列
I < Br <L< OH < F < H2O <L< py< NH3 <L< en< NO < CN,CO 2
第六章配合物和簇合物的结构与性质PPT课件
的点电荷与M的d轨道电子云产生排斥作用。
--
13
在晶体场中d 轨道能级分裂,引起电子排布及其他 一系列性质的变化,据此可解释配位化合物的各种 性质。如光谱、水合热及几何结构等特性。
--
14
六配位和四配位是过渡金属离子配合物的主要形式,
分别称为正八面体场(Oh)、正四面体场(Td)和正
方形场(D4h)。
D4h场
自由离子
Es
dx2-y2
ddxz2y dxz dyz
d轨道 球对称作用部分
x
y
四配位化合物的配位型式与d电子数的多少及配体的电
负性有关
--
21
立方体
四面体
t2g
t2
八面体 eg
平面正方形 dx2-y2
dxy
球对称
t2g
dz2
Td
Oh
eg Oh
配体对称性决定了d轨道能级的分裂
dxz, dyz
这与键的形成有关:dxy,dxz,dyz虽不能与配体L形 成键,但条件适合可形成键,从而影响的大小 ,这与配位场理论有关。
B:当配位体固定时, 随中心离子而改变:
对同一金属离子而言,电荷越高, 值越大;
如:Mn2+对H2O的值为7800cm-1,而Mn3+对H2O的
值为21000cm-1
--
26
对电子构型(d电子及价数)相同的不同金属离子,主 量子数越大(周期),则值越大; 5d 4d 3d
--
12
6.1.1 晶体场理论(CFT)
1.晶体场理论的内容: 把中心离子(M)和配体(L)的相互作用看作类似
离子晶体中正负离子的静电作用。
当L接近M时,M中的d轨道受到L负电荷的
第6章 配合物的结构

测定titmb与 AgCF3SO3在不 同摩尔比时的1H NMR谱
此外, NMR还常用研究配合物与其他分子的相互作 用等. 例如利用NMR研究了辅酶B12模型化合物烷基 钴肟配合物与环糊精(CD)分子的相互作用, 并测定了 两者之间的结合常数.
[2] 顺磁性金属离子中有未成对的电子存在,而且这些未成对的 电子对配合物的NMR会产生很大的影响。其中一部分顺磁性金 属离子, 如Cu(II), Mn(II)等, 会导致其配合物的NMR不可测. 对它们可利用ESR(电子自旋共振)来进行研究.
还有一些金属离子在不同的配合物中有不同的自旋 状态,高自旋时有未成对的电子, 而低自旋时则没有不成 对的电子.例如: Fe(II), Co(III), Ni(II)低自旋时, 其电子 全部成对, 也是抗磁性金属离子.
含有抗磁性金属离子配合物的NMR与配体(有机 化合物)的NMR相近, 化学位移的位置和峰宽发生一 定的变化,但是一般都不大. 因此, 常用来跟踪, 研究 配合物的形成.
***利用紫外-可见光谱研究溶液中配合物形成及其组成 的方法:连续变化法(Job 法)
该方法是将M和L的溶液浓度分别定为CM和CL,然后在CM+CL 一定,及总浓度一定的情况下连续改变二者的比例,例如:
测定不同比例下各种溶液的紫外-可见光谱,以最大吸收峰的 吸光度为纵坐标,以摩尔比x= CL /(CM+CL)为横坐标作图。如 果体系中有固定组成的配合物形成的话,就会出现一个极大值XM。
例子: 在二价钴和二价镍配合物[M(cbim)4(NO3)2][cbim= 4-氰基苄基 咪唑]中每个金属离子与来自4个配体的4个咪唑N原子以及来自2个 硝酸根阴离子的2个O原子配位, 形成具有八面体配位构型的单核高 自旋配合物.
此外, NMR还常用研究配合物与其他分子的相互作 用等. 例如利用NMR研究了辅酶B12模型化合物烷基 钴肟配合物与环糊精(CD)分子的相互作用, 并测定了 两者之间的结合常数.
[2] 顺磁性金属离子中有未成对的电子存在,而且这些未成对的 电子对配合物的NMR会产生很大的影响。其中一部分顺磁性金 属离子, 如Cu(II), Mn(II)等, 会导致其配合物的NMR不可测. 对它们可利用ESR(电子自旋共振)来进行研究.
还有一些金属离子在不同的配合物中有不同的自旋 状态,高自旋时有未成对的电子, 而低自旋时则没有不成 对的电子.例如: Fe(II), Co(III), Ni(II)低自旋时, 其电子 全部成对, 也是抗磁性金属离子.
含有抗磁性金属离子配合物的NMR与配体(有机 化合物)的NMR相近, 化学位移的位置和峰宽发生一 定的变化,但是一般都不大. 因此, 常用来跟踪, 研究 配合物的形成.
***利用紫外-可见光谱研究溶液中配合物形成及其组成 的方法:连续变化法(Job 法)
该方法是将M和L的溶液浓度分别定为CM和CL,然后在CM+CL 一定,及总浓度一定的情况下连续改变二者的比例,例如:
测定不同比例下各种溶液的紫外-可见光谱,以最大吸收峰的 吸光度为纵坐标,以摩尔比x= CL /(CM+CL)为横坐标作图。如 果体系中有固定组成的配合物形成的话,就会出现一个极大值XM。
例子: 在二价钴和二价镍配合物[M(cbim)4(NO3)2][cbim= 4-氰基苄基 咪唑]中每个金属离子与来自4个配体的4个咪唑N原子以及来自2个 硝酸根阴离子的2个O原子配位, 形成具有八面体配位构型的单核高 自旋配合物.
06(ws) 配合物的结构与性质

正八面体
根据配合物的磁矩可以计算配合物中成单的电子数并 由此确定杂化轨道的类型: µ= n ( n + 2 ) 其中 n 为配合物中的成单电子数, µ 为配合物的磁矩。
例, 实验测得 Co(CN)63- 和 CoF63- 均有正八面体的结 构且磁矩分别为 0 和 4.9 B.M. Co 3d74s2: Co3+ 3d6: 配位后, 配位后 CoF63-: sp3d2 在 CoF63- 中, 杂化轨道的类型为 sp3d2, 配离子有 4 个单 电子, 显顺磁性, 为外轨型配合物(也叫电价配合物)。 6F-
2.
3.
例如, 为了说明 Cu2+配合物的平面四方形构型问题, 认为 3d 电子被 激发到 4p 能级从而发生 dsp2 杂化。
Cu2+ 4X- CuX42- dsp2
这里, X是一价阴离子的配位体。在此过程中, 自由离子 Cu2+要由3d激 发一个电子到 4p需要的激发能为1422.6 kJ·mol-1, 看不出这么大的能量从何 而来。要补赏这个能量, 必须使Cu←X键键能至少要达到-356 kJ·mol-1, 已 知Cl-Cl键键能为-243 kJ·mol-1, 这表明, 形成Cu-Cl键放出的能量比形成 Cl-Cl键放出的能量还要大, 这可能是不真实的。 根据这个结构, 可以推测Cu2+的配合物应当很容易地失去未配对的4p电 子而迅速氧化为Cu3+, 但事实并非如此。 因此,
电子的高、低自旋排布: 八面体场中 d 电子的高、低自旋排布: High-Spin Low-Spin High-Spin Low-Spin
High-Spin and Low-Spin
高自旋 or 低自旋:对于一个处于配位场中的金属离子, 其电 子排布究竟采用高自旋, 还是低自旋的状态, 可以根据成对能 和分裂能的相对大小来进行判断。 当 P > △ 时, 因电子成对需要的能量高, 电子将尽量以单电 子排布分占不同的轨道, 取高自旋状态;当 P < △ 时, 电子 成对耗能较少, 此时将取低自旋状态。
根据配合物的磁矩可以计算配合物中成单的电子数并 由此确定杂化轨道的类型: µ= n ( n + 2 ) 其中 n 为配合物中的成单电子数, µ 为配合物的磁矩。
例, 实验测得 Co(CN)63- 和 CoF63- 均有正八面体的结 构且磁矩分别为 0 和 4.9 B.M. Co 3d74s2: Co3+ 3d6: 配位后, 配位后 CoF63-: sp3d2 在 CoF63- 中, 杂化轨道的类型为 sp3d2, 配离子有 4 个单 电子, 显顺磁性, 为外轨型配合物(也叫电价配合物)。 6F-
2.
3.
例如, 为了说明 Cu2+配合物的平面四方形构型问题, 认为 3d 电子被 激发到 4p 能级从而发生 dsp2 杂化。
Cu2+ 4X- CuX42- dsp2
这里, X是一价阴离子的配位体。在此过程中, 自由离子 Cu2+要由3d激 发一个电子到 4p需要的激发能为1422.6 kJ·mol-1, 看不出这么大的能量从何 而来。要补赏这个能量, 必须使Cu←X键键能至少要达到-356 kJ·mol-1, 已 知Cl-Cl键键能为-243 kJ·mol-1, 这表明, 形成Cu-Cl键放出的能量比形成 Cl-Cl键放出的能量还要大, 这可能是不真实的。 根据这个结构, 可以推测Cu2+的配合物应当很容易地失去未配对的4p电 子而迅速氧化为Cu3+, 但事实并非如此。 因此,
电子的高、低自旋排布: 八面体场中 d 电子的高、低自旋排布: High-Spin Low-Spin High-Spin Low-Spin
High-Spin and Low-Spin
高自旋 or 低自旋:对于一个处于配位场中的金属离子, 其电 子排布究竟采用高自旋, 还是低自旋的状态, 可以根据成对能 和分裂能的相对大小来进行判断。 当 P > △ 时, 因电子成对需要的能量高, 电子将尽量以单电 子排布分占不同的轨道, 取高自旋状态;当 P < △ 时, 电子 成对耗能较少, 此时将取低自旋状态。
配合物的结构和异构现象PPT课件

1.三角双锥 2.四方锥 3.多面体之间的转化
三角双锥 (trigonal bipyramid, TBP) D3h
四方锥 (square pyramid, SP)
C4v
[Fe(CO)5] D3h
BiF5
C4v
1.三角双锥
d8、d9、d10 和 d0构型金属离子较常见。
如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 [Co(H)(N2)(PPh3)3]
S
Ag C
Ag
N
N
Ag C
S
AgSCN晶体
二、配位数3
配位数为3的配合物,其空间结构一般 为平面三角形.
原因:当三个配体配位于没有非键电子 的中心原了,只有在配体占等边三角形的三 个角即键角为120°,配体之间的斥力最小。
中心原子是以 sp2、dp2、或ds2杂化轨 道与配体的合适轨道成键。单核的平面3配 位的配合物不多。
(a), (b), D4h
沿四重轴拉长或压扁
(2).沿2个四重轴(C4)改变长度的称正交变形 (Oh→D2h).如图(c).
(3). 沿 着 一 个 三 重 轴 ( C3 ) 的 变 形 称 三 角 变 形 (Oh→D3d).如图(d).
2、三角棱柱(D3h )
1965年出现了第一个三角棱柱配合物 [Re(S2C2Ph2)3]属于这一结构。
一、平面正方形配合物的几何异构现象
1、[MA2B2] 最典型的代表是二氯·二氨合铂 (Ⅱ)[PtCl2(NH3)2],其有两种几何异构体分别为 顺式和反式。
图2.5 [PtCl2(NH3)2]的两种几何异构体
2、[MABCD] 这一类配合物应有三种几何异构体。最早得
到的这一型式的配合物是 [Pt(NH3)(NH2OH)(Py)(NO2)]+ 阳 离 子 , 它 的 三 种 异构体如下图。
三角双锥 (trigonal bipyramid, TBP) D3h
四方锥 (square pyramid, SP)
C4v
[Fe(CO)5] D3h
BiF5
C4v
1.三角双锥
d8、d9、d10 和 d0构型金属离子较常见。
如:[Fe(CO)5]、[CuCl5]3-、[CdCl5]3-、 [Co(H)(N2)(PPh3)3]
S
Ag C
Ag
N
N
Ag C
S
AgSCN晶体
二、配位数3
配位数为3的配合物,其空间结构一般 为平面三角形.
原因:当三个配体配位于没有非键电子 的中心原了,只有在配体占等边三角形的三 个角即键角为120°,配体之间的斥力最小。
中心原子是以 sp2、dp2、或ds2杂化轨 道与配体的合适轨道成键。单核的平面3配 位的配合物不多。
(a), (b), D4h
沿四重轴拉长或压扁
(2).沿2个四重轴(C4)改变长度的称正交变形 (Oh→D2h).如图(c).
(3). 沿 着 一 个 三 重 轴 ( C3 ) 的 变 形 称 三 角 变 形 (Oh→D3d).如图(d).
2、三角棱柱(D3h )
1965年出现了第一个三角棱柱配合物 [Re(S2C2Ph2)3]属于这一结构。
一、平面正方形配合物的几何异构现象
1、[MA2B2] 最典型的代表是二氯·二氨合铂 (Ⅱ)[PtCl2(NH3)2],其有两种几何异构体分别为 顺式和反式。
图2.5 [PtCl2(NH3)2]的两种几何异构体
2、[MABCD] 这一类配合物应有三种几何异构体。最早得
到的这一型式的配合物是 [Pt(NH3)(NH2OH)(Py)(NO2)]+ 阳 离 子 , 它 的 三 种 异构体如下图。
第六章配合物结构化学课件

• π键配位体:利用成键的π电子和反键的空 轨道同时和金属离子配位的配位体
配合物的磁性
磁 性:物质在磁场中表现出来的性质。 顺磁性:被磁场吸引的性质 µ > 0 , n > 0 。 例如:O2,NO,NO2等物质具有顺磁性。 反磁性:被磁场排斥的性质 µ = 0 , n =0 。 大多数物质具有反磁性。 铁磁性:被磁场强烈吸引的性质。例如: Fe,Co,Ni属于铁磁性物质。
K3[Fe(CN)6]
Fe3+:
3d5
µ =2.40
n=1
配合物的空间构型
配合物分子或离子的空间构型与配位数的 多少密切相关。 配位数
2 4 6 4 4 6 2
空间构型 直线形
四面体 平面正方形 八面体
NiCl2 4
Ni(CN) 2 4
例
Ag(NH3 ) 2
Fe(CN)3 6
空间构型 例
纯自旋磁矩: n(n 2)
为玻尔磁子 n —— 未成对电子数
e
e
物质的磁性与内部的电子自旋有关。若 电子都是偶合的,由电子自旋产生的磁效应 彼此抵消,这种物质在磁场中表现反磁性; 反之,有未成对电子存在时,才会在磁场中 显示磁效应。
2 S (S 1) n(n 2)
例, 实验测得Co(CN)63-和CoF63-均有正八面体的结构且磁 矩分别为0和4.9 B.M.
Co 3d74s2: Co3+ 3d6: 配位后, CoF63-:
6F-
sp3d2 在CoF63-中, 杂化轨道的类型为sp3d2, 配离子有4个单电子, 显顺磁性, 为外轨型配合物(也叫电价配合物)。 6CN- Co(CN)63-: d2sp3 在Co(CN)63-中, Co3+中心离子以d2sp3杂化轨道成键, 配离子 没有成单电子, 显抗磁性, 为内轨型配合物(也叫共价型配合物)。
第六章 配位化合物和簇合物的结构与性质

d 轨道与配体间的作用:
图1-1
图1-2 d 轨道在 Oh 场中的能级分裂
2.正四面体场
中心离子位于立方体的中心,在立方体的八个角上每 隔一个角(上下错开)放一个配体。 与八面体场相 反,dz2,dx2- y2的角度极大值指向立方体的面心; 而dxy,dxz,dyz的极大值指向立方体四个边线的中心. 前者离配体较远,斥力小,轨道能量上升少;后者 与配体的斥力大,轨道能量上升多。图形如1-3所示
1. 离子水化热和MX2的点阵能
➢ 考察第一系列过渡金属二价离子由Ca2+— —Zn2+,由于3d电子层受核吸引增大,水合热 理应循序增加,但实际受LFSE(配位场稳定化 能)的影响,出现如图所示形状,它是按弱场 情况变化的。
Ca2+——Zn2+ 由于电子层数3d不变,而核电荷递增, 使3d电子壳层收缩,二价金属离子半径递减。
eg* ,半径又增加,这样便得到一个乡下的双峰曲线,
低自旋6配位的配合物离子半径变化应该是向下的单峰 曲线 。
• ★ 在对称的非线性分子中,系统不可能
在轨道简并状态下保持稳定,而必然要 发生畸变使得轨道能级发生分裂,以消 除这个简并性,这就是姜-泰勒效应。
• 例如:[d(x2-y2)] 2[d(z2)]1和[d( x2-y2)] 1[d
9 10 n
第一序列二价和三价金属离子的6配位化合物离子的半 径随原子序数增大而递减,对高自旋配位化合物而言,从d (0)到(3)离子,d电子逐步进入 t2g轨道,因有效核电 荷逐步增加,故半径逐渐减小,但d(4)d(5)离子中电子 进入eg*轨道,使配位体受到的电子云斥力增加,因此半径 反而增加,d(6)d(7)d(8)离子中电子又进入 t2g轨道, 离子半径又逐渐下降,到d(9)d(10)离子电子又进入
第6章 配合物的结构与性质

z 3 4
设处在x, y, z轴正方向上L的 轨
道分别为1, 2, 3,负方向的为4,
5, 6 。 这些轨道组成与中心离子
的原子轨道匹配的群轨道。
结构化学
5 1 x 6
2
y
生物与化学工程学院
第6 章 配合物的结构与性质
ML6八面体场的分子轨道
M
4s 3dx2-y2 3dz2 4px 4py 4pz 3dxy 3dxz 3dyz
弱场配位体缩小了Δo
Cl-、F-等的p轨道和M的d轨道形成π键,缩 小了Δo,是弱场配体。左图表示轨道叠加,由有电
子的轨道向空轨道提供电子,形成配键。右图表示
能级图。
结构化学 生物与化学工程学院
第6 章 配合物的结构与性质
结构化学
N M 单齿配体
生物与化学工程学院
第6 章 配合物的结构与性质
2. 非螯合多啮配位体 特点:有多个配位点,但同一配位体的几个配位点不能 直接和同一个金属中心配位,如:PO33-、CO32-。 3. 螯合配位体 特点:同一配位体的几个配位点能直接和同一个金属中 心配位,如:EDTA、8-羟基喹啉、柠檬酸钠等。
结构化学 生物与化学工程学院
第6 章 配合物的结构与性质
(1) d轨道角度分布图
y
- + + -
z
- + -
-
z
+ -
x
+
y
+
x
dxy
z
+ - + -
dyz
y -
dxz
+ - + x
生物与化学工程学院
x
d z2
结构化学
设处在x, y, z轴正方向上L的 轨
道分别为1, 2, 3,负方向的为4,
5, 6 。 这些轨道组成与中心离子
的原子轨道匹配的群轨道。
结构化学
5 1 x 6
2
y
生物与化学工程学院
第6 章 配合物的结构与性质
ML6八面体场的分子轨道
M
4s 3dx2-y2 3dz2 4px 4py 4pz 3dxy 3dxz 3dyz
弱场配位体缩小了Δo
Cl-、F-等的p轨道和M的d轨道形成π键,缩 小了Δo,是弱场配体。左图表示轨道叠加,由有电
子的轨道向空轨道提供电子,形成配键。右图表示
能级图。
结构化学 生物与化学工程学院
第6 章 配合物的结构与性质
结构化学
N M 单齿配体
生物与化学工程学院
第6 章 配合物的结构与性质
2. 非螯合多啮配位体 特点:有多个配位点,但同一配位体的几个配位点不能 直接和同一个金属中心配位,如:PO33-、CO32-。 3. 螯合配位体 特点:同一配位体的几个配位点能直接和同一个金属中 心配位,如:EDTA、8-羟基喹啉、柠檬酸钠等。
结构化学 生物与化学工程学院
第6 章 配合物的结构与性质
(1) d轨道角度分布图
y
- + + -
z
- + -
-
z
+ -
x
+
y
+
x
dxy
z
+ - + -
dyz
y -
dxz
+ - + x
生物与化学工程学院
x
d z2
结构化学
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
道。结合晶体场理论,讨论配合物的结构和性能。
……
配合物是物质存在的一种形式,具有广泛的应用价值。
如 [Fe(CN)6]3-
[Ag(CnH2n)]+
(CO)5Mn Mn(CO)5
H CH3
CH CH2 H3C
CH3
R
N
N
Mg
H
N
N
H3C
H
CH3
CH2 CH2 CO
HC CO
CO
O
OCH3
3
CH3
R=CH2CH3 =COCH3
§6-2 晶体场理论(CFT)
M n+与L n-的作用是L n-形成的力场对M n+的作用,使M n+
的d轨道分裂, d电子重排。
一、中心离子d轨道能级的分裂: 1、球对称场的作用:5个d轨道受到的作用是相同的,轨道整
体能量上升,但不发生分裂。
Es
d x2 y2 ,d z2 ,d xy ,d yz ,d zx
一种 d x2 y2 ,d z2
指向四面体面心,受斥
力较小,能量升高较小。
t
Et2
Es
Ee
d
四面体场失去中心对称,且4 9
10Dg
同理 3Et2 2Ee 0
那
4
Et2 Ee 9 10Dg
2 Et2 5 0 1.78Dg
Ee
3 5
0
Eeg
Et2g
0 10Dg
那
Eeg 6Dg
Et2g 4Dg
3、正四面体场的作用:配体从四面体的四个顶点接近中心离子
L L
L L
d xy ,d yz ,d zx
L L
L L
dx2 y2 ,dz2
一种 d xy ,d yz ,d zx
指向四面体棱的中点, 受一定斥力,能量有所 上升;
还原卟啉环系(叶绿素,细菌叶绿素)
NC
CC
His96 N
H2O N
C
Zn C
CN
C
C N
N N His119 CC
C
His94
C
CO2
碳酸酐酶
OH
HCO3
CF3
S
O
O
Zn
O Zn O
N S
N CF3
双核锌大杂环配合物
唐敖庆先生等因在配位场理论方面的贡献和成就,曾获得 国家自然科学一等奖
推荐参考书目: 《 配位化学》,戴安邦等,科学出版社,1987,10 《配位化合物的结构和性质》,游效曾,科学出版社,1992,2
§6-1 配合物的价键理论(VBT)
一、电价配键: M n+与L n-(或有偶极矩的分子),靠 静电引力结合在一起,形成配合物。
结合力——库仑力 取决于L n-的大小和电荷。中心离子M n+ 的电子排布与自由离子一样,一般是高自旋 态,有单电子,显顺磁性。 如[FeF6]3-等
L n- ……L nM n+
5.14 Dg
d yz ,d zx
其它配位体场对中心离子的影响,可类似分析。
二、 d轨道的电子排布:
d轨道分裂后,迫使电子重排。这会使电子成对的能量P增 加,这是自旋引起的量子力学效应。
1、分裂能 和成对能 p
:①配体影响:同一中心离子,配体的场强愈强,引起
依光谱序列
愈大。
I Br OH F H2O py NH3 en NO2 CN ,CO
H2O p , Fe( H2O )6 2 中Fe2+的 d电子排布
eg 2 t2g 31
CN p , Fe( CN )6 4中Fe2+的 d电子排布
eg 0 t2 g 6
3、配合物的紫外可见光谱:
d
2、正八面体场的作用:L从 x, y,z 六个方向接近中心离子
由于d轨道的伸展方向不同,所以,能量升高不一样。
d x2 y2 ,d z2与配体L影响方向相同,排斥力大,能量升高较高;
d xy ,d yz ,d zx 与配体岔开,排斥力较小,能量升高较低。
L L
L
L
L L
dx2 y2 ,dz2
L
L L L
L L
d xy ,d yz ,d zx
Eeg
0 10Dg Es
Et2g
d
能级图中:t—三重简并,e—二重简并,2—以 V 反对称
令 0 10Dg
Dg 为相对场强参数
Eeg Et2g 10Dg
按微扰理论, d轨道的平均能量不变,并令Es=0
2Eeg 3Et2g
第六章 配合物结构
由中心离子或原子(M)与周围配体(L)所组成的化合物为 配合物。 M—L之间的键称配位键
配位键理论:价键理论—VB 晶体场理论—CFT 分子轨道理论—MO 配位场理论—MOT
配位场理论是在分子轨道理论的基础上,把中心原子(M)
的价轨道按 和 的对称性分类,与配体线性组合的群轨 道按 和 对称性匹配的原则,组成配合物的离域分子轨
2.67Dg
4、平面正方形场的作用:配体L从 x, y 四个方向接近中心离子
所受斥力的情况分四种
如下图
L
L
L
L
L
L
L
d x2 y2
斥力最大
d
L
L
L
LL
L
L
L
L
d xy
斥力较大
dz2
斥力较小
12.28 Dg
d x2 y2
d yz ,d zx
斥力最小
2.28Dg d xy
Es
4.28Dg d z2
p :电子成对能。使体系能量升高。
2、 d轨道中d电子的排布:要从 和 p 综合考虑。
① p 配体是弱场, 较小
d电子尽量采取高自旋态。
② p 配体是强场, 较大
d电子尽量采取低自旋态。
如: Fe2 Fe( H2O )6 2 ,Fe( CN )6 4
Fe2 : kk3d 6 , p 19150cm1 H2O 10400cm1 , CN 33000cm1
弱场
中强场
强场
②中心离子影响:配体相同,同一元素,价态高的 大; 同簇元素,周期数大, 大。
如 Fe3 ,H2O 13700cm1 Fe2 ,H2O 10400cm1
③ 随配位原子半径的减小而增大:
如 I Br Cl S F O N C
L n- ……L n-
二、共价配键: M n+ L n-
要点:1、 M n+在配体影响下,价层电子重排,空出足够
的空轨道;
2、 M n+的价轨道进行杂化,决定空间构型。
( n 1)d 2nsnp3 杂化—内轨型
nsnp3nd 2
杂化—外轨型
正八面体
dsp2 , d 4sp 3 杂化
一般,共价配合物多是低自旋态。如 [Fe(CN)6]3-等
……
配合物是物质存在的一种形式,具有广泛的应用价值。
如 [Fe(CN)6]3-
[Ag(CnH2n)]+
(CO)5Mn Mn(CO)5
H CH3
CH CH2 H3C
CH3
R
N
N
Mg
H
N
N
H3C
H
CH3
CH2 CH2 CO
HC CO
CO
O
OCH3
3
CH3
R=CH2CH3 =COCH3
§6-2 晶体场理论(CFT)
M n+与L n-的作用是L n-形成的力场对M n+的作用,使M n+
的d轨道分裂, d电子重排。
一、中心离子d轨道能级的分裂: 1、球对称场的作用:5个d轨道受到的作用是相同的,轨道整
体能量上升,但不发生分裂。
Es
d x2 y2 ,d z2 ,d xy ,d yz ,d zx
一种 d x2 y2 ,d z2
指向四面体面心,受斥
力较小,能量升高较小。
t
Et2
Es
Ee
d
四面体场失去中心对称,且4 9
10Dg
同理 3Et2 2Ee 0
那
4
Et2 Ee 9 10Dg
2 Et2 5 0 1.78Dg
Ee
3 5
0
Eeg
Et2g
0 10Dg
那
Eeg 6Dg
Et2g 4Dg
3、正四面体场的作用:配体从四面体的四个顶点接近中心离子
L L
L L
d xy ,d yz ,d zx
L L
L L
dx2 y2 ,dz2
一种 d xy ,d yz ,d zx
指向四面体棱的中点, 受一定斥力,能量有所 上升;
还原卟啉环系(叶绿素,细菌叶绿素)
NC
CC
His96 N
H2O N
C
Zn C
CN
C
C N
N N His119 CC
C
His94
C
CO2
碳酸酐酶
OH
HCO3
CF3
S
O
O
Zn
O Zn O
N S
N CF3
双核锌大杂环配合物
唐敖庆先生等因在配位场理论方面的贡献和成就,曾获得 国家自然科学一等奖
推荐参考书目: 《 配位化学》,戴安邦等,科学出版社,1987,10 《配位化合物的结构和性质》,游效曾,科学出版社,1992,2
§6-1 配合物的价键理论(VBT)
一、电价配键: M n+与L n-(或有偶极矩的分子),靠 静电引力结合在一起,形成配合物。
结合力——库仑力 取决于L n-的大小和电荷。中心离子M n+ 的电子排布与自由离子一样,一般是高自旋 态,有单电子,显顺磁性。 如[FeF6]3-等
L n- ……L nM n+
5.14 Dg
d yz ,d zx
其它配位体场对中心离子的影响,可类似分析。
二、 d轨道的电子排布:
d轨道分裂后,迫使电子重排。这会使电子成对的能量P增 加,这是自旋引起的量子力学效应。
1、分裂能 和成对能 p
:①配体影响:同一中心离子,配体的场强愈强,引起
依光谱序列
愈大。
I Br OH F H2O py NH3 en NO2 CN ,CO
H2O p , Fe( H2O )6 2 中Fe2+的 d电子排布
eg 2 t2g 31
CN p , Fe( CN )6 4中Fe2+的 d电子排布
eg 0 t2 g 6
3、配合物的紫外可见光谱:
d
2、正八面体场的作用:L从 x, y,z 六个方向接近中心离子
由于d轨道的伸展方向不同,所以,能量升高不一样。
d x2 y2 ,d z2与配体L影响方向相同,排斥力大,能量升高较高;
d xy ,d yz ,d zx 与配体岔开,排斥力较小,能量升高较低。
L L
L
L
L L
dx2 y2 ,dz2
L
L L L
L L
d xy ,d yz ,d zx
Eeg
0 10Dg Es
Et2g
d
能级图中:t—三重简并,e—二重简并,2—以 V 反对称
令 0 10Dg
Dg 为相对场强参数
Eeg Et2g 10Dg
按微扰理论, d轨道的平均能量不变,并令Es=0
2Eeg 3Et2g
第六章 配合物结构
由中心离子或原子(M)与周围配体(L)所组成的化合物为 配合物。 M—L之间的键称配位键
配位键理论:价键理论—VB 晶体场理论—CFT 分子轨道理论—MO 配位场理论—MOT
配位场理论是在分子轨道理论的基础上,把中心原子(M)
的价轨道按 和 的对称性分类,与配体线性组合的群轨 道按 和 对称性匹配的原则,组成配合物的离域分子轨
2.67Dg
4、平面正方形场的作用:配体L从 x, y 四个方向接近中心离子
所受斥力的情况分四种
如下图
L
L
L
L
L
L
L
d x2 y2
斥力最大
d
L
L
L
LL
L
L
L
L
d xy
斥力较大
dz2
斥力较小
12.28 Dg
d x2 y2
d yz ,d zx
斥力最小
2.28Dg d xy
Es
4.28Dg d z2
p :电子成对能。使体系能量升高。
2、 d轨道中d电子的排布:要从 和 p 综合考虑。
① p 配体是弱场, 较小
d电子尽量采取高自旋态。
② p 配体是强场, 较大
d电子尽量采取低自旋态。
如: Fe2 Fe( H2O )6 2 ,Fe( CN )6 4
Fe2 : kk3d 6 , p 19150cm1 H2O 10400cm1 , CN 33000cm1
弱场
中强场
强场
②中心离子影响:配体相同,同一元素,价态高的 大; 同簇元素,周期数大, 大。
如 Fe3 ,H2O 13700cm1 Fe2 ,H2O 10400cm1
③ 随配位原子半径的减小而增大:
如 I Br Cl S F O N C
L n- ……L n-
二、共价配键: M n+ L n-
要点:1、 M n+在配体影响下,价层电子重排,空出足够
的空轨道;
2、 M n+的价轨道进行杂化,决定空间构型。
( n 1)d 2nsnp3 杂化—内轨型
nsnp3nd 2
杂化—外轨型
正八面体
dsp2 , d 4sp 3 杂化
一般,共价配合物多是低自旋态。如 [Fe(CN)6]3-等
