试验委托单(模板格式)
样品试验委托单
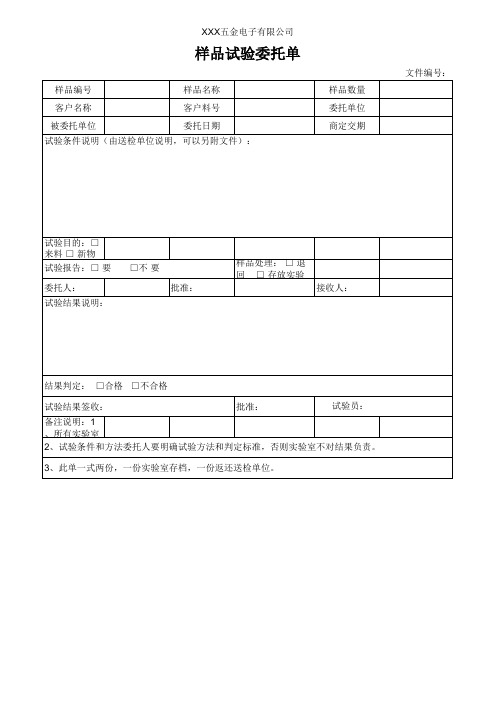
样品试验委托单
样品编号
样品名称
客户名称
客户料号
被委托单位
委托日期
试验条件说明(由送检单位说明,可以另附文件):
样品数量 委托单位 商定交期
文件编号:
试验目的:□ 来料 □ 新物 试验报告:□ 要
委托人: 试验结果说明:
□不 要 批准:
样品处理: □ 退 回 □ 存放实验
接收人:
结果判定: □合格 □不合格
试验结果签收:
批准:
试验员:
备注说明:1 、所有实验室
2、试验条件和方法委托人要明确试验方法和判定标准,否则实验室不对结果负责。
3、此单一式两份,一
试验委托单
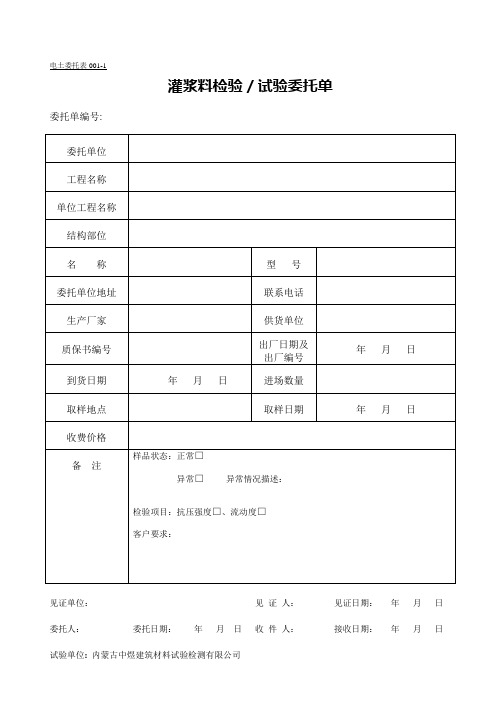
灌浆料检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位名称型号委托单位地址联系电话生产厂家供货单位质保书编号出厂日期及出厂编号年月日到货日期年月日进场数量取样地点取样日期年月日收费价格备注样品状态:正常□异常□异常情况描述:检验项目:抗压强度□、流动度□客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司水泥检验/试验委托单委托单编号: 委托单位工程名称品种、标号、代号厂名、牌号出厂日期年月日供货单位出厂编号质保书编号进场日期年月日进场数量取样日期年月日取样地点联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司砂子检验/试验委托单委托单编号:委托单位工程名称种类规格产地供货单位进场日期年月日进场数量m3取样日期年月日取样地点联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司碎(卵)石检验/试验委托单委托单编号: 委托单位工程名称种类、规格产地出厂日期年月日进场数量m3进场日期年月日供货单位取样日期年月日取样地点联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司外加剂检验/试验委托单委托单编号: 委托单位工程名称单位工程名称生产厂家供货单位种类出厂编号出厂日期年月日合格证编号进场日期年月日进场数量t 取样日期年月日取样地点联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司粉煤灰质量检验/试验委托单委托单编号: 委托单位工程名称生产厂家供货单位出厂编号合格证编号粉煤灰等级出厂日期年月日进场日期年月日进场数量t取样日期年月日取样地点联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司电土委托表006、007钢筋(材)检验/试验委托单委托单编号:委托单位工程名称钢筋种类公称直径(mm)强度等级代号牌号生产厂家级别、外形供货单位到货数量t质保书编号炉批号取样地点取样日期年月日联系电话取样数量(根)拉伸样品编号弯曲其它其它样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司机械连接接头检验/试验委托单委托单编号:委托单位工程名称单位工程名称结构部位委托单位地址联系电话钢筋原材料试验报告编号收费价格操作工姓名公称直径(mm)连接接方法接头型式牌号、外形试件代表接头数量取样数量(根)拉伸样品编号原材样品编号其它样品编号原材样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司焊接接头检验/试验委托单委托单编号:委托单位工程名称单位工程名称结构部位焊工姓名公称直径(mm)焊接方法级别外形试验种类接头型式钢筋原材料试验报告编号试件代表接头数量个联系电话取样数量(根)拉伸试样编号弯曲其它其它试样编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司电土委托表009、010沥青(胶)检验/试验委托单委托单编号: 委托单位工程名称单位工程名称收费价格委托单位地址联系电话生产厂家供货单位合格证编号品种、类别标号到货日期年月日进场数量t取样地点取样日期年月日取样数量代表数量t备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司电土委托表011__________砖检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位收费价格生产厂家供货单位标号(强度等级)种类、等级合格证编号进场数量块到货日期年月日取样日期年月日取样地点取样数量取样方法代表数量块联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:内蒙古康远工程建设监理有限责任公司见证人:见证日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司委托人:委托日期:年月日电土委托表012-1砂浆检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位配合比编号要求稠度mm砂浆种类外加剂及掺和料强度等级抗冻、抗渗标号联系电话备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日砂浆抗压强度检验/试验委托单委托单编号:委托单位工程名称结构部位单位工程名称配合比编号要求稠度mm水泥品种、标号外加剂及掺和料强度等级抗冻、抗渗标号联系电话试件编号要求期龄(d)成型日期实际期龄(d)稠度实测值(mm)试件养护条件试件尺寸(mm)试件制作人备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日混凝土抗折强度检验/试验委托单委托单编号: 委托单位呼和浩特市光源电力安装有限责任公司工程名称呼市高职园区学院110Kv变电站单位工程名称电缆沟工程结构部位墙、板委托单位地址联系电话6947864 配合比编号2010-001 要求坍落度70-90mm水泥品种、标号p.042.5 外加剂及掺和料HZ-6泵送防冻剂强度等级抗冻、抗渗标号C25 收费价格试件编号要求期龄(d)成型日期样品编号坍落度实测值(mm)试件养护条件试件尺寸(mm)试件制作人1 28天2010.11.16 标准养护150×150宁二安备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:内蒙古康远工程建设监理有限责任公司见证人:张学文见证日期:2010年12月14日委托人:杨华委托日期:2010 年12 月14日收件人:接收日期:年月日电土委托表013-2灌浆料抗压强度检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话配合比编号要求坍落度mm水泥品种、标号外加剂及掺和料强度等级抗冻、抗渗标号收费价格试件编号要求期龄(d)成型日期样品编号坍落度实测值(mm)试件养护条件试件尺寸(mm)样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日电土委托表013-3混凝土检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话配合比编号要求坍落度mm水泥品种、标号外加剂及掺和料强度等级抗冻、抗渗标号收费价格备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日电土委托表013混凝土抗压强度检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位配合比编号要求坍落度mm 水泥品种、标号外加剂及掺和料强度等级抗冻、抗渗标号C F P联系电话试件编号要求期龄(d)成型日期实际期龄(d)坍落度实测值(mm)试件养护条件试件尺寸(mm)样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日电土委托表014__________抗冻试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话配合比编号要求坍落度或稠度mm水泥品种、标号外加剂及掺和料强度等级收费价格抗渗标号抗冻标号试件编号要求期龄(d)成型日期样品编号坍落度或稠度实测值(mm)试件养护条件试件尺寸(mm)样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日电土委托表015__________抗渗试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话配合比编号要求坍落度或稠度mm水泥品种、标号外加剂及掺和料强度等级收费价格抗渗标号抗冻标号试件编号要求期龄(d)成型日期实际期龄(d)坍落度或稠度实测值(mm)试件养护条件试件尺寸(mm)样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日电土委托表016回填土(砂)试验委托单委托单编号: 委托单位工程名称单位工程名称施工部位取样处回填厚度cm 土壤(砂)类别回填面积m2密度试验方法辗压机械要求干密度g/cm2辗压遍数试样编号试样数量联系电话样品状态:正常□备注异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日电土委托表017水检验/试验委托单委托单编号: 样品编号: 委托单位工程名称单位工程名称结构部位收费价格委托单位地址联系电话水源、水的类型水样外观生产厂家供货单位合格证编号出厂日期及出厂编号年月日到货日期年月日进场数量取样地点取样日期年月日备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司电土委托表018-1砂浆配合比申请单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话水泥品种、标号生产厂家出厂日期年月日收费价格砂子品种砂子细度模数砂浆强度等级稠度(mm)外加剂品种白灰膏客户要求:备注见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司电土委托表018混凝土配合比申请单委托单编号: 委托单位工程名称单位工程名称结构部位水泥品种、标号生产厂家出厂日期年月日石子品种、规格产地mm 砂子品种细度模数产地砼强度等级 C 坍落度级别mm 外加剂品种掺量备注客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日试验单位:内蒙古中煜建筑材料试验检测有限公司电土委托表019结构钢检验/试验委托单委托单编号: 样品编号: 委托单位委托单位地址联系电话钢材种类牌号收费价格试验要求级别、外形生产厂家钢材厚度、直径(mm)质保书编号供货单位到货数量t 进厂日期年月日取样地点取样日期年月日取样数量(根)拉伸样品编号弯曲样品编号其它样品编号备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日电土委托表020回弹法检测混凝土抗压强度检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话配合比编号要求坍落度mm水泥品种、标号外加剂及掺和料强度等级抗冻、抗渗标号收费价格检验/试验要求备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日电土委托表021材料检验/试验委托单委托单编号: 委托单位工程名称单位工程名称结构部位委托单位地址联系电话材料名称收费价格生产厂家供货单位合格证编号出厂日期及出厂编号年月日到货日期年月日进场数量取样地点取样日期年月日备注样品状态:正常□异常□异常情况描述:检验项目:客户要求:见证单位:见证人:见证日期:年月日委托人:委托日期:年月日收件人:接收日期:年月日。
最新试验委托单

钢筋(材)试验委托合同单委托统一编号:试验编号:委托日期:检测方填写收样人: 样品状态描述:□色泽均匀,无明显杂质。
检测方填写样品状态描述:口表面平整,无缺棱掉角。
收样人:检测方填写样品状态描述:□表面平整,无缺棱掉角。
收样人:环刀(灌砂法)密度试验委托合同单委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:口上下表面平整。
口无明显杂质。
收样人:委托统一编号: 试验编号: 委托日期:检测方填写收样人: 样品状态描述:□表面光洁,无破损。
检测方填写收样人: 样品状态描述:口表面无毛刺,无裂纹。
委托统一编号: 试验编号: 委托日期:士工击实试验委托合同单检测方填写样品状态描述:收样人:委托统一编号:试验编号:委托日期:防水卷材(SBS)试验委托合同单检测方填写样品状态描述:□表面平整,无孔洞缺边裂口疙瘩。
收样人:委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:口表面平整,无折痕。
收样人:委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述: 收样人:委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:表面完整,无破损。
收样人:电线电缆试验委托合同单委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:口表面完好,无破损。
收样人:保温材料试验委托合同单委托统一编号:试验编号:检测方填写样品状态描述:收样人:建筑节能工程用增强网试验委托合同单HBJC/BZ-04-61委托统一编号:试验编号:委托日期:委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:口五金件安装完好,达到正常使用的功能。
收样人:钢结构用高强度螺栓连接副试验委托合同单HBJC/BZ-04-63 委托统一编号:试验编号:委托日期:高强度螺栓连接摩擦面抗滑移系数试验委托合同单HBJC/BZ-04-64 委托统一编号:试验编号:委托日期:委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:收样人:委托统一编号: 试验编号: 委托日期:检测方填写样品状态描述:口无明显杂质。
试验委托单 电子版

混凝土试块试验委托单表式:SFWT-01监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:设计强度等级:试件规格:mm坍落度(工作度):(mm或S)搅拌方法:捣固方法:工作量:m3养护方法和温度:o C成型日期:年月日试压日期:年月日配合比编号:监理工程师:见证单位:砼厂家::试;收:砂浆抗压强度试验委托单表式:SFWT-02监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:施工部位:工程名称:设计强度等级:试件规格:mm工程量:m3砂浆品种:养护方法和温度:o C稠度:mm 水泥品种及强度等级:水泥试验编号:砂子产地及细度模数:水泥厂家:试压日期:年月日成型日期:年月日配合比编号:见证单位:监理工程师::试;收:混凝土抗渗试验委托单表式:SFWT-03监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:施工部位:抗渗等级:设计强度等级:混凝土工程量:(m3)成型日期:年月日试压日期:年月日见证单位:监理工程师:试件制作人:试件送试人;收样人:混凝土抗冻试验委托单表式:SFWT-04监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:抗渗等级:试件规格:mm 抗冻标号及强度等级:搅拌及捣固方法:养护方法和温度:o C工作量:试验日期:年月日成型日期:年月日监理工程师:见证单位:砼厂家:试件制作人:试件送试人;收样人:钢筋试验委托单表式:SFWT-05监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:使用部位:进厂数量:(t)生产厂家:抗震等级:出厂合格证号:监理工程师:见证单位:规格:钢筋牌号:;收:钢筋焊接试验委托单表式:SFWT-06监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:使用部位:工程名称:见证单位:监理工程师:焊工姓名及技术等级:出厂合格证编号:钢材牌号:母材试验单号:强度等级规格:焊工考试证明号:焊接方法及焊接形式长度:生产厂家:焊条或焊剂牌号:;收:结构钢试验委托单表式:SFWT-07监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:主要使用部位:牌号、质量等级:生产厂家:出厂合格证号:进场数量:监理工程师:钢筋名称及规格:见证单位:;收:混凝土配合比试验委托单表式:SFWT-08监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:设计强度等级:外加剂名称:外加剂厂家:水泥品种标号:厂别牌号:出厂日期:试验编号:砂子产地:种类:细度模数:试验编号:石子产地:种类:级:试验编号:水:稠度:搅拌方法:捣固方法:送样人;收样人:砂浆配合比试验委托单表式:SFWT-09监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:施工部位:工程名称:砂浆种类:设计强度等级:水泥品种标号:厂别牌号:出厂日期:试验编号:砂子产地:种类:细度模数:试验编号:掺合料名称:水种类:外加剂名称:外加剂厂家:搅拌方法:稠度要求:送样人;收样人:环境检测委托单表式:SFWT-10监理盖章处合同编号:试验编号:委托日期:年月日委托单位:工程名称:工程类别:建筑面积:竣工时间:装修情况:/ 通风状况::开关试验委托单表式:SFWT-11监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::插座试验委托单表式:SFWT-12监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::电线电缆试验委托单表式:SFWT-13监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::建筑用绝缘电工套管及配件试验委托单表式:SFWT-14监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::散热器试验委托单表式:SFWT-15监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::塑料管材管件试验委托单表式:SFWT-16监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::阀门试验委托单表式:SFWT-17监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:材质(牌号):/ 进场数量:出厂日期:/ 进场日期:::门窗试验委托单表式:SFWT-18监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:厂家:规格:开启方式:进场数量:见证单位:监理工程师:设计等级:设计单位:::砌体砂浆回弹强度检测委托单表式:SFWT-20监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:施工单位:监督单位:设计单位:监理单位:工程名称:::混凝土构件回弹强度检测委托单表式:SFWT-21监理盖章处合同编号:试验编号:委托日期:年月日委托单位:施工单位:工程名称:设计单位:监督单位:监理单位:施工日期:::实体钢筋保护层厚度检测委托单监理盖章处合同编号:试验编号:委托日期:年月日委托单位:施工单位:工程名称:设计单位:监督单位:监理单位:施工日期::表式:SFWT-23陶瓷砖试验委托单(监理盖章处)合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:产地:材料名称:使用部位:规格:进场数量:出厂日期:进场日期:见证单位:监理工程师:送样人:收样人:砖试验委托单(监理盖章处)合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:砖的种类:规格:产地:进场数量:出厂强度等级、质量等级:使用部位:见证单位:监理工程师:送样人:收样人:表式:SFWT-25瓦试验委托单(监理盖章处)合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:材料名称:产地:规格:进场数量:出厂日期:进场日期:见证单位:监理工程师:送样人:收样人:砂子试验委托单表式:SFWT-26(监理盖章处)合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:砂子产地:砂子类别:进场数量(m3)见证单位:监理工程师:送样人:收样人:表式:SFWT-27碎石试验委托单(监理盖章处)合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:产地:种类:规格:级配要求:进场数量(m3)见证单位:监理工程师:送样人:收样人:表式:SFWT-28找平层试验委托单监理盖章处合同编号:试验编号:委托日期:/ 委托单位:/建设单位:工程名称:/ :使用部位:材料名称:产地:/ 出厂日期:/ 进场日期:/见证单位: / 监理工程师:/送样人: / 收样人: /表式:SFWT-29回填土试验委托单监理盖章处合同编号:试验编号:委托日期:年月日委托单位:工程名称:建设单位:使用部位:材料名称:进场数量:/ 产地:出厂日期: / 进场日期:/见证单位:监理工程师:李子东送样人:收样人:表式:SFWT-30玻纤网耐碱拉伸断裂强力试验委托单监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:材料名称:材料规格:mm 进场数量:出厂日期:年月日进场日期:年月日见证单位:监理工程师:试件制作人:试件送试人;收样人:表式:SFWT-31绝热用模塑聚苯乙烯泡沫塑料试验委托单监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:材料名称:材料规格:进场数量:生产厂家:见证单位:监理工程师:试件送试人;收样人:表式:SFWT-32抹面胶试验委托单监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:材料名称:材料规格:Kg/m3 进场数量:出厂日期:年月日进场日期:年月日见证单位:监理工程师:试件制作人:试件送试人;收样人:表式:SFWT-33胶粘剂试验委托单监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:材料名称:材料规格:Kg/m3进场数量:出厂日期:年月日进场日期:年月日见证单位:监理工程师:试件制作人:试件送试人;收样人:表式:SFWT-34防水材料试验委托单监理盖章处合同编号:试验编号:委托日期:年月日建设单位:委托单位:工程名称:施工部位:材料名称:材料规格:进场数量:出厂日期:年月日进场日期:年月日见证单位:监理工程师:试件制作人:试件送试人;收样人:水泥试验委托单表式:SFWT-35监理盖章处合同编号:试验编号:委托日期:年月日委托单位:建设单位:工程名称:使用部位:生产厂厂名:出厂合格证号:水泥品种及标号:出厂日期:/ 进厂数量:吨送样人:收样人:。
建设工程质量检测试验委托单

试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 年月日试验编号:见证人(签章):取(送)样人(签章):收样人:试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01 月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01月01 日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009 年01月01日试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五试验委托单YXJC/JL012-2009委托单位:XX房地产开发有限公司委托日期: 2009年01月01 试验编号:见证人(签章):张三取(送)样人(签章):李四收样人:王五门窗试验委托单YXJC/JL067-2009委托日期:2009.7.1 试验编号:见证人:张三取(送)样人:李四收样人:王五。
实验室检验委托单格式

JZ-JL(ZL)-093检验委托单委托单位:XXXXX 委托日期:XXXXXX 统一编号:见证人:证书号:日期:取〔送〕样人:收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXX 委托日期:XXXXXXX 统一编号:见证人:xxx 证书号:日期:取〔送〕样人:xxx 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:省第筑工程公司委托日期:2012.10.06 统一编号:121009862见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:省第二箭镞工程公司委托日期:2012.10.06 统一编号:121009862见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:JZ-JL(ZL)-093检验委托单委托单位:XXXXXXX 委托日期:XXXXX 统一编号:见证人:XXX 证书号:日期:取〔送〕样人:XXX 收样人:。
压实度试验委托单

检验后样品的留置:A破坏性样品不留置;B其它样品保留15天;C如有特殊要求,请附加说明。
g/cm3
试验方法
□ 环刀法 口灌砂法 口钻芯法
要求压实度*
N%
取样层数及每 层点数*
其他说明
客户须提供取样位置图;
若在本单位委托过击实试验或沥青混合料原材料试验,则应注明相应试验的委托编
号:
试验依据*
□JTG E60-2008《公路路基路面现场测试规程》
□GB/T50123-《土工试验方法标准》
□其它:
试 验 项
目
□密度
□压实度
判定依据*
□JTG F80/1-—《公路工程质量程施工质量检验标准》
□DBJ01-45-《北京市城市道路工程施工技术规程》
□其它:
注:委托方对所提供的一切资料及样品的真实性负责,并提供必要的文件。
检 测 机 构 填 写
压实度试验委托单(表:DLJCS-GLWT-Y21)
委托编号: 试验编号:单位代号*
委 托 单 位 填 写
委托单位*
试样编号*
工程名称及部 位*
委托人*
联系电话*
委托日期*
监理单位*
见证人*(需打印)
施工单位*
材料种类*
最大干密度(注:环刀法、 灌砂法填写)*
g/cm3
*□理论最大密度、口试验室标准密度、口试验段密度(注:钻芯法填写)*
样品状态
外观:口正常 □不正常
价格(元)
见证试验
口是;□否
收样人
年 月 日
注:检测机构对试验结果的准确性负责,保护委托单位的机密和所有权。
工程试验委托书模板

工程试验委托书模板尊敬的[委托方名称]:兹有我方[委托方名称]因[工程名称]项目需要,特委托贵方[受托方名称]进行[具体试验名称]试验。
现就相关事宜明确如下:一、委托事项1. 试验项目:[具体试验名称]。
2. 试验目的:[试验目的描述]。
3. 试验范围:[试验范围描述]。
二、试验要求1. 试验标准:应符合[相关标准或规范名称]。
2. 试验方法:应按照[具体试验方法或步骤]进行。
3. 试验时间:[试验开始时间]至[试验结束时间]。
三、样品提供1. 我方将提供[样品数量]份样品,供试验使用。
2. 样品应符合[样品提供标准或条件]。
四、试验费用1. 试验费用总计为[金额]元。
2. 付款方式:[付款方式描述]。
3. 付款时间:[付款时间节点]。
五、试验报告1. 贵方应在试验完成后[报告提交时间]内向我方提供试验报告。
2. 试验报告应包括[报告应包含的内容或数据]。
六、保密协议1. 双方应对试验过程中涉及的技术和商业信息保密。
2. 未经对方书面同意,任何一方不得向第三方泄露相关信息。
七、违约责任1. 如贵方未能在规定时间内完成试验或试验结果不符合要求,应承担相应的违约责任。
2. 如我方未能按时支付试验费用,应承担相应的违约责任。
八、其他事项1. 本委托书自双方签字盖章之日起生效。
2. 本委托书一式两份,双方各执一份,具有同等法律效力。
委托方(盖章):[委托方名称]授权代表(签字):[代表姓名]联系电话:[联系电话]联系地址:[联系地址]日期:[签订日期]受托方(盖章):[受托方名称]授权代表(签字):[代表姓名]联系电话:[联系电话]联系地址:[联系地址]日期:[签订日期]此致敬礼![委托方名称][委托方地址] [委托方联系电话]。
