高考化学复习考点知识专题练习5---离子共存、离子检验
第五讲 离子共存、离子检验与推断(课件)-【大一轮课堂】2024年高考化学大一轮复习课件+习题

复习目标
1.掌握离子共存的条件,会判断溶液中离子能否大量共存。 2.了解常见离子的检验方法。 3.能利用典型代表物的性质和反应,进行离子的推断和设计常见物质检验 的方案。
考点一 /////// 离子共存 考点二 /////// 离子的检验与推断 /////// 考点三 答题规范-离子检验操作现象描述
思想在线
【例】.常温下,下列各组离子在指定溶液中一定能大量共存的是( B )
A.中性溶液中:NO- 3 、Cl-、Ba2+、Fe3+
c(H+)
B.lg
>0
c(OH-)
溶液:Cl-、Ba2+、NO- 3 、Br-
C.水电离出的 c(H+)=1.0×10-12 mol·L-1 的溶液中:Na+、NH+ 4 、S2-、Br- D.在澄清透明溶液中:Ba2+、SO42-、NO- 3 、Na+
b、因生成沉淀(或微溶性物质)不能大量共存
离子 Ba2+、Ca2+
Ag+ H+ S2- CO23 - OH- AlO2-
不能大量共存的离子 SO24-、CO23-、SO23- 、SiO23-、PO34-等 Cl-、Br-、I-、SO24-、CO23- 、PO34-、S2-等
AlO2-、SiO23-等 Zn2+、 Fe2+、Pb2+、Cu2+、Ag+ 等 Ba2+、Ca2+、 Mg2+、Pb2+、Zn2+、Cu2+、Fe2+、Ag+等 Mg2+、 Cu2+、Fe2+、Fe3+、Al3+ 、Zn2+等
H+、HCO- 3 、HSO- 3 等
②氧化还原反应: 强氧化性离子
ClO-、MnO4-(H+)、 NO3-(H+)、Fe3+
还原性离子
Fe2+(可与Fe3+共存)、S2-、I-、 SO32-、HS-、HSO3-
高考化学一轮复习第5讲离子共存离子的检验和推断练习新人教版(new)

第5讲离子共存离子的检验和推断【考纲要求】 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一|离子共存(重点保分型—-师生共研)授课提示:对应学生用书第23页[核心知识大通关]同一溶液中有多种离子时,若任意两种离子间发生反应,即为不能大量共存。
1.复分解反应型(1)生成难溶物或微溶物的离子不能大量共存。
巧记盐的溶解性口诀钾、钠、铵盐硝酸盐易溶于水,硫酸盐不溶铅和钡,氯化物不溶银亚汞,微溶物质有四种。
说明:①四种微溶物是指:Ag2SO4、CaSO4、MgCO3、Ca(OH)2。
②AgCl、AgBr、AgI、BaSO4及微溶的CaSO4、Ag2SO4都难溶于稀强酸。
(2)生成气体及挥发性物质的离子不能大量共存。
(3)生成难电离物质(水、弱酸、一水合氨等)不能大量共存.2.氧化还原反应型具有较强氧化性的离子与具有较强还原性离子,会发生氧化还原反应而不能大量共存.A中的离子与B中的离子能发生氧化还原反应3离子间因发生络合反应而不能大量共存,中学常见的反应有(1)Fe3+与SCN-因生成Fe(SCN)3而不能大量共存。
(2)Ag+与NH3·H2O因生成[Ag(NH3)2]+而不能大量共存。
4.水解相互促进型当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水,从而使两种离子的水解平衡互相促进而向水解方向移动,甚至完全反应。
常见的因发生相互促进的水解反应而不能大量共存的离子如下:(1)Al3+与CO错误!、HCO错误!、S2-、HS-、AlO错误!、SiO错误!;(2)Fe3+与CO错误!、HCO错误!、AlO错误!、SiO错误!.小题热身1.指出下列离子组不能共存的原因。
(1)Na+、OH-、SO错误!、Fe3+。
___________________________________________。
高中化学 离子共存与离子检验练习

考点过关(上)考点6 离子共存与离子检验电解质在水溶液中的性质,实质就是电解质电离出的各离子在溶液中表现的性质总和.所以化学中的不少问题适宜从离子角度来解析,这样往往能抓住本质、突破难点、避繁就简.离子反应主要涉及电解质和非电解质、强电解质和弱电解质、离子反应发生的条件及离子方程式等内容。
离子共存是离子反应条件和本质的最直接运用,通常以选择题的形式出现.离子共存的实质是判断某些离子在一些特定条件下相互之间能否发生反应,若能够发生反应则离子不能共存,反之不能反应的离子则能在溶液中大量共存,离子在溶液中能否大量共存,涉及到离子的性质及溶液酸碱性等综合知识。
同一溶液中若离子间相互结合成难溶物、难电离物质、气体,或者离子间发生氧化还原反应、络合反应,则不能在溶液中大量共存。
离子检验的推断属于实验、推断题型,主要是对物质中所含的成分,运用实验的手段进行分析和判断,最后得出结论。
离子推断的主要依据是实验结果,解答此类问题必须掌握离子的性质,包括颜色以及与其他物质反应产生的现象,如产生气体、生成沉淀等的变化.该题型难度中等,能力要求较高,主要以选择题和填空题形式出现.离子共存一般可从以下几方面考虑:弱碱阳离子只存在于酸性较强的溶液中,如Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH—不能大量共存;弱酸阴离子只存在于碱性溶液中,如CH3COO-、F—、CO32—、SO32-、S2—、PO43—、 AlO2-均与H+不能大量共存;弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存,它们遇强酸(H+)会生成弱酸分子,遇强碱(OH-)生成正盐和水, 如HSO3-、HCO3-、HS—、H2PO4-、HPO42-等;若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存,如Ba2+、Ca2+与CO32-、SO32-、 PO43-、SO42—等,Ag+与Cl-、Br-、I—等,Ca2+与F—,C2O42—等。
高考化学复习离子共存离子检验和推断习题含解析

高考化学复习离子共存、离子检验和推断1.在强酸性溶液中能大量共存的无色透明离子组是( )A.K+、Na+、NO-3、MnO-4B.Mg2+、Na+、Cl-、SO2-4C.K+、Na+、Br-、Cu2+D.Na+、Ba2+、OH-、SO2-4解析:A选项中的MnO-4在水溶液中显紫色;C选项中的Cu2+在水溶液中显蓝色;D选项中会发生离子反应Ba2++SO2-4===BaSO4↓和H++OH-===H2O。
答案:B2.下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是( ) A.K+、Ca2+、Cl-、NO-3B.K+、Na+、Br-、SiO2-3C.H+、Fe2+、SO2-4、Cl2D.K+、Ag+、NH3·H2O、NO-3解析:A项中离子能大量共存,通入CO2后,溶液呈酸性,不会生成CaCO3沉淀,各离子仍能大量共存,A项正确;B项中通入CO2后SiO2-3因转化为H2SiO3沉淀而不能大量存在;C 项中Fe2+与Cl2发生氧化还原反应不能大量共存;D项中Ag+与NH3·H2O因能生成银氨配离子而不能大量共存。
答案:A3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )A.使酚酞变红色的溶液中:Na+、Al3+、SO2-4、Cl-B.K wc(H+)=1×10-13mol·L-1的溶液中:NH+4、Ca2+、Cl-、NO-3C.与Al反应能放出H2的溶液中:Fe2+、K+、NO-3、SO2-4D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO-2、CO2-3解析:使酚酞变红色的溶液呈碱性,Al3+不能大量存在,A不符合题意;K wc(H+)=1×10-13mol·L-1的溶液呈强酸性,四种离子能大量共存,B符合题意;与Al反应能放出H2的溶液可能呈强酸性也可能呈强碱性,酸性条件下NO-3氧化Fe2+生成Fe3+,碱性条件下,Fe2+不能存在,C项不符合题意;水电离的c(H+)=1×10-13mol·L-1的溶液可能呈强酸性也可能呈强碱性,酸性条件下,AlO-2、CO2-3都不能大量存在,D项不符合题意。
第03讲 离子共存、离子的检验与推断(课件)-2025年高考化学一轮复习讲练测(新教材新高考)

③NH4+与 − 、CO32-, + 与HCO3-等组合中,虽然两种离子都能水解
能
且水解相互促进,但总的水解程度仍很小,它们在溶液中仍____大量共存。
考点突破·考法探究
4.四反应(四种反应类型)
四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不
(NH4+、 + 、+ 、+ 、 + 、+ 、+ 等)
②强碱性溶液中 H+及弱碱阳离子不能大量存在
考点突破·考法探究
特别提醒
1)常见表示呈酸性的溶液:
①常温下,<的溶液
④与镁粉反应放出氢气的溶液
②使试纸变红的溶液
③使甲基橙呈红色的溶液
⑤常温下,c(OH-)<1×10-7
考点突破·考法探究
【变式训练2】 ( ⋅ 天津·二模)由水电离出的 + = × − ⋅
− 的溶液中,一定能大量共存的离子组是( A )
−
A.+ 、+ 、− 、−
B.+ 、+ 、−
、
C.− 、+ 、− 、 −
弱电解质
3.离子之间相互结合生成__________。
H+
OH-
CH3COO-
PO43-
H2O
CH3COOH
H3PO4
考点突破·考法探究
促进水解
4.离子之间发生______________,而不能大量共存
①常见的因发生相互促进的水解反应而不能大量共存的离子如下:
Al3+
CO32-
HCO3-
Fe3+
【变式训练1】 ( ⋅ 天津南开·二模)用经氯气消毒的自来水配制的溶液
高考化学一轮复习限时集训5离子共存离子检验与推断(含解析)

离子共存 离子检验与推断(建议用时:25分钟)1.(2021·常熟联考)室温下,下列各组离子在指定溶液中能大量共存的是( )A .澄清透明的溶液中:Fe 3+、Ba 2+、NO -3、Cl -B .c (NaHCO 3)=0.1 mol·L -1的溶液:K +、OH -、Cl -、SO 2-4C .K wc OH -=0.1 mol·L -1的溶液:Na +、K +、SO 2-4、ClO -D .能使酚酞变红的溶液中:Mg 2+、Ba 2+、ClO -、I -A [B 项,HCO -3与OH -反应;C 项,K w c OH -=0.1 mol·L -1的溶液呈酸性,ClO -不能大量共存;D 项,溶液呈碱性,Mg 2+不共存,同时ClO -与I -能发生氧化还原反应。
]2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )A .c 水(H +)·c 水(OH -)=10-22(mol·L -1)2的溶液中:Mg 2+、K +、Br -、HCO -3 B .pH>7的溶液中:I -、Cl -、NO -3、Na + C .加水稀释,c OH -c H+明显增大的溶液中:K +、Mg 2+、Cl -、ClO - D .pH =7的溶液中:Fe 3+、Al 3+、Cl -、NO -3B [A 项,溶液可能为酸或碱液,HCO -3、Mg 2+不一定大量共存;C 项,溶液为酸性溶液,ClO -不能大量共存;D 项,中性溶液中Fe 3+、Al 3+不能大量共存。
]3.某溶液中含有大量的K +、Cl -及X 与Y 两种离子,现向该溶液中加入W 试剂,根据实验现象得到的关于X 、Y 的推断能成立的是( ) 选项W 试剂 实验现象 X 、Y 的推断 AKI淀粉溶液 溶液变蓝 Fe 3+、SO 2-4 B酚酞试液 无明显现象 CH 3COO -、Na + C硝酸酸化的AgNO 3溶液 白色沉淀 CO 2-3、NH +4 D 过量NaOH 溶液 无明显现象 Al 3+、Mg 2+A [加入Fe 3+,且K +、Cl -、Fe 3+、SO 2-4在该溶液中可以大量共存,A 项符合题意;加入酚酞试液无明显现象说明溶液不呈碱性,若含有CH 3COO -,则该溶液显碱性,B 项不符合题意;若含有CO 2-3,则加入硝酸酸化的AgNO 3溶液还会产生气体,与实验现象不符,C 项不符合题意;若含有Mg 2+,加入过量NaOH 溶液,产生Mg(OH)2沉淀,D 项不符合题意。
专题复习_离子共存、离子的检验和推断
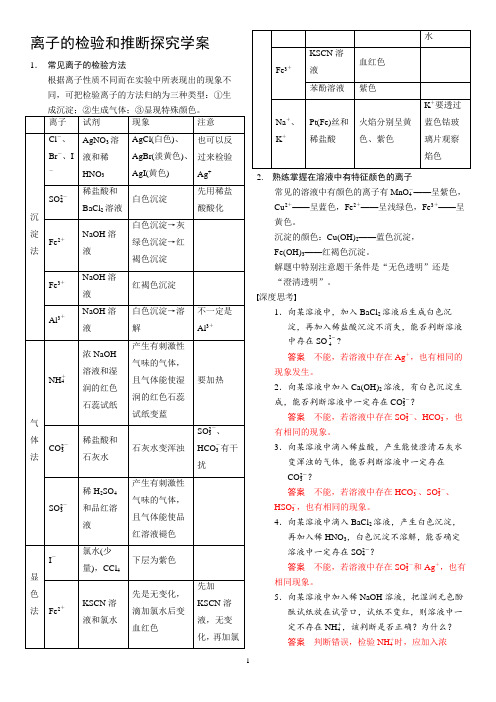
离子的检验和推断探究学案1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生2. 熟练掌握在溶液中有特征颜色的离子常见的溶液中有颜色的离子有MnO-4——呈紫色,Cu2+——呈蓝色,Fe2+——呈浅绿色,Fe3+——呈黄色。
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。
解题中特别注意题干条件是“无色透明”还是“澄清透明”。
深度思考1.向某溶液中,加入BaCl2溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,能否判断溶液中存在SO 24?答案不能,若溶液中存在Ag+,也有相同的现象发生。
2.向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO2-3?答案不能,若溶液中存在SO2-3、HCO-3,也有相同的现象。
3.向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在CO2-3?答案不能,若溶液中存在HCO-3、SO2-3、HSO-3,也有相同的现象。
4.向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,能否确定溶液中一定存在SO2-4?答案不能,若溶液中存在SO2-3和Ag+,也有相同现象。
5.向某溶液中加入稀NaOH溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶液中一定不存在NH+4,该判断是否正确?为什么?答案判断错误,检验NH+4时,应加入浓12NaOH 溶液,并加热,且用湿润的红色石蕊试纸。
6.向某溶液中滴加氯水,再加入KSCN 溶液,溶液变红色,则溶液中一定存在Fe 2+,该判断是否正确?为什么?答案 判断错误,检验Fe 2+时,应先加KSCN ,再加氯水,否则,Fe 3+干扰结果的判断。
7.做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素,该判断是否正确?为什么?答案 判断错误,钾的焰色反应必须透过蓝色钴玻璃片才能观察到。
离子大量共存的练习题

离子大量共存的练习题离子间能发生化学反应,它们在同一溶液中不能大量共存;离子间不发生化学反应,它们能在同一溶液中大量共存。
准确判断离子间能否发生化学反应是解决这一类问题的关键和难点。
在设计这种这类题目的时候,可能还会设计出溶液的颜色等附加条件。
1、有颜色的离子:Cu 2+(蓝)Fe 3+(棕黄)Fe 2+(浅绿)MnO 4-(紫红)Cr 2O 42+(橙)2、酸碱性:直接说明溶液呈酸碱性、或间接说明—如溶液使指示剂显示颜色,水电离出的C (H +)、C (OH -)等:如某酸性溶液(存在H +);能使酚酞显红色的溶液(说明是碱性溶液);水电离出的H + 和 OH - 的物质的量浓度的乘积为1×10-24 (可能是酸溶液,也可能是碱溶液)溶液中离子能否大量共存的规律可分为:一、发生复分解反应不能大量共存:1、生成气体。
如CO 32-、SO 32-、HCO 3-、HSO 3-、S 2-、HS -等易挥发性的弱酸的酸根与H +不能大量共存;NH 4+与OH - 不能大量共存;2、生成难溶物或者微溶物而不能大量共存。
Ag +与Cl -、Br -、I -、CO 32-、SO 32-、S 2-、PO 43-等不能大量共存。
AlO 2--和Al 3+不能大量共存。
3、生成弱电解质(弱酸、弱碱、水)不能大量共存。
OH -、ClO -、CH 3COO -、HPO 42-、H 2PO 4-、AlO 2-与H +不能大量共存;HCO 3-、HS -、HSO 3-、H 2PO 4-、HPO 42-与OH-等不能大量共存。
二、发生氧化还原反应不能大量共存 : 如Fe 3+和I -、S 2-1、NO 3-在酸性条件下具有强氧化性,能氧化Fe 2+、S 2- 、HS -、SO 32-、I -等还原性物质2、S 2- 和SO 32-在碱性条件下能共存,但在酸性条件下不共存,2S 2- + SO 32- + 6H += 3 S ↓+ 3H 2O三、发生双水解不能大量共存:1、Al 3+ 与 HS - 、 S 2-、 ClO- 、 AlO 2- 、 CO 32- 、 HCO 3-等发生盐的双水解反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学复习考点知识专题练习专题05 离子共存、离子检验1.常温下,由水电离出的c(H +)=10-13 mol·L -1的溶液中,下列离子组一定能大量共存的是A .NH 4+、Al 3+、NO 3-、Cl -B .Na +、K +、Cl -、NO 3-C .Cu 2+、Fe 2+、Cl -、 NO 3-D .Na +、AlO 2-、SO 42-、SiO 32- 【答案】B【解析】A 项:NH 4+、Al 3+在碱性溶液中不能大量存在,A 项错误;B 项:Na +、K +、Cl -、NO 3-在酸性、碱性溶液中都能大量共存,B 项正确;C 项:Cu 2+、Fe 2+在碱性溶液中不能大量存在,C 项错误; D 项:AlO 2-、SiO 32-在酸性溶液中不能大量存在,D 项错误。
2.常温下,下列各组离子中,在溶液中能大量共存的是( )A .CO 32-、S 2-、NO 3-、Ca 2+B .Al 3+、Na +、S 2-、SO 42-C .Al 3+、NH 4+、K +、SO 42-D .Fe 2+、Ca 2+、H +、NO 3-【答案】C【解析】A.CO 32-与Ca 2+不能大量共存,会产生碳酸钙沉淀,故A 不选;B.Al 3+与S 2-之间发生双水解反应生成Al(OH)3沉淀和H 2S 气体,不能大量共存,故B 不选;C.该组离子之间不发生反应,可以大量共存,故C 选;D.Fe 2+、NO 3-与H +之间发生氧化还原反应,不能大量共存,故D 不选。
3.常温下,下列各组离子在指定溶液中能大量共存的是( )A .使pH 试纸显蓝色的溶液中:Na +、Mg 2+、ClO -、HSO 3-B .c(Fe 3+)=0.1 mol·L -1的溶液中:K +、NH 4+、SO 42-、SCN -C .w -K c(OH )=0.1 mol·L -1的溶液中:Na +、HCO 3-、K +、NO 3-D .0.1 mol·L -1的NaHCO 3溶液中:NH 4+、NO 3-、Na +、SO 42-【答案】D【解析】A. 使pH 试纸显蓝色的溶液呈碱性,HSO 3-、Mg 2+不能大量存在 ,且ClO -与HSO 3-因发生氧化还原反应而不能大量共存,选项A 错误;B. c(Fe 3+)=0.1 mol·L -1的溶液中:Fe 3+与SCN -发生络合反应而不能大量共存,选项B 错误;C. w -K c(OH )=0.1 mol·L -1的溶液中c(H +)=10-1mol/L ,为强酸性溶液,HCO 3-不能大量存在,选项C 错误;D. 0.1 mol·L -1的NaHCO 3溶液中:NH 4+、NO 3-、Na +、SO 42-、HCO 3-相互之间不反应,能大量共存,选项D 正确。
4.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )A .K +、H +、Fe 2+、NO 3-B .Fe 3+、Ba 2+、SO 42-、NO 3-C .Al 3+、Na +、SO 42-、CO 32-D .Fe 3+、H +、SO 42-、ClO ﹣【答案】A【解析】A.H +、Fe 2+、NO 3-离子之间发生氧化还原反应而不能共存,故A 选;B.Ba 2+、SO 42-结合生成沉淀而不能共存,因为复分解反应不能共存,故B 不选;C.Al 3+、CO 32-相互促进发生双水解而不能共存,故C 不选;D.H +、ClO ﹣结合生成HClO 弱电解质而不能共存,故D 不选。
5.在酸性溶液中能大量共存而且为无色透明的溶液是 ( ) A .NH 4+、Al 3+、SO 42-、NO 3-B .K +、Na +、NO 3-、CH 3COO -C .K +、Fe 3+、Cl -、NO 3-D .Na +、K +、HCO 3-、NO 3- 【答案】A【解析】A .在酸性溶液中,NH 4+、Al 3+、SO 42-、NO 3-可以大量共存且溶液为无色,A 项符合题意;B .醋酸根离子与氢离子结合变成了醋酸分子,酸性条件下醋酸根不能大量存在,B 项不符合题意;C .虽然K +、Fe 3+、Cl -、NO 3-在酸性溶液中能大量共存,但是含铁离子的溶液呈黄色,C 项不符合题意;D .碳酸氢根离子与氢离子反应生成二氧化碳和水,酸性条件下HCO 3-不能大量存在,D 项不符合题意。
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )A .在新制的漂白粉溶液中:K +、Na +、NO 3-、CH 3COO -B .使红色石蕊试纸变蓝的溶液中:Na +、Cu 2+、SO 42-、NO 3-C .在0.1 mol·L -1的NH 4HCO 3溶液中:Na +、Al 3+、Cl -、NO 3-D .在c (Fe 3+)=1 mol·L -1的溶液中:K +、NH 4+、SCN -、I -【答案】A【解析】A .新制的漂白粉溶液中主要含有Ca 2+、ClO -和Cl -,K +、Na +、NO 3-、CH 3COO-在溶液中能大量共存,故A正确;B.使红色石蕊试纸变蓝的溶液中存在大量氢氧根离子,Cu2+与OH-发生反应,在溶液中不能大量共存,故B错误;C.NH4HCO3溶液中存在大量HCO3-,Al3+和HCO3-发生相互促进的水解反应而不能大量共存,故C错误;D.Fe3+、SCN-离子之间结合生成络离子,I-能与Fe3+发生氧化还原反应,不能大量共存,故D错误。
7.某待测溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。
下列说法不正确的是A.SO42-、SO32-至少含有一种B.沉淀B的化学式为BaCO3C.肯定存在的离子有Na+、CO32-、HCO3-、Cl-D.肯定不存在Br—【答案】C【解析】A.根据以上分析可知,待测液中至少存在SO42-、SO32-中的一种,故A正确;B.根据分析可知,沉淀B为BaCO3,HCO3-与Ba2+、OH-反应生成的BaC03,故B正确;C.根据分析可知不能确定待测液中是否存在Cl-,故C错误;D.根据分析可知待测液中一定不存在Br-的离子,故D正确。
8.某溶液含有K+、Fe3+、SO42-、CO32-、I-中的几种。
取样,滴加KSCN溶液后显血红色。
下列判断错误的是A.一定存在的离子为Fe3+、SO42-B.一定不存在的离子为CO32-、I-C.不能确定的离子为K+、SO42-D.需要通过焰色反应来确定是否含有K+【答案】C【解析】A.根据上述分析可知,溶液中一定存在Fe3+、SO42-,故A正确;B.溶液中一定存在Fe3+,因此溶液中一定不存在与Fe3+反应的CO32-、I-,故B正确;C.溶液中一定含有SO42-,不能确定的离子为K+,故C错误;D.无法确定是否含有钾离子,可以通过焰色反应来确定是否含有K+,故D正确。
9.常温下,下列各组离子在指定溶液中一定能大量共存的是()A.某份不含其他离子澄清溶液中:Fe3+、Ca2+、NO3-、Cl-B.在含0.1mol/LHNO3溶液中:Cu2+、Na+、Cl-、SO32-C.在含0.1mol/LFeCl3溶液中:K+、NH4+、I-、SCN-D.与铝粉反应放出氢气的无色溶液中:NO3-、Cu2+、Na+、SO42-【答案】A【解析】A、这些离子能够大量共存,故A符合题意;B、HNO3具有强氧化性,SO32-以还原性为主,两者能发生氧化还原反应,因此题中所给离子不能在指定溶液中大量共存,故B不符合题意;C、Fe3+能氧化I-,Fe3+与SCN-发生络合反应,因此题中所给离子在指定的溶液中不能大量共存,故C不符合题意;D、能与铝反应放出氢气,该溶液可能为碱,也可能为酸,该溶液为无色溶液,Cu2+显蓝色,如果溶液是碱,则Cu2+不与OH-大量共存,如果溶液为酸,NO3-在酸性条件下具有强氧化性,与金属反应不产生氢气,题中所给离子不能在指定溶液中大量共存,故D不符合题意。
10.向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。
则下列离子组在对应的溶液中一定能大量共存的是A.a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-B.b点对应的溶液中:Na+、S2-、SO42-、Cl-C.c点对应的溶液中:K+、Ag+、Ca2+、NO3-D.d点对应的溶液中:K+、NH4+、CO32-、SO42-【答案】B【解析】A.a点溶液显碱性,NaOH过量,则不可能存在HCO3-,不能共存,A项错误;B.b点恰好生成偏铝酸钠,溶液显碱性,Na+、ClO-、SO42-、Cl-不反应,能大量存在,B项正确;C.c点偏铝酸钠与氯化铝恰好完全反应生成氢氧化铝,还生成氯化钠,则不可能存在Ag+,不能共存,C项错误;D.d点为氯化铝溶液,氢氧根离子与铵根离子反应,不能大量共存,D项错误。
11.下列各组离子在指定溶液中一定能大量共存的是()①酸性溶液中:Na+、ClO-、SO42-、I-②无色溶液中:K+、Na+、MnO4-、SO42-③碱性溶液中:Cl-、CO32-、SO42-、K+、AlO2-④中性溶液中:Fe3+、K+、Cl-、SO42-⑤由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-⑥与铝粉反应放出H2的无色溶液中:NO3-、Al3+、Na+、SO42-A.③⑤B.③④C.①②④D.⑤⑥【答案】A【解析】①酸性溶液中ClO-与I-发生氧化还原反应,不能大量共存,故错误;②无色溶液中不存在紫色MnO4-,故错误;③碱性溶液中该组离子之间不反应,能够大量共存,故正确;④Fe3+在溶液中水解使溶液呈酸性,中性溶液中不可能存在Fe3+,故错误;⑤由水电离出的c(OH-)=1×10-13mol·L-1的溶液,水的电离受到抑制,既可能是酸的溶液,也可能是碱的溶液,无论是酸性溶液还是碱性溶液该组离子之间不反应,能够大量共存,故正确;⑥与铝粉反应放出H2的无色溶液,可能是酸性溶液,也可能是碱性溶液。
酸性溶液中若存在NO3-,不可能生成氢气。
碱性溶液中Al3+会生成氢氧化铝沉淀或偏铝酸根离子,则该组离子一定不能大量共存,故错误;正确的为③⑤,故选A。
12.某固体混合物中可能含有:Na+、K+、SO42- 、Cl- 、CO32-等离子,取两份该固体的溶液进行如下实验:第一份:加入过量的Ba(NO3)2溶液产生白色沉淀,分离滤液和沉淀。
