CYP2C19基因多态性检测
CYP2C19基因多态性检测的临床实验室性能验证

DOI:10.13602/j.cnki.jcls.2021.03.17·质量管理研究·CYP2C19基因多态性检测的临床实验室性能验证李婧,李林静,刘转,杨文娟,马青梅,张安安,杨海棠,刘泽菁,刘欣跃(兰州大学第二医院检验医学中心,兰州730030)摘要:目的 对人细胞色素P450酶等位基因(CYP2C19)多态性检测试剂盒进行性能验证。
方法 根据中国合格评定国家认可委员会CNAS GL039:2019《分子诊断检验程序性能验证指南》相关要求,结合试剂盒说明书,从符合率、精密度、检出限和抗干扰能力4个方面对“人CYP2C19基因多态性检测试剂盒(荧光PCR法)”进行性能验证。
符合率验证采用荧光PCR法和Sanger测序法检测;精密度验证选择杂合突变CYP2C19c.681GA、c.636GA样本进行检测;抗干扰能力验证判断基因型检测是否受影响。
结果 PCR法和Sanger测序法的检测符合率为100%;CYP2C19c.681G和A等位基因的FAM和ROX荧光通道精密度检测CV值分别为3.78%、1.76%、3.76%和3.56%;CYP2C19c.636G和A等位基因的FAM和ROX荧光通道精密度检测CV值分别为3.08%、2.81%、3.40%和3.73%;样本最低检出限为10ng/μL;抗干扰能力验证显示基因型可以正常检测。
结论 人CYP2C19基因多态性检测试剂盒(荧光PCR法)符合ISO15189质量管理要求,可以为临床提供准确可靠的检测结果。
关键词:细胞色素P450酶等位基因;基因多态性;性能验证中图分类号:R446.9 文献标志码:APerformanceverificationfordetectionofCYP2C19genepolymorphisminclinicallaboratoryLIJing,LILinjing,LIUZhuan,YANGWenjuan,MAQingmei,ZHANGAnan,YANGHaitang,LIUZejing,LIUXinyue(ClinicalLa boratoryCenter,LanzhouUniversitySecondHospital,Lanzhou730030,Gansu,China)Abstract:Objective ToverifytheperformanceofthedetectionkitsforhumancytochromeP450enzymeallele(CYP2C19)polymor phism.Methods AccordingtoChina′sConformityAssessment(CNAS)NationalApprovalCommitteeCNAS GL039:2019“Guid anceonthePerformanceVerificationforMolecularDiagnosticProcedures”combinedwiththereagentinstruction,fouraspectsofper formancesforthehumanCYP2C19genepolymorphismdetectionkit(real timequantitativePCR),i.e.,coincidencerate,precision,detectionlimitandanti interferenceability,wereverified.ThecoincidenceratewasverifiedbyfluorescencePCRandSangersequen cing.ThesamplesofheterozygousmutantCYP2C19c.681GAandc.636GAwereselectedtoverifytheprecision.Theanti interferenceabilitytestwasusedtoassesstheinterferencesofgenotypedetection.Results ThecoincidencerateoftheresultsofPCRandSangersequencingwas100%.CVvaluesofprecisionverificationofFAMandROXfluorescencechannelsforCYP2C19c.681allelesGandAwere3.78%,1.76%,3.76%and3.56%,respectively.CVvaluesofprecisionverificationforFAMandROXfluorescencechannelsofCYP2C19c.636allelesGandAwere3.08%,2.81%,3.40%and3.73%,respectively.Theminimumdetectionlimitofsampleswas10ng/μL.Theverificationforanti interferenceabilityshowedthatallthegenotypescouldbedetectednormally.Conclusion ThekitforhumanCYP2C19genepolymorphismdetection(real timequantitativefluorescentPCR)conformedtoISO15189qualitymanagementrequirementsandcouldprovideaccurateandreliabledetectionresultsforclinicalpractice.Keywords:cytochromeP450enzymeallele;genepolymorphism;performanceverification 人细胞色素P450酶等位基因(CYP2C19)编码的S-美芬妥英羟化酶参与了一系列临床常用药物代谢,其中最常见的就是氯吡格雷抵抗[1]。
CYP2C19临床检测意义

CYP2C19临床检测意义首先,CYP2C19的多态性在患者之间存在显著的差异。
不同的CYP2C19基因型会导致该酶活性的变化,从而对药物代谢和疗效产生不同的影响。
其中最常见的CYP2C19多态性基因型是CYP2C19*2、CYP2C19*3和CYP2C19*17、CYP2C19*2和CYP2C19*3是一种非功能性基因型,其对CYP2C19酶的活性具有抑制作用,使得有这些基因型的患者代谢药物的速度较慢。
而CYP2C19*17是一种增功能基因型,其对CYP2C19酶的活性具有增强作用,使得有这个基因型的患者代谢药物的速度较快。
因此,通过CYP2C19基因型检测,可以确定患者对一些药物代谢的速度,从而更好地个体化用药。
其次,CYP2C19的多态性与一些药物的药物动力学和药物疗效之间存在着密切的关联。
一些药物,如氯氮平和克唑吡啶,通过CYP2C19酶的代谢来产生活性代谢产物。
在代谢较慢的CYP2C19变异体患者中,这些药物的代谢会减慢,导致药物在体内的浓度增加,从而增加药物的不良反应的风险。
而在代谢较快的CYP2C19变异体患者中,这些药物的代谢会加速,导致药物的疗效降低。
因此,对于这些药物的使用,如果事先进行CYP2C19基因型检测,可以根据患者的基因型选择合适的药物剂量,更好地预测患者的药物疗效和不良反应的风险。
此外,CYP2C19的多态性与抗血小板药物如氯吡格雷的疗效也有关联。
氯吡格雷是一种常用的抗血小板药物,用于防治心血管疾病。
然而,由于CYP2C19酶对氯吡格雷的代谢具有重要的作用,CYP2C19变异体患者中氯吡格雷的疗效会明显降低。
多项临床研究表明,具有CYP2C19*2基因型的患者与敏感基因型相比,其持续使用氯吡格雷后心血管事件的风险显著增加。
再添加CYP2C19*17基因型后,氯吡格雷的疗效则会增加,与正常代谢者相比有更好的抗血小板效应。
因此,通过CYP2C19基因型检测,可以更好地指导氯吡格雷的个体化用药。
CYP2C19药物代谢酶基因多态性检测试剂注册技术审查指导原则

CYP2C19药物代谢酶基因多态性检测试剂注册技术审查指导原则CYP2C19药物代谢酶基因多态性检测试剂是一种用于检测CYP2C19基因的多态性的试剂。
CYP2C19基因是人体内编码CYP2C19酶的基因,CYP2C19酶参与了大约10%的临床药物的代谢,因此CYP2C19基因的多态性与药物的代谢差异相关。
目前,CYP2C19基因多态性检测试剂已经投入了临床应用。
对于CYP2C19药物代谢酶基因多态性检测试剂的注册技术审查,以下是一些指导原则:1.产品安全性评价:注册技术审查应对产品的安全性进行评估,确保试剂没有明显的毒副作用,并对其可能引发的不良反应进行评估。
此外,审查时还应考虑对试剂进行质量控制的要求。
2.技术验证:技术验证是注册审查的关键环节,应要求申请者提供有关试剂的技术特性、敏感性和特异性的数据。
此外,还应要求申请者提供试剂性能验证的数据,确保试剂的可靠性和准确性。
3.临床试验设计和结果分析:临床试验的设计和结果分析也是审查的重点。
注册技术审查应确认试剂是否已经进行了充分的临床试验,并根据试验结果评估试剂的准确性和预测性能。
4.试剂标定和参考范围:试剂标定和参考范围的确定也是注册技术审查的重点。
应要求申请者提供标定方法和结果,确保试剂标定的准确性,并根据标定结果确定参考范围。
5.试剂使用说明:注册技术审查还应对试剂的使用说明进行评估,确保使用说明能够引导用户正确操作试剂,并对可能产生的不良反应和错误操作风险进行警示。
6.质量管理体系:最后,注册技术审查还应对申请者的质量管理体系进行评估,确保申请者具备实施质量管理的能力和措施,以确保试剂的质量。
总之,CYP2C19药物代谢酶基因多态性检测试剂注册技术审查应对产品的安全性、技术验证、临床试验设计和结果分析、试剂标定和参考范围、试剂使用说明以及质量管理体系进行综合评估,确保试剂的安全和准确性。
这些指导原则对于试剂的注册技术审查提供了明确的方向。
CYP2C19基因多态性(SNP)检测

2005年12月,病人感到胸痛,但冠脉造影未发现血管狭 窄;
2007年11月,病人出现了持续性的胸痛和非ST段抬高的 心梗。冠脉造影发现在弯曲的支架处出现血栓,只好更换 新的药物缓释支架(2.75mmX18mm);
3、为什么要检测CYP2C19基因多态性?
多中心,随机对照,双盲试验,研究增加剂量(up to 300mg)对CYP2C19突 变患者血小板聚集抑制的改善情况。
*1/*1
*1/*2
*2/*2
结论:CYP2C19 *1/*2型患者,维持剂量增加至225mg,其对血小板活性的抑 制程度方可达到*1/*1型患者的水平。而对于*2/*2型患者,即使维持剂量增加 至300mg,仍然难以达到相当的血小板抑制水平。
2009年7月,病人在打曲棍球时,又发生胸痛,并在弯曲 的支架处再次发生血栓,入院进行球囊扩张,重新安放支 架 (2.25mmX12mm);
2009年8月对病人进行了CYP2C19基因型检测,结果为 *2/*2型,这提示他是个氯吡格雷的慢代谢患者。因此停 用氯吡格雷,改用普拉格雷;
2011年6月接受心脏造影,一切正常。
• 换用新药替格瑞洛(已在国内上市); • 联用西洛他唑(cilostazol),两联改为
三联抗血小板治疗; • PCI效果不佳者,可考虑改做搭桥手术。
病例一:慢代谢患者使用5个支架后换用普拉格雷
2005年2月,医生为他进行经皮冠脉介入手术,植入一个 药物缓释支架 (2.75mmX16mm),并开始服用氯吡格雷;
伏立康唑 Nelfinavir 那非那韦 Proguanil
氯胍
Thank you!
CYP2C19 基因检测

2006 2007 2008 2009 2010
May, 2008
Trenk et al find CYP2C19 polymorphism is associated with adverse outcomes for patients on clopidogrel followed for one year
4
精品文档
药物安全与个体化医疗
因药物不良反 应住院的病人
250万/每年
直接 死亡 20万
25-30%的药 物代谢基因 为慢代谢型
5
精品文档
药物代谢可能特别慢,造成 代谢产物堆积或有效活性浓
度不足等不良反应
合理用药影响因素
性别
年龄 老年、儿 童、新生
儿
身高、体重 合并症
遗传结构与基 因型
环境因素 食物/ 吸烟 /
4. Eur Heart J, 2003, 24:193 5. Circulation, 2004, 109:3171
Emerging information established a role for CYP2C19 in clopidogrel response
October, 2006
Hulot et al identify CYP2C19 polymorphisms as major determinant of variability in platelet aggregation in healthy subjects; additional publications later confirm this finding
剂量 300/75 300/75 600/75 75 300/75
发生率 28% 31-35% 5-11% 31% 25% 5-35%
11 CYP2C19基因检测标准操作流程

药物代谢酶多态性检测标准操作规程一、检验目的为保证本实验室检测药物代谢酶基因型时DNA提取、PCR扩增及扩增产物杂交、显色、芯片扫描实验操作的标准化,确保检测结果的准确性、重复性,制定本规程。
二、适用范围适用于血液样本基因组DNA的提取、PCR扩增、杂交显色及报告。
三、方法原理采用基因芯片技术,测序原理是杂交测序方法,即通过与一组已知序列的核酸探针杂交进行核酸序列测定的方法,在一块基片表面固定了序列已知的靶核苷酸的探针。
当溶液中带有荧光标记的核酸序列TATGCAATCTAG,与基因芯片上对应位置的核酸探针产生互补匹配时,通过确定荧光强度最强的探针位置,获得一组序列完全互补的探针序列,据此可重组出靶核酸的序列。
CYP2C19基因在体内主要表达细胞色素P450(Cytochrome P450,CYP)同功酶也称药酶,是由一系列结构和功能相关的酶组成的超家族,是体内药物代谢的主要酶系。
其中,CYP2C19基因由于遗传多态性,不同个体间表达的药酶活性存在显著不同。
通过该酶代谢的药物(如质子泵抑制剂,抗惊厥药等)随患者基因型不同,其疗效和副作用也有明显不同。
本项目检测患者基因组DNA中CYP2C19基因型,通过对患者基因分型检测,判定患者的药物代谢速率类型,从而帮助医生正确选择药物并合理调整药物剂量,提高药物使用有效性,并降低毒副作用。
四、性能指标1. 最低检出限:20ng基因组DNA。
2. 准确度:以6种CYP2C19基因型的DNA样品分别检测试剂盒,结果符合相应型别;以10份企业标化的阴性质控品进行平行两次检测,结果一致且均为阴性;以浓度为8ng/ul 的CYP2C19基因型基因组DNA样品分别检测试剂盒,结果符合相应型别。
2. 精密度:以6种CYP2C19基因型的DNA样品分别对同一批试剂盒平行检测20次,每天4次,分为5天,检测结果一致。
五、标本收集1. 标本类型:静脉血的全血标本作为检测标本(抗凝剂为EDTA,抗凝剂的质量应符合化试药品要求——化学纯或分析纯,使用的比例以厂家推荐为准)。
氯吡格雷代谢基因(CYP2C19-2-3-17)多态性检测结果说明
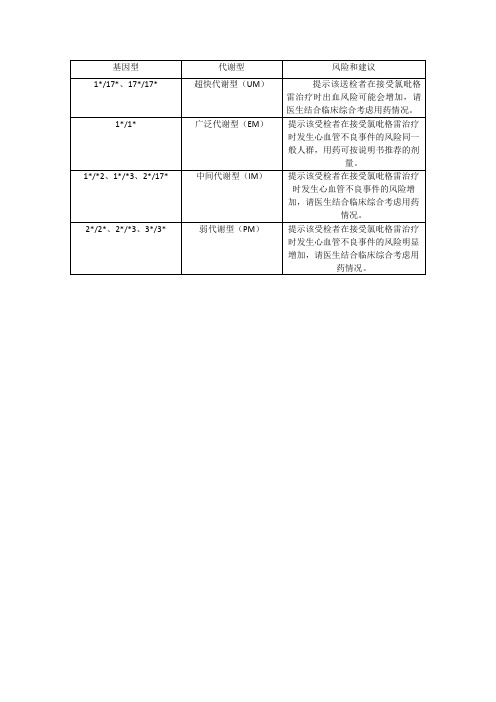
提示该受检者在接受氯吡格雷治疗时发生心血管不良事件的风险增加,请医生结合临床综合考虑用药情况。
2*/2*、2*/*3、3*/3*
弱代谢型(PM)
提示该受检者在接受氯吡格雷治疗时发生心血管不良事件的风险明显增加,请医生结合临床综合考虑用药情况。
基因型
代谢型
风险和建议
1*/17*、17*/17*
超快代谢型(UM)
提示该送检者在接受氯吡格雷治疗时出血风险可能会增加,请医生结合临床综合考虑用药情况。
1*/1*
广泛代谢型(EM)
提示该受检者在接受氯吡格雷治疗时发生心血管不良事件的风险同一2*/17*
CYP2C9和VKORC1基因多态性检测
CYP2C9和VKORC1基因多态性检测项目简介:CYP2C19基因是CYP450酶第二亚家族中的重要成员,是人体重要的药物代谢酶;CYP2C9能羟化代谢许多不同性质的药物,主要是酸性底物,据统计,目前约有16%的的临床药物由CYP2C9负责代谢。
VKORC1是维生素K依赖性凝血因子生成的限速酶。
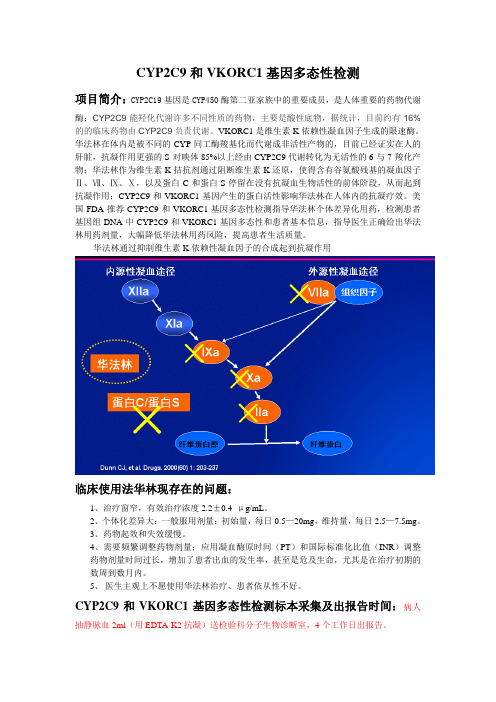
华法林在体内是被不同的CYP同工酶羧基化而代谢成非活性产物的,目前已经证实在人的肝脏,抗凝作用更强的S-对映体85%以上经由CYP2C9代谢转化为无活性的6-与7-羧化产物;华法林作为维生素K拮抗剂通过阻断维生素K还原,使得含有谷氨酸残基的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ,以及蛋白C和蛋白S停留在没有抗凝血生物活性的前体阶段,从而起到抗凝作用;CYP2C9和VKORC1基因产生的蛋白活性影响华法林在人体内的抗凝疗效。
美国FDA推荐CYP2C9和VKORC1基因多态性检测指导华法林个体差异化用药,检测患者基因组DNA中CYP2C9和VKORC1基因多态性和患者基本信息,指导医生正确给出华法林用药剂量,大幅降低华法林用药风险,提高患者生活质量。
华法林通过抑制维生素K依赖性凝血因子的合成起到抗凝作用临床使用法华林现存在的问题:1、治疗窗窄,有效治疗浓度2.2±0.4 μg/mL。
2、个体化差异大:一般服用剂量:初始量,每日0.5—20mg,维持量,每日2.5—7.5mg。
3、药物起效和失效缓慢。
4、需要频繁调整药物剂量:应用凝血酶原时间(PT)和国际标准化比值(INR)调整药物剂量时间过长,增加了患者出血的发生率,甚至是危及生命,尤其是在治疗初期的数周到数月内。
5、医生主观上不愿使用华法林治疗、患者依从性不好。
CYP2C9和VKORC1基因多态性检测标本采集及出报告时间:病人抽静脉血2ml(用EDTA-K2抗凝)送检验科分子生物诊断室,4个工作日出报告。
电话:8801063 手机:余宗涛65327 高波 64444华法林剂量计算:国际华法林药物基因组学联合会(the International Warfarin Pharmaeogenetics Consortium)通过大量数据,根据CYP2C9和VKORC1的检测结果和临床信息,制定个体华的华法林剂量方案,如下:基于基因型和临床信息的华法林剂量计算公式:未来临床用药剂量模式:临床意义:华法林的抗凝疗效一特点是其稳定剂量在不同种族间及个体间存在着较大差异。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CYP2C19基因多态性检测
项目简介:CYP2C19是CYP450酶第二亚家族中的重要成员,是人体重要的药物代谢
酶,在肝脏中有很多表达。
CYP2C19基因座位于染色体区10q24.2上,由9个外显子构成。
CYP2C19具有很多SNP位点,最常见的是CYP2C19*2和CYP2C19*3。
CYP2C19*2会导致转录蛋白的剪切突变失活,而CYP2C19*3能构成一个终止子,破坏转录蛋白的活性。
据统计,CYP2C19*2和CYP2C19*3两个突变位点能解释几乎100%的东亚人和85%的高加索人种的相关弱代谢遗传缺陷,而其他两种等位基因CYP2C19*4和CYP2C19*5主要在高加索人种中分布。
大量证据证实,不同人种在CYP2C19的底物的代谢能力有很大差异;2–5%高加索人是弱代谢者,而13–23%的亚洲人是弱代谢者。
这是由于在亚洲人口中CYP2C19*2和CYP2C19*3等位基因的高频率造成的。
通过CYP2C19基因检测,判断患者对相关药物的代谢能力,可以指导临床用方案的制定,实现个体化用药治疗。
临床上常用的经由CYP2C19酶代谢的药物:
1、治疗胃酸相关性疾病:如质子泵抑制剂:奥美拉唑(omeprazole)、兰索拉唑(lansoprazole)、泮托拉唑(pantoprazole)、 雷贝拉唑(rabeprazole)、埃索美拉唑 (Esomeprazole)。
2、治疗心血管疾病:Clopidogrel、氯吡格雷、抗凝血药物。
3、抗真菌药物:Voriconazole、伏立康唑、广谱抗真菌药物。
4、神经类药物:①S-美芬妥英mephenytoin为乙内酰脲类抗癫痫药,在体内的羟化代谢主要由单基因CYP2C19编码表达的CYP2C19酶蛋白介导,由羟化酶CYP2C19氧化生成4’-羟基美芬妥英;②地西泮diazepam,一种长效的镇静、安眠药;③丙米嗪imipramine ,抗抑郁药,N-去甲基化和2-羟化;④苯巴比妥phenobarbital,传统的抗癫痫药;⑤抗心律失常药,抗抑郁药,抗精神病药,β受体阻断剂,抗高血压药和止痛剂。
5、抗肿瘤药:环磷酰胺。
6、抗结核药:利福平。
7、孕激素:黄体酮。
8、抗疟疾药:氯胍。
9、HIV蛋白酶抑制剂。
10、抗移植排斥药物:他克莫司、兰索拉唑。
CYP2C19基因多态性检测标本采集及出报告时间:病人抽静脉血2ml(用
EDTA-K2抗凝)送检验科分子生物诊断室,4个工作日出报告。
电话:8801063 手机:余宗涛65327 高波 64444
CYP2C19基因多态性检测临床意义:
1、基因剂量效应。
2、CYP2C19基因多态性,导致了个体间酶活性的多样性。
等位基因的突变使酶活性降低,对药物代谢的能力随着等位基因的不同组合而呈现出一定的规律性,表现出正常基因纯合子>正常基因与突变基因杂合子> 突变基因纯合子或杂合子的变化趋势。
3、对于不同代谢能力的个体,运用不同的药物剂量等策略是非常必要的,可达到更好的治疗效果。
4、根据CYP2C19基因型给予个性化的药物和剂量可以降低副作用发生率-安全性;提高治
疗效果-有效性;节省治疗费用-经济性。
