弱电解质的解离度和解离常数ppt课件
弱电解质的解离度和解离常数课件

02
解离常数是表示弱电解质电离 程度的常数,通常用K表示, 它的大小反映了弱电解质电离 程度的大小。
03
解离度的计算公式为:解离度 = (已解离的弱电解质的浓度 / 弱电解质的总浓度) × 100%
CATALOGUE
解离常数与电离平衡常数的关系
电离平衡常数的定义
在
解离常数与电离平衡常数的关系
1 2 3
要选择合适的波长,避免干扰物质的影响,同时要保证实验温度 的一致性。
高效液相色谱法测定解离度
原理
01
实验步骤
02
注意事项
03
CATALOGUE
解离常数的应用实例
在药物研发中的应用
预测药物在生物体内的解离和药效 优化药物的配方和剂型 指导新药的研发
在化学工程中的应用
优化化学反应条件
选择合适的催化剂
VS
它反映了弱电解质在水溶液中的电离 程度,是衡量弱电解质电离程度的重 要指标。
解离度的物理意 义
解度反映了弱电解质在水溶液中解离成离子的能力,即弱电解质的电离程度。
解离度的大小与溶液的浓度、温度、溶剂的性质等因素有关。
解离度的计算方法
01
解离度的计算方法通常是通过 实验测定的,一般通过测定溶 液中弱电解质的浓度和已知的 解离常数来计算。
设计离子交换和分离过程
在环境科学中的应用
评估水体的酸碱性和化学平衡
预测土壤中化学物质的迁移和转 化
THANKS
感谢观看
解离常数的应用
CATALOGUE
影响弱电解质解离度的因素
温度的影响
要点一
温度升高,解离度增大
弱电解质在溶液中存在电离平衡,升温促进电离,解离度 增大。
弱电解质的电离平衡电离平衡常数 原创 优秀课件

BD
8.氢氧化铝的电离方程式可以表示为 — + 3+ — AlO2 + H + H2O Al(OH)3 Al +3OH , 试根据平衡移动的原理解释下列问题: (1)向氢氧化铝沉淀中加入盐酸,沉淀溶解, 原因 ____,有关的离子方程式 ___________。 (2)向氢氧化铝沉淀中加入苛性钠溶液,沉淀 溶解,原因_________,有关的离子方程式 __________________________________。
A.醋酸与锌反应放出的H2多 B.盐酸与锌反应放出的H2多 C.醋酸与锌反应速率大 D.盐酸和醋酸分别与锌反应的速率一样大
3、有H+浓度相同、体积相等的三种酸:a、 盐酸 b、硫酸 c、醋酸, 同时加入足量的锌, 速率由C(H+)决定 则开始反应时速率 a=b=c ,
反应过程中的平均速率 a=b<c
Ka=
c ( H+) .c( A-) c(HA)
对于一元弱碱 MOH
Kb=
M++OH-,平衡时
c ( M+).c( OH- )
c(MOH)
2、意义:K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。K值只随温度变化。
探究活动
酸性:醋酸>碳酸>硼酸
电离常数:醋酸>碳酸>硼酸
3、对于多元酸:
反应完全后生成H2的质量 a=b<c (用<、=、> 表示) 由n(H+)决定
,
。
4、将10ml 0.1mol/L的HAc加水稀释,有关 稀释后的醋酸溶液的说法,错误的是: D C
A、电离程度增大
B、溶液中离子总数增多 C、溶液导电性增加 D、溶液中醋酸分子增多
醋酸解离度和解离常数的测定(讲义)2011(1)
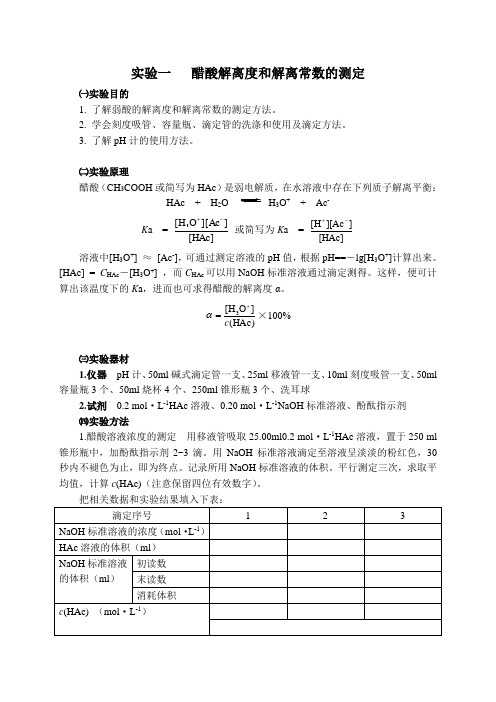
实验一 醋酸解离度和解离常数的测定㈠实验目的1. 了解弱酸的解离度和解离常数的测定方法。
2. 学会刻度吸管、容量瓶、滴定管的洗涤和使用及滴定方法。
3. 了解pH 计的使用方法。
㈡实验原理醋酸(CH 3COOH 或简写为HAc )是弱电解质,在水溶液中存在下列质子解离平衡:HAc + H 2O H 3O + + Ac - K a =[HAc]]][Ac O H [3-+ 或简写为K a = [HAc]]][Ac H [-+溶液中[H 3O +] ≈ [Ac -],可通过测定溶液的pH 值,根据pH==-lg[H 3O +]计算出来。
[HAc] = C HAc -[H 3O +] ,而C HAc 可以用NaOH 标准溶液通过滴定测得。
这样,便可计算出该温度下的K a ,进而也可求得醋酸的解离度α。
)HAc (]O H [3c +=α×100%㈢实验器材1.仪器 pH 计、50ml 碱式滴定管一支、25ml 移液管一支、10ml 刻度吸管一支、50ml 容量瓶3个、50ml 烧杯4个、250ml 锥形瓶3个、洗耳球2.试剂 0.2 mol ·L -1HAc 溶液、0.20 mol ·L -1NaOH 标准溶液、酚酞指示剂 ㈣实验方法1.醋酸溶液浓度的测定 用移液管吸取25.00ml0.2 mol ·L -1HAc 溶液,置于250 ml 锥形瓶中,加酚酞指示剂2~3滴。
用NaOH 标准溶液滴定至溶液呈淡淡的粉红色,30秒内不褪色为止,即为终点。
记录所用NaOH 标准溶液的体积。
平行测定三次,求取平均值,计算c (HAc)(注意保留四位有效数字)。
2.配制不同浓度的醋酸溶液 用刻度吸管或移液管分别量取2.50 ml 、5.00 ml 、25.00 ml 已知准确浓度的HAc 溶液于3个50 ml 容量瓶中,加蒸馏水至满刻度,摇匀,备用。
3.测定醋酸溶液的pH 值 将上述四种不同浓度的醋酸溶液分别加入四个干燥的50 ml 烧杯中,按由稀到浓的顺序用pH 计分别测定它们的pH 值。
弱电解质的解离反应

15
c(H+)与c(S2-)的关系
H2S
H+ + HS-
[c(H+)/c ][c(HS-)/c
Ka(1)=
[c(H2S)/c ]
]
HS-
H+ + S2-
Ka(2)=
[c(H+)/c ][c(S2-)/c [c(HS-)/c ]
]
两式相加 HS- 2H+ + S2- Ka= Ka(1)·Ka(2) [c(H+)]2[c(S2-)] c(H2S)(c )2 =Ka(1)·Ka(2)
Ki 与α都能说明弱电解质的解离程度;
但20α21与/4/21 c有关,Ki 与c无关。
6
3-2-3 弱酸或弱碱溶液中离子浓度计算
一元弱电解质溶液中离子浓度的计算
若Ki »Kw , c(mol·L-1)不很小,可忽略水的解离。
一3元-2弱-3酸弱溶酸液或中弱c(H碱+)溶的液计中算离子浓度
一元弱酸
1c(H2+0)21=/4c/21(KOwH-)=
1.0×10-14 1.34×10-3
mol·L-1=7.5×10-12
mol·L-
9
例 计算0.100mol·L-1氨水溶液中的
c(OH-)、pH和氨水的解离度。
解:
NH3·H2O NH4++OH-
平衡浓度/(mol·L-1) 0.100-x x x
一元弱碱溶液中c(H+)的计算
一元弱碱
BOH B+ + OH-
同理
c(OH-)≈ (c·c )Kb
pOH=
-lg
c(OH-) c
高考化学(全国通用):弱电解质的电离平衡(PPT讲解版)

优秀同龄人的陪伴 让你的青春少走弯路
弱电解质的电离平衡的知识点特点
一、【简单好懂,抓好细节】 知识点相对简单,好理解 常考细节,需抓好关键点 二、【弄清原理,举一反三】 积累电离平衡移动的情形 题型较固定,变化不大 弄清原理是关键,举一反三
使用说明-内容说明
PART 1
构建弱电解质的电离平衡知识网络图
4、意义:衡量弱电解质的电离程度 (1)电离常数越大,弱电解质的电离程度越大 (2)相同温度和浓度的弱酸(碱),电离常数越大,酸(碱)性越强。
如:在25℃时,HNO2的K=4.6×10 -4,CH 3COOH的K=1.8×10 -5,HNO 2的酸性比CH 3COOH的强
电离度
1、概念:一定条件下,当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来弱电解质 总分子数的百分比。
Ka
=
c(H c(
) c(N HN)
)
ROH(弱碱) R OH
Kb
c(R )gt;>Ka2>>K
a3
H2CO3 H HCO3
注意:
HCO3
H CO32
K a1
c(H ) c(HCO3 ) c(H 2CO3)
Ka2
c(H ) c(CO32 ) c(HCO3 )
答案解析1
1.关于强、弱电解质叙述正确的是(ꢀꢀ) A.强电解质都是离子化合物,弱电解质都是共价化合物 B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
解析: A.氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,故A错误; B.硫酸钡为强电解质,难溶于水,醋酸为弱电解质,易溶于水,故B错误; C.强电解质在水中完全电离,不存在溶质分子,弱电解质在水中部分电离,存在溶质分子,故C正确; D.水溶液中导电能力与自由移动的电荷浓度有关,与强弱电解质无关,故D错误。 故选C.
高三化学一轮复习《电离平衡常数、水解常数、溶度积常数的应用》PPTpptx

2. 水解平衡常数 特点:
• 水解平衡常数与温度有关,升高温度,Kh增大。 • 水解平衡常数反映盐水解的相对强弱,Kh越大,表示
盐越易水解。
3.电离平衡常数与水解常数的关系:
以CH3COONa为例
3.电离平衡常数与水解常数的关系:
(1)K a·K h=K w 或 K b·K h=K w (2)Na2CO3的水解常数 (3)NaHCO3的水解常数
(1)判断沉淀的先后
以CH3COONa为例
已知K (AgCl)=1.56×10 ,K (AgBr)=7.7×10 , 010 mol·L-1,向该溶液中逐滴加入0.
水C.解B平r-衡、常C数l-反、映C盐rO水4解2-的相对D.强B弱r-,s、pKhC越rO大42,-、表C示l-
-10 sp
-13
1. 电离平衡常数 特点:
• 电离平衡常数与温度有关,升高温度,K值增大。 • 电离平衡常数反映弱电解质的相对强弱,K越大,表示弱电解
质越易电离,酸性或碱性越强。 • 多元弱酸的各级电离平衡常数的大小关系是K1 K2 K3……
2. 水解常数 以CH3COONa溶液为例,存在如下水解平衡: CH3COO-+H2O CH3COOH+OH-
2×10-8,Ka3=4.
磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。
内容要求
认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的 含义。
认识盐类水解的原理和影响盐类水解的主要因素。 认识难溶电解质在水溶液中存在沉淀溶解平衡。
学业要求
以CH3COONa为例
(填“>”“<”或“=”)7。 -1
m o l ·L - 1 的
酸碱反应沉淀反应之弱电解质解离反应介绍课件

氧化还原反应: 氧化剂与还原剂 发生电子转移, 生成新的氧化剂 和还原剂
离子交换反应: 离子交换树脂与 溶液中的离子进 行交换,达到分 离和纯化的目的
吸附反应:吸附 剂与溶液中的物 质发生吸附,达 到分离和纯化的 目的
弱电解质解离反应的应用
酸碱中和反应:弱电解质解离反应
A
在酸碱中和反应中起到重要作用,
课件重点和难点
酸碱反应:酸碱中和反 应、酸碱指示剂变色原 理
弱电解质解离反应:弱电 解质的解离平衡、解离常 数的计算
沉淀反应:沉淀溶解平 衡、沉淀生成和溶解的 条件
难点:酸碱中和反应的定 量计算、沉淀溶解平衡的 判断和计算、弱电解质解 离反应的平衡移动和计算
课件教学建议
01
强调酸碱反应和沉淀反应的基本原理和规律
如盐酸和氢氧化钠的反应。
沉淀反应:弱电解质解离反应在沉
B
淀反应中起到重要作用,如氯化银
和硫化钠的反应。
络合反应:弱电解质解离反应在络
C
合反应中起到重要作用,如EDTA
和金属离子的反应。
氧化还原反应:弱电解质解离反应
D
在氧化还原反应中起到重要作用,
如亚硫酸钠和次氯酸钠的反应。
酸碱反应、沉淀反应和弱电解质解离反应的联系
01
弱电解质在水中部分 解离,形成离子
02
解离平衡常数:衡量弱 电解质解离程度的常数
03
解离平衡常数与温度、 浓度有关
04
解离平衡常数与弱电 解质的解离度有关
弱电解质解离反应类型
酸碱反应:酸与 碱发生中和反应, 生成盐和水
沉淀反应:金属 离子与酸根离子 结合,生成不溶 于水的沉淀
络合反应:金属 离子与配位体结 合,形成稳定的 络合物
电解质溶液PPT课件

2、盐效应
在弱电解质溶液中,加入与弱电解质不具有共 同离子的强电解质而使弱电解质的电离度略有增大
的现象称为盐效应。
例如,在1L0.1mol/L HAc溶液中加0.1molNaCl,
会使HAc的解离度由原来的0.013上升至0.017。
原因:加入不具有共同离子的强电解质时,溶
液中离子的浓度显著增大,离子间相互牵制作用增 强,减少了离子结合成分子的机会,从而导致弱电
.
10
❖ 例如:25℃时,0.1mol/LHAc α =1.33% ❖ 表示:一万个醋酸分子中有133个发生了
电离。 2.影响因素:内因:弱电解质的本性;
外因:溶液的温度,溶液浓度 通常说某种电解质溶液的电离度都是指一 定温度和一定浓度时的电离度。
.
11
❖ 3.意义:反映电解质的相对强弱。
根据 25℃,0.1mol·L-1 α 电解质溶液的α判断强弱:
第二章 电解质溶液
第一节 弱电解质溶液的解 离平衡
第二节 酸碱质子理论
第三节 酸碱溶液pH的计算
.
1ห้องสมุดไป่ตู้
本章学习要求
❖ 充分理解弱电解质的解离平衡移动原理 ❖ 掌握质子理论、共轭酸、共轭碱 的概念 ❖ 熟悉弱酸 弱碱 酸常数Ka 碱常数Kb 的概念 ❖ 熟练掌握酸碱 pH 值计算
.
2
第一节 弱电解质溶液的解离平衡
>30% 强电解质 5~30% 中强电解质 <5% 弱电解质
.
12
电离常数K和电离度α影响因素: 相同:都受电解质本身性质和温度的影响; 不同:α受电解质浓度的影响。
提到浓度对电离度α的影响,就不能不知道什
么是同离子效应和盐效应。下面我们就来学习
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5
将上式改写成
Λc
Λ Λ Λ 1 m
1
m
Kc
mc
m
2
以
1
Λ
cΛ m
作图,从截距和斜率求得Λ
m
和
K
c
m
值。
这就是俄籍德国物理化学家Ostwald提出的定 律,称为Ostwald稀释定律。
精选ppt
6
精选ppt
7
精选pptБайду номын сангаас
8
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
从上节课23页所学的两个公式(8.21)和(8.22) 联立可得333333333
所以得444444
精选ppt
4
设弱电解质AB解离如下:
AB A+ B 起始 c 0 0
平衡时 c(1) c c
Λ
=Λ
m
m
c 2
Kc
c 1
Kc
c c
Λ Λmm
2
Λ
Λ 1
m
Λ m
c Λ2
cm
Λ Λ Λm
m
m 精选ppt
计算弱电解质的解离度和解离常数
精选ppt
1
什么是解离度?用什么符号来表示?
精选ppt
2
解离度是指电解质达到解离平衡时,已解 离的分子数与原有的分子数之比。习惯上 用a来表示。它的单位为1,习惯上用百分 率来表示。
精选ppt
3
在弱电解质溶液中,只有已解离的部分才能承担传递电 荷量的任务。在无限稀释的溶液中可认为弱电解质已全 部电离,此时溶液的摩尔电导率为 1111111.可用离子 的无限稀释摩尔电导率相加而得。而一定浓度下电解质 的摩尔电导率22222与无限稀释溶液中摩尔电导率11111 是有差别的,有两点原因,一是电解质的不完全解离; 二是离子间存在着相互作用力。所以把22222通常称为 表观摩尔电导率。
