全国高中化学竞赛初赛模拟精彩试题
全国高中化学竞赛(初赛)模拟试题7(word含答案)

高中化学竞赛初赛模拟试卷(07)(时间:3小时满分:100分)第一题(11分)除糖类和蛋白质外,类脂化合物也是维持正常的生命活动不可缺少的物质。
1.由动物或植物中取得的油脂是多种物质的混合物,其主要成分是;2.桐油酸和蓖麻油酸的结构简式分别为CH3(CH2)3(CH=CH)3(CH2)7COOH和CH3(CH2)5CH(OH)CH2CH=CH(CH2)7COOH,请分别命名。
3.油脂在空气中氧、水分和霉菌的作用下酸败的主要产物是、等(类别)。
4.表面活性剂是能降低的物质,阴离子型表面活性剂是其中一类,如CH3(CH2)10CH2OSO3Na、RSO3Na、R--SO3Na,主要用于。
5.蜡和石蜡的物态、物性相近,而化学性质完全不同,蜡的主要组分是高级脂肪酸的高级饱和一元醇酯,而石蜡是。
列举蜡的一种用途。
6.磷脂是一类含磷的脂类化合物,他们在结构上的共同点是分子中同时有与______,使得磷脂类化合物在细胞膜中起着重要的生理作用。
7.萜类化合物广泛存在于动植物界,它们的共同点是分子中的碳原子数都是的整数倍。
(填数字)8.甾体化合物也叫类固醇化合物,广泛存在于动植物界。
它们的共同特点是都含有一个由与氢化菲并联的骨架。
第二题(7分)云母是一种重要的硅酸盐,它具有韧度、弹性、透明度、高介电强度、化学惰性和热稳定性。
白云母可看作叶腊石中1/4的SiⅣ被AlⅢ所取代,再由KⅠ平衡其电荷后形成的。
而叶腊石可以看作SiO2中有1/3的SiⅣ被AlⅢ取代,再由KⅠ平衡其电荷形成的。
1.白云母写成氧化物形式的化学式为。
2.研究表明,在硅酸盐中,AlⅢ很容易取代SiⅣ,取代后不会引起原硅酸盐结构大的变化。
从立体几何的知识看,AlⅢ与SiⅣ最直接的关系是。
3.黑云母的化学式为KMg3AlSi3O10(OH)2,在水与二氧化碳的同时作用下,风化为高岭土[AI2Si2O5(OH)4]。
(1)写出离子反应方程式。
(2)上述反应为什么能够发生?(3)风化后Al为什么不能以Al3+形式被地下水溶解?第三题(7分)等物质的量的醇A 与“HQ ”在一定条件下相互作用形成一种食品抗氧化剂“TBHQ ”。
(精品)全国高中化学竞赛(初赛)模拟试题20套
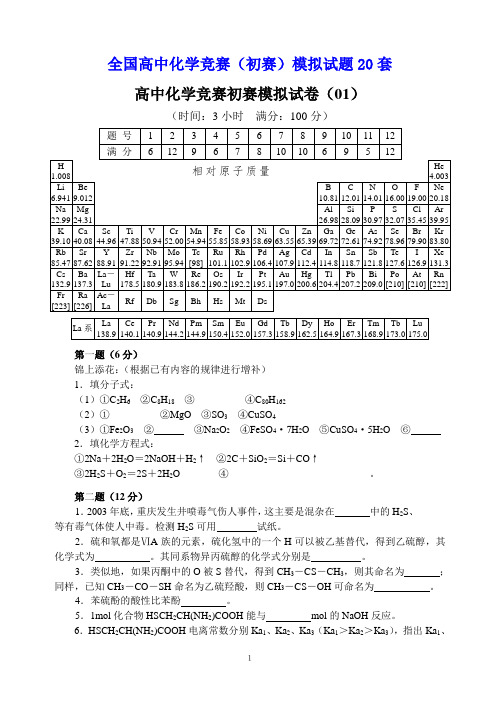
全国高中化学竞赛(初赛)模拟试题20套高中化学竞赛初赛模拟试卷(01)(时间:3小时满分:100分)第一题(6分)锦上添花:(根据已有内容的规律进行增补)1.填分子式:(1)①C2H6②C8H18③________ ④C80H162(2)①________ ②MgO ③SO3④CuSO4(3)①Fe2O3②③Na2O2④FeSO4·7H2O ⑤CuSO4·5H2O ⑥2.填化学方程式:①2Na+2H2O=2NaOH+H2↑②2C+SiO2=Si+CO↑③2H2S+O2=2S+2H2O ④____________________________。
第二题(12分)1.2003年底,重庆发生井喷毒气伤人事件,这主要是混杂在中的H2S、______等有毒气体使人中毒。
检测H2S可用试纸。
2.硫和氧都是ⅥA族的元素,硫化氢中的一个H可以被乙基替代,得到乙硫醇,其化学式为。
其同系物异丙硫醇的化学式分别是。
3.类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为。
4.苯硫酚的酸性比苯酚。
5.1mol化合物HSCH2CH(NH2)COOH能与mol的NaOH反应。
6.HSCH2CH(NH2)COOH电离常数分别Ka1、Ka2、Ka3(Ka1>Ka2>Ka3),指出Ka1、1Ka2、Ka3相对应的基团各是哪个?第三题(9分)完成下列各步反应的化学反应式1.由AgCl制备AgNO3:将gCl溶解在氨水中,电解,所得产物溶于硝酸;2.由Hg2Cl2得到Hg:浓硝酸氧化,加热至干,溶于热水后电解;3.由Pb5(VO4)3Cl得到V:盐酸加热溶解(无气体产生),金属铝还原。
第四题(6分)某溶液含Fe 10.0mg,现将它苹取入某有机溶剂中,其分配比为D=99。
1.当用等体积的该溶剂萃取两次后,水相中剩余的Fe是多少mg?2.若用等体积水将上述合并后的有机相洗一次,将损失多少mg的Fe?3.若将洗后分出的水相以适当的方法显色后,定容至50.00mL,然后用1.0cm的比色皿测其吸光度,设摩尔吸光系数ε为2.0×104L·mol-1·cm-1,计算其吸光度。
2023年全国化学竞赛初赛模拟试卷含答案

2023年全国化学竞赛预赛模拟试卷5(时间:3小时满分:100分)第一题(4分)一核反映为4个相同的原子A聚合成为一个原子B、两个正电子和两个反中微子,其中B 为元素C最常见的同位素,C不是在地球上发现的天然元素。
写出核反映方程式。
第二题(8分)在低温下,对某化合物A进行准确的元素分析,发现其元素质量分数分别为:C 42.1%,Si 24.6%,N 24.6%。
进一步研究发现,A中所有元素的原子最外层电子数都达成稳定结构,分子中有两种化学环境的碳原子。
已知A的摩尔质量为114g/mol。
1.试拟定A的分子式,写出其结构简式。
2.A在光照下,能发生分解反映生成B和气体C。
B中Si 55.8%(质量分数,下同),Si 32.6%。
已知B中不具有氮元素,分子中存在三种化学环境的碳原子,且分子中所有元素的原子最外层电子数都达成稳定结构。
C是一种稳定的单质。
试拟定B的结构简式。
3.2B→D。
试拟定D最为稳定的结构简式。
第三题(10分)SO2是现今空气污染的重要物质,如何消除SO2对空气的污染是化学家有待解决的问题。
182023,化学家GayLussac作了一个有趣的实验:将SO2与MnO2作用,生成了A和B两种盐。
进一步研究发现:A和B两种盐只有三种离子,其中A的阴离子为正四周体结构,B的阴离子是通过顶角相连的二个三角锥,A和B的阴离子的中心原子相同。
若将A和B物质分别溶解在稀酸中,久置后都变成同一种酸。
1.试拟定A和B的分子式。
2.上述反映可以看作发生了两个反映。
第一个反映是MnO2与SO2生成了A;第二个反映是MnO2被SO2还原成C,同时生成D。
C再与SO2反映,生成盐E。
盐E不稳定,分解成盐F和B。
盐E被D氧化成A。
已知C、E结构分别与Fe2O3和Fe2(SO3)3[注:该盐要在非水溶剂中制备]类质同晶。
写出C、E、F的分子式。
3.写出生成C、E和F的化学反映方程式。
第四题(10分)将硫磺在氟气中燃烧,可得到非极性分子A 。
2023年高中化学竞赛初赛模拟试题含答案

高中化学竞赛初赛模拟试卷(09)(时间:3小时满分:100分)第一题(4分)硝酸盐在国计民生各方面有广泛旳用途,例如,含氮量最高旳无机肥是______,用作感光材料旳是_______,在喜庆节日放焰火中发绿色光旳是______,发红色光旳是______。
第二题(4分)将透明容器内旳NO与过量旳O2旳混合气体压缩并使体系旳温度降至-11.2℃时,容器内旳颜色由____色变成____色。
此时容器内旳物种中,具有顺磁性旳是_____________,具有抗磁性旳是_______。
第三题(6分)长期使用劣质香粉,脸上有时出现某些黑色斑点,这是由于在劣质香粉里具有铅白[2PbCO3·Pb(OH)2],它与皮肤中旳硫化物产生了黑色旳硫化铅。
除去这种黑色斑点旳重要措施是选用合适旳氧化剂将其氧化为难溶于水和酸旳白色化合物,供选择旳氧化剂有:①漂白粉、②高锰酸钾、③双氧水。
试回答:1.应选用作氧化剂去掉PbS,理由是。
2.去掉PbS时也许旳化学方程式是。
ﻬ第四题(20分)乙烯是十分重要旳石油化工产品,乙烯旳产量是衡量一种国家石油化工发展水平旳一种指标,其原因是从乙烯出发可以合成为数众多旳有机化工产品。
下面所列旳只是其中旳一小部分,请你在下列空格内填入合适旳试剂、反应条件或产物。
第五题(10分)用0.200mol/L NaOH溶液滴定一份具有H3PO4与NaH2PO4旳混合酸溶液,当加入5.0mLNaOH时测得溶液pH为2.16,而当滴加至15.00mL NaOH时测得溶液pH 为4.68。
试求:1.原混合溶液中,H3PO4与NaH2PO4旳含量各多少mmol?2.为到达第二计量点,所需NaOH总体积多少mL?已知:H3PO4旳Ka1=6.9×10-3Ka2=6.3×10-8,Ka3=4.8×10-13。
第六题(23分)许多有机化合物在碱性条件下有着不一样寻常旳行为,如碳架旳重排和基团旳引入、消去等,如法伏尔斯基重排:;赖默一梯曼反应:等。
全国高中化学竞赛初赛模拟试题

20XX 年第28届全国高中学生化学竞赛(省级赛区)模拟试卷1.008Zr Nb Mo T c RuRh Pd Ag Cd In S n S b Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c Ti V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
全国高中化学竞赛(初赛)试题20套20

高中化学竞赛试题精选及答案班级 姓名1. 在一定条件下将a 体积NO 2和b 体积O 2同时通入倒立于水中且盛满水的容器内充分反应后,容器内残留a 9体积的气体,该气体遇空气即变为红色,则a 与b 的比值为--------------------------------------------------------------------------------------[B]A 、1:6B 、6:1C 、8:3D 、3:8〖提示〗:残留的a 9体积的NO 气体是由剩余的39a NO 2与水反应得到有,故与O 2参加反应的NO 2的体积为a-39a =69a ,消耗O 2的体积为69a 的四分之一。
2. 某学生为测定一瓶失去标签的铁的氧化物样品的成份,称取14.00克该样品用足量的CO 在适宜的条件下使其全部还原,将生成的CO 2用足量的澄清石灰水吸收生成26.25克沉淀,据此可推断出该样品是--------------------------------[A]A 、Fe 2O 3B 、Fe 3O 4C 、不纯的Fe 2O 3D 、FeO〖提示〗:CO 与之反应后均生成CO 2,其中的一个氧原子全部来自铁的氧化物,所以生成的CO 2的物质的量(0.2625摩)也就是铁氧化物中所含的氧原子的量,其中每1摩氧原子所对应的式量=1400026255333...= 3. a 在常温下为离子晶体,由X 、Y 两元素构成,在a 中X m+和Y n-的电子层结构相同。
已知下列反应: (1)a+H 2O 电解−→−−H 2+b+c (2)H 2+c →d (气) (3)b+c →a+e+H 2O 则a 、e 、f 依次是-----------------------------------------------------------------------[B] A 、NaCl NaClO HCl B 、CaCl 2 Ca(ClO)2 HClO C 、Na 2S Na 2SO 3 H 2SO 3 D 、K 2S K 2SO 3 H 2SO 4 4.将amol/L 的碳酸氢钙溶液跟bmol/L 的烧碱溶液等体积混合后的溶液中含有四种生成物,则下列a 与b 的关系正确的是----------------------------------------------[B] A 、a:b ≥1:2 B 、1:2<a:b<1:1 C 、2a=b D 、a=2b 5.①将0.1升1.0mol/L 的纯碱溶液逐滴加入到0.1升1.25mol/L 的盐酸中②将0.1升1.25mol/L 的盐酸逐滴加入到0.1升1.0mol/L 的纯碱溶液中,两种操作产生二氧化碳的体积比为------------------------------------------------------------------------[A] A 、5:2 B 、2:5 C 、2:1 D 、1:1 6.二种短周期元素组成的化合物中,原子个数比为1:3,若二种元素的原子序数分别为a 和b ,则a 、b 的关系可能是------------------------------------------[D] ①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8 A 、①②③ B 、①②④ C 、②③④ D 、①②③④ 7. 某离子晶体的空间构型如图所示,则该晶体中X 、Y 的离子个数比为[BD]A、XY4B、XY2C、YXD、YX28.向含有a摩AlCl3溶液中加入含有b摩KOH溶液,生成沉淀的物质的量可能是-------------------------------------------------------------------------------------------------[A]①a摩②b摩③a/3摩④b/3摩⑤0摩⑥(4a-b)摩A、①③④⑤⑥B、①②③④⑤C、①④⑤⑥D、①④⑤9.用H2还原某+n价的金属氧化物,如有1克H2恰好还原a克氧化物时,则该金属的相对原子质量(原子量)为-----------------------------------------------------[B]A、(8-a)nB、(a-8)nC、an+8nD、an+16n10.25℃时,在0.1mol/LNaX溶液中,水的电离度为α1;在0.1mol/L盐酸中,水的电离度为α2,若αα12=109,则NaX溶液的PH值为----------------------[C]A、5B、7C、10D、1111.已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面的中心。
全国高中化学竞赛(初赛)模拟试题6(word含答案)

高中化学竞赛初赛模拟试卷(06)(时间:3小时满分:100分)题号 1 2 3 4 5 67 8 9 10满分 6 5 11 8119 11 8 1615H 1。
008 相对原子质量He4。
003Li6。
941Be9.012B10。
81C12.01N14.01O16.0F19.0Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32。
07Cl35.45Ar39.95K39。
10 Ca40.08Sc44.96Ti47。
88V50。
94Cr52。
00Mn54.94Fe55.85Co58.93Ni58。
69Cu63。
55Zn65.39Ga69。
72Ge72。
61As74。
92Se78.96Br79.90Kr83。
80Rb85.47Sr87.62Y88.91Zr91。
22Nb92。
91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107。
9Cd112.4In114.8Sn118.7Sb121。
8Te127.6I126。
9Xe131。
3Cs 132.9Ba137.3La-LuHf178.5Ta180。
9W183.8Re186.2Os190。
2Ir192。
2Pt195。
1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac—LaRf Db SgBhHs Mt DsLa系La138。
9Ce140。
1Pr140.9Nd144.2Pm144.9Sm150.4Eu152。
0Gd157。
3Tb158.9Dy162.5Ho164.9Er167。
3Tm168。
9Tb173.0Lu175。
0 第一题(6分)1.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示为:CH2=C=O+HA→CH3—A。
乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是A与HCl加成生成CH3COClB与H2O加成生成CH3COOHC 与CH3OH加成生成CH3COCH2OHD 与CH3COOH加成生成CH3—-O--CH32。
全国高中学生化学竞赛(初赛)试题与答案

全国高中学生化学竞赛(初赛)试题与答案全国高中学生化学竞赛(初赛)试题与答案1.1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。
按已知的原子结构规律,118号元素应是第周期第族元素,它的单质在常温常压下最可能呈现的状态是(气、液、固选一填入)态。
近日传闻俄国合成了第166号元素,若已知原子结构规律不变,该元素应是第周期第族元素。
(5分)答案】七;零;气;八;VIA(5分,每个填空得1分)2.今年是XXX(Le Chatelier1850-1936)诞生150周年。
请用勒沙特列原理解释如下生活中的常见现象:打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
(6分)答案】1)啤酒瓶中二氧化碳气体与啤酒中溶解的二氧化碳达到平衡:CO2(气)CO2(溶液),打开啤酒瓶,二氧化碳气体的压力下降。
根据勒沙特列原理,平衡向放出二氧化碳气体的方向移动,以减弱气体压力下降对平衡的影响。
2)温度是保持平衡的条件,玻璃杯的温度比冰镇啤酒的温度高,根据勒沙特列原理,平衡应向减弱温度升高的方向移动,即应向吸热方向移动,从溶液中放出二氧化碳气体是吸热的,因而,应从溶液中放出二氧化碳气体。
注:压力和温度各3分,不与勒沙特列原理挂钩不给分。
3.1999年合成了一种新化合物,本题用X为代号。
用现代物理方法测得X的相对分子质量为64;X含碳93.8%,含氢6.2%;X分子中有3种化学情况分歧的氢原子和4种化学情况分歧的碳原子;X份子中同时存在C—C、C=C和C≡C三种键,并发觉其C=C键比寻常的C=C短。
1.X的分子式是____(2分)2.请画出X的可能布局。
(4分)答案】1.C5H42.如右右上图注:只有一种可能布局;重键位置必须正确,而键角和平面结构则不必要求。
右上图是用Chemsketch程序制作的立体结构图,图形未画出重键,仅供参考,不是答案。
4.空想的宏观单一晶体呈规则的多面体外形。
多面体的面叫晶面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2008年全国高中化学竞赛模拟试题十四1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt第一题、联胺和草酸是许多贵金属的提纯常用的还原剂。
以下是工业中的两个例子 1-1联胺可以从含AgCl 的浆料中还原沉积银,写出反应的方程式1-2 用NaClO 3-H 2SO 4-NaCl 溶浸金矿得到的浸出液中含一阴离子,含金元素百分比为58.1%,草酸可以从该浸出液中提取金。
写出该反应的方程式 第二题、试解释下列现象:2-1硅没有类似于石墨的同素异性体。
2-2 氮没有五卤化氮,却有+5氧化态的N 2O 5,HNO 3及其盐,这两者是否有矛盾? 2-3酸性大小:HIO 4﹥H 5IO 6 第三题、3-1、画出分子式为C 4H 4的包含等价氢原子的所有三种可能构型异构体的结构图。
指明并论证哪两个预期是不稳定的。
用价键理论讨论稳定的C 4H 4异构体及其较低同系物C 3H 4结构和键合情况。
3-2、用价键理论讨论 (1) C 3O 2(线型) (2) C 4O 42(环状)的结构和键合情况。
第四题、在无氧的条件下以干燥的钠汞齐(以Na—Hg表示)和干燥的二氧化硫一起振荡,只制得固态化合物A。
已知A中钠元素的质量分数为26.41%,氧元素的质量分数为36.76%,其余为S元素。
4-1.试确定A的化学式并命名A。
写出生成A的化学反应方程式。
4-2.若在有氧的条件下,进行上述反应,会有什么样的结果?说明A具有什么样的化学性质?4-3.若将A加热到402K时,质量减轻了18.39%。
分析得到的固体残渣,发现是两种物质(记为B和C)组成的混合物。
试写出A分解的化学反应方程式。
第五题、铬的化学丰富多采,实验结果常出人意料。
将过量30%H2O2加入(NH4)2CrO4的氨水溶液, 热至50℃后冷至0℃,析出暗棕红色晶体A。
元素分析报告:A含Cr 31.1%,N 25.1%,H 5.4%。
在极性溶剂中A不导电。
红外图谱证实A 有N-H键,且与游离氨分子键能相差不太大,还证实A 中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
5-1.以上信息表明A的化学式为:;可能的结构式为:5-2.A中铬的氧化数为:。
5-3.预期A 最特征的化学性质为:。
5-4.生成晶体A的反应是氧化还原反应,方程式是:。
第六题、安定药安宁可由2-甲基戊醛出发按下列方法合成:2-A (C7H14O2HCHOB (C7H16O2)C (C9H14Cl2O4)NH3安宁 (C9H18N2O4)6-2 安宁还可以通过丙二酸酯合成法合成,请设计一条以丙二酸二乙酯、丙烯、甲醇和必第七题、氧化还原液流电池是近年来研究的一个热点。
在液流电池体系中,多硫化钠溴液流电池与全钒液流电池处于主导地位。
全钒氧化还原液流电池(Vanadium Redox Battery,VRB)作为一种新型的绿色环保储能电池,具有充放电性能优良、使用寿命长及成本低等特点而备受关注,经过20年的发展,正逐步走向实用化.下图为全钒液流电池工作原理示意图在反应体系中电解液为3mol/L H 2SO 4, 以及分布在离子选择隔膜两侧的VO 2+, VO 2+, V 3+, V 2+四种活性离子,隔膜只允许H +通过 1、 给出充,放电时两极反应的方程式2、 VRB 可应用于风力发电系统,克服风力发电的缺陷,试分析他们是如何完美结合的。
第八题、命名下列化合物8-1、C CC 6H 5CH 3CH 3C CH 2CH 38- 2、COOHCH 3CO_____________________________________, ____________________________________H +A B CDCH 3OOC COOCH 3O O OO OCO 2C C CH 3OOC COOCH 38-3、OClClNO28- 4、OH__________________________________, ____________________________________ 第九题、不稳定的化合物A 分子式C 3H 4,经三分子聚合得到B 。
B 与丁炔二酸二甲酯共热得化合物C ,后者经酸性高锰酸钾处理生成D 并放出二氧化碳1mol 。
请给出A 、B 、C 的结构简式并为A 、B 、D 命名。
第十题、化合物A (C 7H 12),在酸性高锰酸钾溶液中加热回流,反应液中只有环己酮一种有机物,A 与氯化氢反应得化合物B ,B 与乙醇钠-乙醇溶液共热生成化合物C ,C 能使溴的四氯化碳溶液褪色并生成化合物D ,再将D 与乙醇钠-乙醇溶液共热则得到化合物E ,E 与高锰酸钾溶液加热回流得丁二酸和丙酮酸。
化合物C 若经臭氧解(O 3氧化,然后用H 2O/Zn 处理)则生成6–氧代庚醛。
10-1 写出化合物A –E 的结构式(不考虑化合物的立体异构)。
10-2用系统命名法命名化合物B ,C ,D ,E10-3上述化合物中哪个可以由乙烯和2–甲基–1,3–丁二烯经一步反应而制得?请用反应式表示。
10-4如何将6–氧代庚醛转化为1,6–庚二醇?请用反应式表示。
第十一题、固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。
这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。
固体电解质取代液体电解质,可以做成全固态电池及其它传感器、探测器等,在电化学、分析化学等领域的应用日益广泛。
碘化银具有α、β和γ等多种晶型。
在水溶液中Ag +与I -沉淀形成的是γ-AgI 和β-AgI 的混合物,升温至136℃全变为β-AgI ,至146℃变为α-AgI 。
α-AgI 是一种固体电解质,导电率为1.31Ω–1·cm –1(注:强电解质水溶液导电率为10–3~1Ω–1·cm –1)。
y = 0 y = 41a y = 21a y = 43a γ-AgI 和β-AgI 晶体的导电性极差。
其中γ-AgI 晶体属立方晶体,其晶胞截面图如上所示。
图中实心圆和空心圆分别表示Ag +和I -,a 为晶胞边长。
11-1试指出和γ-AgI 晶体的点阵型式和Ag +、I -各自的配位数(已知通常I -,Ag +的半径为100~150pm )。
11-2 α-AgI 晶体中,I -离子取体心立方堆积,Ag +填充在其空隙中。
试指出α-AgI 晶体的晶胞中,八面体空隙、四面体空隙各有多少?11-3 通常Ag +离子半径有一个变化范围,为什么?11-4实验发现,α-AgI 晶体中能够迁移的全是Ag +,试分析Ag +能够发生迁移的可能原因。
2008年全国高中化学竞赛模拟试题十四参考答案第一题、1-1 4AgCl + N 2H 4 + 4OH- → 4Ag ↓+ 4 Cl - + 4H 2O + N 2 ↑ (有铵离子生成,配平也对) 1-2 阴离子应为 AuCl 4—,2HAuCl 4 + 3 H 2C 2O 4 → 2 Au ↓ + 8 HCl + 6 CO 2 ↑ 第二题 2-1 Si 是第三周期元素,原子半径比C 的大,Si-Si 键长大于C-C 键长,垂直于键平面的p 轨道不易侧向重叠形成∏键,所以Si 不能形成含有离域∏键的类似石墨结构的同素异性体。
2-2 氮的假电子层有4个价轨道,最大共价键数只能是4,故不能形成含有5个共价键的NX 5,在N 2O ,HNO 3及其盐中,N 的共价键数并未超过4,只是代表电荷偏移的氧化态为+5而已。
2-3 HIO 4和H 5IO 6分子中的非羟基数目不同,前者有三个,后者有一个,故前者是强酸,后者是弱酸。
第三题、3-1H HC C HHC CCH HC H HHC =C =C =C H H(I ) (II ) (III )H(I )不稳定,因为其π电子数=4,不符合4n + 2规则;(II )不稳定,其中每个C 原子sp 3杂化,理应∠CCC =109o 28′,但三元环中的∠CCC 远小于109o28′,环中存在张力,不稳定。
(III )中两端的两个碳原子是sp 2杂化,中间两个碳原子是sp 杂化,成键为:HHHH C CCCπππ同系物C 3H 4中两端的两个碳原子是sp 2杂化,中间碳原子是sp 杂化,成键为:H HHC C Cπ3-2、(1) C 3O 2(线型):O =C =C =C =O ,每个碳原子采取sp 杂化,每个O 原子sp 2杂化。
或可看作C 、O 原子都采取sp 杂化,形成两个65∏O CC C O65∏65∏(2) C 4O 42-(环状): 每个C 原子采取sp 2杂化,其中两个碳原子未参与杂化的2p 轨道分别与两个O 原子的2p 轨道“肩并肩”形成π键,另外两个碳原子未参与杂化的2p 轨道相互“肩并肩”重叠成π键。
O -O C C C OO -第四题4-1.A :Na 2S 2O 4;连二亚硫酸钠; 2SO 2+2Na -Hg = Na 2S 2O 4+2Hg4-2.有O 2存在时,A 会被氧化(得到Na 2S 2O 6或NaHSO 3);说明Na 2S 2O 4具有强还原性。
CO2CH3CO2CH3CH2 C CH2A:丙二烯(1分)B:1,2,4—三亚甲基环己烷(4分)C:(4分)D:2,4,6,9,11—四羰基十二碳二酸二甲酯或2,4,6,9,11—四氧代十二碳二酸二甲酯(3分)4-3.2Na2S2O4 = Na2S2O3+Na2SO3+SO2↑第五题5-1.A 的化学式Cr(NH3)3O4或CrN3H9O4(写成其他形式也可以)A 的可能结构式如下图:1式和/或2式均得满分,但无2个过氧键O—O者得零分。
