重金属氧化物word版
(完整word版)污染词汇

wastes 农业废物hazardous wastes 危险废物heavy metals 重金属industrial emissions 工业排放物industrial fumes 工业烟尘inorganic pollutants 无机污染物motor vehicle emissions 机动车辆排放物nitrogen oxides 氮氧化物persistent organic pollutants 难降解有机污染物pharmaceutical wastes 医药废物plastic wastes 塑料废物radioactive substances 放射性物质sewage 污水solid wastes 固体废物toxic substances 有毒物质toxins 毒素battery disposal 电池处理chemical treatment of waste 废物的化学处理disposal sites 处置场所incineration of waste 废物焚烧oil residue recuperation 残油回收radioactive waste management 放射性废物管理recycled materials 回收的材料recycling 回收reuse of materials 材料再利用sanitary landfills 卫生填埋sewage disposal 污水处置sewage treatment systems 污水处理系统solid waste disposal 固体废物处置waste disposal in the ground 废物土地处置waste recovery 废物回收waste use 废物利用water reuse 水的再利用。
铝合金化学氧化膜常用的处理方法word文档

铝合金化学氧化膜常用的处理方法 化学氧化膜常用的处理方法有与铬酸盐有关的碱性溶液氧化法,铬酸盐法及磷酸盐法以及新发展的多种无铬转化处理方法。
目前铝及其合金化学氧化处理液大多以铬酸(盐)法为主,按溶液酸碱性和酸性两类。
按溶液的组成可分为:1.以碳酸钠为主体;2.以铬酸或重铬酸盐为主体;3.以氟化物为主体;4.以磷酸为主体。
而所生成的化学氧化膜组成由主要取决于化学氧化处理液的成分。
含有铬酸盐的处理方法如下。
1.碱性溶液氧化法 该法是传统的铝及其合金化学氧化处理方法,其处理液主要使用氢氧化钠、碳酸钠、铬酸钠等。
2.铬酸盐法 铬酸盐法最早是于1915年由德国的Bauer和Vogel提出,简称BV 法,其处理液为碳酸钾、碳酸钠、重铬酸钾等。
德国人GustavEckert对BV法进行了改进,形成MBV法,其处理液为碳酸钠、铬酸钠。
铬酸盐还原成氧化铬,进入铝的氧化膜中,使氧化膜成为灰色。
一般来说,在氧化性溶液中添加重金属氧化物时,它们将被还原成低价氧化物或单质金属,成为氧化膜的组成部分,使氧化膜呈现各种颜色。
用MBV法处理纯铝或含Mg、Mn、Si的合金效果最好,对含铜铝合金也有效,但对硬铝系合金或含铜及其他重金属多的铝合金,即使把处理时间缩短到1至1.5min,所形成的氧化膜也是粗糙疏松的。
3.磷酸-铬酸盐法 该法最早于1945年出现于美国,处理液主要含有H3PO4、F-和铬酸,pH=1.5-3.0.磷酸-铬酸盐法的氧化膜组成为AlPO4、CrPO4和Al2O3.3H2O,属非晶质膜。
该法所得的氧化膜的最大优点是不存在六价离子,因此可作为食品包装和装饰村料的保护膜。
4.无铬转化处理方法 铝及其合金的铬酸盐处理和磷酸-铬酸盐处理,就其功能来说已经满足各种要求,国内外对此研究与应用也取得一定进展。
但由于六价铬对人体的危害性和含铬废水及残渣的处理费用十分昂贵,随着高新科技产业的迅猛发展和人们生活水平的快速提高。
(完整word版)重金属检测方法汇总

重金属检测方法汇总重金属检测方法及应用一、重金属的危害特性从环境污染方面所说的重金属,实际上主要是指汞、镉、铅、铬、砷等金属或类金属,也指具有一定毒性的一般重金属,如铜、锌、镍、钴、锡等。
我们从自然性、毒性、活性和持久性、生物可分解性、生物累积性,对生物体作用的加和性等几个方面对重金属的危害稍作论述。
(一)自然性:长期生活在自然环境中的人类,对于自然物质有较强的适应能力。
有人分析了人体中60多种常见元素的分布规律,发现其中绝大多数元素在人体血液中的百分含量与它们在地壳中的百分含量极为相似。
但是,人类对人工合成的化学物质,其耐受力则要小得多。
所以区别污染物的自然或人工属性,有助于估计它们对人类的危害程度。
铅、镉、汞、砷等重金属,是由于工业活动的发展,引起在人类周围环境中的富集,通过大气、水、食品等进入人体,在人体某些器官内积累,造成慢性中毒,危害人体健康。
(二)毒性:决定污染物毒性强弱的主要因素是其物质性质、含量和存在形态。
例如铬有二价、三价和六价三种形式,其中六价铬的毒性很强,而三价铬是人体新陈代谢的重要元素之一。
在天然水体中一般重金属产生毒性的范围大约在1~10mg/L之间,而汞,镉等产生毒性的范围在0.01~0.001mg/L之间。
(三)时空分布性:污染物进入环境后,随着水和空气的流动,被稀释扩散,可能造成点源到面源更大范围的污染,而且在不同空间的位置上,污染物的浓度和强度分布随着时间的变化而不同。
(四)活性和持久性:活性和持久性表明污染物在环境中的稳定程度。
活性高的污染物质,在环境中或在处理过程中易发生化学反应,毒性降低,但也可能生成比原来毒性更强的污染物,构成二次污染。
如汞可转化成甲基汞,毒性很强。
与活性相反,持久性则表示有些污染物质能长期地保持其危害性,如重金属铅、镉等都具有毒性且在自然界难以降解,并可产生生物蓄积,长期威胁人类的健康和生存。
(五)生物可分解性:有些污染物能被生物所吸收、利用并分解,最后生成无害的稳定物质。
欧盟垃圾焚烧污染物排放标准DIRECTIVE_2000[中文版]
![欧盟垃圾焚烧污染物排放标准DIRECTIVE_2000[中文版]](https://img.taocdn.com/s3/m/47194ace7c1cfad6185fa72f.png)
欧盟垃圾焚烧污染物排放标准DIRECTIVE_2000欧盟议会和理事会考虑到欧盟成立条约,特别是第175(1)条,委员会的建议,经济和社会委员会的意见,当地委员会的意见,按照251条的规定条约和10月11日调解委员会批准的联合文本鉴于:(1)第五个环境行动计划:实现可持续发展-欧洲共同体关于环境和可持续发展的方案政策和行动,由2179/98/EC补充,设置的目标为某些污染物如氮氧化物(NOx),二氧化硫(SO2),重金属和二噁英的浓度和临界负荷不应超过标准,同时空气质量的目标是所有人应得到有效保护,免受来自大气污染的健康风险。
方案的进一步目标是到2005年确定的二噁英排放量相比于1985年减少90%,所有途径的镉(Cd),汞(Hg)和铅(Pb)的排放量至少减少70%。
(2)由联合国欧洲经济委员会公约框架内的国家签署的关于持久性有机污染物的协议,规定远距离越境空气污染,如二噁英和呋喃的排放限值为0.1ng/m,每小时燃烧3t生活垃圾产生的二噁英类毒性当量排放限值为0.5 ng/m,每小时燃烧1t医疗垃圾产生的二噁英类毒性当量排放限值为0.2 ng/m。
(3)由联合国欧洲经济委员会公约框架内的国家签署的关于重金属污染物的协议,规定远距离越境空气污染,如危险和医疗垃圾焚烧产生的颗粒排放限值为10mg/m3,危险垃圾焚烧产生的汞的排放限值为0.05 mg/m3,生活垃圾焚烧产生的汞的排放限值为0.08 mg/m3。
(4)国际癌症研究机构和世界卫生组织指出一些多环芳烃的芳香族碳氢化合物(PAHs)是致癌物质,因此,各成员国可设定多环芳烃的排放限值。
(5)为符合条约5的辅助性和对称性原则,共同体需要采取行动,预防原则为进一步的措施提供了基础,这些规章限定了焚烧和焚烧厂的最低要求。
(6)此外,第174条规定,关于环境的社会政策必须为保护人类健康作出贡献。
(7)因此,高水平的环境保护和人类健康保护需要设置和保持严格的经营条件,技术条件和焚烧厂的排放限值,该排放限值应该能够最大限度地防止和限制对环境产生的的负面影响和对人类健康产生的风险。
(完整word版)USP翻译

231 HEAVY METALS重金属This test is provided to demonstrate that the content of metallic impurities that are colored by sulfide ion, under the specified test conditions, does not exceed the Heavy metals limit specified in the individual monograph in percentage (by weight) of lead in the test substance, as determined by concomitant visual comparison (see Visual Comparison in the section Procedure under Spectrophotometry and Light—Scattering(851) with a control prepared from a Standard Lead Solution。
[NOTE-Substances that typically will respond to this test are lead, mercury, bismuth, arsenic,antimony, tin, cadmium, silver, copper, and molybdenum. ]本检验是用来测定与硫化物离子作用显色的金属杂质含量,在规定检验条件下,其检测结果不得超过专论中规定的重金属限度供试品中铅的百分比(重量比),该检验是通过与标准铅溶液配制的对照进行视觉比较来得出结论的(参看分光光度法和光散射法<851>中规程部分的视觉比较).[注意:与本检验起反应的代表性物质为铅、汞、铋、砷、锑、锡、镉、银、铜和钼。
土壤中重金属的氧化

土壤中重金属的氧化
首先,自然氧化是指重金属在土壤中与氧气发生化学反应的过程。
土壤中的氧气和水分会与重金属发生氧化反应,形成氧化物或
氢氧化物。
这些氧化物或氢氧化物通常以固体形式存在于土壤中,
对土壤质地和化学性质产生影响。
其次,人为氧化是指人类活动导致土壤中重金属发生氧化的过程。
工业排放、农药施用、废弃物填埋等活动都可能导致土壤中重
金属的氧化。
例如,工业废气中的氧化物和气溶胶经过降水沉降到
土壤中,与土壤中的重金属发生氧化反应。
此外,长期施用含有重
金属的化肥和农药也会导致土壤中重金属的氧化。
重金属的氧化对土壤环境和生态系统具有重要影响。
一方面,
氧化后的重金属通常具有较高的毒性和生物有效性,对土壤微生物、植物生长和生态系统稳定性产生不利影响。
另一方面,氧化后的重
金属也更容易迁移和积累,可能对地下水和周围水体造成污染。
为了减少土壤中重金属的氧化,可以采取一系列措施。
例如,
加强工业废气治理,减少重金属排放;合理使用化肥和农药,避免
重金属的过量积累;开展土壤修复和植被恢复工作,减少土壤中重
金属的生物有效性。
此外,也可以通过监测和评估土壤中重金属的氧化情况,及时采取措施进行治理和修复。
综上所述,重金属的氧化是一个复杂的过程,需要综合考虑自然和人为因素,以及其对土壤环境和生态系统的影响,才能有效进行管理和控制。
(完整word版)双氧水-安全技术说明书(MSDS)
储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。保持容器密封。应与易(可)燃物、还原剂、活性金属粉末等分开存放,切忌混储。储区应备有泄漏应急处理设备和合适的收容材料。
第八部分:接触控制/个体防护
职业接触限值
中国MAC(mg/m3):
未制定标准
前苏联MAC(mg/m3):
未制定标准
皮肤接触:
脱去污染的衣着,用大量流动清水冲洗。
眼睛接触:
立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:
迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:
饮足量温水,催吐。就医。
第五部分:消防措施
危险特性:
爆炸性强氧化剂。过氧化氢本身不燃,但能与可燃物反应放出大量热量和氧气而引起着火爆炸。过氧化氢在pH值为3.5~4.5时最稳定,在碱性溶液中极易分解,在遇强光,特别是短波射线照射时也能发生分解。当加热到100℃以上时,开始急剧分解。它与许多有机物如糖、淀粉、醇类、石油产品等形成爆炸性混合物,在撞击、受热或电火花作用下能发生爆炸。过氧化氢与许多无机化合物或杂质接触后会迅速分解而导致爆炸,放出大量的热量、氧和水蒸气。大多数重金属(如铁、铜、银、铅、汞、锌、钴、镍、铬、锰等)及其氧化物和盐类都是活性催化剂,尘土、香烟灰、碳粉、铁锈等也能加速分解。浓度超过74%的过氧化氢,在具有适当的点火源或温度的密闭容器中,能产生气相爆炸。
大包装:塑料桶(罐),容器上部应有减压阀或通气口,容器内至少有10%余量,每桶(罐)净重不超过50公斤。试剂包装:塑料瓶,再单个装入塑料袋内,合装在钙塑箱内。
运输注意事项:
双氧水应添加足够的稳定剂。含量≥40%的双氧水,运输时须经铁路局批准。双氧水限用全钢棚车按规定办理运输。试剂包装(含量<40%),可以按零担办理。设计的桶、罐、箱,须包装试验合格,并经铁路局批准;含量≤3%的双氧水,可按普通货物条件运输。铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。运输时单独装运,运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与酸类、易燃物、有机物、还原剂、自燃物品、遇湿易燃物品等并车混运。运输时车速不宜过快,不得强行超车。公路运输时要按规定路线行驶。运输车辆装卸前后,均应彻底清扫、洗净,严禁混入有机物、易燃物等杂质。
稀土氧化物的介绍Microsoft Word 文档 (4)
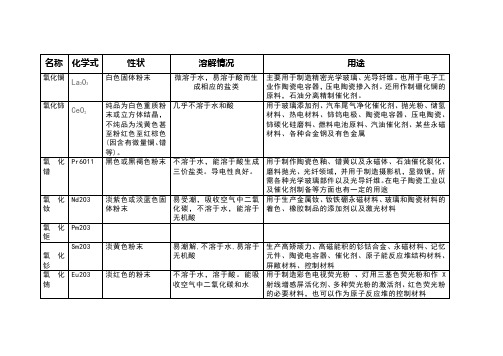
Tm2O3
淡绿色立方晶系晶体
不溶于水,溶于热硫酸
主要用于制造携带式X射线透射装置也用作反应堆的控制材料
氧化镱
Yb2O3
白色略带微绿色粉末
不溶于水和冷酸,溶于温稀酸。
用于热屏蔽涂层材料、电子材料、有源器件材料、电池材料、生物制药等
氧化镥
Lu2O3
白色粉末
不溶于水,溶于无机酸
石油裂化催化剂
氧化钇
Y2O3
几乎不溶于水和酸
用于玻璃添加剂、汽车尾气净化催化剂、抛光粉、储氢材料、热电材料、铈钨电极、陶瓷电容器、压电陶瓷、铈碳化硅磨料、燃料电池原料、汽油催化剂、某些永磁材料、各种合金钢及有色金属
氧化镨
Pr6O11
黑色或黑褐色粉末
不溶于水,能溶于酸生成三价盐类。导电性良好。
用于制作陶瓷色釉、镨黄以及永磁体、石油催化裂化、磨料抛光、光纤领域,并用于制造摄影机,显微镜,所需各种光学玻璃部件以及光导纤维。在电子陶瓷工业以及催化剂制备等方面也有一定的用途
氧化钬
Ho2O3
浅黄色结晶粉末
不溶于水,溶于酸
用于制造新型光源镝钬灯,也可用作钇铁获钇铝柘榴石的添加剂及制取金属钬
氧化铒
Er2O3
粉红色粉末
微溶于无机酸,不溶于水
主要用作钇铁柘榴石添加剂和核反应堆控制材料,也用于制造特种发光玻璃和吸收红外线的玻璃,还用作玻璃着色剂。由硝酸铒或硫酸铒溶液与碱反应后,经分离、灼烧而得。
氧化钕
Nd2O3
淡紫色或淡蓝色固体粉末
易受潮,吸收空气中二氧化碳,不溶于水,能溶于无机酸
用于生产金属钕、钕铁硼永磁材料、玻璃和陶瓷材料的着色、橡胶制品的添加剂以及激光材料
氧化钷
Pm2O3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、Fe2O3、Fe(OH)3、CuO、Cu (OH)
2、ZnO、Zn(OH)2不溶解于水。
2、Al
2O
3
常温下不溶于水;Al(OH)
3
难溶于水,易形成胶体溶液,不稳定,易受热
分解氧化铝Al
2O
3。
3、镉:
CdO,可致癌,不溶于水,可溶于酸,生成Cd[H
2O]
6
2+;也可溶于碱,生成[Cd(OH)
4
]2−。
Cd(OH)
2
,溶于稀酸、氢氧化铵和氯化铵溶液,微溶于氢氧化钠溶液,几乎不溶
于水。
4、汞
HgO,红色氧化汞(剧毒),不溶于水,剧毒。
Hg(OH)
2
只存在于溶液中,以汞离子和氢氧根离子的形式存在,氢氧化汞的溶解
度不是很大,在碱性溶液中溶解度更小,以橙色沉淀的形式析出,Hg(OH)
2
沉淀不稳定,析出沉淀后立刻分解成溶解度更低的HgO,故至今未曾制得氢氧化汞固体。
5、铅
PbO不溶于水,不溶于乙醇,溶于硝酸、乙酸、热碱液。
不溶于水,不溶于乙醇,溶于硝酸、乙酸、热碱液。
Pb(OH)
2
,微溶于水。
溶于硝酸和醋酸。
易溶于强碱溶液,生成亚铅酸盐
M 2[Pb(OH)
4
]。
PbO
2
氧化铅,不溶于水、醇,溶于乙酸、氢氧化钠水溶液。
见光分解为四氧化三铅和氧。
受高热分解放出氧气,首先成为三氧化二铅,而后成为四氧化三铅,更高的温度下为PbO。
氧化铅(IV)的水合物的为铅酸。
有正铅酸Pb(OH)
4,六羟基铅酸H
2
[Pb(OH)
6
]、
偏铅酸H
2PbO
3。
通常以铅酸盐的形式存在。
6、砷
As
2O
3
,微溶于水,溶于酸、碱。
三氧化二砷溶于水制得亚砷酸H
3
AsO
3
或 As(OH)
3
,
只能存在于水溶液中,还没有分离出纯酸。
中性环境水体一般为亚砷酸H
3AsO
3
为主。
As
2O
5
,在315℃以上时分解为氧气及三氧化二砷,在水中溶解形成砷酸H
3AsO
4
,毒性虽不及亚砷酸,但仍较高。
在中性和弱碱性富氧环境则以H
2
AsO
4
-、
HAsO
4
2-为主。
7、铬
Cr
2O
3
溶于加热的溴酸钾溶液,微溶于酸类和碱类,几乎不溶于水、乙醇和丙酮。
Cr(OH)
3
不溶于水,溶于酸和强碱溶液。
水体中铬的形态主要为Cr3+、CrO
2-、CrO
4
-、Cr
2
O
7
-,六价铬在酸/碱性溶液较为稳
定并以溶解(铬酸根离子)的状态存在,将三价铬氧化为六价铬不利于铬的去除。
CrO
3
,溶于水。
8、镍
NiO,不溶于水、碱液,为碱性氧化物,溶于酸和氨水。
Ni (OH)
2
,不溶于水。
9、铍
BeO氧化铍,剧毒,不溶于水。
水体中溶解态Be(OH)+、Be
3(OH)
3
3+,不溶态BeO、Be(OH)
2。
pH>7.8,主要以不
溶Be(OH)
2
的形态存在。
10、钡
BaO,微溶于冷水,溶于热水、酸、乙醇。
Ba(OH)
2
,溶于水,若从空气中迅速吸收二氧化碳变成碳酸盐后,则不能完全溶于水。
11、银
Ag
2
O,微溶于水。
高温分解为银和氧气。
氧化银较氢氧化银难溶,但在溶液中仍以氢氧根离子和银离子形式存在。
氢氧化银,低温下可制得氢氧化银在水中的白色沉淀,室温下,AgOH遇水分解,在水溶液中完全解离出OH-。
结论:
(1)除碱金属元素、某些碱土金属元素可以和水反应外,大多金属氧化物都不溶于水,不与水直接反应。
(2)碱性氧化物(一定是金属氧化物),其对应的水化物是碱。
并不是所有碱性氧化物都可以与水反应生成对应的碱。
大部分碱都不溶于水,溶于水的碱有:氢氧化锂、氢氧化钠、氢氧化钾、氢氧化铷、氢氧化铯、氢氧化钡、氢氧化钙(微溶,视为溶于水)。
(3)两性氧化物:两性金属难溶于水,主要有BeO、Al
2O
3
、Cr
2
O
3
、ZnO、Au2O3等。
两性金属氢氧化物都难溶于水。
(4)酸性氧化物
一般是非金属元素的氧化物和某些过渡金属元素的高价氧化物,酸性氧化物与水
反应生成相应的酸(除了SiO
2,它不与水反应),如五氧化二磷P
2
O
5
【也就是磷
酸的酸酐】、七氧化二锰Mn
2O
7
【也就是高锰酸的酸酐】、三氧化铬CrO
3
【也就
是铬酸的酸酐】。
大多数的酸性氧化物都可溶于水。
故将铬、砷、锰氧化为最高价,其将会以酸根的形式存在。
(注:本资料素材和资料部分来自网络,仅供参考。
请预览后才下载,期待您的好评与关注!)。
