常见金属氧化物、碱、盐性质表
利用思维导图巧记酸碱盐的化学性质

❖ s2:酸能与某些盐反应,生成新盐和新酸(酸+盐
→新盐+新酸);
❖ s3:酸能与指示剂反应,能使紫色石蕊溶液变为红
色;
❖ s4:酸能与活泼金属反应(H前金属,酸+金属→
盐+ H2↑)
❖ s5:酸能与某些金属氧化物反应,生成盐和水(酸
+金属氧化物→盐+H2O)。
碱“四性”
❖ j1:碱能与酸反应,生成盐和水(碱+酸→盐 +H2O);
初三化学专题复习 巧记酸碱盐的化学性质
巧记酸碱盐的化学性质
酸
碱
盐
指示剂
酸
碱
盐
指示剂
酸
碱
盐
金属氧化物
指示剂
酸
碱பைடு நூலகம்
非金属 氧化物
盐
金属
金属氧化物 酸
指示剂
碱
非金属 氧化物
盐
金属
金属
金属氧化物 酸
指示剂
碱
非金属 氧化物
盐
盐 金属
金属
金属氧化物 酸
指示剂
碱
非金属 氧化物
盐+水
盐
盐 金属
金属
金属氧化物 酸
❖ j2:碱溶液能与某些盐溶液反应,生成新盐和 新碱(碱+盐→新盐+新碱);
❖ j3:可溶性碱能与指示剂反应,使紫色石蕊溶 液变为蓝色,使无色酚酞溶液变为红色;
❖ j4:碱能与某些非金属氧化物反应,生成盐和 水(碱+非金属氧化物→盐+ H2O);
盐“四性”
❖ y1:盐能与酸反应,生成新盐和新酸(盐+酸→ 新盐+新酸);
氧化物的分类及性质金属活动顺序表常见酸碱盐物质溶解性表的解读

氧化物的分类及性质⾦属活动顺序表常见酸碱盐物质溶解性表的解读氧化物的分类及性质⾦属活动顺序表常见酸碱盐物质溶解性表的灵活应⽤⼀. 本周教学内容:1. 氧化物的分类及性质。
2. ⾦属活动顺序表、常见酸碱盐物质溶解性表的灵活应⽤。
⼆. 教学⽬的要求:1. 熟悉物质分类的原则及各种物质的概念。
2. 会运⽤⾦属活动顺序表来判断某些置换反应能否发⽣。
3. 根据复分解反应发⽣的条件,判断某些反应能否发⽣。
三. 重点、难点:氧化物的分类是教学难点,⾦属活动顺序表、常见酸碱盐物质溶解性表的灵活应⽤是重点。
四. 知识要点:(⼀). 氧化物的分类及性质。
(1)氧化物是指由两种元素组成,其中有⼀种是氧元素的化合物。
氧化物属于化合物,也⼀定是纯净物。
(2)按组成分类:--属元素组成的氧化物。
由氧元素和另⼀种⾮⾦⾮⾦属氧化物素组成的氧化物。
由氧元素和某种⾦属元⾦属氧化物氧化物(3)按性质分类:氧化物:①成盐氧化物—能与酸或碱反应⽣成盐的氧化物。
a . 酸性氧化物—仅能与碱反应⽣成盐和⽔的氧化物。
如:CO 2、SO 2b . 碱性氧化物—仅能与酸反应⽣成盐和⽔的氧化物。
如Na 2O 、MgOc . 两性氧化物—既能与酸反应⼜能与碱反应⽣成盐和⽔的氧化物。
如:Al 2O 3、ZnO②不成盐氧化物—既不能与酸反应⽣成盐也不能与碱反应⽣成盐的氧化物。
如:H 2O 、CO 等。
凡能跟酸起反应,⽣成盐和⽔的氧化物叫做碱性氧化物,如:Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 、CuO+2HCl=CuCl 2+H 2O 。
⾦属氧化物⼤多数是碱性氧化物,例如:CuO 、CaO 、MgO 等都属于碱性氧化物。
在常见的碱性氧化物中,只有K 2O 、Na 2O 、BaO 、CaO 少数⼏种能跟⽔直接化合⽣成可溶性碱。
但碱性氧化物⽆论能否溶于⽔,⼀般均可跟酸反应⽣成盐和⽔。
凡能跟碱起反应,⽣成盐和⽔的氧化物叫做酸性氧化物,如:CO 2+2NaOH=Na 2CO 3+H 2O 。
酸、碱、盐、金属、金属氧化物、非金属氧化物的通性

发生反应,生成和
BaCl2+H2SO4=
CaCO3+2HCl=
碱的通性
项目
反应情况
反应实例
(1)跟指示剂
使紫色的石蕊试液变色,无色酚酞变色
(2)跟酸
发生反应,生成和
NaOH+HCl=
Cu(OH)2+H2SO4
(aOH+SO2=
Ca(OH)2+CO2=
(4)跟某些盐
K2O+H2O=
Na2O+H2O=
BaO+H2O=
CaO+H2O=
跟酸反应
生成和
金属氧化物不论溶不溶于水均可溶于酸中
Na2O+HCl=
CUO+H2SO4=
项目
反应条件
反应情况
反应
与氧气反应
大多数金属都能与氧气反应有些常温时就能反应如:K、Ca、Na、Mg、Al、Zn,
有些要加热才能反应如:Fe、Cu,
CaCO3+HCl=
3、盐与碱反应
发生复分解反应和成和
反应物中的盐和碱要可溶于水生成物要有沉淀或气体或水
CuSO4+NaOH=
NH4Cl+Ca(OH)2=
4、盐与盐反应
发生复分解反应和成和
反应物中的盐和盐要可溶于水生成物要有沉淀或气体或水
NaCl+AgNO3=
CuSO4+BaCl2=
非金属氧化物通性(除NO、CO)外
发生反应,生成新和新
NaOH+CuSO4=
Ca(OH)2+FeCl3=
盐的通性
项目
反应情况
反应条件
反应实例
酸碱盐的溶解性表
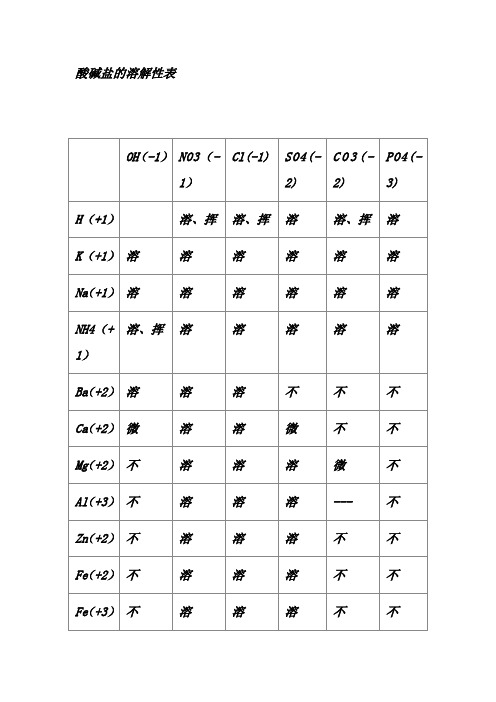
酸碱盐的溶解性表说明:此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了背诵口诀1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶钾钠钡钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【f e(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)说明【】内为前一物质的特点2.钾钠铵盐全都溶碳酸除镁是微溶其他全都不能溶AgCl、BaSO4酸也不溶磷酸盐,更不溶一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O (3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃 CO224.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃 CO227.煤炉的中层:CO2 + C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃 2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O442. 铜在空气中受热:2Cu + O2 加热 2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O (3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O (4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O (2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl钾钠硝铵均可溶,盐酸盐不溶AgCl,硫酸盐不溶BaSO4 ,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
常见的酸、碱、盐

常见的碱一、氢氧化钠(NaOH)1、俗称:“火碱”、“烧碱”、“苛性钠”。
从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH可做干燥剂。
NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应NaOH+HCl=NaCl+H2ONaOH+HNO3=NaNO3+H2O2NaOH+H2SO4=Na2SO4+2H2O(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(蓝色沉淀)3NaOH+FeCl3=3NaCl+Fe(OH)3↓(红褐色沉淀)氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。
注意:NaOH必须密封保存。
原因:空气中含水和CO2,如果将NaOH露置,①NaOH易潮解②NaOH 易与CO2反应而变质。
二、氢氧化钙[Ca(OH)2]1、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+H2O=Ca(OH)2,反应放出大量的热可以使水沸腾。
生石灰熟石灰3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应CO2+Ca(OH)2=CaCO3↓+H2O 白色沉淀,可溶于酸产生使澄清石灰水便浑浊的无色气体(3)与酸反应2HCl+Ca(OH)2=CaCl2+2H2O(4)与某些盐反应Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 白色沉淀,可溶于酸产生使澄清石灰水便浑浊的无色气体由于Ca(OH)2的碱性不如NaOH强,所以此反应进行时溶液的pH值不断上升,工业用此反应来制取NaOH,称为“苛化制碱”法,分离NaOH和CaCO3可采用溶解、过滤、蒸发的方法。
常见的单质、氧化物、酸、碱、盐及化学方程式

常见的单质、氧化物、酸、碱、盐及化学方程式1、非金属单质:氢气、氧气、氯气、氮气、2、金属单质:锌、铁、镁、钙、铜、银3、酸性氧化物(非金属氧化物):二氧化碳、二氧化硫、三氧化硫;4、碱性氧化物(金属氧化物):氧化铜、氧化钙、氧化铁、氧化亚铁、氧化锌;氧化镁;5、酸:硫酸、盐酸、硝酸、磷酸;6、碱:(读“氢氧化某”)①可溶性碱:氢氧化钠、氢氧化钾、氨水;②微溶性碱:氢氧化钙;③不溶性碱:氢氧化铜(颜色:色)、氢氧化铁(颜色:色)、氢氧化镁、氢氧化锌;7、盐:(读“某酸某”或“氯化某”)①硝酸盐:硝酸钾、硝酸钠、硝酸银、硝酸钡、硝酸铜、硝酸铵、②氯盐:氯化铵、氯化钾、氯化钡、氯化钙、氯化银、氯化铁、氯化亚铁;③硫酸盐:硫酸铵、硫酸钠、硫酸镁、硫酸铝、硫酸铜、硫酸铁、硫酸亚铁、⑤碳酸盐:碳酸铵、碳酸钠、碳酸钡、碳酸钙、(碳酸盐遇酸放出CO2,这是检验碳酸盐的方法)9、金属(氢前)+盐酸或稀硫酸盐+氢气①镁与盐酸:、②铝与盐酸:③锌与稀硫酸:、④铁与稀硫酸:10、金属(前)+盐 +另一金属(后)+另一种盐①铁与硫酸铜溶液:、②铜与硝酸银溶液11、酸性氧化物+可溶性碱盐+水①二氧化碳与氢氧化钙溶液:②三氧化硫与氢氧化钠溶液:12、碱性氧化物+酸盐+水①氧化铁与盐酸、氧化铜与稀硫酸13、酸+碱盐+水(中和反应)①盐酸与氢氧化铝溶液②硫酸与氢氧化钠溶液14、酸+盐新酸+新盐①硫酸与氯化钡溶液、②盐酸与硝酸银溶液、15、可溶性碱+可溶性盐新碱+新盐①氢氧化钠与氯化铁溶液、②氢氧化钙与氯化铜溶液、16、可溶性盐+可溶性盐两种新盐①硫酸钠溶液与氯化钡溶液、②硝酸银溶液与氯化钙溶液、③碳酸钠溶液与氯化钙溶液、【练习】指出下列符号中“2”的意义:①2H________________________________;②H2__________________________ _;③2O3 ______________________________________;④2H+_______________________ _;⑤Mg2+________________________ ;⑥Mg+2____________________________。
氧化物的分类及性质金属活动顺序表常见酸碱盐物质溶解性表的解读

氧化物的分类及性质 金属活动顺序表 常见酸碱盐物质溶解性表的灵活应用一. 本周教学内容:1. 氧化物的分类及性质。
2. 金属活动顺序表、常见酸碱盐物质溶解性表的灵活应用。
二. 教学目的要求:1. 熟悉物质分类的原则及各种物质的概念。
2. 会运用金属活动顺序表来判断某些置换反应能否发生。
3. 根据复分解反应发生的条件,判断某些反应能否发生。
三. 重点、难点:氧化物的分类是教学难点,金属活动顺序表、常见酸碱盐物质溶解性表的灵活应用是重点。
四. 知识要点:(一). 氧化物的分类及性质。
(1)氧化物是指由两种元素组成,其中有一种是氧元素的化合物。
氧化物属于化合物,也一定是纯净物。
(2)按组成分类:⎩⎨⎧--属元素组成的氧化物。
由氧元素和另一种非金非金属氧化物素组成的氧化物。
由氧元素和某种金属元金属氧化物氧化物 (3)按性质分类:氧化物:① 成盐氧化物—能与酸或碱反应生成盐的氧化物。
a . 酸性氧化物—仅能与碱反应生成盐和水的氧化物。
如:CO 2、SO 2b . 碱性氧化物—仅能与酸反应生成盐和水的氧化物。
如Na 2O 、MgOc . 两性氧化物—既能与酸反应又能与碱反应生成盐和水的氧化物。
如:Al 2O 3、ZnO② 不成盐氧化物—既不能与酸反应生成盐也不能与碱反应生成盐的氧化物。
如:H 2O 、CO 等。
凡能跟酸起反应,生成盐和水的氧化物叫做碱性氧化物,如:Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 、CuO+2HCl=CuCl 2+H 2O 。
金属氧化物大多数是碱性氧化物,例如:CuO 、CaO 、MgO 等都属于碱性氧化物。
在常见的碱性氧化物中,只有K 2O 、Na 2O 、BaO 、CaO 少数几种能跟水直接化合生成可溶性碱。
但碱性氧化物无论能否溶于水,一般均可跟酸反应生成盐和水。
凡能跟碱起反应,生成盐和水的氧化物叫做酸性氧化物,如:CO 2+2NaOH=Na 2CO 3+H 2O 。
金属氧化物酸碱盐的化学通性 酸碱盐氧化物化学知识点

金属氧化物酸碱盐的化学通性酸碱盐氧化物化学知识点氧化物的性质:①有四种碱性氧化物跟水反应生成碱,其他的碱性氧化物不溶于水跟水不反应na2o+h2o=2naohcao+h2o=ca(oh)2k2o+h2o=2kohbao+h2o=ba(oh)2②酸性氧化物:大部分非金属氧化物都是酸性氧化物,跟水化合生成同价的含氧酸。
co2+h2o=h2co3so2+h2o=h2so3so3+h2o=h2so41.盐酸和硫酸用途:硫酸和盐酸可除去金属表面的锈,都是重要的工业原料盐酸(氢氯酸,hcl气体的水溶液,无色液体)浓盐酸有挥发性,会挥发出hcl硫酸(h2so4)浓硫酸有吸水性,可作气体的干燥剂2.浓硫酸的稀释:稀释浓硫酸时,必须把浓硫酸沿着容器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速扩散,切不可把水倒入浓硫酸里。
盐酸(或氯化物)和硫酸(硫酸盐)的不同方法:最好用可溶性钡的化合物氯化钡(硝酸钡或氢氧化钡),有白色沉淀生成的是硫酸(硫酸盐),无现象的是盐酸不可以用硝酸银溶液,因硝酸银跟硫酸反应有硫酸银白色沉淀生成。
3.硝酸(hno3)有酸的通性,但跟金属反应不生成氢气磷酸h3po44.氢氧化钠(俗名:烧碱、火碱、苛性钠化学式:naoh)物理性质:白色固体,极易溶于水且放出大量热,有吸水性,易潮解氢氧化钠易潮解,称量时必须放在玻璃器皿(如烧杯、表面皿)里称量。
naoh会吸收空气中的水分,又会跟二氧化碳反应,所以必须密封保存用途:作中性或碱性气体的干燥剂,不可以干燥二氧化硫、二氧化碳、氯化氢,可干燥h2、o2、n2、co、nh3、ch4等;用于肥皂、石油、造纸等工业化学性质:(koh的化学性质跟naoh相同)①二氧化碳、二氧化硫分别通入氢氧化钠溶液里(无明显现象)co2+2naoh=na2co3+h2oso2+2naoh=na2so3+h2oso3+2naoh=na2so4+h2o②硫酸和硝酸分别跟氢氧化钠溶液发生中和反应(无明显现象)③氢氧化钠跟盐反应a.氢氧化钠溶液跟氯化铁、硫酸铁、硝酸铁溶液的现象和方程式:现象有红褐色沉淀生成:6naoh+fe2(so4)3=3na2so4+2fe(oh)3↓b.氢氧化钠溶液跟氯化铜、硫酸铜、硝酸铜溶液的现象和方程式:现象有蓝色沉淀生成:2naohcuso4=na2so4+cu(oh)2↓c.氢氧化钠溶液跟氯化镁、硫酸镁、硫酸铝溶液的现象有白色沉淀生成方程式:2naoh+mgso4=na2so4+mg(oh)2↓5.氢氧化钙(俗名:消石灰、熟石灰化学式ca(oh)2)白色固体,微溶于水,溶解度随温度升高而降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O2- OH- Cl- SO4 2- NO3- CO32-NH4+NH4OH或NH3·H20 无色有强刺激气味液体35.28%的氨水密度为0.88g/mlNH3·H20是氨存在于水溶液中的主要成分氨水有弱碱性、挥发性、弱腐蚀性、络合性NH4Cl白色晶体密度1.53g/cm3,350℃升华溶于水和甘油、液氨,微溶于乙醇易潮解。
水溶液为酸性,对铁、铜等有腐蚀(NH4)2SO4纯品无色斜方晶体密度1.769g/cm3,熔点513±2℃(密封管中)溶于水,不溶于乙醇。
水溶液带有辛辣咸味工业品是白色或带微黄色的小晶粒NH4NO3 无色斜方或单斜晶体溶于水、乙醇、甲醇密度1.725g/cm3,熔点169.6℃210℃分解为水和N2O(加热过猛会引起爆炸)(NH4)2CO3 纯品是无色或白色晶体常温下是固体溶于水,遇热水分解。
不溶于乙醇和CS2在58℃分解为氨、二氧化碳、水Ag+ Ag2O 褐色立方晶体密度7.143g/cm3易溶于硝酸、氨水,难溶于水和乙醇在300℃迅速分解,日光中逐渐分解为银和氧AgOH 白色固体常温下是固体遇水会分解成黄褐色氧化银沉淀在空气中缓慢分解AgCl 白色立方晶体密度5.56g/cm3,熔点455℃,沸点1550℃难溶于水、乙醇或稀酸,溶于氰化钾溶液等露光变黑,还溶于氨水等,微溶于盐酸Ag2SO4 白色斜方晶体,见光变灰色密度5.45g/cm3,熔点652℃溶于氨水、硝酸、硫酸和热水,不溶于乙醇在1085℃分解AgNO3 无色透明斜方晶体密度4.352g/cm3,熔点212℃,沸点444℃易溶于水,极易溶于氨水,略溶于乙醚纯净空气中露光不变色,有机物存在时变Ag2CO3 新制为浅黄色粉未,久置色变暗密度6.077g/cm3溶于氨水、稀硝酸、KCN、硫代硫酸钠溶液不溶于水和醇,感光性很强Cu2+CuO 黑色密度立方体6.40g/cm3,三斜晶体6.45g/cm3不溶于水和乙醇,溶于稀酸、氰化钾溶液还溶于碳酸铵溶液,在氨水中缓慢溶解Cu(OH)2 结晶物呈天蓝色片状或针状密度3.368g/cm3不溶于水,溶于酸一般沉淀在70-90℃发黑,并分解为CuO和水CuCl2 棕黄结晶粉末,二水物绿斜方晶体密度3.054(二水2.38)g/cm3,熔点498℃溶于水、甲醇、乙醇等二水物有潮解性,110℃失去结晶水,有毒CuSO4 无水绿白色粉末,五水蓝三斜晶体密度3.606(五水2.286)g/cm3,熔点220℃溶于水和氨水,不溶于无水乙醇、液氨误食后会急性中毒,650℃分解成CuO和SO3Cu(NO3)2 六水物蓝色斜方晶体六水物密度2.074g/cm3、熔点114.5℃极易溶于水和乙醇六水物易潮解,加热时分解为氧化铜常为Cu2(OH)2CO3浅绿细粒的无定形粉末密度4.0g/cm3不溶于水和醇,溶于酸形成相应的铜盐有孔雀石矿物,200℃分解成黑色的氧化铜Al3+Al2O3 白色粉末密度3.9-4.0g/cm3,熔点2050℃沸点2980℃不溶于水,能渐渐溶于浓硫酸又称矾土,自然界有刚玉Al(OH)3 无臭无味的白色单斜晶体密度2.42g/cm3不溶于水和乙醇;溶于热盐酸、硫酸和碱类典型的两性氢氧化物。
在300℃时失却结晶水AlCl3 无色透明六角晶体密度2.44g/cm3,熔点194℃(0.25兆帕)溶于水、乙醇和乙醚,同时放出大量的热量在178℃升华,它的蒸气是缔合的双分子Al2(SO4)3 白色晶体,十八水物单斜晶体密度2.71(十八水1.69)g/cm3,熔点770℃溶于水,不溶于乙醇十八水物加热膨胀成海绵状物,在770℃分解Al(NO3)3 九水物无色斜方晶体九水物密度1.72g/cm3、熔点73.5℃易溶于水和乙醇九水物潮湿空气中潮解,150℃分解为氧化铝Fe3+ Fe203 红色或黑色无定形粉末密度Fe(OH)3 棕色絮凝沉淀密度3.4-3.9g/cm3FeCl3 棕黑色晶体或六角形薄片密度2.898g/cm3,熔Fe2(SO4)3 无水白黄粉末,九水黄绿晶体密度3.097(九水Fe(NO3)3 九水物淡紫色单斜晶体5.12-5.24g/cm3;熔点1560℃,并分解不溶于水,溶于盐酸天然有赤铁矿,用作颜料、催化剂等不溶于水、乙醇和乙醚,溶于酸加热时逐渐分解成氧化铁点282℃,沸点315℃溶于水、乙醇、甘油、乙醚和丙酮,难溶苯极易潮解,有六水物,达到沸点即分解2.1)g/cm3溶于水和乙醇,不溶于浓硫酸水溶液水解成氢氧化铁的溶胶体,变红褐色九水物密度1.684g/cm3、熔点47℃易溶于水,微溶于浓硫酸完全纯的无色Fe2+FeO 黑色粉末密度5.7g/cm3,熔点1420℃溶于酸,不溶于水和碱溶液用于制玻璃等Fe(OH)2 高纯为白色,常为浅绿色密度3.40g/cm3不溶于水新生成的会与水和氧气反应生成氢氧化铁FeCl2 绿灰晶体或六角形小片密度2.98g/cm3,熔点674℃,沸点1024℃溶于水、甲醇、乙醇和丙酮四水物是透明的浅天蓝色晶体FeSO4 无水物白粉末,七水物蓝单斜晶体密度3.4(七水1.90)g/cm3,七水物熔点64℃溶于水和甘油,几乎不溶于乙醇在空气中渐渐风化,并氧化而成黄褐色Fe(NO3)2 固体密度比水大溶于水,水溶液为浅绿色溶液通入氯气变为硝酸铁和氯化铁FeCO3 灰白色的结晶粉状物密度比水大不溶于水,溶于盐酸、硝酸和硫酸可由可溶亚铁盐与NaOH反应制得Zn2+ZnO 白色六角晶体或粉末密度5.606g/cm3,熔点1975℃溶于酸、NaOH和NH4Cl溶液;不溶于水或乙醇两性氧化物。
高温黄,冷却白。
1800℃升华Zn(OH)2 无定形白色粉末密度3.053g/cm3几乎不溶于水,溶于酸、碱溶液和氨水一种两性氢氧化物。
在125℃分解成氧化锌ZnCl2 白色潮解性晶体密度2.91g/cm3,熔点283℃,沸点732℃极易溶于乙醚,溶于乙醇在水中水解而生成白色氢氧化锌沉淀ZnSO4 无水物白粉末,七水物无色斜方晶体密度3.54(七水1.96)g/cm3,七水熔点100℃易溶于水置于干燥空气中易风化,740℃分解成氧化锌Zn(NO3)2 六水物为无色晶体六水物密度2.065g/cm3、熔点36.4℃溶于水和乙醇在105℃失去结晶水ZnCO3 白色结晶粉末密度4.42g/cm3不溶于水,溶于酸、碱溶液和氨水在300℃失去二氧化碳而成氧化锌Ba2+BaO 白色立方晶体密度5.72g/cm3,熔点1923℃,沸点2000℃溶于酸,与水作用生成氢氧化钡有毒,极易吸收水分及二氧化碳生成碳酸钡Ba(OH)2 白色粉末,八水物为单斜晶体密度4.5g/cm3;熔点408℃,八水物为78℃易溶于稀酸,微溶于水,难溶于乙醇和丙酮有毒,八水物780℃失全结晶水,易吸收CO2BaCl2 有毒,α型为无色单斜系晶体α型密度3.9g/cm3,熔点925℃,沸点1560℃溶于水,微溶盐酸和硝酸,难溶乙醇和乙醚β型无色立方系晶体,二水物无色单斜系晶体BaSO4 白色斜方晶体密度4.499g/cm3,熔点1580℃难溶于水和酸天然矿物有重晶石,有毒Ba(NO3)2 透明或白色立方晶体密度3.24g/cm3,熔点592℃溶于水,不溶于乙醇有毒,微具吸湿性BaCO3 白色斜方晶体密度4.43g/cm3,熔点1740℃不溶于冷水,难溶于沸水,溶于酸有毒。
在1450℃分解失去二氧化碳Ca2+ CaO 白色立方晶体或粉末密度3.35g/cm3,熔点2580℃,沸点2850℃易溶于酸,与水作Ca(OH)2 白色粉末密度2.24g/cm3微溶于水氢氧化钙的澄清水溶液称石灰水CaCl2 白色晶体,六水物无色六角晶体密度2.15g/cm3,熔点772℃,沸点1600℃CaSO4 白色晶体密度2.96g/cm3,熔点1450℃微溶于水有二水物(石膏或生石膏)和半水物(烧石膏)Ca(NO3)2 四水物为无色透明单斜晶体四水物密度1.9g/cm3、熔点45℃CaCO3 白色晶体或粉末密度2.70-2.95g/cm3极难溶于水,溶于酸放出二氧化碳用生成氢氧化钙露置于空气中逐渐吸收二氧化碳而成碳酸钙溶于水、氨水、乙醇、丙酮有潮解性,用作干燥剂(不可干燥乙醇和氨)易溶于水、液氨、丙酮、醇,不溶于浓硝酸用于制火柴、烟火、炸药、电子管等加热至825℃左右,分解成CaO和二氧化碳Mg2+ MgO 白色粉末,无臭无味密度3.58g/cm3,熔点2800℃,沸点3600℃溶于酸和铵盐水溶液,能逐渐从空气中吸收水分和二氧化碳Mg(OH)2 无色六方柱晶体密度2.36g/cm3,熔点280℃(真空分解)不溶于水,溶于酸和铵盐溶液在350℃分解而成氧化镁MgCl2 无色六角晶体,六水物白单斜晶体密度2.325g/cm3,熔点712℃,沸点1412℃溶于水,六水物溶于乙醇六水物加热失水和HCl成MgO,无水物易潮解MgSO4 无水物白粉末,七水物晶体或粉末密度2.66(七水1.68)g/cm3,熔点1124℃溶于水、甘油和乙醇在200℃失去全部结晶水,用于医药重泻药Mg(NO3)2 六水物为白色易潮解单斜晶体六水物密度1.4663g/cm3、熔点95℃溶于水、液氨和乙醇在330℃分解,有强氧化作用MgCO3 白色菱面晶体密度3.037g/cm3不溶于水和丙酮,溶于酸和二氧化碳水溶液天然产有菱镁矿K+K2O 固体常温下是固体极易溶于水,与水作用生成强碱氢氧化钾在空气中易吸收水分KOH 白色半透明晶体密度2.044g/cm3,熔点360℃,沸点1320℃溶于水时放强热,易溶于乙醇,也溶于乙醚极易从空气中吸收水分和CO2,生成碳酸钾KCl 无色立方晶体,结晶体常呈长柱状密度1.984g/cm3,熔点776℃,沸点1500℃溶于水,微溶甘油和乙醇,不溶乙醚和丙酮20℃时在水中的溶解度为34.7gK2SO4 无色或白色晶体或粉末,味苦而咸密度2.662g/cm3,熔点1069℃,沸点1689℃溶于水,不溶于乙醇、丙酮和二硫化碳用于医药缓泻剂,是很好水溶性钾肥KNO3 无色透明棱柱晶体或粉末密度2.109g/cm3,熔点334℃溶于水、甘油,不溶于无水乙醇和乙醚在400℃分解,在空气中不潮解K2CO3 白色结晶粉末密度2.428g/cm3,熔点891℃极易溶于水,不溶于乙醇和乙醚在湿空气中潮解,三水物100℃失结晶水Na+ Na2O 白色无定形片状或粉末密度2.27g/cm3,与水剧烈反应生成氢氧化钠并放出大量热与酸剧烈反应,与铵盐反应放出氨气NaOH 无色透明晶体密度2.13g/cm3,熔点318.4℃,沸点1390℃有潮解性、强碱性、强腐蚀性,易吸收CO2NaCl 白色立方晶体或细小结晶粉末密度2.165g/cm3,熔点801℃,溶于水和甘油,难溶于乙醇可由海水浓缩结晶而制得,是重要化工原料Na2SO4 无水白粉末,十水颗粒或粉状晶体密度2.698(十水1.464)g/cm3,熔点884℃不溶于乙醇,溶于水和甘油在空气中迅速风化,十水物熔点32.4NaNO3 无色六角晶系晶体密度2.257g/cm3,熔点308溶于水和甘油,难溶于乙醇在380℃分解,在空气中潮解Na2CO3 白色粉末或细粒密度2.532g/cm3,熔点851℃易溶于水,不溶于乙醇、乙醚吸湿性强,能因吸湿而结成硬快。
