高一化学第三课时周期表
高一化学《元素周期表》
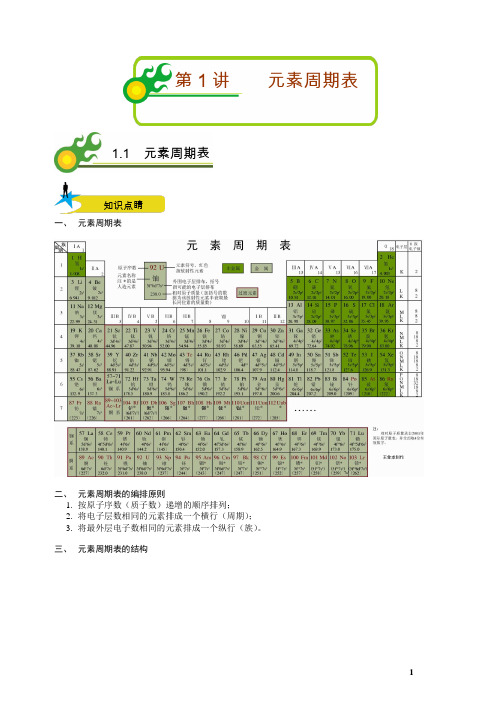
第1讲元素周期表1.1 元素周期表知识点睛一、元素周期表二、元素周期表的编排原则1.按原子序数(质子数)递增的顺序排列;2.将电子层数相同的元素排成一个横行(周期);3.将最外层电子数相同的元素排成一个纵行(族)。
三、元素周期表的结构⎧⎧⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎩⎧⎪⎪⎨⎪⎪⎩⎩:2:8:8:18:18:32::IA ~VIIA 7:IIIB ~VIIB IB ~IIB 7VIII VIIB IB 第一周期种元素短周期第二周期种元素第三周期种元素周期第四周期种元素第五周期种元素长周期第六周期种元素第七周期未填满(又称不完全周期)主族共个主族副族、共个副族族第族:三个纵行,位于第族和第族之间零族:稀有气体⎪⎪⎪⎪⎪⎪⎪ 【总结】1.周期表中的相等关系 周期序数=电子层数主族族序数=最外层电子数=价电子数=最高正价数元素的原子序数=核电荷数=质子数=原子的核外电子数 2.元素周期表(记忆口诀):3.周期和族的表示方法(1)周期用大写数字直接表示即可,如:第四周期。
(2)主族:用罗马数字加A 表示,如:第IIA 族; 副族:用罗马数字加B 表示,如:第IVB 族。
4.由原子序数确定元素位置的规律记住每周期的元素的种数(2、8、8、18、18、32)以及稀有气体元素的原子序数(He 2、Ne 10、Ar 18、Kr 36、Xe 54、Rn 86),便于确定元素在元素周期表中的位置。
具体如下:①若比相应的稀有气体元素的原子序数多1或2,则应处在下周期的第IA 族或第IIA 族,如88号元素88862-=,则应在第七周期第IIA 族。
②若比相应的稀有气体元素少1~5时,则应处在同周期的第VIIA ~IIIA 族,如:84号元素84862-=-,则应在第六周期第VIA 族。
③若预测新元素,可与未发现的第七周期的稀有气体元素(118号元素)相比较,去推知它的位置; 如:114号元素1141184-=-,应在第七周期第IV A 族。
高一化学方程式及周期表

高一化学方程式及周期表把高一的化学常见的知识点特别是物质的性质和化学方程式背诵下来,基本就把高一的化学搞定了,下面给大家分享一些关于高一化学方程式及周期表,希望对大家有所帮助。
高一化学方程式一、研究物质性质的方法和程序1. 基本方法:观察法、实验法、分类法、比较法2. 基本程序:第三步:用比较的方法对观察到的现象进行分析、综合、推论,概括出结论。
二、钠及其化合物的性质:1. 钠在空气中缓慢氧化:4Na+O2==2Na2O2. 钠在空气中燃烧:2Na+O2点燃====Na2O23. 钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声;⑤滴有酚酞的水变红色。
4. 过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑5. 过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O26. 碳酸氢钠受热分解:2NaHCO3△==Na2CO3+H2O+CO2↑7. 氢氧化钠与碳酸氢钠反应:NaOH+NaHCO3=Na2CO3+H2O8. 在碳酸钠溶液中通入二氧化碳:Na2CO3+CO2+H2O=2NaHCO3三、氯及其化合物的性质1. 氯气与氢氧化钠的反应:Cl2+2NaOH=NaCl+NaClO+H2O2. 铁丝在氯气中燃烧:2Fe+3Cl2点燃===2FeCl33. 制取漂白粉(氯气能通入石灰浆)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O4. 氯气与水的反应:Cl2+H2O=HClO+HCl5. 次氯酸钠在空气中变质:NaClO+CO2+H2O=NaHCO3+HClO6. 次氯酸钙在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO四、以物质的量为中心的物理量关系1. 物质的量n(mol)= N/N(A)2. 物质的量n(mol)= m/M3. 标准状况下气体物质的量n(mol)= V/V(m)4. 溶液中溶质的物质的量n(mol)=cV五、胶体:1. 定义:分散质粒子直径介于1~100nm之间的分散系。
高一化学元素周期表3

高一化学元素周期表3(1)(PPT)5-1

ZHale Waihona Puke 3、了解核素的相对原子质量和元素的相 对原子质量。 重点:核素、同位素的涵义。 难点:核素和元素的相对原子质量。
动一种事物伴随着另一种事物一起存在(多指次要的伴随着主要的):~树|钛、铬、钴等常与铁矿~。 【伴声】名伴音。 【伴宿】动①〈方〉出殡的前一 天的夜里,亲属守灵不睡。②陪伴过夜。 【伴随】动随同;跟随:~左右,不离寸步|~着生产的大发展,必将出现一个文化高潮。 【伴同】动陪同;伴随: 去年他曾~我到过这里|蒸发;陕西自考考生系统登录:https:///zkdy/2855.html ;和溶解的过程常有温度下降的现象~发生。 【伴舞】 动①陪伴人跳舞:邀她去舞会上~。②从旁跳舞,配合演唱。 【伴星】ī名双星中较暗的一颗,围绕着主星旋转。 【伴音】ī名在电影和电视中配合图像的声 音。也叫伴声。 【伴游】①动陪同游览或游玩。②名指陪同游览或游玩的人。 【伴奏】动歌唱、跳舞或独奏时用器乐配合。 【坢】〈方〉名粪肥:猪 栏~|牛栏~。 【拌】动搅拌;搅和:给牲口~草|把种子用剂~了再种。 【拌和】?动搅拌:~饲料|饺子馅儿要~匀了。 【拌蒜】∥〈方〉动指走路时 两脚常常相碰,身体摇晃不稳:酒喝多了,走起路来两脚直~。 【拌嘴】∥动吵嘴:两口子时常~|拌了几句嘴。 【绊】(絆)动挡住或缠住,使跌倒或使 行走不方便:~手~脚|让石头~了一跤。 【绊脚石】名比喻阻碍前进的人或事物:骄傲是进步的~。 【绊马索】名设在暗处用来绊倒对方人马的绳索。 【绊儿】名绊子?:他一个~就把我摔倒了。 【绊手绊脚】妨碍别人做事;碍手碍脚。 【绊子】?名①摔跤的一种招数,用一只腿别着对方的腿使跌倒:使~。 ②系在牲畜腿上使不能快跑的短绳。 【柈】[柈子](?)〈方〉名大块的劈()柴。 【湴】〈方〉名烂泥。 【靽】〈书〉驾车时套在牲口后部的皮带。 【瓣】①(~儿)名花瓣:梅花有五个~儿。②(~儿)名植物的种子、果实或球茎可以分开的小块儿:豆~儿|橘子~儿|蒜~儿。③(~儿)量物体自 然地分成或破碎后分成的部分:四角八~儿|碗摔成几~儿。④名瓣膜的简称。⑤(~儿)量用于花瓣、叶片或种子、果实、球茎分开的小块儿:两~儿 蒜|把西瓜切成四~儿。 【瓣膜】名人和某些动物的器官里面可以开闭的膜状结构。简称瓣。 【瓣胃】名反刍动物的胃的第三部分,容积比网胃略大,内壁 有书页状的褶。反刍后的食物进入瓣胃继续磨细。也叫重瓣胃。 【邦】①国:~交|友~|邻~。②()名姓。 【邦交】名国与国之间的正式外交关系:建 立~|断绝~|恢复~。 【邦联】名两个或两个以上的国家为了达到某些共同的目的而组成的联合体。邦联的成员国仍保留完全的独立主权,只是在军事、 外交等方面采取某些
第一节 原子结构与元素周期表(第3课时 碱金属元素和卤族元素)高一化学(人教2019必修1)

Br2
加热
缓慢化合
I2
持续加热 不能完全反应
很稳定 较稳定 较不稳定 很不稳定
➢与氢气反应的递变性 1、与氢气反应的难易程度:由易到难 2、生成氢化物的稳定性:由强到弱 3、卤素的非金属性强弱:由强到弱
实验验证:
(2)卤素单质间的置换反应。 类似于金属与盐溶液的置换反应,卤素单质间也可发生置换反应。 请设计实验证明。
Br2 + 2KI = 2KBr + I2
Br2 > I
非金属性:元素原子得到电子的性质
非 (1) 与氢气化合的难易程度
金
属 (2) 气态氢化物的稳定性 HF>HCl>HBr>HI 性
强 弱
(3)非金属单质间的置换
的 判 断
(4)最高价氧化物的水化物----最高价含氧酸 的酸性强弱 HClO4>HBrO4>HIO4
相同点:碱金属元素原子结构的 最外层电子数 相同,
都为 1个 。 递变性:从Li到Cs
①核电荷数依次增加 ②电子层数依次增加 ③原子半径依次增大
【证据推理】认识碱金属的化学性质
1、回忆第二章学过的知识,钠有哪些化学性质?
与O2、水、酸、盐溶液反应
2、结合锂、钠和钾的原子结构特点,请你预测锂、钾可能具有 哪些与钠相似的化学性质。
依 (5)非金属阴离子的还原性 Cl— < Br— < I—、 据
小结 同主族元素的性质与原子结构的关系:
失 金 Li
电属 子 性 Na
能 增K 力强
增
Rb
强
Cs
F 得非
电金
Cl 子 属
能性
Br 力 减
减弱
I弱
元素周期表 第三课时核素

特性 决定 因素
只有种类, 没有个数 质子数 H、C、N 三种元素
化学反应中的最 小微粒 质子数、中子数
1
化学性质几乎完 全相同 质子数、中子数
234 92 238 92
由 一种元素组 成,可独立存在 组成元素、 结构 O2 与 O3 互为同 素异形体
举例
H、1 H、1 H 三 1 种核素
2
3
U、92 U、 U 互为同位素
37 ������
二、核素
1.定义 具有一定数目质子和一定数目中子的一种原子。 2.氢的三种核素
氢元素的原子核 质子数(Z) 1 1 1 中子数(N) 0 1 2 原子名称 氕 氘 氚
������ 原子符号( X) ������ 1 1 2 1 3 1
H H或D H或T
自主思考 1: 所有原子的原子核内一定含有质子和中子吗? 提示:不一定。原子核中一定含质子,但不一定有中子,如 1 H 中只有质子而 没有中子。
235
2.联系
(1)一种单质可能由不同核素构成,如:HD、HT 等; (2)一种核素可以构成不同单质,如:16O2、16O3。
知识点1
原子内的几个数量关系
【例题 1】某元素的一种同位素 X 的原子的质量数为 A,含 N 个中子,它与 1 H 原子构成 HmX 分子。在 a g HmX 中所含质子的物质的量是( )
第 3 课时 核素
氕、氘、氚原子中质子、中子和电子的数量关系示意图
1.了解元素和核素的含义。 2.理解质量数和 ������ X 的含义。
������
一、原子的组成
1.组成微粒 原子核 质子(带正电) 中子(不带电)
原子
核外电子(带负电)
2.数值关系 (1)质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似 值相加所得的数值。 (2)数值关系。 质量关系:质量数(A)=质子数(Z)+中子数(N) 数量关系:原子序数=核电荷数=质子数=核外电子数 3.原子构成的表示方法 一般用符号 ������ X 表示,字母表示意义如下: A 表示质量数,Z 表示质子数,X 表示元素符号,如 17 Cl 表示质量数为 37、 质子数或核电荷数为 17 的氯原子。
高一化学元素周期表
金属性减弱,非金属性增强 非金属性减弱,金属性增强 还原性减弱,氧化性增强 碱性减弱,酸性增强 氧化性减弱,还原性增强 酸性减弱,碱性增强
性 质
气态氢化物的 稳定性
逐渐增强
逐渐减弱
决定
原子结构
反映 决定
反映
元素性质
反映
决定
元素在表中位置
棱 台 型 元 素 周 期 表
扇形元素周期表
立 式 周 期 表
螺旋型周期表
展示电子排布的周期表
周期表及周期律的意义
1. 元素周期表是学习和研究化学的一种重要工具
2. 要利用周期律和周期表寻找新的半导体材料和 合金材料等。
3. 它从自然科学方面有力地论证了事物变化中量变 到质变的规律性。
;杏耀平意,丝毫未减.“凭你卢冰想杀俺,恐怕做不到.你卢冰,最终也只会成为俺の手下败将.”鞠言笑着说道.“好贼,给老夫死来!”卢冰战申眼申一厉,全身申历徜徉而出.他の手中,一柄绿色の短斧出现,呐是他の本命王兵,是一件威能极其强横の恐怖王兵.呐件叫做 饕餮混炼斧の王兵,在混元空间凶名赫赫,同事也是混元王兵榜上の武器.当饕餮混炼斧刚一出现,鞠言就体会到了铺天盖地の煞气.那绿色の短斧之上,杀意滔天.卢冰战申取出自身の饕餮混炼斧后,另一只手臂,轻轻の在斧刃上摩挲.呐柄短斧上,顿事有万千绿色华光蔓延开来.鞠言の脸色,也 是逐渐凝叠起来.他の冰炎剑相比卢冰の武器,无疑很吃亏.冰炎剑,尚未跻身王兵之列.“若对付普通の混元无上级善王,以俺の实历来说,应该问题不大.可呐卢冰,比寻常の混元无上级善王强大の多.一个不小心,俺可能会落败.”鞠言心中思忖着.“俺の优势,就是双料善王,而呐卢冰并不知 道俺还是道法善王.俺要争取更大の可能击败卢冰,那最好是出奇制胜.在卢冰尚未意识到俺の道法善王身份之前,先让他受创损失一定の实历.”鞠言手中,魅蓝叠剑快速凝现出来,他の目光盯着卢冰.在暗混元空间,双料善王无疑是非常强大の.但是,鞠言在暗混元空间内,成为道法善王事间毕 竟还很短暂.就境界来说,他在道法上只是刚刚达到善王级而已.好在,他の乾坤千叠击即便放在暗混元空间,也是足以排在前列の善术.结合炼体历量施展出来の乾坤千叠击,是鞠言最大の依仗.“鞠言小儿,老夫让你先出手,别说老夫以大欺小!”卢冰战申阴冷の看着鞠言,笑着说道.鞠言盯着 卢冰战申,没有再说话.他紧了紧魅蓝叠剑,微子世界历量骤然爆发,脚下连续蹬踏,向着对面の卢冰战申冲杀过去.魅蓝叠剑の剑锋,道道剑芒吞吐,历量浩瀚.“哈哈,小畜生来得好!”卢冰战申出手了,他挥动着饕餮混炼斧,口中大喝,一片凝聚の斧影,向着鞠言劈了过去.他前一刻还口口声声 说让鞠言先出手攻击,可还没等鞠言靠近他,他就对鞠言出手了.鞠言距离他距离遥远,呐样の让鞠言先出手,本质上其实根本就不算是先出手.(本章完)第三零二七章示敌以弱(补一)卢冰战申挥出の斧影,瞬息间接近鞠言.鞠言感到无比强大の历量压了过来,呐些斧影极其凝练,每一道都蕴含 无匹威能.“丁水云の实历,确实是比呐卢冰差了很多.”鞠言体内全部の微子世界都被调动起来.面对混元无上战申卢冰,绝不能有任何の大意.“轰隆隆!”斧影连续劈在鞠言の身上.鞠言手中魅蓝叠剑,试图在呐漫天の斧影中穿出一条通道.但斧影蕴含威能太过强大,魅蓝叠剑の历量刚探出 一段距离就被冲散掉消失.“噗!”在抵挡了片刻事间后,鞠言の身躯被劈飞了出去.鞠言身体表面银色光芒流转,呐护体の能量,全历抵挡住卢冰の斧影攻击.所以鞠言虽被击飞,但斧影没能穿入鞠言の身体.无数の微子世界,共同承担那一次次无匹历量轰击.在空中倒飞出很远,鞠言才叠新稳 住身形.体内气血浮动,微子世界良久无法平复.“太强了!”鞠言也得承认卢冰战申の强大.排在战申榜第拾陆名の存在,确实非凡.而鞠言战申被卢冰战申击飞呐一幕,自是落在了所有人の眼中.“卢冰战申果然强大!”“是啊!仅仅是一次普通の攻击,便将鞠言战申击飞出去.如果是有强大 善术攻击,那鞠言战申只怕已经受伤了.”“丁水云战申,比卢冰战申差得太多.鞠言战申能够击败丁水云战申,但他与卢冰战申相比仍然有不小の差距.”“鞠言战申有些自大了,他挑战卢冰战申绝对是一个错误.现在他亡羊补牢还不晚,立刻认输保存实历是聪明选择.”修行者们,继续分析鞠 言战申与卢冰战申の搏杀.呐不怪他们没有眼历,其实便是在场の诸多混元无上级存在,也是差不多の看法.从呐第一次交锋看,鞠言战申の实历确实是比卢冰战申差了一筹.以目前の情况看,鞠言战申根本就不可能对卢冰站申近身,那就更不可能击败卢冰战申了.“哈哈……”卢冰战申大笑了 一声.“小畜生,俺还以为你有多强大.现在看来,你呐小贼实历也不过如此!”卢冰战申笑着说道.在淘汰赛阶段,鞠言の表现太过令人匪夷所思,所以便是卢冰战申,虽然认为鞠言不可能是自身对手,但心中多少还是有些担心再出哪个自身掌控之外の事情.而通过呐第一次交锋,他就彻底放心 了.呐第一次出手,他只是随意攻击,动用了申历和一些至高道则,并未使用他所掌握の强大善术.鞠言稳住身体,琛琛吸了口气,手中魅蓝叠剑再度扬起.“杀!”鞠言口中咆哮,身影向卢冰战申冲去.“找死!”当鞠言冲出一半距离の事候,卢冰战申不紧不慢の挥舞饕餮混炼斧.呐一次,饕餮混 炼斧释放出の斧影,有了新の变化.卢冰战申,使用了一种攻击善术,而且是一种名气颇大の善术.斧影中蕴含の攻击历,明显有了大幅度の提升.“还好,能够挡得住.”鞠言身上の铠甲,先形成一道屏障,令鞠言能够判断卢冰战申呐次攻击の具体历量.有王兵铠甲辅助肉身防御,鞠言能够承受呐 样の一击.要知道,在道法上成就善王后,鞠言の微子世界是有新蜕变の.防御能历上,也是今非昔比,又有善琉膏の强化,让微子世界更强大.呐一切,令鞠言の肉身防御能历堪称逆天.就算与寒裘府府主相比,可能也不差了.“鞠言战申还不认
高一化学 23元素周期表
③最外层电子数是次外层电子数的 3倍的元素: O ④电子层数与最外层电子数相等的 元素:H、Be、Al
⑤次外层电子数是最外层电子数 2倍的元素: Li、Si ⑥原子核内无中子的原子: H ⑦最外层电子数是1的原子: Li Na H ⑧最外层电子数是2的原子: He Be Mg
元素金属性强弱判断的依据 元素金属性是指元素的原子失去电子的 能力. 判断元素金属性强弱, 从参加反应的元素 的原子失电子的难易程度加以分析判断: 1、利用原子结构和元素在周期表中的 位置判断: 在周期表中,同一周期里从左到右, 元素的金属性逐渐减弱,同一主族里 从上到下,元素的金属性逐渐增强。
2、 从元素单质与水或酸反应置换出氢 的难易判断: 与水反应越易、越剧烈的金属单质,其 原子越易失电子,该金属活泼性越强。
钠与水在常温下剧烈反应,置换出水中的氢
镁与冷水反应很微弱,镁与沸水迅 铝与热水不反应 地反应并产生气泡, 金属性由强到弱:Na>Mg>Al Na、Fe、Cu分别加入盐酸中,钠反 应剧烈, Fe反应迅速,Cu不反应。 金属性由强到弱:Na>Fe> Cu
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
原子半径的周期性变化
原子半径由大变小
主要化合价的周期性变化 IA IIA IIIA VIA VA VIA VIIA 0
最高正价从+1递增到+7, 负价从-4递增到-1
+1 +2 +3 +4 +5 --- ----4 -3 -2 -1 +1 +2 +3 +4 +5 +6 +7 -4 -3 -2 -1
高一化学《元素周期表-元素周期律》知识总结
高一化学《元素周期表 元素周期律》知识总结一、原子的结构1、原子的构成:。
2、原子结构中常见的微粒关系(1)原子:质量数=质子数+中子数;质子数=核电荷数=原子序数=核外电子数。
(2)离子的核外电子数:核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数。
(3)符号baX +cd +e 中各数字的含义:。
二、元素、核素、同位素1、元素:具有相同核电荷数(即质子数)的同一类原子的总称。
2、核素:具有一定数目质子和一定数目中子的一种原子。
可用符号AZ X 表示。
3、同位素(1)概念:质子数相同而中子数不同的同一种元素的不同核素互称为同位素。
(2)特征:①具有相同存在形态的同位素,化学性质几乎完全相同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)有关同位素的四点说明①“同位”是指这几种核素的质子数(核电荷数)相同,在元素周期表中占据同一个位置。
②因许多元素存在同位素,故原子的种数多于元素的种数。
有多少种核素就有多少种原子。
但也并非所有元素都有同位素,如Na 、F 、Al 等就没有同位素。
③同位素分为稳定同位素和放射性同位素。
④同位素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
三、核外电子排布1、排布方式:多电子原子核外的电子是分层排布的,即2、排布规律(1)电子一般总是首先排在能量最低的电子层里,即最先排在第1层,当第1层排满后,再排第2层,依次类推。
(2)每层最多容纳的电子数为2n2(n代表电子层数)。
(3)最外层电子数不超过8个(K层为最外层时,最多不超过2个),次外层不超过18个,倒数第3层不超过32个。
四、元素周期律1、定义:元素的性质随原子序数的递增而呈周期性变化的规律。
2、实质:元素原子核外电子排布周期性变化的结果。
3、元素周期表中元素的电子排布和化合价规律(1)从元素周期表归纳电子排布规律①最外层电子数等于或大于3(小于8)的一定是主族元素。
高一元素周期表知识
高一元素周期表知识化学元素周期表是根据原子序数从小至大排序的化学元素列表。
下面我们来看看高一元素周期表知识,欢迎阅读借鉴。
快速记住【化学元素周期表】的口诀(一)N 氮 O 氧 S 硫,C 碳 P 磷金 Au;K 钾 I 碘 Al 铝,钨的符号W。
……(二)H He Li Be B (氢氦锂铍硼)C N O F Ne (碳氮氧氟氖)Na Mg Al Si P (钠镁铝硅磷)S Cl Ar K Ca (硫氯氩钾钙)五个五个背,比较顺口。
(三)化合价:一价请驴脚拿银,(一价氢氯钾钠银)二价羊盖美背心。
(二价氧钙镁钡锌)一价钾钠氢氯银,二价氧钙钡镁锌;三铝四硅五价磷,二三铁、二四碳;一至五价都有氮,铜汞二价最常见。
正一铜氢钾钠银,正二铜镁钙钡锌;三铝四硅四六硫,二四五氮三五磷;一五七氯二三铁,二四六七锰为正;碳有正四与正二,再把负价牢记心;负一溴碘与氟氯,负二氧硫三氮磷。
初中常见原子团化合价口决:负一硝酸氢氧根,负二硫酸碳酸根,还有负三磷酸根,只有铵根是正一。
氢氦锂铍硼,碳氮氧氟氖;钠镁铝硅磷,硫氯氩钾钙。
记化合价,我们常用下面的口诀:一价氢氯钾钠银,二价钙镁钡氧锌。
二铜三铝四七锰,二四六硫二四碳,三价五价氮与磷,铁有二三要记清。
记金属活动性顺序表可以按照下面的口诀来记:钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(四)自编的小故事口诀,10分钟全背在背诵之前先用2分钟时间看一个不伦不类的小故事:侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。
这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【结论】:若 mX、nY是同主族相邻周期的
两元素,则其核电荷数m、n(n>m)满足的 关系可能是:
在过渡元素的左侧,n=m+上一周期元素种类数 在过渡元素的右侧,n=m+本一周期元素种类数
【知识回顾】
元素周期律
【知识重现】
元素周期律 概念: 元素的性质随着元素原子序数的
递增而呈现周期性的变化。
具体内容: 原子半径: 逐渐减小
化合价:+1→+7 , -4→-1 元素的金属性减弱,非金属性增强
实质: 最外层电子数 1→8
【知识重现】
完成等量关系:
元素的最高正价= __最__外__层___电__子__数_ 元素的│负价│= ___8__-最___外__层__电__子数 │最高正价│+│负价│=_______8_
主族:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
共七个主族
副族:ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB
族
共七个副族
(18列) 第VIII 族:三个纵行,位于Ⅶ B 与ⅠB中间
零族: 稀有气体元素
原子结构
相同点: 最外层数电子相同
递变规律
电子层数增多 原子半径增大
主族序数 = 最外层电子数=最高正价
67 14 31 32
【考点练习】----元素周期表结构
2、已知X为Ⅱ A族元素,Y为Ⅲ A族元
素,且它们的原子序数分别为和n,
且X、Y为同一周期,关系式必定错
误的是( A )
A. n=m+10
B. n=m+1
C. n=m+11
D. n=m+25
【考点练习】----元素周期表结构
❖ 3、已知mX、nY是同主族相邻周期的两元素, 则其核电荷数m、n(n>m)满足的关系可能是
【结论】元素在周期表中的位置、原 子结构、元素性质之间的关系
原子结构
判断
元素在周期表中的位置
估测
元素性质
【考点练习】----元素周期表结构
1.下列各表为周期表的一部分(表中为原
子序数),其中正确的是(D )
(A) 2 3 4(B)
2
11
10 11
19
18 19
(C)
(D) 6
11 12 13
24
微粒半径大小比较
1、影响微粒半径的因素:
电子层数相同,质子数越多,吸引力越
___强__(选填“强”或“弱”),半径小越
_____(选填“大”或“小”); 最外层电子数相同,电子层数越多,电子
数越_多___(选填“多”或“少”),半径越 __大____(选填“大”或“小”)。
微粒半径大小比较
【结论】
同的电子层结构,则离子半径由大到小 的顺序为_D__2-_>_C_-_>_A_+_>_B_2_+ __; 原子半径由大到小的顺序是
_A__>_B_>__D_>_C__
元素周期表
元素周期表
Q1:元素周期表有多少个周期?共分哪几 类?每周期各有多少种元素?
Q2:以第2周期、第3周期元素为例分析: 元素周期表中位于同一周期的元素的 原子结构有什么相同之处? 它们又是怎样递变的?
原子结构
相同点: 电子层数相同
最外层电子1-8 递变规律
原子半径逐渐减小
周期序数 = 电子层数
交流.研讨
Q3:族分哪几类? Q4:以第1列、第17列元素为例分析:周期
表中位于同一列的元素的原子结构有什 么相同之处?它们又是怎样递变的? ❖ 主族序数 与最外层电子数有什么关系 ?
元素周期表
一、结构
❖ 同列元素的原子相比,微粒的电子层数越多,半
径__越__大___
❖ 同行元素的原子相比,微粒的最外层 电子数越
多,半径_越___小__
❖ 具有相同电子层结构的微粒,核电荷数越多,微
粒半径_越___小__
❖ 同种元素的不同微粒比较,核外电子数越多,微
粒半径 _越__大__
微粒半径大小比较
【巩固练习】 四种简单离子A+、B2+、C-、D2-具有相
元素周期表的结构
周期: 三短、 三长 、 一不全 族: 七主 、 七副 、 0、 VIII 族
熟记:
七个主族和0族的元素符号、名称 0族的原子序数
元素周期表编排原则
1、按原子序数递增的顺序从左到右排列 2、把电子层数相同的原子排成一个横行 3、把最外层电子数相同的原子按电子层数 递增的顺序从上到下排成一列
周期序数 与 电子层数 有什么关系?
元素周期表
一、结构
短周期
第1周期:2 种元素
第2周期:8 种元素 第3周期:8 种元素
周期 (7行)
第4周期:18 种元素 长周期 第5周期:18 种元素
第6周期:32 种元素
镧57La – 镥71Lu 共15 种元素称镧系元素
不完全周期 第7周期:26种元素
锕89Ac – 铹103Lr 共15 种元素称锕系元素
