爆炸极限计算ppt课件
混合气体的爆炸极限怎么计算

爆炸极限L=1/(Y1/L1+Y2/L2+Y3/L3)其中:Y1、Y2、Y3代表混合物中组成L1、L2、L3代有混合气体各组份相应的爆炸极限求混合物爆炸下限(或上限)时,L1、L2、L3分别为各纯组份的爆炸下限(或下限);爆炸极限的计算1 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中0.55——常数;c0——爆炸气体完全燃烧时化学理论体积分数。
若空气中氧体积分数按20.9%计,c0可用下式确定c0=20.9/(0.209 n0)式中n0——可燃气体完全燃烧时所需氧分子数。
如甲烷燃烧时,其反应式为CH4 2O2→CO2 2H2O此时n0=2则L下=0.55×20.9/(0.209 2)=5.2由此得甲烷爆炸下限计算值比实验值5%相差不超过10%。
2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:2.1 莱?夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱?夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1 P2 P3)/(P1/LEL1 P2/LEL2 P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1 P2 P3)/(P1/UEL1 P2/UEL2 P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理?查特里公式理?查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1 V2/L2 …… Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L 下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
爆炸极限的计算-6页文档资料

爆炸与防爆前言(1)爆炸是物质的一种非常急剧的物理、化学变化,在变化过程中,伴有物质所含能量的快速转变,即变为该物质本身、变化产物或周围介质的压缩能和运动能。
其重要特征是大量能量在有限的时间里突然释放或急剧转化,这种能量能在有限的时间和有限的体积内大量积聚造成高温高压等非寻常状态,对邻近介质形成急剧的压力突跃和随后的复杂运动,显示出不寻常的移动或破坏效应。
在石油、化工等行业生产过程中,从原料到成品,使用、产生的易燃易爆物质很多,一旦发生爆炸事故,常会带来非常严重的后果,造成巨大的经济损失和人员伤害,譬如泵房垮塌、油罐爆炸着火、装置报废、人员伤亡。
正因如此,控制爆炸是石油、化工等行业的重中之重。
要科学有效地控制气体、粉尘爆炸,就不能不对爆炸极限有一个正确的理解。
爆炸极限的定义(2)可燃性气体或蒸气与助燃性气体的均匀混合系在标准测试条件下引起爆炸的浓度极限值,称为爆炸极限。
助燃性气体可以是空气、氧气或辅助性气体。
一般情况提及的爆炸极限是指可燃气体或蒸气在空气中的浓度极限,能够引起爆炸的可燃气体的最低含量称为爆炸下限Low Explosion - Level(LEL),最高浓度Upper Explosion - Level称为爆炸上限(UEL)。
影响爆炸极限的因素(3)1 可燃气体1.1 混合系的组分不同,爆炸极限也不同。
1.2 同一混合系,由于初始温度、系统压力、惰性介质含量、混合系存在空间及器壁材质以及点火能量的大小等都能使爆炸极限发生变化。
a.温度影响因为化学反应与温度有很大的关系,所以,爆炸极限数据必定与混合物规定的初始温度有关。
初始温度越高,引起的反应越容易传播。
一般规律是,混合系原始温度升高,则爆炸极限范围增大即下限降低,上限增高。
但是,目前,还没有大量的系统实验结果。
因为系统温度升高,分子内能增加,使原来不燃的混合物成为可燃、可爆系统。
初始温度对混合物爆炸极限的影响示例见表1。
b.压力影响系统压力增高,爆炸极限范围也扩大,明显体现在爆炸上限的提高。
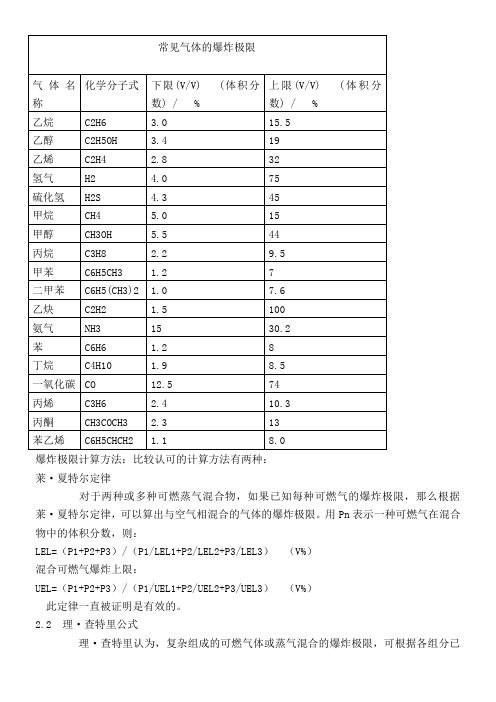
常见气体的爆炸极限及爆炸极限计算公式

爆炸极限计算方法:比较认可的计算方法有两种:莱·夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
2.2 理·查特里公式理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369德迈数据计算:废气风量:19000Nm3/h废气中可燃性成分:戊烷7kg/h;甲醛29kg/h,其它约5kg/h(当甲醛计算)戊烷体积=7000/72*22.4/1000=2.178 Nm3/h 体积分数=2.178/19000=0.012% 甲醛体积分数=25.39 Nm3/h 体积分数=25.39/19000=0.134% 混合气体中可燃气体的总体积分数=0.146%由公式:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)得:混合气体的爆炸下限=0.146%/(0.012/1.7+0.134/7)=5.57%结论:混合气体中可燃气体的总体积分数为0.146%,混合气体的爆炸下限为5.57%,可燃气体浓度是爆炸下限浓度的1/38,放心烧吧!。
常见气体的爆炸极限及爆炸极限计算公式

常见气体的爆炸极限及爆炸极限计算公式Document number:NOCG-YUNOO-BUYTT-UU986-1986UT爆炸极限计算方法:比较认可的计算方法有两种:莱·夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)混合可燃气爆炸上限:UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)此定律一直被证明是有效的。
理·查特里公式理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=%)、乙烷15%(L下=%)、丙烷4%(L下=%)、丁烷1%(L下=%)求爆炸下限。
Lm=100/(80/5+15/+4/+1/)=德迈数据计算:废气风量:19000Nm3/h废气中可燃性成分:戊烷7kg/h;甲醛29kg/h,其它约5kg/h(当甲醛计算)戊烷体积=7000/72*1000=h体积分数=19000=%甲醛体积分数=h体积分数=19000=%由公式:LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)得:混合气体的爆炸下限=%/(+7)=%结论:混合气体中可燃气体的总体积分数为%,混合气体的爆炸下限为%,可燃气体浓度是爆炸下限浓度的1/38,放心烧吧!。
爆炸极限计算

爆炸极限计算爆炸反应当量浓度、爆炸下限和上限、多种可燃气体混合物的爆炸极限计算方法如下:1爆炸反应当量浓度;爆炸性混合物中的可燃物质和助燃物质的浓度比例,在恰好能发生完全的化合反应时,则爆炸所析出的热量最多,所产生的压力也最大;实际的反应当量浓度稍高于计算的反应当量浓度,这是因为爆炸性混合物通常含有杂质;可燃气体或蒸气分子式一般用CαHβOγ表示,设燃烧1mol气体所必需的氧摩尔数为n,则燃烧反应式可写成:C αHβOγ+nO2→生成气体按照标准空气中氧气浓度为20.9%,则可燃气体在空气中的化学当量浓度X%,可用下式表示:可燃气体在氧气中的化学当量浓度为Xo%,可用下式表示:也可根据完全燃烧所需的氧原子数2n的数值,从表1中直接查出可燃气体或蒸气在空气或氧气中的化学当量浓度;其中;可燃气体蒸气在空气中和氧气中的化学当量浓度2爆炸下限和爆炸上限;各种可燃气体和燃性液体蒸气的爆炸极限,可用专门仪器测定出来,或用经验公式估算;爆炸极限的估算值与实验值一般有些出入,其原因是在计算式中只考虑到混合物的组成,而无法考虑其他一系列因素的影响,但仍不失去参考价值;1根据完全燃烧反应所需的氧原子数估算有机物的爆炸下限和上限,其经验公式如下;爆炸下限公式:体积爆炸上限公式:体积式中 L下——可燃性混合物爆炸下限;L上——可燃性混合物爆炸上限;n——1mol可燃气体完全燃烧所需的氧原子数;某些有机物爆炸上限和下限估算值与实验值比较如表2:表2 石蜡烃的化学计量浓度及其爆炸极限计算值与实验值的比较从表中所列数值可以看出,实验所得与计算的值有一定差别,但采用安全系数后,在实际生产工作中仍可供参考;2根据化学当量浓度计算爆炸极限和爆炸性混合气完全燃烧时的化学当量浓度,可以估算有机物的爆炸下限和上限;计算公式如下:此计算公式用于链烷烃类,其计算值与实验值比较,误差不超过10%;例如甲烷爆炸极限的实验值为5%~15%,与计算值非常接近;但用以估算H2、C2H2以及含N2、Cl2等可燃气体时,出入较大,不可应用;3多种可燃气体组成混合物的爆炸极限;由多种可燃气体组成爆炸混合气的爆炸极限,可根据各组分的爆炸极限进行估算,其计算公式如下:式中 Lm——爆炸性混合气的爆炸极限%;L 1、L2、L3、Ln——组成混合气各组分的爆炸极限%;V 1、V2、V3、…Vn——各组分在混合气中的浓度%;V 1+V2+V3+…Vn=100该公式用于煤气、水煤气、天然气等混合气爆炸极限的计算比较准确,而对于氢与乙烯、氢与硫化氢、甲烷与硫化氢等混合气及二硫化碳的混合气体,则计算的误差较大,不得应用;——摘自安全科学技术百科全书中国劳动社会保障出版社,2003年6月出版explosive limit 可燃性气体或蒸气与助燃性气体形成的均匀混合系在标准测试条件下引起爆炸的浓度极限值;助燃性气体可以是空气、氧气或其他助燃性气体;一般情况提及的爆炸极限是指可燃气体或蒸气在空气中的浓度极限;能够引起爆炸的可燃气体的最低含量称为爆炸下限;最高浓度称为爆炸上限;混合系的组分不同,爆炸极限也不同;同一混合系,由于初始温度、系统压力、惰性介质含量、混合系存在空间及器壁材质以及点火能量的大小等的都能使爆炸极限发生变化;一般规律是:混合系原始温度升高,则爆炸极限范围增大,即下限降低、上限升高;因为系统温度升高,分子内能增加,使原来不燃的混合物成为可燃、可爆系统;系统压力增大,爆炸极限范围也扩大,这是由于系统压力增高,使分子间距离更为接近,碰撞几率增高,使燃烧反应更易进行;压力降低,则爆炸极限范围缩小;当压力降至一定值时,其上限与下限重合,此时对应的压力称为混合系的临界压力;压力降至临界压力以下,系统便不成为爆炸系统个别气体有反常现象;混合系中所含惰性气体量增加,爆炸极限范围缩小,惰性气体浓度提高到某一数值,混合系就不能爆炸;容器、管子直径越小,则爆炸范围就越小;当管径火焰通道小到一定程度时,单位体积火焰所对应的固体冷却表面散出的热量就会大于产生的热量,火焰便会中断熄灭;火焰不能传播的最大管径称为该混合系的临界直径;点火能的强度高、热表面的面积大、点火源与混合物的接触时间不等都会使爆炸极限扩大;除上述因素外,混合系接触的封闭外壳的材质、机械杂质、光照、表面活性物质等都可能影响到爆炸极限范围;可燃性蒸气的爆炸极限值是由可燃液体表面产生的蒸气浓度决定的;对于可燃液体而言,爆炸下限浓度对应的闪点温度又可以称为爆炸下限温度;爆炸上限浓度对应的液体温度又可以称为爆炸上限温度;混合气体、蒸汽的爆炸极限可以根据理.查特里法则计算L下= 1/N1/L1+N2/L2.....100%L上= 1/N1/L1+N2/L2.....100%理查特公式是对两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算,它是根据各组分已知的爆炸极限来计算的,适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物;Lm=100/V1/L1+V2/L2+……+Vn/Ln式中Lm——混合气体爆炸极限,%;L1、L2、L3——混合气体中各组分的爆炸极限,%;V1、V2、V3——各组分在混合气体中的体积分数,%;•爆炸与防爆:爆炸极限的计算42008/6/241 根据化学理论体积分数近似计算爆炸气体完全燃烧时,其化学理论体积分数可用来确定链烷烃类的爆炸下限,公式如下:L下≈0.55c0式中——常数;c0——爆炸气体完全燃烧时化学理论体积分数;若空气中氧体积分数按%计,c0可用下式确定c0=+n0式中 n0——可燃气体完全燃烧时所需氧分子数;如甲烷燃烧时,其反应式为CH4+2O2→CO2+2H2O此时n0=2则L下=×+2=由此得甲烷爆炸下限计算值比实验值5%相差不超过10%;2 对于两种或多种可燃气体或可燃蒸气混合物爆炸极限的计算目前,比较认可的计算方法有两种:莱·夏特尔定律对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限;用Pn表示一种可燃气在混合物中的体积分数,则:LEL=P1+P2+P3/P1/LEL1+P2/LEL2+P3/LEL3 V%混合可燃气爆炸上限:UEL=P1+P2+P3/P1/UEL1+P2/UEL2+P3/UEL3 V%此定律一直被证明是有效的;理·查特里公式理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已知的爆炸极限按下式求之;该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物;Lm=100/V1/L1+V2/L2+……+Vn/Ln式中Lm——混合气体爆炸极限,%;爆炸极限的意义可燃物质、蒸气和与空气或氧气必须在一定的浓度范围内均匀混合,形成预混气,遇着火源才会发生爆炸,这个浓度范围称为爆炸极限,或爆炸浓度极限;例如与空气混合的爆炸极限为%~80%;可燃性混合物能够发生爆炸的最低浓度和最高浓度,分别称为和爆炸上限,这两者有时亦称为着火下限和着火上限;在低于爆炸下限时不爆炸也不着火;在高于爆炸上限不会发生爆炸,但会着火;这是由于前者的可燃物浓度不够,过量空气的冷却作用,阻止了火焰的蔓延;而后者则是空气不足,导致火焰不能蔓延的缘故;当可燃物的浓度大致相当于反应当量浓度时,具有最大的爆炸威力即根据完全燃烧反应方程式计算的浓度比例;影响爆炸极限的因素混合系的组分不同,爆炸极限也不同;同一混合系,由于初始温度、系统压力、惰性介质含量、混合系存在空间及器壁材质以及点火能量的大小等的都能使爆炸极限发生变化;一般规律是:混合系原始温度升高,则爆炸极限范围增大,即下限降低、上限升高;因为系统温度升高,分子内能增加,使原来不燃的混合物成为可燃、可爆系统;系统压力增大,爆炸极限范围也扩大,这是由于系统压力增高,使分子间距离更为接近,碰撞几率增高,使燃烧反应更易进行;压力降低,则爆炸极限范围缩小;当压力降至一定值时,其上限与下限重合,此时对应的压力称为混合系的临界压力;压力降至临界压力以下,系统便不成为爆炸系统个别气体有反常现象;混合系中所含惰性气体量增加,爆炸极限范围缩小,惰性气体浓度提高到某一数值,混合系就不能爆炸;容器、管子直径越小,则爆炸范围就越小;当管径火焰通道小到一定程度时,单位体积火焰所对应的固体冷却表面散出的热量就会大于产生的热量,火焰便会中断熄灭;火焰不能传播的最大管径称为该混合系的临界直径;点火能的强度高、热表面的面积大、点火源与混合物的接触时间不等都会使爆炸极限扩大;除上述因素外,混合系接触的封闭外壳的材质、机械杂质、光照、表面活性物质等都可能影响到爆炸极限范围;爆炸极限与可燃物的危害可燃性混合物的爆炸极限范围越宽、爆炸下限越低和爆炸上限越高时,其爆炸危险性越大;这是因为爆炸极限越宽则出现爆炸条件的机会就多;爆炸下限越低则可燃物稍有泄漏就会形成爆炸条件;爆炸上限越高则有少量空气渗入容器,就能与容器内的可燃物混合形成爆炸条件;应当指出,可燃性混合物的浓度高于爆炸上限时,虽然不会着火和爆炸,但当它从容器或管道里逸出,重新接触空气时却能燃烧,仍有发生着火的危险;爆炸极限的表示爆炸极限的单位气体或蒸气的爆炸极限的单位,是以在混合物中所占体积的百分比%来表示的,如氢与空气混合物的爆炸极限为4%~75%;可燃粉尘的爆炸极限是以混合物中所占体积的质量比g/m^3来表示的,例如铝粉的爆炸极限为40g/m^3;可燃性蒸气的爆炸极限值是由可燃液体表面产生的蒸气浓度决定的;对于可燃液体而言,爆炸下限浓度对应的闪点温度又可以称为爆炸下限温度;爆炸上限浓度对应的液体温度又可以称为爆炸上限温度;可燃气体或蒸气分子式爆炸极限%下限上限氢气H2 75氨NH3 27一氧化碳CO甲烷CH4 14乙烷C2H6乙烯C2H4 32乙炔C2H2 81苯C6H6甲苯C7H8环氧乙烷C2H4O乙醚C2H5O乙醛CH3CHO丙酮CH32CO乙醇C2H5OH甲醇CH3OH 36醋酸乙酯C4H8O2 9常用可燃气体爆炸极限数据表LEL/UEL及毒性物质名称分子式爆炸浓度V% 毒性下限LEL 上限UEL甲烷CH4 5 15 ——乙烷C2H6 3丙烷C3H8丁烷C4H10戊烷液体C5H12己烷液体C6H14庚烷液体CH3CH25CH3辛烷液体C8H18 1乙烯C2H4 36丙烯C3H6 2丁烯C4H8 10丁二烯C4H6 2 12 低毒乙炔C3H4 100环丙烷C3H6煤油液体C10-C16 5城市煤气 4液化石油气 1 12汽油液体C4-C12松节油液体C10H16苯液体C6H6 中等甲苯C6H5CH3 低毒氯乙烷C2H5CL 中等氯乙烯C2H3CL 33氯丙烯C3H5CL 中等二氯乙烷CLCH2CH2CL 16 高毒四氯化碳CCL4 轻微麻醉三氯甲烷CHCL3 中等环氧乙烷C2H4O 3 100 中等甲胺CH3NH2 中等乙胺CH3CH2NH2 14 中等苯胺C6H5NH2 11 高毒二甲胺CH32NH 中等乙二胺H2NCH2CH2NH2 低毒甲醇液体CH3OH 36乙醇液体C2H5OH 19正丁醇液体C4H9OH甲醛HCHO 7 73乙醛C2H4O 4 60丙醛液体C2H5CHO 17乙酸甲酯CH3COOCH3 16乙酸CH3COOH 16 低毒乙酸乙酯CH3COOC2H5 11丙酮C3H6O丁酮C4H8O 10氰化氢氢氰酸HCN 40 剧毒丙烯氰C3H3N 28 高毒氯气CL2 刺激氯化氢HCL氨气NH3 16 25 低毒硫化氢H2S 神经二氧化硫SO2 中等二硫化碳CS2 50臭氧O3 刺激一氧化碳CO 剧毒氢H2 4 75本表数值来源基本上以SH3063-1999 石油化工企业可燃气体和有毒气体检测报警器设计规范为主,并与常用化学危险品安全手册进行了对照,补充;。
常见气体的爆炸极限及爆炸极限计算公式
爆炸极限计算方法:比较认可的计算方法有两种:
莱·夏特尔定律
对于两种或多种可燃蒸气混合物,如果已知每种可燃气的爆炸极限,那么根据莱·夏特尔定律,可以算出与空气相混合的气体的爆炸极限。
用Pn表示一种可燃气在混合物中的体积分数,则:
LEL=(P1+P2+P3)/(P1/LEL1+P2/LEL2+P3/LEL3)(V%)
混合可燃气爆炸上限:
UEL=(P1+P2+P3)/(P1/UEL1+P2/UEL2+P3/UEL3)(V%)
此定律一直被证明是有效的。
2.2 理·查特里公式
理·查特里认为,复杂组成的可燃气体或蒸气混合的爆炸极限,可根据各组分已
知的爆炸极限按下式求之。
该式适用于各组分间不反应、燃烧时无催化作用的可燃气体混合物。
Lm=100/(V1/L1+V2/L2+……+Vn/Ln)
式中Lm——混合气体爆炸极限,%;
L1、L2、L3——混合气体中各组分的爆炸极限,%;
V1、V2、V3——各组分在混合气体中的体积分数,%。
例如:一天然气组成如下:甲烷80%(L下=5.0%)、乙烷15%(L下=3.22%)、丙烷4%(L下=2.37%)、丁烷1%(L下=1.86%)求爆炸下限。
Lm=100/(80/5+15/3.22+4/2.37+1/1.86)=4.369。
爆炸极限、压力和温度的计算

五、建筑灭火器配置(一)、建筑灭火器适用范围度危险场所划分扑救A类火灾应选用水型、泡沫、磷酸铵盐干粉、卤代烷型灭火器。
扑救B类火灾应选用干粉、泡沫、卤代烷、二氧化碳型灭火器。
扑救极性溶剂B类火灾不得选用化学泡沫灭火器。
扑救C类火灾应选用干粉、卤代烷、二氧化碳、干粉型灭火器。
扑救A、B、C类和带电火灾应选用磷酸铵盐干粉、卤代烷型灭火器。
扑救D类火灾的灭火器材应由设计部门和当地公安消防监督部门协商解决。
危险场所分为严重危险级、中危险级、轻危险级。
(二)、建筑灭火器的配置基准与设置灭火器配置场所的火灾种类;灭火有效程度;对保护物品的污损程度;设置点的环境温度;使用灭火器人员的素质。
(三)、建筑灭火器的灭火级别与选择灭火器的灭火级别应由数字和字母组成,数字应表示灭火级别的大小,字母(A或B)、应表示灭火级别的单位及适用扑救火灾的种类。
(四)、建筑灭火器的使用与维护灭火器应设置在明显和便于取用的地点,且不得影响安全疏散。
灭火器应设置稳固,其铭牌必须朝外。
手提式灭火器宜设置在挂钩、托架上或灭火器箱内,其顶部离地面高度应小于1.50 m;底部离地面高度不宜小于0.15 m。
灭火器不应设置在潮湿或强腐蚀性的地点,当必须设置时,应有相应的保护措施。
设置在室外的灭火器,应有保护措施。
灭火器不得设置在超出其使用温度外范围的地点。
灭火器的使用温度范围应符合规范规定。
在卤代烷灭火器定期维修、水压试验或作报废处理时,必须使用经国家认可的卤代烷回收卤代烷灭火剂。
已配置在工业与民用建筑及人防工程内的所有卤代烷灭火器,除用于扑灭火灾外,不得随意向大气中排放。
在非必要配置卤代烷灭火器的场所已配置的卤代烷灭火器,当其超过规定的使用年限或达不到产品质量标准要求时,应将其撤换,并应作报废处理。
六、初起火灾的扑救与人员疏散逃生(一)、初起火灾扑救的方法和原则发生火灾后,要及时使用本单位(地区)、的灭火器材、设备进行扑救。
有手动灭火系统的应立即启动。
爆炸极限理论与计算

第五节爆炸极限理论与计算一、爆炸极限理论可燃气体或蒸气与空气的混合物,并不是在任何组成下都可以燃烧或爆炸,而且燃烧(或爆炸)的速率也随组成而变。
实验发现,当混合物中可燃气体浓度接近化学反应式的化学计量比时,燃烧最快、最剧烈。
若浓度减小或增加,火焰蔓延速率则降低。
当浓度低于或高于某个极限值,火焰便不再蔓延。
可燃气体或蒸气与空气的混合物能使火焰蔓延的最低浓度,称为该气体或蒸气的爆炸下限;反之,能使火焰蔓延的最高浓度则称为爆炸上限。
可燃气体或蒸气与空气的混合物,若其浓度在爆炸下限以下或爆炸上限以上,便不会着火或爆炸。
爆炸极限一般用可燃气体或蒸气在混合气体中的体积百分数表示,有时也用单位体积可燃气体的质量(kg·m—3)表示。
混合气体浓度在爆炸下限以下时含有过量空气,由于空气的冷却作用,活化中心的消失数大于产生数,阻止了火焰的蔓延。
若浓度在爆炸上限以上,含有过量的可燃气体,助燃气体不足,火焰也不能蔓延。
但此时若补充空气,仍有火灾和爆炸的危险。
所以浓度在爆炸上限以上的混合气体不能认为是安全的。
燃烧和爆炸从化学反应的角度看并无本质区别。
当混合气体燃烧时,燃烧波面上的化学反应可表示为A+B→C+D+Q(4—1)式中A、B为反应物;C、D为产物;Q为燃烧热。
A、B、C、D不一定是稳定分子,也可以是原子或自由基。
化学反应前后的能量变化可用图4—4表示。
初始状态Ⅰ的反应物(A+B)吸收活化能正达到活化状态Ⅱ,即可进行反应生成终止状态Ⅲ的产物(C+D),并释放出能量W,W=Q+E。
图4-4 反应过程能量变化假定反应系统在受能源激发后,燃烧波的基本反应浓度,即反应系统单位体积的反应数为n,则单位体积放出的能量为nW。
如果燃烧波连续不断,放出的能量将成为新反应的活化能。
设活化概率为α(α≤1),则第二批单位体积内得到活化的基本反应数为anW/E,放出的能量为。
αnW2/E。
后批分子与前批分子反应时放出的能量比β定义为燃烧波传播系数,为现在讨论β的数值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
100
3.2
10.0
(2)初始压力
一般压力增大,爆炸极限扩大 压力降低,则爆炸极限范围缩小 待压力降至某值时,其下限与上限重合,将此时的最低压力称为
爆炸的临界压力。若压力降至临界压力以下,系统便成为不爆炸
5
图4-21 不同压力下甲烷爆炸极限 1.火焰向下传播,圆筒容器尺寸为 37×8cm;2.端部或中心点,球形 容器;3.火焰向下传播,圆筒容器
3
4.4.2爆炸极限的影响因素
(1)初始温度
爆炸性混合物的初始温度越高,则爆炸极限范围越大,即爆炸下 限降低而爆炸上限增高
图4-19 温度对甲烷爆炸极限的影响
图4-20 温度对氢气爆炸极限的影响
4
温度对丙酮爆炸极限的影响
混合物温度,℃
爆炸下限,%
爆炸上限,%
0
4.2
8.0
50
4.0
9.8
x下=
V V'
100%
V
100%
V1 100 V2 100 V3 100 Vi 100
惰化能力:
CCl4 > CO2 > H2O > N2 > He > Ar
图4-23 各种惰性气体对甲烷爆炸极限的影 响
7
(4)容器
容器管子直径越小、爆炸极限范围越 小。
同一可燃物质,管径越小,其火焰蔓 延速度亦越小。当管径(或火焰通道) 小到一定程度时,火焰即不能通过。 这一间距称最大灭火间距,亦称临界 直径(消焰径)。当管径小于最大灭火 间距,火焰因不能通过而被熄灭。
图4-22 不同压力下氢气爆炸极限 1.火焰向下传播,圆筒容器尺寸为 37×8cm;2.端部或中心点,球形 容器;3.火焰向下传播,圆筒容器
6
(3)惰性介质即杂质
若混合物中含惰性气体的百分数增加,爆炸极限的范围缩小,惰 性气体的浓度提高到某一数值,可使混合物不爆炸
加入惰性气体, 爆炸上限显著下降 爆炸下限略可燃气体组成的混合物爆炸极限的计算
莱—夏特尔公式
x
100
%
P1 P2 P3 Pi
N1 N2 N3
Ni
莱—夏特尔公式的证明如下:
证明时的指导思想:将可燃混合气体中的各种可燃气与空气组成一组,其 组成符合爆炸下限时的比例,可燃混气与空气组成的总的混合气体为各组之 和。
4.4 爆炸极限理论及计算
4.4.1 爆炸极限理论
爆炸下限 爆炸上限 混合爆炸物浓度在爆炸下限以下时含有过量空气,由于空气
的冷却作用,阻止了火焰的蔓延,此时,活化中心的销毁数 大于产生数。 同样,浓度在爆炸上限以上,含有过量的可燃性物质,空气 非常不足(主要是氧不足),火焰也不能蔓延。但此时若补 充空气同样有火灾爆炸的危险
当混合气燃烧时,其波面上的反应如下式: A+B→C+D+Q
E W
反应热Q=W-E
A+B
C+D
1
设燃烧波内反应物浓度为n 则单位体积放出能量为nw。 燃烧波向前传递,使前方分子活化,活化概率为α (α ≤1) 则活化分子的浓度为α nW/E。第二批活化分子反应后再放出能量为α nW2/E。
前后两批分子反应时放出的能量比为 nW 2 / E W 1 Q
4.4.4 爆炸极限的经验公式
1)通过1摩尔可燃气在燃烧反应中所需氧原子的摩尔数(N)计算
有机可燃气爆炸极限(体积百分数)
x下= 4.761N0-0 1+1%
x
上=
400 4.76N
4
%
如:甲烷:N=4 x下= 6.5%, x上= 17.3%,
9
(2)利用可燃气体在空气中完全燃烧时的化学计量浓度x0计算
有机物爆炸极限
x下=0.55 x0
x 上=4.8
x0
A+nO2+3.76nN2→生成物
有机可燃气A在空气中的化学计量浓度为
x0
%
1
100 4.76n
%
如:甲烷:n=2 x0%= 9.5%, x下= 5.2%,x上= 14.7%
10
(3)通过燃烧热计算有机可燃气的爆炸下限
x1Q1 x2Q2 Cx
nW
E E
当β<1时,表示反应系统在受能源激发后,放热越来越少,也就是说,引起反 应的分子数越来越少,最后反应停止,不能形成燃烧或爆炸。 当β=1时,表示反应系统在受能源激发后能均衡放热,有一定数量的分子在 持续进行反应。这就是决定爆炸极限的条件(严格说稍微超过一些才能爆炸)。 当β>1时,表示放热量越来越大,反应分子越来越多,形成爆炸
11
1)设各种可燃气体积为:V1,V2,V3,……,Vi。则总的可燃气体积为
V=V1+V2+V3+……+Vi
2)设各组可燃气—空气在爆炸下限时的体积为: V’1,V’2,V’3,……,V’I 。
则总的可燃混气—空气体积为 V′= V’1+V’2+V’3,……,V’I
3)设各种可燃气爆炸下限为:x1下,x2下,x3下,…xi下。则
x1下=
V1 V' 1
100
x
2下=
V2 V' 2
100
x3下=
V3 V' 3
100
…x
i下=
Vi V' i
100
V'1
=
V1 x1下
100
V'
2
=
V2 x 2下
100
V'
3
=
V3 x 3下
100
…
V' i
= Vi x i下
100
12
4)设总的可燃混气的爆炸下限为x下。则有
2
在爆炸极限时,β=1
1 Q 1
E
设爆炸下限为L下(体积百分比)与反应概率α 成正比,
即
KL下
1 =K1+Q L下 E
当Q与E相比较大时,上式可近似写做
1 =K Q
L下
E
各可燃气体的活化能变化不大,可大体上得出 :
L下 Q=常数
爆炸下限L下与可燃性气体的燃烧热Q近于成反比,可燃性气体燃烧热 越大,爆炸下限就越低。
(5)点火能源
火花的能量、热表面的面积、火源与 混合物的接触时间等,对爆炸极限均 有影响
图4-24 火源能量对甲烷爆 炸极限的影响 (常压,26℃)
8
4.4.3 爆炸极限的测定
爆炸极限的测定一般采用传播法
测试原理:首先将爆炸管内抽成真空,然后充以一定浓度的可燃气 与空气的混合气体,用循环泵使可燃气混合均匀,再用电极点火, 观察火焰传播情况。火焰传播的最低浓度或最高浓度(可燃气的体 积百分含量),即为该可燃气的爆炸下限或爆炸上限。
