蛋白质的分子结构
4.3 蛋白质的分子结构

⑦ 拼接出整条肽链的序列
► 从多肽链中部分水解得到的肽段可用化学法
或酶法测序,然后比较用不同方法获得的两 套肽段的氨基酸顺序,根据它们彼此重叠的 部分,确定每个肽段的适当位置,拼凑出整 个多肽链的氨基酸顺序。
►P.75
第13题
14
⑧ 确定二硫键的位置
--用蛋白酶水解带有二硫键的蛋白质 --从部分水解产物中分离出含二硫键的肽段 --拆开二硫键 --将两个肽段分别测序 --与整个多肽链比较 --确定二硫键的位置
在天然蛋白质 中,几乎所有
α-螺旋都是右
手螺旋。
26
α-螺旋结构特征:
(1)结构参数:3.6个AA/圈 螺距= 0.54nm/圈 直径1.1nm 旋转100° /AA 上升0.15nm/AA
比完全伸展的构象压缩2.4倍
27
(2)主链(肽链)在螺旋内部, 侧链(R基团)在螺旋外部;
28
(3)每个氨基酸残基的C=O都与后面第四个残基N-H
一两肽段彼此靠近。
如蚕丝蛋白中含有大量的β-折叠,因为蚕丝蛋白
中含有大量的甘氨酸残基和丙氨酸残基。
40
α-螺旋与β-折叠的比较
形状 氢键 R基团 延伸性 链内 较大 较大 α-螺旋 螺旋状 β-折叠 锯齿状 链内或链间 较小 较小
41
烫发是一项生物化学工程
破坏二硫键,断开氢键,解开α螺旋。 固定形状,添加氧化剂,回复α螺旋。
情况各异。 3. 它们在单链旋转时产生空间位阻和静电
效应,制约着大量的构象形成。
22
可将肽链的主链看成是由被Ca隔开的 许多平面组成的。
N端
蛋白质结构
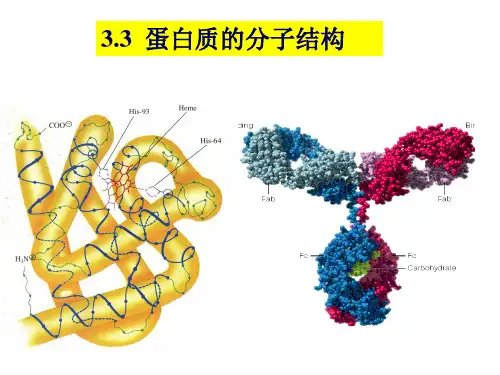
c. 链由141AA残基组成, 链由146AA残基组成。
3.3.2 蛋白质的二级结构
• 指蛋白质分子中多肽链本身的折叠和盘绕的方式,它仅涉及肽 链中主链的构象,并不涉及侧链的构象。 • 蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨 架原子的相对空间位置。
酰胺平面是构成主链构象的基本单元.
酰胺平面
多肽链可以看成由Cα串联起来的无数个酰胺平面组成
a .一条多肽链,153个氨基酸残基,一个血红素辅基,分子
量17600。 折叠成8段较直的-螺旋体(A-H),最长的有23个氨基酸残基, 最短的有7个氨基酸残基。拐弯处多由Pro、Ser、Ile、Thr等组 成。
b.肌红蛋白的整个分子具有外圆中空的不对称结构,肽链共
c.具有极性侧链的氨基酸残基分布于分子表面,而带非极性
5
βββ
5
回形拓扑结构
2 3 4 1 回形拓扑结构
平行-折叠的结构比较
卵溶菌酶
黄素蛋白 丙糖磷酸异构酶 乳酸脱氢酶结构域1
丙酮酸激酶结构域4
羧肽酶
腺苷酸激酶
(a)
(b)
next
木瓜蛋白酶
ห้องสมุดไป่ตู้
3.3.5.蛋白质的三级结构(Tertiary Structure)
是指多肽链在二级结构、超二级结构、结构域的基础上,进 一步盘绕、折叠形成的包括主链和侧链构象在内的特征三维 结构。即多肽链上的所有原子(包括主链和侧链)在三维空 间的分布。
蛋白质中相邻的二级结构单位(即单个α -螺旋或β -折叠或β -转角)组合 在一起,形成有规则的、在空间上能辩认的二级结构组合体称为蛋白质的超二 级结构. 基本组合方式:α α ;β
αβ ; β β β
蛋白质的分子结构

别构效应 蛋白质一级结构与功能的关系 核酸结构与功能的关系 抗体结构与免疫性
一、蛋白质的一级结构
蛋白质一级结构又称化学结构(primary structure), 是指氨基酸在肽键中的排列顺序和二硫键的位臵,肽链中氨基 酸间以肽键为连接键。蛋白质的一级结构是最基本的结构,它 决定了蛋白质的二级结构和三级结构,其三维结构所需的全部 信息都贮存于氨基酸的顺序之中。 (一)肽键与肽平面 肽键是一分子氨基酸的α-羧基与另一分子氨基酸的α-氨 基脱水缩合形成的酰胺键(一CO—NH一),属共价键。肽键是蛋 白质结构中的主要化学键,此共价键较稳定,不易受破坏。
A. α-α B. β-α-β C. β-β-β(Rossmann pleat) D. β-meander E. Greek key
(三)蛋白质的三级结构与构象
蛋白质的三级结构(tertiary structure)是指蛋 白质的一条多肽链的所有原子的整体排列。包括形成主 链构象和侧链构象的所有原子在三维空间的相互关系。 也就是一条多肽链的完整的三维结构。
β—折叠结构图
β-转角
β-转角是多肽链180°回折部分所形成的一种二级结构, 其结构特征为: (1)主链骨架本身以大约180°回折; (2)回折部分通常由四个氨基酸残基构成; (3)构象依靠第一残基的-CO基与第四残基的-指多肽链主链部分形成的无规律的卷曲构象。虽相 对没有规律性排布,但是其同样表现重要生物学功用,但 习惯称为“无规卷曲”。 酶的功能部位常包含此构象,灵活易变。
二、蛋白质的空间结构
(一)蛋白质二级结构与结构域
1、α-螺旋 螺旋结构是指蛋白质肽链骨架围绕一个轴形成的构象,是蛋白质 中最常见、最典型、含量最丰富的二级结构元件。α—螺旋结构的 特点如下: (1)肽单元围绕中心轴呈有规律右手螺旋,每3.6个氨基酸残基螺旋 上升一圈,螺距为0.54nm,每个残基上升0.15nm,螺旋半径0.23nm; (2)α—螺旋的每个肽键的N—H与相邻第四个肽键的羰基氧形成氢键 (hydrogen bond),氢键的方向与螺旋长轴基本平行,肽链中的全部 肽键都可形成氢键,是维持α—螺旋结构稳定的主要次级键。
蛋白质的分子结构考点总结

蛋白质的分子结构考点总结
●一级结构
●蛋白质中氨基酸的种类和数量以及氨基酸在多肽链中的排列顺序
●肽键、二硫键
●二级结构
●多肽链主链骨架中的若干肽段各自沿某个轴盘旋转或折叠,并以氢键维持从而形成
具有规律的构象或结构
●氢键
●α-螺旋β-折叠β-转角无规则卷曲
●每隔3.6个氨基酸残基上升一圈,螺距0.54nm
●超二级结构
●蛋白质分子中由若干相邻的二级结构单元(α-螺旋、β-折叠、β-转角等)组合在一
起,彼此相互靠近,形成在空间上能辨认的、有规则的二级结构组合体。
●疏水键
●三级结构
●整个多肽链在三维空间上的构象成为球状蛋白质分子。
●氢键、疏水键、离子键、范德华力
●四级结构
●数条具有独立的三级结构和多肽链通过非共价键相互连接而成的聚合体结构
●疏水键(主要)、氢键、范德华力、离子键。
蛋白质分子结构

无
规
则
卷
曲
无规则卷曲
示
意
图
细胞色素C的三级结构
蛋白质分子中那些没有确定规律性的部分肽链构象称为无规卷曲。
三、蛋白质的三级结构
(一) 定义
整条肽链中全部氨基酸残基的相对空间位置。 即肽链中所有原子在三维空间的排布位置,包括 主链和侧链。三级结构的形成使得在序列中相隔 较远的氨基酸侧链相互靠近。 主要的化学键
亚基之间的结合力主要是疏水作用,其次 是氢键和离子键。
-亚基
如:血红蛋白含有四个亚基,为22,血红素 每个亚基含一个血红素,每个血红素 Fe2
+
可结合一个氧分子。亚基含141个氨 基酸残基,亚基含146个氨基酸残基。 -亚基
-亚基
血红素 Fe2
+
-亚基
第五节 蛋白质结构与功能的关系
一、蛋白质一级结构与功能的关系
疏水键、离子键、氢键和 Vander Waals力等。
目录
肌红蛋白 (Mb) 的三级结构
C 端
N端
四、蛋白质的四级结构
有些蛋白质分子含有二条或多条多肽链, 每一条多肽链都有完整的三级结构,称为蛋白 质的亚基 (subunit)。
蛋白质分子中各亚基的空间排布及亚基接 触部位的布局和相互作用,称为蛋白质的四级 结构。
蛋白质构象改变导致疾病的机理:有些蛋 白质错误折叠后相互聚集,常形成抗蛋白水解 酶的淀粉样纤维沉淀,产生毒性而致病,表现 为蛋白质淀粉样纤维沉淀的病理改变。
这类疾病包括:人纹状体脊髓变性病、老 年痴呆症、亨停顿舞蹈病、疯牛病等。
蛋白质的结构与功能

2. β-折叠结构特点
(1) 相邻肽键平面的夹角为1100 ,呈锯齿状排列; 侧链R基团交错地分布在片层平面的两侧。
(2) 2~5条肽段平行排列构成,肽段之间 可顺向平行(均从N-C),也可反向平行 。 (3)由氢键维持稳定。其方向与折叠的长轴 接近垂直。
(三)β-转角(β-turn)
1.概念
以氨基末端开始→羧基末端结束,依次编1、
2、3………
蛋白质多肽链中氨基酸残基的排列顺 序称为蛋白质的一级结构
NH2 Met Phe Lys Cys Ser Thr Val COOH
各种蛋白质的根本差异在于一级结构的不同
人胰岛素的一级结构
二、蛋白质二级结构
概念:
是指蛋白质分子中一段多肽链的局部空
蛋白质的二级结构类型
蛋白质的二级结构主要包括α-螺旋,β-折 迭,β-转角及无规卷曲等
(一)α -螺旋 (α -helix)
1.概念 由肽键平面盘旋 形成的螺旋状构象
2.α -螺旋的结构特征 (1)以肽键平面为 单位,以α -碳原 子为转折盘旋形成 右手螺旋
(2) 每3.6个氨基酸残基 绕成一个螺圈(3600) 螺距为0.54nm 每个氨基酸上升0.15nm 肽键平面与中心轴平行
*类型
全a-螺旋、全β-折叠、
无规卷曲
由这些结构域缔合成具有三级结构的分 子或亚基
蛋白质三级结构的意义: 蛋白质的三级结构决定了蛋白质的
生物学功能。
维持三级结构稳定的键
侧链基团之 间形的 氢 键、 离子键、 疏水作用、 分子引力、 二硫键
维系蛋白质分子结构的作用力
1. 肽键 共价键
维系蛋白质一级结构
第二节
蛋白质的分子结构
一、 蛋白质的一级结构—基本结构
蛋白质的分子结构
defined AA sequence.
MW:5700 dalton,51个氨基酸残基,A链21个残基,B链30个残基。 A链内有1个2硫键 Cys 6 — Cys 11
A.B链间有2个2硫键 A.Cys 7-B.Cys 7 A.Cys 20 — B.Cys 19
(2)牛胰核糖核酸酶(RNase) 一条多肽链,124AA残基组成,四 个链内二硫键,分子量12600.它是测出一 级结构的第一个酶分子。
(2)胰岛素原的激活
preproinsulin
signal peptidase peptidase
proinsulin
insulin
5)多肽或蛋白质的人工合成
Solid-phase synthesis of polypeptide P193:
+
第 二 向
a b
+
第一向
pH6.5 图中a、b两个斑点是 由一个二硫键断裂 产生的肽段
-
Brown和Hartlay对角线电泳图解
3.蛋白质一级结构生物功能 1 )蛋白质一级结构举例:
(1)胰岛素(Insulin)
The determination of the AA sequence of insulin (1953) is a landmark in biochemistry because it showed for the first time that a protein has a precisely
镰刀状红细胞贫血病:病人体内红细胞的形状为新月 形,即镰刀状。此种细胞壁薄,而且脆性大,极易涨破 而发生溶血;再者,病变的细胞粘滞加大,易栓塞血管; 由于流速较慢,输氧机能降低,使心脏器官供血出现障 碍,从而引起头昏、胸闷而导致死亡。
蛋白质的分子结构
N N C C
顺向 平行
N C
C N
反向
平行
3、 β-转角
β-转角是指蛋白质 的分子的多肽链经常出 现180º的回折,在回折 角上的结构就称β-转角, 也称发夹结构,或称U形 转折。由第一个氨基酸 残基的C=O与第四个氨基 酸残基的N—H之间形成 氢键。
角蛋白
又称自由卷曲,是指没有一定规律 的松散肽链结构。酶的功能部位常常处
于这种构象区域。 无规卷曲常出现在 a- 螺旋与 a- 螺旋、 a螺旋与β- 折叠、 β- 折叠与β- 折叠之间。 它是形成蛋白质三级结构所必需的。
β-转角
RNase的分子结构
β-折叠
α-螺旋
无规则卷曲
Ω环。。
如毛发、甲、角、鳞和羽等。可分为a-角蛋白和 -角蛋白。 a-角蛋白主要由a-螺旋构象的多肽链组成。肽链 之间有二硫键交联以维持其稳定性。 a-角蛋白的伸缩性能很好,当a-角蛋白氢键被破 坏而不能复原。此时a-螺旋转变成-折叠结构, 称为-角蛋白。
卷发(烫发)的生物化学基础
永久性卷发(烫发)是一项生物化学
练习
5、关于蛋白质分子三级结构的描述,其中错
误的是: A.天然蛋白质分子均有三级结构 B.具有三级结构的蛋白质一定有生物学活 性 C.三级结构的稳定性主要靠非共价键维系 D.亲水基团常聚集在蛋白质分子的表面
练习
下列哪项不是四级结构蛋白质的特征: A.由两条或两条以上的多肽链组成 B. 每条多肽链称为一个亚基 C.每条多肽链都具有独立的生物学活性 D.依赖非共价键维系四级结构的稳定性
蛋白质的分子结构
一级结构
初级结构
蛋白质的分子结构
三、蛋白质的分子结构蛋白质的分子结构(一)一级结构(线性结构、基本结构)蛋白质的一级结构(primary structure ) 指它的氨基酸序列 。
比喻:珍珠项链1954年英国生物化学家Sanger 报道了胰岛素(insulin )的一级结构(参见教材P7),这是世界上第一个被确定一级结构的蛋白质。
A 链:21个AA ,B 链:30个AA ,A 、B 两链通过两个二硫键相连,A 链本身第6及11位两个半胱氨酸形成一个链内二硫键。
1960年Moore 和Stein 测出了牛胰核糖核酸酶的一级结构,含124个AA ,链内有4个二硫键。
蛋白质的一级结构是决定其空间结构的基础,而空间结构则是其实现生物学功能的基础。
(二)空间结构(又称构象)定义:是指蛋白质分子内各原子围绕某些共价键的旋转而形成的各种空间排布及相互关系。
Pr 构象:主链构象、侧链构象两者相互依赖,相互影响一般根据蛋白质构象的范围和复杂程度,人为地将Pr 的空间结构分为:二级、三级和四级结构。
1.1.二级结构二级结构二级结构::蛋白质多肽链主链原子的局部空间排布。
(1) 形成二级结构的基础肽键平面:肽键中的C 、H 、O 、N 、四个原子和与它们相邻的两个α碳原子都处在同一个平面上,这个平面称为~。
多肽链=通过可旋转的α-碳原子连接的酰胺平面链提问:影响蛋白质构象的作用力有哪些?内力(内因):蛋白质分子内各原子间作用力外力(外因):与溶剂及其他溶质作用力内因为主,外因通过改变内因起作用(2)基本形式:包括α-螺旋、β-折叠、β-转角、不规则卷曲(自由回转或松散肽段)四种方式。
A. α-螺旋(蛋白质最常见的二级结构形式)天然蛋白质大部分为右手螺旋(顺时针)几个数值:螺旋一周3.6个AA,螺距0.54nm,每个残基跨距为0.15nm作用力:氢键—相邻螺旋之间通过肽键上的酰基氧与亚氨基氢形成。
B.β折叠:是多肽链的折叠形式平行肽链间以氢键从侧面连接的构象维持β-折叠的作用力也是肽键衍生出的氢键:平行式、反平行式C.β转角作用力——同样是肽键衍生来的氢键但由于只有这一个氢键,只形成β—转角结构。
蛋白质分子结构
蛋白质分子结构蛋白质结构是指蛋白质分子的空间结构。
蛋白质主要由碳、氢、氧、氮等化学元素组成,是一类重要的生物大分子,所有蛋白质都是由20种不同氨基酸连接形成的多聚体,在形成蛋白质后,这些氨基酸又被称为残基。
蛋白质和多肽之间的界限并不是很清晰,有人基于发挥功能性作用的结构域所需的残基数认为,若残基数少于40,就称之为多肽或肽。
要发挥生物学功能,蛋白质需要正确折叠为一个特定构型,主要是通过大量的非共价相互作用(如氢键,离子键,范德华力和疏水作用)来实现;此外,在一些蛋白质(特别是分泌性蛋白质)折叠中,二硫键也起到关键作用。
为了从分子水平上了解蛋白质的作用机制,常常需要测定蛋白质的三维结构。
由研究蛋白质结构而发展起来了结构生物学,采用了包括X射线晶体学、核磁共振等技术来解析蛋白质结构。
一定数量的残基对于发挥某一生物化学功能是必要的;40-50个残基通常是一个功能性结构域大小的下限。
蛋白质大小的范围可以从这样一个下限一直到数千个残基。
估计的蛋白质的平均长度在不同的物种中有所区别,一般约为200-380个残基,而真核生物的蛋白质平均长度比原核生物长约55%。
更大的蛋白质聚合体可以通过许多蛋白质亚基形成;如由数千个肌动蛋白分子聚合形成蛋白纤维。
蛋白质的分子结构可划分为四级,以描述其不同的方面:一级结构:组成蛋白质多肽链的线性氨基酸序列。
二级结构:依靠不同氨基酸之间的c=o和n-h基团间的氢键形成的稳定结构,主要为α螺旋和β折叠。
三级结构:通过多个二级结构元素在三维空间的排列所形成的一个蛋白质分子的三维结构。
四级结构:用于描述由不同多肽链(亚基)间相互作用形成具有功能的蛋白质复合物分子。
扩展资料:蛋白质的物理性质包括:1、水解性:蛋白质经水解后为氨基酸。
有的蛋白质能溶于水,如鸡蛋白,有的难溶于水,如丝、毛等。
2、盐析性:蛋白质的盐析性一般是可逆的,也就是说,蛋白质经过盐析并没有丧失生物活性。
在蛋白质溶液中加入(NH4)2SO4有沉淀生成,加入水后沉淀有消失,这就是一个盐析的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C
C
C
N
0.132nm
N
C
H❖ 虽是单键却有部分双键性 ❖ 周边六个原子在同一平面上
肽键平面
★多肽链可以看成由Cα串联起来的无数个 平面组成
(三)二级结构单元的种类
1. -螺旋(-helix)
二. 蛋白质的二级结构
鲍林(Linus pauling)
是著名的量子化学家,他在化学的多个 领域都有过重大贡献。
二、β-折叠结构(β-pleated sheet)
方向:若两条肽链走向相同:顺向平行
若两条肽链走向相反:反向平行(较稳定)
N
C
顺向
N
C 平行
N
C
反向
C
N 平行
(三) β-转角
β-转角是指蛋白质 的分子的多肽链经常 出现180º的回折,在 回折角上的结构就称 β-转角,也称发夹结 构,或称U形转折。由 第一个氨基酸残基的 C=O与第四个氨基酸 残基的N—H之间形成 氢键。
又称自由卷曲,是指没有一定规律 的松散肽链结构。酶的功能部位常常处 于这种构象区域。
无规卷曲常出现在a-螺旋与a-螺旋、a螺旋与β-折叠、 β-折叠与β-折叠之间。它 是形成蛋白质三级结构所必需的。
β-转角
RNase的分子结构
β-折叠
α-螺旋
无规则卷曲
Ω环。
最近发现普通存在于球状蛋白质 中的一种新的二级结构。
这种结构出现在蛋白质分子的表 面,与生物功能有关。
在分子识别中可能起重要作用。
(一)三级结构的概念
四.蛋白质的三级结构
三级结构(tertiary structure):指每一条多肽 链内所有原子的空间排布,包括主链、侧链构象内容。 是在主链构象二级结构的基础上,由于侧链R基相互 作用,进一步折叠盘曲构成的。
由一条多肽链构成的蛋白质,具有三级结构才具有生物学活性。
H2N b
N
H3N+
COO-
H
a O
C
CH3
c
c
CH3
CH2 O H Oa
SS
CHCH3CH3
CH
CH2 CH3
CH3
cO
C aO
OH
H2N C O
NH2+
C O- b
C CH2OH c CH2OH
维持蛋白质分子构象的各种化学键
a 氢键
b 离子键 c 疏水键
O
H
O
H—N—CH2—C—OH + H—N—CH2—C—OH
H
OH
O
H—N—CH2—C——N—CH2—C—OH
肽键
性质:分子间脱水反应
蛋白质分子中的共价键与次级键
化学键
共价键
肽键 二硫键
一级结构
氢键
二、三、四级结构
疏水键 非共价键键 盐键
三、四级结构
范德华力
(van der Waals 力)
(一)二级结构的概念
二. 蛋白质的二级结构
蛋白质的二级结构是指多肽主链原子的局部空 间排列,不涉及氨基酸残基侧链的构象。
天然蛋白质包括α-螺旋、 β-折叠、 β-转角、 无规则卷曲等二级结构。
例如:-螺旋
C--N 0.147 nm (正常) C=N 0.123nm (正常)
二. 蛋白质的二级结构
O
C—N 0.132 nm
蛋白质的一级结构: 蛋白质分子中氨基酸的排列顺序。
1965年9月 17日,我国科研人员第一次人工合 成出的蛋白质──晶体胰岛素(放大)
(二)一级结构的测序
(一)一级结构 主要键:肽键、二硫键
一. 蛋白质的一级结构
一级结构是由遗传信息决定的。 一级结构是蛋白质空间结构和特异生物学功能的基础。
H
血红蛋白由四条多肽链形成,是一种寡聚蛋白 质。这四条链主要通过非共价键相互作用缔合在 一起。
血 红 蛋 白
的 四 级 结 构
(二) 维持四级结构的作用力
❖ 疏水作用 ❖ 氢键 ❖ 盐键 ❖ 范德华力
五.蛋白质的四级结构
图4-13 血红蛋白质的三级和四级结构
蛋白质分子中的共价键与次级键
化学键
共价键
角蛋白
如毛发、甲、角、鳞和羽等。可分为-角蛋白和角蛋白。
-角蛋白主要由-螺旋构象的多肽链组成。肽链 之间有二硫键交联以维持其稳定性。
-角蛋白的伸缩性能很好,当-角蛋白氢键被破 坏而不能复原。此时-螺旋转变成-折叠结构,称 为-角蛋白。
卷发(烫发)的生物化学基础
永久性卷发(烫发)是一项生物化学工 程。
曾两次荣获诺贝尔奖金(1954年化学奖, 1962年和平奖),有很高的国际声誉。
(1)-螺旋
多肽链中的各个肽平面围绕 同一轴旋转,形成螺旋结构, 螺旋一周,沿轴上升的距离 即螺距为0.54nm,含3.6个 氨基酸残基;两个氨基酸之 间的距离为0.15nm;
肽链内形成氢键,氢键的取 向几乎与轴平行,第一个酰 胺基团的-CO基与第四个酰 胺基团的-NH基形成氢键。
COOH
胰岛素分子的三级结构
溶菌酶分子的三级结构
(二) 结构域
大分子蛋白质的三级结构常可分割成一个或 数个球状或纤维状的区域,折叠得较为紧密,各 行使其功能,称为结构域(domain) 。
免疫球蛋白结构域示意图
C 端
N端
肌红蛋白 (Mb)
(一) 四级结构的概念
五.蛋白质的四级结构
四级结构(quaternary structure):由两条 或两条以上具有独立三级结构的多肽链聚合而成。 每条多肽链称为一个亚基。
右手-螺旋。
蛋白质分子中氢键的形成
(三)二级结构单元的种类
二. 蛋白质的二级结构
2、-折叠(-pleated sheet)
一种比较伸展、锯齿状的肽链结构。
维持β-折叠结构稳定性的力 —— 氢键由 一条链上的羰基和另一条链上的氨基之间 形成,即氢键是在链与链之间形成的。
图 4-4 蛋白质分子中的β-折迭结构 左:顺向平行 右:逆向平行
上节课内容回顾
蛋白质的元素组成 氨基酸的结构通式 氨基酸分类 氨基酸的理化性质
两性解离 等电点(pI) 紫外吸收性质 茚三酮反应 肽 肽键 寡肽 多肽
LOGO
LOGO
。
蛋白质的分子结构
一级结构 二级结构 三级结构 四级结构
初级结构 高级结构(空间结构)
(一)一级结构的概念
一. 蛋白质的一级结构
肽键 二硫键
一级结构
氢键
二、三、四级结构
疏水键 非共价键键 盐键
三、四级结构
—螺旋在湿热条件下可以伸展转变 为—转角,但在冷却干燥时又可自 发地恢复—螺旋。
把头发卷成一定形状 ↓
涂还原剂(破坏二硫键)
↓
加热(—螺旋转变为—折叠);
↓
除去还原剂,涂上氧化剂(建立新的二硫键)
↓ 洗涤并冷却头发(—折叠转变为—螺旋)
(三)二级结构单元的种类
二. 蛋白质的二级结构
4、无规则卷曲(non-regular coil)
