2016药品不良反应报告总结
医疗安全不良事件分析报告
2016年度医疗(安全)不良事件分析报告XXXXXX人民医院质控科随着人们法律观念和维权意识日益增强,对医护人员的职业道德、技术水平及服务质量提出了更高的要求。
为进一步加强医疗安全管理,促进医疗质量的持续改进,保障医疗安全,进一步明确以“病人安全”为导向,自从2014年我院制定了非处罚性的《医疗安全不良事件报告制度及工作流程》以来,各科室严格监控和管理,按规定及时、主动上报,2016年度各科室上报不良事件及药品不良反应312例,未发生重大安全事件。
现将各科室报告医疗安全不良事件进行分析,以利于消除安全隐患,防范医疗事故及纠纷,不断提高医疗质量。
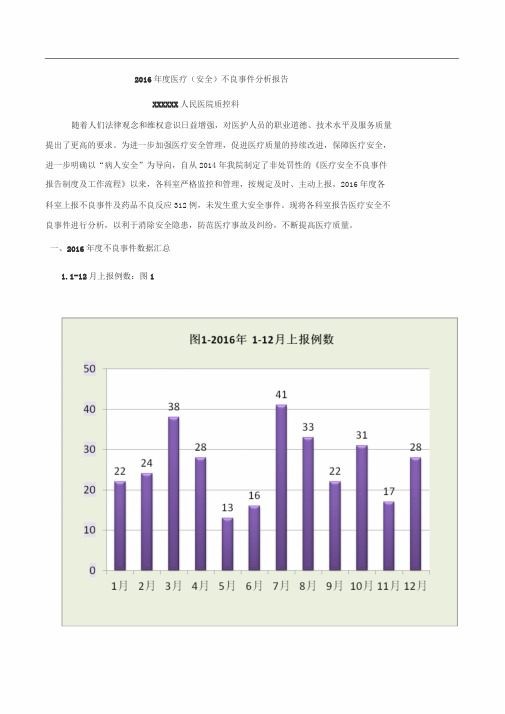
一、2016年度不良事件数据汇总1.1-12月上报例数:图12.医疗安全不良事件科室分布:图23.不良事件分类:4.2016年与2015年不良事件对比,见图4图42016年与2015年各类不良事件对比4.各类不良事件1-12月趋势,见图5图5—2016年1-12月趋势图5.不良事件发生场所,见图6二、2016年各类不良事件汇总分析(一)医疗安全不良事件1.医疗不良事件分类:图7—-医疗不良事件分类柏拉图2.医疗不良事件分级:3.医疗安全不良事件小结:医疗安全不良事件中,由医生上报7例,护士上报19例。
绝大多数属于Ⅳ级事件,占73%,主要是医嘱事件,Ⅲ级事件占27%,主要有医疗处置事件、用药错误等。
医嘱事件16例,其中录错药物数量5例、录错药物剂量4例、漏录电脑4例、录错患者3 例;医疗处置事件4例,包括胸腔闭式引流操作2例,导尿操作2例;用药错误2例,包括用法错误、提前用药各1例;跌倒事件2例,均为脑血管疾病患者夜间坠床;意外事件1例,为住院处录入身份信息错误;输液反应1例。
(二)护理安全不良事件1.护理不良事件分类:2.护理不良事件分级3.2016年与2015年护理不良事件对比,见图11图11—2016年与2015年护理不良事件对比4.护理不良事件小结:从图9、图11中看出:用药错误共发生27例,比2015年增加8例,增长率42%;坠床/跌倒事件23例,比2015年增加11例,增长率91%;管路事件13例,比2015年减少9例,降低40%;意外事件15例,包括:床档致皮肤挫裂伤、皮肤烫伤、手术物品不齐全、服药伤害、患者走失等;操作处置事件12例,包括静脉输液操作4例、导尿操作2例、输液泵操作不当2例、肾透析操作2例;标本采集事件9例,包括用错试管、血标本溶血、试管错误、血标本送检延误等。
医院药品不良反应的总结分析报告.doc
2014年药品不良反应分析、反馈报告药品不良反应(ADR)监测是合理用药的重要依据,是关系到广大患者用药安全,减少医患纠纷的一项重要工作。
我院2014年共收集上报135例ADR,较2013年的71例增加了90.14%。
现就2014年的ADR报告进行统计、分析,了解ADR的一般规律和特征,为临床合理用药提供依据。
报告人职业和科室分布报告人包括医生和药师,其中医生上报122份,占90.37%;药师上报13份,占9.63%。
ADR报告来自全院18个科室,132例住院患者,3例门诊患者。
详见表1。
表1 2014年ADR上报科室排序科室例数(例)构成比外三病区16 11.85%内一病区15 11.11%内二病区15 11.11%内四病区14 10.37%内三病区12 8.89%临床药学室10 7.41%外一病区8 5.93%儿科病区8 5.83% 中医二病区(肛肠)7 5.19% 中医一病区7 5.19%外四病区 5 3.70% 中医二病区(康复) 5 3.70% ICU综合组 4 2.96%妇产科病区 2 1.48%住院药房 2 1.48%门诊急诊科 2 1.48%外二病区 2 1.48%门诊西药房 1 0.74%合计135 100% 发生ADR的患者性别及年龄分布情况在报告的135例ADR中,男81例,女54例,年龄分布区间为1-95岁,情况详见表2。
表2 患者年龄分布情况年龄例数百分比小于1岁 2 1.48%1-4岁 3 2.22%5-14岁 4 2.96%15-44岁31 22.96%45-64岁38 28.15% 65岁及其以上57 42.22% 总计135 100%用药情况分析用药途径包括静脉给药及口服、皮下注射等。
最常见仍为静脉滴注,占74.85%。
详细统计见表3:表3:给药途径统计排名给药途径一般严重总计例次百分比例次百分比例次静脉滴注116 95.08% 6 4.92% 122口服19 76.0% 6 24.0% 25皮下注射 3 75.0% 1 25.0% 4泵内注射 2 100.0% 0 0.0% 2皮内注射 2 100.0% 0 0.0% 2静脉注射 1 50.0% 1 50.0% 2鞘内给药0 0.0% 2 100.0% 2灌注 1 100.0% 0 0.0% 1肌内注射 1 100.0% 0 0.0% 1阴道给药 1 100.0% 0 0.0% 1鼻饲 1 100.0% 0 0.0% 1总计147 90.18% 16 9.82% 163引起ADR的可疑药物共包含73个品种,可疑药品依据药理作用分类,共包括10种药物;其品种数及上报次数排名统计结果见表4所示:表4 药物类别品种数排名及上报次数排名药物类别品种数构成比(%)上报次数构成比(%)抗感染药物21 28.77 55 33.74中药注射剂7 9.59 41 25.15循环系统药物 5 6.85 9 5.52血液系统药物8 10.96 11 6.75神经系统药物 4 5.48 9 5.52呼吸系统药物 2 2.74 4 2.45消化系统药物 3 4.11 4 2.45镇痛药物 6 8.22 10 6.13内分泌系统药物 6 8.22 7 4.29其他专科用药11 10.87 13 12.90合计73 100.00 163 100.00由表4可见,引起ADR例数最多的为抗感染药物,其所含品种数也最多,排名第二的则为中药注射剂。
某院2016年药品不良反应报告的分析

某院2016年药品不良反应报告的分析雷雅琳【摘要】目的分析我院药品不良反应(ADR)发生的规律和特点,为安全合理用药提供参考.方法收集我院2016年1月至2016年12月上报的ADR报告119份,分别从患者的年龄、性别、ADR涉及的药物品种、ADR涉及的器官或系统、给药途径等进行统计分析.结果 119例ADR报告中,男52例(43.69%),女67例(56.30%);46~75岁ADR发生率较高为54.6%.抗菌药物所致ADR居首位(48.74%),引起ADR的主要途径是静脉给药(98.32%),ADR涉及的器官或系统主要为皮肤及其附件.结论加强ADR报告与监测工作,促进临床合理用药,提高临床用药安全水平【期刊名称】《中国医药指南》【年(卷),期】2018(016)001【总页数】2页(P79-80)【关键词】药品不良反应;分析;合理用药【作者】雷雅琳【作者单位】大连市金州区第一人民医院药剂科,辽宁大连116000【正文语种】中文【中图分类】R969.3药品不良反应(ADR)是指合格药品在正常的用法用量下出现的与用药目的无关的或意外的有害反应。
国家实行药品不良反应(ADR)报告制度,发现ADR并及时上报是医务人员应尽的法定义务。
2016年我院共报告ADR119例,本文通过对ADR发生的规律和特点进行统计、分析、总结,以期减少ADR的发生,保障患者用药安全,促进临床合理用药。
表1 119例ADR涉及的药物品种及构成比药物品种例数构成比(%) 主要涉及药物抗菌药 58 48.74 哌拉西林他唑巴坦、美洛西林舒巴坦、阿莫西林克拉维酸钾中药制剂 31 26.05 红花黄色素、疏血通、血必净、参麦注射液辅助用药 10 8.40 脑苷肌肽、转化糖电解质、鹿瓜多肽对比剂 8 6.72 碘佛醇、泛影葡胺循环系统药物7 5.88 单硝酸异山梨酯注射液、胺碘酮、长春西汀抗肿瘤药物 3 2.52 表柔比星、吡柔比星、榄香烯消化系统药物 2 1.68 注射用泮托拉唑合计 119 100.00 -1 资料与方法收集我院2016年上报的ADR报告119份。
2016年上半年度药物不良反应报告分析
2016年上半年度药物不良反应报告分析总结为了解我院药物不良反应(ADR)发生的特点和规律,促进临床合理用药。
现对我院2016年上半年收集并上报国家药品不良反应监测系统62例 ADR进行汇总分析,旨在进一步完善药品监测措施,加强ADR呈报比率及质量控制,保障患者用药安全,提高合理用药水平,同时为明确今后我院ADR监测工作重心提供参考。
药物不良反应(ADR)是指合格药品在正常用法用量下出现的与用药目的无关或意外的有害反应。
可分为A,B,C三种类型是。
从我院2016年上半年度收集的62例ADR报告中,分别从患者性别、年龄、药品类别,药品种类、给药途径和临床表现等方面进行统计分析。
现总结如下:1.患者一般情况:62例ADR报告中,男性27例,女性35例,男女比例为0.8:1;年龄最小的为1岁,最大的为90岁,将患者年龄划分为0-18岁,18--40岁,40-65岁,65岁以上4个阶段,构成比例分别为8%(5例),21%(13例),45%(28例),26%(16例),见表1。
ADR的发生频率男女比例基本相当。
40-65岁和65岁以上患者发生ADR的频率最高,占总病倒数的71%。
这与老年人的生理特征有关,随着年龄的增加,脏器功能逐步衰退,影响药物的代谢和排泄,造成药物在体内的蓄积;而且老年人往往合并多种疾病,临床治疗中多为联合用药,药物相互作用增加,使得老年人发生ADR的机率高于其他年龄段。
故临床对老年人用药应遵循个体化原则,从小剂量开始,逐步达最适量,以减少ADR的发生。
2.引发ADR的给药途径分布:在62例ADR中多以静脉滴注给药方式为主(61例,占98%),其次为口服给药(1例,占2%)。
ADR与药品的剂型和给药途径密切相关。
静脉给药是引发ADR最多的给药方式,与文献报道相似。
在62例ADR中,静脉给药达到98%,口服给药仅占2%,这与临床医师的用药习惯有关,特别是住院患者,主要依赖于静脉给药治疗,药物在直接进入血液循环迅速发挥疗效的同时也增加了ADR发生的可能性,因此临床医师在治疗过程中,应注意选择合适的给药剂型,能口服给药的尽量避免静脉给药,效果不佳情况下再依次考虑肌肉注射和静脉给药。
药品不良反应分析报告

2016年药品不良反应分析报告一、药品不良反应类型统计:2016年我院共上报药品不良反应/事件报告179例,其中严重报告3例,占1.68%;新(de)严重报告2例,占1.12%;一般报告120例,占67.04%;新(de)一般报告54例,占30.16%.二、按药品种类统计化学药品不良反应上报166例,占92.7%;中成药品不良反应上报13例,占7.3%.详见见表1:表1 按药品种类上报情况表三、按药理作用统计抗感染药品不良反应上报112例,占62.57%;非抗感染药品不良反应上报67例,占37.43%.见表2:表2 按药理作用上报情况表四、抗感染药品不良反应报告:硝基咪唑类上报6例,占5.36%;头孢菌素类上报36例,占32.14%;青霉素类上报1例,占0.89%;其他B-内酰胺类上报5例,占4.46%;喹诺酮类上报54例,占48.12%;大环内酯类上报3例,占2.68%;其他抗生素上报6例,占5.36%;抗病毒药品上报1例,占0.89%.见表3:表3 抗感染药品ADR上报情况表五、报告科室分布药品不良反应报告来自全院18科室,其中住院患者162例,门急诊患者17例.详见表4:表4 ADR科室上报情况表六、药品不良反应报告性别和年龄分布在报告(de)179例ADR中,男性75例,女性104例.年龄分布区间为1-90岁,具体情况见表5:表5 患者年龄分布情况七、用药途径情况分析:用药途径包括静脉给药及口服、皮下注射等.最常见仍为静脉滴注,占%.详见表6表6 给药途径情况表八、药物不良反应涉及(de)系统、器官及表现情况分析上报(de)ADR涉及(de)系统损害多为皮肤及其附件损害,常见症状为皮疹、瘙痒等,具体内容见表7:表7 药物不良反应所涉及(de)系统、器官及临床表现情况九、统计ADR报表中发现(de)问题1.上报药品不良反应类型单一:由表7可见,我院上报(de)药品不良反应多局限为各种药物致皮疹,且均为轻微皮疹,停药后多自行消散,所涉及药物无上市5年内(de)新药.医务人员应对不良反应类别(de)定义严格掌握,临床应鼓励医务人员积极发现新(de)、严重(de)不良反应,对于造成器官损害、致残、致畸、致死、导致住院治疗甚至延长住院时间(de)药物不良反应,要在规定时限内准确上报.2.药物不良反应报表书写不规范:本次回顾分析发现,本院ADR报表书写虽比往年有很大提高,但仍存在部分不规范(de)情况,如填写漏项、不良反应发生经过描述不详、阐述内容无逻辑关系等,导致这一现象(de)主要原因是上报人对于表格各项目(de)要求理解不到位.3.抗菌药物使用(de)安全隐患:与国内文献报道一致,我院2016年收集到(de)ADR病例怀疑由抗菌药物引起(de)不良反应所占比例最大,其中以喹诺酮类抗菌药物为主,由此提示临床科室在用药过程中应告知患者,如感觉不适应立即反馈.4.开展ADR监测工作需要医务人员(de)共同努力,全面配合.做好药物不良反应事件(de)管理工作是医务人员(de)责任,与医疗安全息息相关,希望我院医务人员提高对ADR监测工作(de)积极性和主动性,进一步推进此项工作,促进临床安全合理用药.。
不良反应分析总结

不良反应分析总结不良反应(Adverse reaction)是指使用药物或其他治疗方法后出现的对患者身体或心理健康产生负面影响的反应。
药物治疗是临床医学中常用的治疗方法之一,但在使用药物的过程中,不可避免地会有一些不良反应发生。
这些不良反应主要包括药物副作用、药物过敏反应和药物相互作用等。
本文将对不良反应进行总结和分析,以提高对不良反应的认识和预防。
一、药物副作用药物副作用是指在正常剂量下,经过合理用药后出现的药物不良反应。
药物副作用的发生率和严重程度与药物的种类、用药剂量、个体差异和使用时的其他因素等有关。
药物副作用常见的有肠胃道反应、中枢神经系统反应、心血管系统反应、免疫系统反应、肝肾毒性等。
其中,肠胃道反应包括恶心、呕吐、腹泻等;中枢神经系统反应包括头晕、头痛、失眠等;心血管系统反应包括心悸、血压升高等;免疫系统反应包括过敏反应、药疹等;肝肾毒性包括肝功能损害、肾功能损害等。
药物副作用的发生原因主要有以下几个方面:1. 药物的化学性质和药理作用:某些药物本身具有一定的毒性或不良反应,如一些抗生素、抗肿瘤药物等。
2. 药物的剂量和疗程:药物的剂量和疗程越大,不良反应的发生风险越高。
3. 患者的个体差异:不同个体对同一药物的敏感性不同,有的人容易出现不良反应,有的人则不容易。
4. 药物的相互作用:某些药物在相互作用时可增强或减弱不良反应的发生。
预防药物副作用主要是在用药过程中注意以下几个方面:1. 合理用药:选择合适的药物、剂量和疗程,避免滥用和不当使用药物。
2. 监测不良反应:在用药过程中,定期监测患者的生命体征和相关指标,及时发现和处理药物副作用。
3. 加强饮食调理:在用药期间,注意饮食调理,避免刺激性食物和饮料,保持规律饮食。
4. 患者教育:对患者进行药物治疗的教育,告知药物的不良反应及可能的处理方法,提高患者的自我保健和合理用药意识。
二、药物过敏反应药物过敏反应是指在用药过程中,因患者对药物产生过敏反应而引起的不良反应。
药物不良反应报告及处理总结
药物不良反应报告及处理总结《篇一》在我职业生涯的这些年里,药物不良反应报告及处理工作一直是我的重要职责。
作为一名从事药品监测的专业人员,我深知这项工作的重要性,它关乎着无数患者的生命安全和社会公共健康。
在此,我想对我所从事的药物不良反应报告及处理工作进行一个简要的总结和反思。
一、基本情况药物不良反应(ADR)是指在正常用法用量下,药物产生的与治疗目的无关或意外的有害反应。
近年来,随着药品种类的不断增多和人们用药观念的改变,药物不良反应报告及处理工作在我国得到了越来越多的关注。
我所在的工作单位也高度重视这项工作,积极建立和完善药物不良反应监测体系,提高药品安全性预警能力。
二、工作重点我的工作重点主要包括以下几个方面:1.收集和分析药物不良反应信息:定期收集国内外药物不良反应报道,对不良反应案例进行详细分析,评估药物安全风险。
2.制定和实施药品监测政策:根据国家相关政策,制定药品不良反应监测方案,组织实施,确保监测工作顺利进行。
3.及时反馈和处理不良反应信息:对发现的不良反应案例,及时向相关部门报告,参与不良反应的处理工作,并专业意见。
4.提高药品安全意识:开展药品安全性教育,提高医护人员和患者的药品安全意识,促进合理用药。
三、取得成绩和做法在工作过程中,我始终秉持严谨、负责的态度,努力提高自己的业务水平。
通过不断学习和实践,我取得了一定的成绩:1.成功发现并处理多起药物不良反应案例,保障了患者用药安全。
2.参与制定的药品监测政策在实际工作中取得了良好的效果,得到了上级部门的认可。
3.通过开展药品安全性教育,提高了医护人员和患者的用药安全意识,促进了合理用药。
我的工作做法主要包括:1.注重团队合作:与同事保持良好的沟通和协作,共同应对药物不良反应挑战。
2.持续学习:关注国内外药品安全动态,不断提高自己的专业素养。
3.严谨态度:对待每一个不良反应案例,都认真分析、严谨判断,确保用药安全。
四、经验教训及处理办法在工作中,我积累了丰富的经验,也总结出一些教训:1.经验:通过不断实践,我掌握了药物不良反应的识别、评估和处理方法,提高了工作效率。
药品不良反应工作总结范文
药品不良反应工作总结范文英文回答:Adverse drug reactions (ADRs) are an important aspectof pharmacovigilance and play a crucial role in ensuringthe safety and efficacy of medications. As a pharmacovigilance officer, I have been responsible for monitoring and reporting ADRs, as well as implementing measures to minimize their occurrence. In this work summary, I will discuss the challenges faced, strategies employed, and outcomes achieved in relation to ADR reporting and management.One of the main challenges in ADR reporting is the underreporting of ADRs by healthcare professionals. Thiscan be attributed to various factors, such as lack of awareness, time constraints, and fear of legal consequences. To address this issue, I have conducted educationalsessions and workshops for healthcare professionals, highlighting the importance of ADR reporting and theprocedures involved. Additionally, I have implemented auser-friendly online reporting system, making it easier for healthcare professionals to report ADRs. These efforts have resulted in an increase in ADR reporting rates, leading toa better understanding of the safety profiles of medications.Another challenge in ADR management is theidentification and causality assessment of ADRs. Sometimes, it can be difficult to determine whether an observedadverse event is truly caused by a medication or is coincidental. To overcome this challenge, I have utilized various tools and resources, such as the Naranjo algorithm and the World Health Organization (WHO) causality assessment criteria. These tools help in systematically evaluating the likelihood of a medication causing anadverse event. By employing these tools, I have been ableto accurately identify and assess ADRs, enablingappropriate actions to be taken to ensure patient safety.In addition to reporting and management, proactive measures to minimize ADRs have also been a focus of my work.This includes conducting regular medication safety audits, reviewing prescribing patterns, and implementing risk minimization strategies. For example, if a particular medication is found to have a high incidence of ADRs, I collaborate with healthcare professionals to develop strategies to minimize the risks associated with its use. This may involve updating prescribing guidelines, providing additional training to healthcare professionals, or implementing stricter monitoring protocols. By taking these proactive measures, I have successfully reduced the occurrence of ADRs and improved patient outcomes.Overall, my work in ADR reporting and management has been instrumental in ensuring the safety and efficacy of medications. Through educational initiatives, improved reporting systems, and proactive risk minimization strategies, I have been able to overcome challenges, accurately identify and assess ADRs, and take appropriate actions to mitigate their occurrence. By continuously monitoring and addressing ADRs, we can contribute to the overall improvement of patient care and medication safety.中文回答:药品不良反应(ADR)是药物监测的重要方面,对于确保药物的安全性和疗效起着至关重要的作用。
个人药品不良反应工作总结
个人药品不良反应工作总结
个人药品不良反应工作总结:
1. 坚持严格的药品不良反应报告制度,及时汇总、分析和上报相关数据,以便监测药品的安全性。
2. 加强对医务人员和药店个人的药品不良反应监测与提示工作,提高相关人员的意识和敏感度。
3. 定期组织培训和教育活动,提高医务人员和药店个人的不良反应报告能力。
4. 建立完善的药品不良反应报告信息系统,便于方便地查阅和分析数据。
5. 加强与国内外相关机构的合作,及时掌握和交流药品不良反应问题。
6. 定期开展相关的药品安全评价工作,对不良反应高发药品进行风险评估和监测。
7. 加强对药品广告的监督和管理,避免虚假宣传和误导消费者。
8. 提高公众的药品安全意识和自我保护能力,加强自愿报告不良反应的意识。
9. 加强对特殊人群(如儿童、孕妇、老年人等)使用药品的监测和警示工作。
10. 加强对药品生产和质量控制环节的监督和抽查,确保药品的质量安全。
11. 定期评估和调整药品不良反应报告流程和工作指南,保持工作的高效性和科学性。
12. 建立健全的药品不良反应风险评估和管理机制,及时采取措施降低不良反应的风险。
药品不良反应报告(3篇)
药品不良反应报告药品不良反应报告(3篇)我们眼下的社会,报告的使用成为日常生活的常态,我们在写报告的时候要避免篇幅过长。
我们应当如何写报告呢?下面是小编收集整理的药品不良反应报告,仅供参考,大家一起来看看吧。
药品不良反应报告1有资料显示,在全球每年患者死亡病例中,约1/3是由药品不良反应(adr)所致;在我国每年5000多万住院病人中,有250多万人与药物不良反应有关,其中大量相同或相近的反应重复发生,可见用药过程中药物不良反应的发生是相当频繁的。
今年,鱼腥草、亮菌甲素(齐二药)、克林霉素注射液(欣弗)等不良反应事件的相继发生,特别是“齐二药”、“欣弗”事件,是当初作为药品不良反应案件及时报告才避免了事态的进一步恶化,使众多患者逃过一劫。
因此,强化安全合理用药意识,健全药品不良反应报告制度,规范药品不良反应监测管理,确保人民群众用药安全有效的工作刻不容缓。
一、基本情况我市是从20xx年开始启动药品不良反应监测工作的,在建立的33家adr监测单位中有18家乡镇级以上医疗机构、6家药品生产企业、9家药品经营企业,这些adr监测机构都配备的专职或兼职人员从事药品不良反应上报工作,同时建立了药品不良反应监测管理机构。
各监测单位在明确职责和加强组织建设的同时,逐步确定并完善了药品不良反应的报告程序,建立健全了adr报告制度,初步形成了我市药品不良反应报告与监测工作的组织构架,为adr监测工作的开展奠定了坚实的基础。
特别是充分发挥了医疗机构在药品不良反应监测工作中的突出作用,保证了全市药品不良反应监测网络的良性运行,使我市的药品不良反应报告在完成计划指标的同时,数量逐年提高。
其中:20xx年上报药品不良反应10例,20xx年36例,20xx年87例,20xx年204例。
二、存在的问题1、医疗机构报告adr数量和质量有待于提高。
目前,我市大多患者处方用药是经医师处方得到的,adr报告也都来源于医疗机构。
由此可见,医疗机构不仅是诊断、治疗疾病的主要场所,同时也是adr产生和防治的主要场所,还是adr监测与报告的主要场所。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016药品不良反应报告总结
今年以来,我局严格按照《药品不良反应报告和监测管理办法》认真扎实开展工作,不断加大措施,健全组织,完善制度促使药品不良反应监测工作得以顺利开展。
现将我局药品不良反应监测工作情况汇报如下。
根据年初市局下达的不良反应任务140例,截至目前共计上报149例,超额完成9例。
医疗器械不良事件22例。
药物监测工作是一项关系药品安全的基础性的工作。
目前,自监测工作开展以来,绝大部分单位能够按照规定开展监测工作,但是也出现上报单位不平衡、积极性不高、上报质量和数量不够、录用率低的现象。
为了改善此现象,我局首先要求各监测单位要切实加强领导,迅速建立健全药品不良反应监测工作机构和制度,明确专人负责,由专(兼)职人员通过填写纸质报表或电子形式进行上报,进一步规范药品不良反应报告和监测工作,保证药品不良反应报告的及时性、可靠性。
其次,加强培训、加强交流沟通。
于今年3月26日召开药品不良反应监测工作和培训会。
县食药监局相关负责人和全县乡镇以上医疗机构、民营医院及药品生产、经营企业负责人等100余人参加了会议。
会上县局主管局长通报了各上报单位药物监测开展情况,讲解了药物监测基本知识对全县药物监测工作进行了部署。
要求各上报单位平时加强学习探讨,组织本单位医生、护士、技术人员、药学人员认真学习药品不良反应监测法律法规和专业知识,采取多种形式,进一步提高药品不良反应监测的意识以及监测人员的专业技术水平。
第三、加强报表统计、通报制度。
对全县各单位药品不良反应报表进行定期统计、评估,并通过局网站或其他形式予以通报。
年终,我局将对全县药品不良反应监测、报告工作情况、报告数量及质量进行考评总结并发通报,对上报数量质量优秀的单位和个人将给予表彰。
对发现药品不良反应隐瞒不报,情节严重并造成不良后果的,将依照有关法律法规进行处理。
以上是我们在药品不良反应监测工作中的几点做法,但还是存在很大的不足,我们将加强学习、深入调研、增加交流沟通,多措并举,切实做好ADR监测工作,为全县人民健康服务。
2016年工作计划:
1、将加强学习、深入调研、增加交流沟通,提高不良反应报告的真实性、准确性、完整性。
2、广泛宣传、深化培训、加强统计、通报,调动各监测单位的上报积极性、主动性。
以上这篇药品不良反应报告总结就为您介绍到这里,希望它能够对您的工作和生活有所帮助,如果您喜欢这篇文章,请分享给您的好友,更多范文尽在:工作总结,希望大家多多支持第一公文网网,谢谢。
