化学变化中的三角转化关系图
第三章第二节铁及其化合物考点Fe2+、Fe3+的检验铁及其化合物的转化关系-课件新高考化学一轮复习

C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是 Fe3+和 Fe2+,一
定不含 Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是 Fe2+,一定
不含 Cu2+和 Fe3+
解析:氧化性 Fe3+>Cu2+>Fe2+,加入铁粉后有固体剩余,Fe3+一定不存 在;若剩余固体全部都是 Cu,溶液中还可能有 Cu2+,也可能恰好被完全 置换;若剩余固体是 Cu 和 Fe,则溶液中不可能有 Cu2+和 Fe3+。 答案:D
(1)Fe 只具有还原性,可以被氧化剂氧化 ①与弱氧化剂反应 Fe 能被 S、Fe3+、Cu2+、H+等弱氧化剂氧化为 Fe2+,如 Fe+2Fe3+===3Fe2+。 ②与强氧化剂反应 Fe 能被 Cl2、HNO3 等强氧化剂氧化为 Fe3+。
(2)Fe2+既具有氧化性又具有还原性,以还原性为主 ①与氧化剂反应 当 Fe2+遇到强氧化剂(如 H2O2、Cl2、HNO3、酸性 KMnO4 溶液)时,被氧化 为 Fe3+,如 2Fe2++H2O2+2H+===2Fe3++2H2O。 ②与还原剂反应 当 Fe2+遇到 C、Al、Zn、CO 等还原剂时,可以被还原为 Fe,如 Fe2++ Zn===Zn2++Fe。 (3)Fe3+具有较强的氧化性,可被还原为 Fe2+或 Fe ①Fe3+被 C、CO、Al 等还原为 Fe,如 Fe2O3+2Al=高==温==2Fe+Al2O3。 ②Fe3+被 Fe、Cu、I-、H2S 等还原为 Fe2+,如 2Fe3++Cu===2Fe2++Cu2+, 2Fe3++H2S===2Fe2++S↓+2H+。
FeCl2(aq) FeCl3(aq)
加过量铁粉后过滤
立谁志不是 向事前业看的,大谁门就,会工面作临是许登多门困入难室。的旅程。
第三章第12讲铁及其化合物的转化关系2025年高考化学一轮复习

第三章 金属及其化合物
第12讲 铁及其化合物的转化关系
化学
高考总复习精准备考方案
— 返回 —
— 返回 —
[复习目标] 1.基于“价—类”二维图认识铁及其重要化合物之间的转化关系,并应 用于分析、解决相关问题。2.通过实验探究亚铁盐、铁盐的化学性质及相互转化关系。
— 2—
考点一 基于“价—类”二维图理 解铁及其化合物的转化 考点二 “铁三角”的相互转化及实 验探究
棕黄色溶液
+Cu2+
化性
— 21 —
答案
— 返回 —
【解析】 向 FeCl2 溶液中通入 Cl2,Fe2+被氧化为 Fe3+,溶液变成棕黄色,Fe2+作还原 剂,表现还原性,A 正确;向 FeCl2 溶液中加入锌片,Zn 将 Fe2+还原为 Fe,溶液变成无色, Fe2+作氧化剂,表现氧化性,B 正确;向 FeCl3 溶液中加入铁粉,发生反应:2Fe3++Fe===3Fe2 +,Fe 作还原剂,表现还原性,C 正确;向 FeCl3 溶液中加入铜粉,发生反应:2Fe3++Cu===2Fe2 ++Cu2+,溶液由棕黄色变为蓝色,Fe3+作氧化剂,表现氧化性,D 错误。
2Fe3++Cu===2Fe2++Cu2+
。
(3)向 FeSO4 溶液中滴加 KMnO4(H+):
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
。
(4)将 FeCl2 溶液滴入稀硝酸中,有无色气体放出:
3Fe2++NO- 3 +4H+===3Fe3++NO↑+2H2O
。
— 13 —
— 20 —
解析
— 返回 —
二、实验探究“铁三角”的转化关系
3.(教材改编题)为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验
高考化学一轮复习(第二辑)考点26 铝的冶炼及含铝化合物之间的转化(含解析)
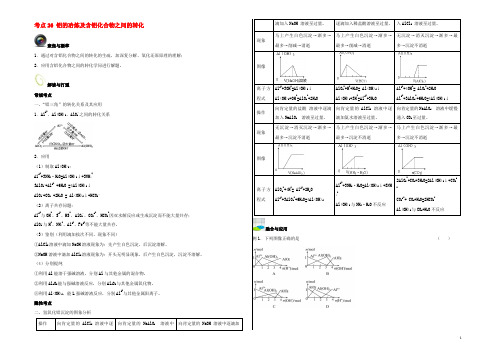
考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。
化学平衡移动(图像)

实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化
剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
√C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
√D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催
化剂效率较高
1.下列图象中,不能表示反应A2(g)+ 3B2(g) 2AB3(g)(△Q>0)平衡体系 的是…( D )
V(逆)
V(逆)
0 ⑤增大压强
t
0
⑥减小压强
t
增大压强时,正逆反应速率都
增大,但
增大程度相同 ,减小压强时,正逆反应速率都 减小 ,但 减小程度相同 ,故平衡 不 移动。
2、压强变化对化学平衡的影响
结论: mA(g)+nB(g) pC(g)+qD(g)
对于有气体参与的反应:
(1)若m+n==p+q : 增大压强,平衡往气体分子数减少的方向移动 ;
二、速率-时间图:可用于:
பைடு நூலகம்
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
1、以mA(g)+nB(g) 为例
qC (g);
若增大压强,或升高温度,重新达到平
衡v正、v逆变化如图,则△Q_<__0, m+n__>_q
高中化学必修一 课时第3章第7节 铝的重要化合物20202021学年精品讲义)

铝的重要化合物【学习目标】1、掌握铝的重要化合物[Al2O3、Al(OH)3、Al3+、AlO-2、KAl(SO4)2·12H2O]的主要性质及其应用2、掌握“铝三角”及其转化,熟悉铝的化合物的互滴实验【主干知识梳理】一、氧化铝(Al2O3)1、物理性质:白色固体,难溶于水,熔点很高,是优良耐火材料2、化学性质:Al2O3是典性的两性氧化物,既能与酸,又能与碱反应(1)能与酸反应:Al2O3+6HCl===2AlCl3+3H2O Al2O3+6H+===2Al3++3H2O(2)能与碱反应:Al2O3+2NaOH===2NaAlO2+H2O Al2O3+2OH—===2AlO2—+H2O两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,称为两性氧化物3、Al2O3的制备(1)实验室制法:2Al(OH)3Al2O3+3H2O(2)工业制法:铝土矿→Al2O34、主要用途:制造耐火、耐高温器材、工业冶炼铝、可以制作各种宝石【即学即练1】1、下列叙述中不正确的是()A.氧化铝固体不溶于水,不导电,它是非电解质B.氧化铝熔点很高,是一种较好的耐火材料C.氧化铝是一种白色的固体,是冶炼铝的原料D.铝表面形成的氧化铝薄膜可防止铝被腐蚀2、下列关于氧化铝的叙述正确的是()A.氧化铝与酸、碱都能反应生成铝盐和水B.氧化铝既是碱性氧化物又是酸性氧化物C.氧化铝既不是碱性氧化物也不是酸性氧化物D.氧化铝溶于水可得到氢氧化铝3、下列说法正确的是()A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物B.因为Al2O3是金属氧化物,所以它是碱性氧化物C.Al2O3能跟所有的酸、碱溶液反应D.Al2O3能跟强的酸、碱溶液反应二、氢氧化铝[Al(OH)3]1、物理性质:白色胶状不溶于水的固体,有较强的吸附性2、化学性质:Al(OH)3是典型的两性氢氧化物,既能与酸,又能与碱反应(1)能与酸反应:Al(OH)3+3HCl===AlCl3+3H2O Al(OH)3+3H+ ===Al3++3H2O(2)能与碱反应:Al(OH)3+NaOH===NaAlO2+2H2O Al(OH)3+OH—===AlO2—+2H2O两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物Al(OH)3的电离方式与酸和碱反应过程Al(OH)3电离强度相当微弱,只有加入强酸(或强碱)时,大量H+(或OH-)才能破坏Al(OH)3的电离平衡,使平衡向右(或左)移动,生成铝盐(或偏铝酸盐),所以Al(OH)3既具有碱性,又具有酸性,当加入弱酸或弱碱时,因H+或OH-浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸(H2CO3等)、弱碱(NH3·H2O)微点拨强酸或强碱也是相对而言的,Al(OH)3不溶于H2CO3、NH3·H2O,但溶于CH3COOH(3)热稳定性差:2Al(OH)3Al2O3+3H2O3、用途(1)Al(OH)3有较强的吸附性,能凝聚水中悬浮物,又能吸附色素,可以用作净水剂(2)Al(OH)3碱性不强,不至于对胃壁产生强烈的刺激作用或腐蚀作用,却可以与酸反应,起到中和胃酸的作用,可以用作胃酸中和剂4、有关Al(OH)3的少量、过量问题(1)NaOH和AlCl322 2【即学即练2】1、下列关于Al(OH)3的性质叙述错误的是()A.受热易分解生成Al2O3和H2O B.是难溶于水的白色胶状物质C.能凝聚水中的悬浮物,也能吸附色素D.既能溶于NaOH溶液、氨水,又能溶于盐酸2、以硫酸铝溶液为原料之一,在实验室里制取少量氢氧化铝,并且容易分离,最好向溶液中加入的是() A.氢氧化钠溶液B.氢氧化钡溶液C.稀盐酸D.氨水3、氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的哪个性质()A.酸性B.碱性C.两性D.氧化性三、明矾——十二水合硫酸铝钾(1)化学式:KAl(SO4)2·12H2O (十二水合硫酸铝钾)(2)电离方程式:KAl(SO4)2==K++Al3++2SO42-(3)属类:复盐(由两种不同的金属离子和一种酸根离子组成的化合物)(4)物理性质:无色晶体,可溶于水(5)用途:作净水剂,原因是其在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来(6)化学性质:兼有Al3+和SO42-性质①向明矾中滴入Ba(OH)2溶液,当Al3+恰好完全沉淀时(沉淀的物质的量最大),化学方程式为:______________________________________________________________________________②向明矾中滴入Ba(OH)2溶液,当SO42-完全沉淀时(沉淀的质量最大),化学方程式为:_________________________________________________________________________________【即学即练3】1、关于明矾的下列说法错误的是()A.明矾的化学式为KAl(SO4)2 B.明矾是纯净物C.明矾中存在K+和Al3+两种阳离子D.明矾是一种复盐2、明矾是一种净水剂,明矾净水的原理是()A.Al3+有较强的吸附性B.Al3+与悬浮物生成沉淀C.Al3+与水反应生成的氢氧化铝胶体,具有吸附性D.明矾难溶于水四、互滴实验(试剂的滴加顺序不同而产生的现象不同)1、NaOH和AlCl3(1)向AlCl3溶液中逐滴加入NaOH溶液(开始时NaOH不足)先:AlCl3+3NaOH===Al(OH)3↓+3NaCl产生白色沉淀后:Al(OH)3+NaOH===NaAlO2+2H2O沉淀溶解现象:先产生白色沉淀后沉淀消失(2)向NaOH溶液中逐滴加入AlCl3溶液(开始时NaOH过量)先:AlCl3+4NaOH===NaAlO2+3NaCl+2H2O无白色沉淀产生后:3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+3NaCl产生白色沉淀现象:开始无现象后出现白色沉淀2、NaAlO2和盐酸(1)向NaAlO2溶液中逐滴加入盐酸先:NaAlO2+HCl+H2O===Al(OH)3↓+NaCl产生白色沉淀后:Al(OH)3+3HCl===AlCl3+3H2O沉淀溶解现象:先产生白色沉淀后沉淀消失(2)向盐酸中逐滴加入NaAlO2溶液先:NaAlO2+4HCl===NaCl+AlCl3+2H2O无白色沉淀产生后:3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+3NaCl产生白色沉淀现象:开始无现象后出现白色沉淀3、Na2CO3溶液与盐酸(1)向Na2CO3溶液中逐滴加入盐酸(开始时酸不足)先:Na2CO3+HCl===NaHCO3+NaCl无气体产生后:NaHCO3+HCl===NaCl+H2O+CO2↑有气体产生现象:刚开始无气泡产生,盐酸滴加到一定量后,有气泡产生(2)向盐酸中逐滴加入Na2CO3溶液(开始时酸过量)2HCl+Na2CO3===2NaCl+CO2↑+H2O现象:立即产生大量的气泡【即学即练4】1、(多选)下列各组物质的无色溶液,不用其他试剂即可鉴别的是()A.NaOH、AlCl3B.NaHCO3、H2SO4C.NaAlO2、NaHSO4D.Na2CO3、HCl E.Na2CO3、NaHCO3、Ca(OH)22、(多选)下列各组溶液中,只用试管和胶头滴管,不用其他任何试剂就可以鉴别的是() A.KOH和Al2(SO4)3B.稀盐酸和Na2CO3C.CaCl2和Na2CO3D.Ba(OH)2和NaHSO43、下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是() A.H2SO4滴入NaAlO2溶液中B.Ba(OH)2溶液滴入Al2(SO4)3溶液中C.Al2(SO4)3溶液滴入NaOH溶液中D.氨水滴入Al2(SO4)3溶液中4、下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有几组()①向饱和碳酸钠溶液中通入CO2至过量②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量③向BaCl2溶液中通入CO2至过量④向澄清石灰水中逐渐通入CO2至过量⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量⑥向NaAlO2溶液中逐滴滴加盐酸至过量⑦向NaAlO2溶液中逐渐通入CO2至过量⑧向NaOH溶液中逐滴滴加AlCl3至过量A.2 B.3 C.4 D.5五、“铝三角”的转化关系及其应用1、Al3+、Al(OH)3、AlO-2之间的转化关系Al3+→Al(OH)3①Al3++3NH3·H2O===Al(OH)3↓+3NH+4②Al3++3AlO-2+6H2O===4Al(OH)3↓③Al3++3OH-===Al(OH)3↓Al(OH)3→Al3+Al(OH)3+3H+===Al3++3H2O Al3+→AlO-2Al3++4OH-===AlO-2+2H2O AlO-2→Al3+AlO-2+4H+===Al3++2H2OAlO-2→Al(OH)3①AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3(CO2过量)②AlO-2+H++H2O===Al(OH)3↓Al(OH)3→AlO-2Al(OH)3+OH-===AlO-2+2H2O2、“铝三角”转化的应用(1)选择制备Al(OH)3的最佳途径①向铝盐中加入足量氨水,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH+4②向偏铝酸盐中通入足量CO2,离子方程式为:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3③NaAlO2与AlCl3的溶液混合,离子方程式为:3AlO-2+Al3++6H2O===4Al(OH)3↓(2)分析离子反应顺序①向含有H+、NH4+、Al3+的混合溶液中逐滴加入NaOH,反应的顺序是:______________________②向含有OH-、CO32-、AlO2-的混合溶液逐滴加入盐酸,反应的顺序是:______________________【即学即练5】1、向HCl、MgCl2、AlCl3、NH4Cl溶液中(假设各1 mol),逐滴加入NaOH溶液,沉淀的物质的量随NaOH溶液体积变化的图像如图。
高中化学第7讲 常见元素及其化合物的性质及转化(教案)

第7课时 核心价值——常见元素及其化合物的性质及转化(学科本质价值)常见元素及其化合物的性质及转化是高考命题的热点,该类试题体现《化学课程标准》对“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”等学科核素素养的要求,要求考生能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“性质决定性质”的观念,能从宏观和微观相结合的视角分析与解决实际问题。
1.直线型转化关系A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HCl Al(OH)3――→HCl AlCl 3Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOHAlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属:用H 2、C 冶炼金属。
(2020·江苏卷)下列选项所示的物质间转化均能实现的是( )A .NaCl(aq)――→电解Cl 2(g)――→石灰水漂白粉(s)B .NaCl(aq)――→CO 2(g )NaHCO 3(s)――→加热Na 2CO 3(s)C .NaBr(aq)――→Cl 2(g )Br 2(aq)――→NaI (aq )I 2(aq)D .Mg(OH)2(s)――→HCl (aq )MgCl 2(aq)――→电解Mg(s)C [由Cl 2制备漂白粉应通入石灰乳而不是石灰水中,A 项错误。
化学反应速率和化学平衡图像

化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。
2021-2022学年黑龙江省大庆市东城领秀学校九年级下学期开学摸底考试化学试卷有答案

阴离子阳离子
OH-
Ca2+
微溶
不溶
可溶
Mg2+
不溶
微溶
可溶
【查阅资料】天然水中含有Ca2+、Mg2+、 等离子,在加热条件下,这些离子趋于生成溶解度更小的物质—水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见右表:
下列有关说法正确的是
A.第①步中除去粗盐中的 、Ca2+、Mg2+等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸
B.第②步中加入的试剂为CaCl2溶液
C.第③步中发生分解反应
D.在第④步中溴元素被还原
二、填空题(共30分)
11.化学用语可准确、简洁表达化学信息。
一、单选题(10个小题,每题4分,共40分)
【1题答案】C【2题答案】C【3题答案】C【4题答案】B【5题答案】A
【6题答案】D【7题答案】A【8题答案】D【9题答案】C【10题答案】C
二、填空题(共30分)
【11题答案】(1)①.NH3②.3Mg2+(2)①.P②.3##三
(3)①.1:1②.18③.
(2)实验室制取二氧化碳应选用的一组装置是_______(填序号),反应的化学方程式是_____。图G是某同学利用报废试管设计的制二氧化碳的发生装置,该设计除了废物利用的优点外,请另写一个优点:________。
(3)用收集的氧气完成图E铁丝燃烧的实验,集气瓶中预先放少量水的原因是_______;如图F向装满CO2的软塑料瓶注入约1/3体积的水,立即旋紧瓶盖,振荡,观察到的现象是_________。
