第四节 氨 硝酸 硫酸(第2课时)PPT课件
高中化学第四节氨硝酸硫酸硝酸(第2课时)课件新人教版必修1

N2+3H2 催化剂 2NH3
催化剂
4NH3+5O2==△== 4NO+6H2O
2NO + O2=== 2NO2
3NO2
+H2O
===2HNO 第六页,共20页。
3
+NO
第四节 氨 硝酸(xiāo suān) 硝酸硫(xi酸ā(o s三uā)n)
第七页,共20页。
三、硝酸(xiāo suān)
第四页,共20页。
若该实验在标况下完成,烧瓶(shāopíng)的 容积为VL,喷泉实验后溶液充满整个烧瓶 (shāopíng),所得溶液中溶质的物质的量浓 度为多少?
V c n 22.4 1 mol / L
V V 22.4
第五页,共20页。
O2 O2 H2O
N2 NH3 NO NO2 HNO3
第十八页,共20页。
氧化(yǎnghuà)性酸小结: 硝酸(浓或稀)、硫酸(浓)、次氯酸、王水 (wángshuǐ)(硝酸和盐酸)等,都是具有强氧 化性的酸。
易钝化物质(wùzhì)小结: Mg、Al在空其表面形成致
密的氧化物薄膜而钝化。
第四节 氨 硝酸(xiāo suān) 硫酸(二) 硝酸(xiāo suān)
第一页,共20页。
【思考(sīkǎo)】:
将氨的酚酞溶液倒入拴有小气球的试管中, 加热。
现象(xiànxiàng):溶液红色褪色,冷却后 恢复红色。
NH3·H2O不稳定,受热时容易(róngyì)分解 为NH3和H2O。不加热不分解.
第十九页,共20页。
硝酸(xiāo suān)的用途: 硝酸是一种重要的化工原料, 可用于制造炸药、染料 (rǎnliào)、塑料、硝酸盐等, 在实验室里它是一种化学试剂。
第四节 氨 硫酸 硝酸

△
与非金属反应
C+ 2H2SO4(浓) === CO2↑+ 2SO2↑+ 2H2O
△
在加热条件下,浓硫酸能与大多数金属或 非金属起氧化还原反应生成二氧化硫。
思考与交流
设计一个实验检验碳与浓硫酸反应的生 成物。
有人认为,“比较浓硝酸和稀硝酸的还原产物 的化合价,浓HNO3中的氮从+5降为+4,而稀 HNO3中的氮从+5价降为+2,从化合价变化可 以判断稀硝酸的氧化性比浓硝酸强。”这种看 法是否正确?为什么?
2、强氧化性
与金属反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
[4Zn + 10HNO3(稀) = 4Zn(NO3)2 + N2O + 5H2O]
④非金属单质可被HNO3氧化为最高价氧化物或其
含氧酸。
应用:
1、实验室可利用这个性质来检验NH4+的 存在。 2、实验室制取氨气。
原理:
氨气的实验室制法
△ 2NH4Cl + Ca(OH) 2 === CaCl2 + 2NH3↑+ 2H2O 装置:固体 + 固体加热
收集方法:
向下排空气法检验Biblioteka 法:使湿润的红色 石蕊试纸变蓝
环保措施:
在试管口塞一团用稀硫酸浸湿的棉花。
玻尔巧藏诺贝尔金奖章
丹麦有位叫玻尔的科学家,37岁时他获得了 1922年的诺贝尔奖。第二次世界大战期间,玻尔被 迫离开即将被德军占领的祖国,为了表示他一定要 返回祖国的决心,他决定将诺贝尔奖章留在实验室。 玻尔把金奖章溶解在盛有王水试剂瓶里。后来,纳 粹分子窜入玻尔实验室,那个试剂瓶就在他们的眼 皮底下,他们却一无所知。战争结束后,玻尔 从王 水中把金还原出来,并重 新铸成奖章。而玻尔配制
莫第四章第4节_《氨、硝酸、硫酸》课件

③ 氨的还原性----氨的催化氧化
催化剂
4NH3+5O2
H2
△
4NO+6H2O
O2
H2O
硝酸的制取过程
N2 NH3 催化氧化 NO
O2
NO2
HNO3
思考: 1.上述反应中,氮元素发生氧化反应
和发生还原反应的是哪几步?
3、氨的用途
制氮肥 铵盐
制硝酸 纯碱
氨的用途
有机合成 工业原料
致冷剂
巩固: 1.某同学在实验室中发现了一瓶有刺激性气 味的气体,判断可能是氨气,下列提供的 方法中,你认为能帮他检验是否为氨气的 方法是( AC ) A、将湿润的红色石蕊试纸放在瓶口 B、将干燥的红色石蕊试纸放在瓶口 C、用蘸有浓盐酸的玻璃棒靠近瓶口 D、将湿润的蓝色石蕊试纸放在瓶口
(NH4)2SO4 + 2NaOH===Na2SO4+2NH3↑+2H2O
NH4NO3 + NaOH===NaNO3+NH3 ↑+H2O
NH4+的检验: 讨论后回答:取样、操作(试剂)、现象、 结论。 (1)取少量样品与碱混合于试管中共热,用 湿润的红色石蕊试纸靠近试管口,若试纸 变蓝,则证明样品中含有NH4+;
金属单质+浓硫酸
硫酸盐 + SO2↑+ H2O
常温下,浓H2SO4可使 Fe、Al等金属钝化
浓硫酸作干燥剂
1. 不能干燥碱性气体:NH3 2.不能干燥还原性气体:
H2S、HI、HBr
3.能够干燥: SO2、HCl、 CO2、 H2、 O2等
思考题: 如何用实验方法证明木炭与浓硫酸
反应的产物? 提供以下试剂与装置(装置可多次使用):
高一化学第四节氨、硝酸、硫酸
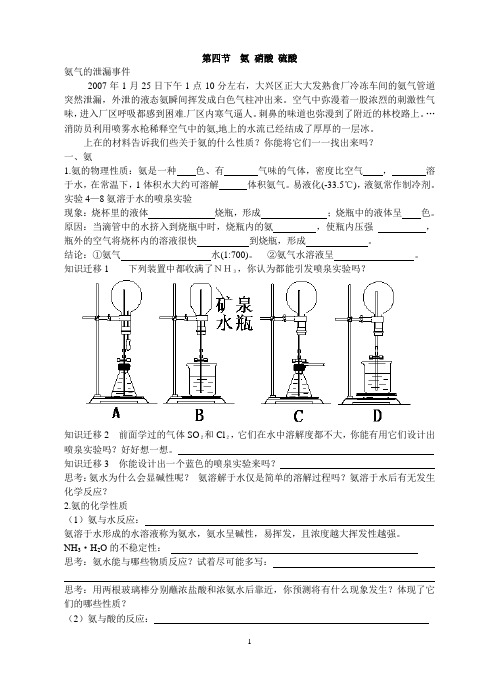
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
第四节氨、硝酸、硫酸

思考:稀释浓硫酸时应该如何操作?
正确操作: 将浓硫酸慢 慢地沿器壁倒入盛有蒸 馏水的烧杯内,并用玻 棒不断搅拌。 如果不小心把少量浓硫酸沾 在皮肤上,应如何处理? 如果不小心沾上硫酸,应立即用布拭去,然 后用大量的水冲洗,最后涂上3%-5%的 NaHCO3溶液。
三、浓硫酸的特殊性
1、吸水性 应用:作干燥剂(实验室中常用来 干燥不与它起反应的气体。)
思考题:
如何实现下列转化:
S SO2 SO3 H2SO4
一、稀硫酸具有酸的通性:
H2SO4==2H++SO42(1)使酸碱指示剂变色 (2)与活泼金属反应生成盐和氢气
(3)与金属氧化物反应生成盐和水
(4)与碱反应生成盐和水 (5)与某些盐反应生成新盐和新酸
二、浓硫酸的物理性质
• 纯硫酸:无色、黏稠、油状、液体 • 浓硫酸: ρ=1.84g/cm3, ω=98.3%, c=18.4mol/L • 密度大 ρ=1.84g/cm3 • 高沸点(338℃ )—— 难挥发 • 极易溶于水,能与水以任意比混溶 • 溶解时放出大量的热
硫酸铜
品红1
检验CO2
KMnO4 品红2
石灰水
检验SO2是否除尽
三、浓硫酸的特殊性
3、氧化性 ⑵与金属反应
演示实验4-9:观察硫酸溶液与品红溶液的变化 现象: 有气体产生,此气体使品红溶液褪色 反应后溶液倒入少量的水中,溶液呈蓝 色。 反应原理: △ Cu+2H2SO4 (浓)== CuSO4+SO2↑+2H2O
三、浓硫酸的特殊性
强 3、 氧化性
化合价升高,失2e—,被氧化
+4 ∆ +2 +6 Cu + 2H2SO4(浓)==CuSO4 + SO2 ↑ + 2H2O 0 +6
H2SO4浓硫酸

第四节 氨 硝酸 硫酸 (第二课时)三维目标:知识与技能:掌握浓硫酸的重要性质-----氧化性。
过程与方法:通过对浓、稀硫酸的化学性质的对比,学习比较的方法,培养分析、归纳归纳的能力。
情感态度与价值观:通过比较浓稀硫酸性质的差异,体会“量变到质变”的哲学观。
重难点:硫酸的氧化性。
学法指导:复习稀硫酸的化学性质,掌握浓硫酸特殊的化学性质。
知识链接:酸的通性:(1)酸使石蕊试液变 。
(2)酸+碱(3)酸+碱性氧化物(4)酸+盐 新酸+新盐(5)酸 + 金属 盐 +氢气学习内容: 一、硫酸1、硫酸的物理性质纯硫酸是一种 油状液体。
H 2SO 4的质量分数为98.3%的浓硫酸的沸点是338℃.硫酸是一种 的强酸,易溶于水,能以任意比与水混溶。
浓硫酸溶解时放出大量的热。
2、硫酸的化学性质(1)硫酸的吸水性。
例如做干燥剂 (2)强氧化性(实验4-9)实验现象:加热时反应,放出能使紫色石蕊试液变 或使品红溶液 的气体。
反应后生成物的水溶液显 色。
Fe 、Al 遇冷 浓硫酸发生“钝化”在常温下,浓硫酸与铁、铝接触时,能在金属表面生成一薄层致密的氧化物,从而阻止内部的金属继续反应,这种现象叫钝化。
因此可以用 或 器皿贮存浓硫酸,但是在加热条件下它们可以反应。
温馨提示:钝化是氧化还原反应,是化学变化而不是物理变化。
练习:写出化学方程式并标出电子转移的方向和数目。
H 2SO 4(浓)+ Cu △H 2SO 4(浓)+ C △(3)硫酸的脱水性。
例如图4-31合作学习:此反应中放出的有刺激性气味的气体是什么?怎样产生的?3、硫酸用途:硫酸是化学工业中最重要的产品之一,用途极广。
达标训练:1.(A )将下列性质的番号,填入各小题后面对应的括号中:A .脱水性;B .强酸性;C .二元酸;D .氧化性; (E) 吸水性(1)将胆矾放入装有浓H 2SO 4的干燥器中,过一段时间胆矾变白色。
( ) (2)NaOH 与H 2SO 4反应,可生成Na 2SO 4和NaHSO 4这两种盐。
高一化学人教版必修1课件:第四章 第四节 第一课时 氨 (33张PPT)

C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 解析:铵盐与氢氧化钠溶液共热产生氨气,B、C、D 均能够
检验出氨气,但 A 将铵盐直接加热,会产生干扰氨气检验的
生成物(如碳酸氢铵),导致无法准确地检验,A 不可行。
答案:A
氨气的实验室制法
1.实验室能否用加热氯化铵的方法制取氨气? 提示:不能,氯化铵受热分解生成的氨气和氯化氢遇冷 会重新结合生成氯化铵。 2.实验室制取氨气时常在收集氨气的试管口塞一团疏松 的棉花团,其目的是什么?
提示:防止氨气与空气的对流,以收集到较纯净的氨气。
1.氨气的干燥装置 通常用碱石灰干燥氨气,不能用五氧化二磷、浓硫酸和无 水氯化钙干燥。
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
形成喷泉的条件 使容器内外产生较大压强差的两类情况 (1)容器内气体极易溶于水或容器内气体易与溶液中的溶质发 生化学反应。 ①喷泉形成原理:
气体与水或其 气体溶解或发 容器内压 外部液体进入 他液体接触 ―→ 生化学反应 ―→ 强减小 ―→ 形成喷泉
②常见气体与吸收剂的组合
气体
HCl
NH3
CO2、Cl2、 H2S、SO2
NO2+O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液
水
(2)容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)
2.尾气处理 多余的氨要吸收掉(可在导管口放一团用水或稀硫酸浸湿 的棉花球)以避免污染空气。在尾气吸收时要防止倒吸,常采 用的装置有:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
失2e-×1
0
+6
+2
+4
Cu + 2H2SO4(浓) = CuSO4+ SO2↑+ 2H2O
得2e-×1
还原剂 氧化剂
氧化产物 还原产物
若铜过量,硫酸能否完全反应?为什么?
2021/2/27
15
二、硫酸和硝酸的氧化性
在常温下,浓硫酸跟某些金属,如铁、 铝等接触时,能够使金属表面生成一薄层 致密的氧化物薄膜,从而阻止内部的金属 继续跟硫酸发生反应(钝化现象)。因此, 冷的浓硫酸可以用铁或铝的容器贮存。但 受热时,浓硫酸可以与Fe、Al反应。
2021/2/27
20
二、硫酸和硝酸的氧化性
③与活泼金属
常温下,与铁和铝等接触发生钝化
受热时,能跟绝大多数金属发生反应
2021/2/27
21
二、硫酸和硝酸的氧化性
【思考】浓硫酸具有强氧化性,稀硫酸是否 有氧化性?如果有,其氧化性与浓硫酸的氧 化性有何不同? 浓硫酸与稀硫酸比较:
稀H2SO4:由H+和SO42-构成——弱氧化性(由H+体 现)——可与活泼金属反应生成H2 浓H2SO4:由H2SO4分子构成——强氧化性(由 S 体现)— 加热时可与大多数金属和某些非金
6
二、硫酸和硝酸的氧化性
思考:如何稀释浓硫酸?
将浓硫酸沿着容器内壁(或沿着玻璃棒)缓
慢地注入水中,并用玻璃棒不断搅拌,使 产生的热量迅速扩散。
将浓硫酸与其它低密度的液体混合时,方法 与硫酸在水中的溶解方法相同。
2021/2/27
7
二、硫酸和硝酸的氧化性
【讨论】:现有浓硫酸、浓盐酸 各一瓶(无标签,试剂瓶大小一 样,酸的体积相同),不用化学 方法怎样识别?根据是什么?
第四章 非金属及其化合物 第四节 氨 硝酸 硫酸
第2课时
2021/2/27
1
二、硫酸和硝酸的氧化性
思考与交流
1、硫酸、硝酸、盐酸都是酸,它们在组成上用什么 特点? 它们都是酸,在水溶液中电离出H+,硫酸、硝酸 是含氧酸,盐酸是无氧酸;硫酸是二元酸,硝酸 和盐酸是一元酸
2、这些特点与酸的通性有什么关系?用电离方程 式表示。 在水溶液中都电离出氢离子 HA=H++A— 3、实验室里用金属与酸反应制取氢气时,往往用稀硫
2021/2/27
11
二、硫酸和硝酸的氧化性
现象:蔗糖变黑,体积膨胀,形成疏松多孔的
海绵状的炭,并有刺激性气味的气体产生。 反应如下:
C12H22O11浓H2SO4 12C+11H2O
蔗糖
2021/2/27
12
二、硫酸和硝酸的氧化性
【实验4-9 】
浸有碱液 的棉团
品红溶液 石蕊溶液
浸有碱液的棉团的作用,吸收多余的SO2, 防止大气污染
2021/2/27
16
二、硫酸和硝酸的氧化性
运硫酸的铁罐车
2021/2/27
17
二、硫酸和硝酸的氧化性
②与某些非金属反应 2H2SO4(浓)+C=△=CO2↑+2H2O+2SO2↑ 氧化剂 还原剂
气态的CO2、SO2从炭的空隙中冲 出,导致了炭内形成无数个分布 不均的孔洞,使炭呈多孔蓬松状。
2021/2/27
2021/2/27
13
二、硫酸和硝酸的氧化性
铜分别和浓、稀硫酸反应比较
反应物 条件
现象
结论
铜和 不加热 稀硫酸 加热
无变化 无变化
常温下不反应 加热也不反应
铜和 不加热 浓硫酸
加热
无变化
常温下不反应
有使品红褪色 的气体产生
产物为SO2
溶液变蓝 产物有铜盐
2021/2/27
14
二、硫酸和硝酸的氧化性
气味、状态(油状)、 重量、白雾
2021/2/27
8
二、硫酸和硝酸的氧化性
2、浓硫酸的特性
⑴ 吸水性 浓硫酸吸收物质本来就有的水),
直接与水分子结合; 用途:可以作干燥剂 可用来干燥与它不起反应的气体,如 H2、 O2、Cl2、CO2、CO、CH4、SO2、N2、 NO2、NO、HCl。 不能干燥NH3、H2S、HBr、HI
属反应,通常生成SO2
2021/2/27
22
二、硫酸和硝酸的氧化性
练习:下列现象反映了硫酸的哪些主要性质 (1)浓硫酸滴在木条上,过一会儿,木条变黑。 (2)敞口放置浓硫酸时,质量增加。 (3)锌粒投入稀硫酸中,有气泡产生。 (4)把铜片放入浓硫酸里加热,有气体产生。 (5)利用浓硫酸和食盐固体反应可制HCl气体。 (6)浓硫酸不能用来干燥硫化氢气体。 (7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
18
二、硫酸和硝酸的氧化性
如何用实验方法证明木炭与浓硫酸反应的产物?
提供以下试剂与装置(装置可多次使用):
澄清石灰水 饱和NaHCO3
无水硫酸铜
2021/2/27
品红
KMnO4溶液
19
二、硫酸和硝酸的氧化性
仪器连接如下:
说明:应首先用无水硫酸铜验证水,然后用品 红验证二氧化硫,再用高锰酸钾氧化多余的二 氧化硫,接着再次验证二氧化硫是否全部被氧 化,最后才验证二氧化碳。
酸或盐酸,而不用浓硫酸或硝酸,这是为什么?
2021/2/27
2
二、硫酸和硝酸的氧化性
一、硫酸(H2SO4) (一)稀硫酸具有酸的通性
H2SO4=2H++SO42- ①与指示剂反应; ②与活泼金属反应; ③与金属氧化物反应生成盐和水; ④与盐的反应生成新盐和新酸; ⑤与碱的反应,生成盐和水。
2021/2/27
2021/2/27
9
二、硫酸和硝酸的氧化性
2021/2/27
10
二、硫酸和硝酸的氧化性
⑵ 脱水性
脱水性是指浓硫酸能把有机物中的氢氧原 子按2:1(H2O)的个数比脱去。
【实验】取10g蔗糖放入小烧杯中,加入几滴 水,用玻璃棒搅拌均匀,再加入10mL浓硫酸, 并用玻璃棒迅速搅拌。观察物质的颜色、体 积变化并闻味。
②、纯硫酸难挥发,沸点338℃。 (高沸点酸)
③、密度:质量分数为98.3%的硫酸的密 度为1.84g/cm3
2021/2/27
5
二、硫酸和硝酸的氧化性
④、易溶于水,能以任意比与 水混溶
(浓硫酸溶解时放出大量的热)
浓硫酸的特点“两高”、“两 大”:高沸点,密度高,溶解度 大,溶解放热量大。
2021/2/27
3
二、硫酸和硝酸的氧化性
稀硫酸
H+ SO42- H+ SO42- H+ SO42-
H2SO4= SO42-+2H+
石蕊试液 金属Fe 金属氧化物 碱 盐 (BaCl2) CuO Cu(OH)2
2021/2/27
4
二、硫酸和硝酸的氧化性
(二)浓硫酸 :
1、物理性质 ①、纯硫酸是无色、油状、液体(常用浓硫 酸质量分数为98.3%)。
