05-8-第四章 酶
生物化学:第四章 酶(6周1-2节)
第四章酶Enzymes本章主要内容(9学时)一.酶的概念(重点)二.维生素与辅酶(重点)三.酶促反应动力学(重点)四.酶的结构和催化作用机制(重点)五.酶的调控(重点)六.人工酶与酶工程(自学为主)一、酶的概念⏹生物机体的一切生理活动,都是由无数复杂的化学变化(反应)来实现的。
⏹生物体内进行的所有这些化学变化都在酶的催化下进行的。
⏹Much of the history of biochemistry is the history of enzyme research.一、酶的概念⏹In the late 1700s, biological catalysis was first recognized.⏹1897年,E. Büchner,首次从酵母细胞中提取出酶,实现无细胞生醇发酵。
一、酶的概念⏹1926年,James Sumner,结晶出第一个蛋白酶---脲酶。
⏹pepsin, trypsin, andother digestive enzymesAll enzymes are proteins.一、酶的概念⏹J. B. S. Haldane⏹A paper entitled “Enzymes”.weak bonding interactions between an enzyme and its substrate might be used to catalyze a reaction.一、酶的概念⏹1989年,推翻“酶都是蛋白质”这一传统概念。
⏹In 1982,Thomas Cech,RNA spliced itselfaccurately without anyprotein enzymes fromTetrahymena(四膜虫).Most Enzymes Are Proteins.一、酶的概念酶是生物催化剂⏹生物催化剂(Biocatalysts):活细胞产生的一类具有催化功能的生物分子。
生化第4章学习酶

5、80年代初发现了具有催化功能的RNA——核酶(ribozyme),这一
V、异构酶:催化 各种异构体之间的互变。
A
B
常见的有消旋和变旋、醛酮异构、顺反异构和变位酶类。
异构酶按照异构化的类型不同,分为 6 个亚类。命名时分别在底 物名称的后面加上异构酶(isomerase)、消旋酶(racemase)、 变位酶(mutase)、表异构酶(epimerase)、顺反异构酶(cistrans-isomerase)等。
几何异构 专一性
相对专一性:可作用于一类或一些结构很相似的底物。
O 酯酶:R—C—O—R′ + H2O
RCOO- +R O′H + H+
CH2OH
α-葡萄糖 苷酶
5 OH
OH
O 1O R +H2O
OH
绝对专一性:只能作用于某一底物。
第一章 酶学通论
1、酶的催化性质 2、酶的化学本质 3、酶的分类命名 4、酶的专一性 5、酶的活力与分离纯化
概述-酶的发现及研究历史
人们对酶的认识起源于生产与生活实践。 夏禹时代,人们掌握了酿酒技术。 公元前12世纪周朝,人们酿酒,制作饴糖和酱。 春秋战国时期已知用麴(曲)治疗消化不良的疾病。
2.1 酶的化学组成
化
①经酸碱水解终产物是aa
学
②能被蛋白酶水解而失活
本
③酶可变性失活
质 是
④酶是两性电解质
人卫版生物化学 第4章 酶

2. 多元催化(multielement catalysis) 3. 表面效应(surface effect)
目录
第四节
影响酶催化作用的 因素
目录
概念
研究各种因素对酶促反应速度的影响,并加以定 量的阐述。
影响因素包括有
酶浓度、底物浓度、pH、温度、 抑制剂、激活剂等。
※ 研究一种因素的影响时,其余各因素均恒定。
目录
* 举例:乳酸脱氢酶(LDH1~ LDH5)
H H H H H H H M H H M M H M M M M M M M
LDH1 亚基: (H4)
分布: 心肌细胞 中较多
LDH2 (H3M)
LDH3 (H2M2)
LDH4 (HM3)
LDH5 (M4)
肝、骨骼肌 细胞中较多
乳酸脱氢酶的同工酶
目录
目录
R
O P
O + X HO E
R
O P
O + O E HX
R'
O
R'
O
有机磷化合物
羟基酶
失活的酶
酸
Cl As Cl CH CHCl + E
SH
S
E
SH S
As
CH
CHCl +
2HCl
路易士气
巯基酶
失活的酶
酸
S E S As CH CHCl
CH2
SH SH OH E
SH
CH2
S As CH CHCl S OH
目录
一、底物浓度对反应速度的影响
研究前提 I. 单底物、单产物反应 II. 酶促反应速度一般在规定的反应条件下, 用单位时间内底物的消耗量和产物的生 成量来表示 III. 反应速度取其初速度,即底物的消耗量 很小(一般在5﹪以内)时的反应速度 IV.底物浓度远远大于酶浓度
《生物化学第四章酶》PPT课件

2×9600 2×56000
第三节 酶的分类和命名
一、酶的分类
1. 氧化还原酶 Oxido-reductase
氧化-还原酶催化氧化-还原反应。主要包括脱氢
酶(dehydrogenase)和氧化酶(Oxidase)。
AH2+B
A+BH2
如: 乳酸脱氢酶催化乳酸的脱氢反应。
CH3CHCOOH NAD+
根据酶蛋白质分子的特点,将酶分为:
单体酶:仅有一个活性中心,由一条或多条共价 相连的肽链组成的酶分子。
牛胰RNase 鸡卵清溶菌酶 胰凝乳蛋白酶
124 aa 129 aa 三条肽链
单链 单链
寡聚酶:由两个或多个相同或不同亚基组成的酶。 单独的亚基一般无活性。
① 含相同亚基的寡聚酶: 苹果酸脱氢酶(鼠肝),2个相同的亚基
二、酶的命名
(1) 国际系统命名法(systematic name)
是以酶所催化的整体反应为基础,规定每一种酶的名 称应当明确标明酶的底物及催化反应的性质。
(2)习惯命名法(recommended name)
根据酶的作用底物及其所催化的反应类型来命名。
如: 谷氨酸 + 丙酮酸 -酮戊二酸 + 丙氨酸 丙氨酸: -酮戊二酸氨基转移酶 谷丙转氨酶
比非催化高108~1020倍,比非生物催化剂高107~1013
2. 倍酶。具有高度专一性
酶对反应的底物和产物都有极高的专一性,几乎没 有副反应发生。
3. 酶易失活
常温、常压,中性pH 环境下反应。
4. 酶的催化活性可被调节控制
酶抑制剂调节、反馈调节、酶原激活、共价修饰、 激素控制等。
三、酶的化学本质
O
生物化学第四章酶

是指酶在催化生化反应时对底物的选择性,即一种酶只能作 用于某一类或某一种特定的物质。亦即酶只能催化某一类或 某一种化学反应。
如:蛋白酶催化蛋白质的水解;淀粉酶催化淀粉的水解;核酸酶催化核酸 的水解。
3. 酶反应条件的温和性
酶促反应一般在pH 5-8 水溶液中进行,反应温度范围 为20-40C。
•绝大多数的酶都是蛋白质(Enzyme和Ribozyme)
•酶催化的生物化学反应,称为酶促反应(Enzymatic reaction)。
•在酶的催化下发生化学பைடு நூலகம்化的物质,称为底物 (substrate)。
酶的研究历史
•1897年,酶的发现和提出:Buchner(1911诺贝 尔化学奖)兄弟用不含细胞的酵母汁成功实现了 发酵。提出了发酵与活细胞无关,而与细胞液中 的酶有关。 •1913年,Michaelis和Menten提出了酶促动力学原 理—米氏学说。 •1926年,Sumner从刀豆种子中分离、纯化得到了 脲酶结晶,首次证明酶是具有催化活性的蛋白质。 •1982年,Cech对四膜虫的研究中发现RNA具有催 化作用。
根据酶的存在位置
1.胞内酶:
在合成分泌后定位于细胞内发生作用的酶, 大多数的酶属于此类。
2.胞外酶:
在合成后分泌到细胞外发生作用的酶, 主 要为水解酶。
酶国际系统分类法
1961年国际酶学委员会(Enzyme Committee, EC) 根据酶所催化的反应类型和机理,把酶分成6大类:
1. 氧化-还原酶类 Oxido-reductases 2. 转移(移换)酶类 Transferases 3 . 水解酶类 hydrolases 4 . 裂合(裂解)酶类 Lyase 5. 异构酶类 Isomerases 6. 合成酶类 Ligases or Synthetases
《生物化学》课件——酶(人卫版)

苷酸,辅酶I)
NADP+(尼克酰胺腺嘌呤二核
苷酸磷酸,辅酶II)
FMN (黄素单核苷酸)
FAD(黄素腺嘌呤二核苷酸)
醛基
TPP(焦磷酸硫胺素)
酰基
辅酶A(CoA)
硫辛酸
烷基
钴胺素辅酶类
二氧化碳
生物素
氨基
磷酸吡哆醛
甲基、甲烯基、 四氢叶酸
甲炔基、甲酰基
等一碳单位
尼克酰胺(维生素PP之一)
尼克酰胺(维生素PP之一)
• 将酶促反应达到最大速度的某一温度范围叫
做酶作用的最适温度。
反 应 速 度
最适温度 温度
•
温度对酶促反应速度的影响在临床上
具有理论指导意义。
• 低温一般不破坏酶,一旦温度回升后,酶又恢复活性。
所以对酶制剂和酶检测标本(如血清、血浆等)应放在 低温保存。
• 低温麻醉可通过低温降低酶活性以减慢组织细胞代谢速
第四章 酶
enzyme
酶(enzyme ):生物催化剂(biocatalyst)
两类生物催化剂:
酶(enzyme,E)是机体内催化 各种代谢反应最主要的催化剂 。
核酶(ribozyme)是具有高 效、特异催化作用的核酸
第一节 概述
introduction
酶(enzyme ):
由活细胞合成的、对其特异底物具有高效 催化作用的特殊蛋白质 。
(一)绝对特异性 (absolute specificity)
(二)相对特异性 (relative specificity)
(三)立体异构特异性 (stereo specificity)
三、酶催化活性的可调节性
物质代谢在动态平衡中 催化各条代谢过程酶活性的调节作用是维持 这种平衡的重要环节 。
生物化学-酶
酶一级结构的差别也决定了催化性质的不同, 如胰蛋白酶、 胰糜蛋白酶和弹性蛋白酶三种蛋白 酶的活性中心Ser残基附近都有一个在立体结构上 的“口袋”状结构。由于三种蛋白酶的口袋”状结 构不同,决定其与不同底物结合即有不同特异性。
酶的特异的三维空间结构是酶催化功能的基础。 酶的二、三级结构是维持酶的活性中心空间构象的 必需结构。
酶的命名包括习惯命名和系统命名,酶可分为六类。 酶与疾病发生、诊断、治疗等密切相关。
➢一、酶的概念 酶是由生物活细胞产生的具有高效催化功能
和高度专一性的一类特殊蛋白质,又叫生物催化 剂•.绝大多数的酶都是蛋白质。
酶的化学本 质是什麽?
酶的概念
• 一、相关概念 • 酶催化的生物化学反应,称为酶促反应。 • 被酶的催化的物质称为底物(S) • 反应的生成物为产物(P) • 酶所具有的催化能力称酶的活性. • 酶失去催化能力称酶的失活.
第四章 酶 (Enzymes)
内容简介
酶是具有高度催化效率及高度特异性的蛋白质。 酶通过多种机制降低反应活化能使反应速率增加。 酶分子一级结构及空间结构是催化功能的基础。 酶促反应速率受到[S]、[E]、pH、T、抑制剂及激活
剂的影响
酶活性可受到别构调节、共价修饰、酶原激活、关键 酶、多酶体系、同工酶等调节
H N C O
COOH CH
R6
氨基酸
氨基酸
消化道中各种蛋白酶的专一性
3.立体异构特异性:一些酶仅能催化一种立体异
构体进行反应,或其催化的结果只产生一种立体异
构体,酶对立体异构物的选择性称为立体异构特异
性(stereospecificity)。
L-乳酸
D-乳酸
H
H
C
OH
生物化学笔记之第四章酶
第四章酶酶是一类具有高效率、高度专一性、活性可调节的高分子生物催化剂。
1957巴斯德提出酒精发酵是酵母细胞活动的结果。
1 分子Glc→2分子乙醇+2分子CO2 从Glc开始,经过12种酶催化,12步反应,生成乙醇。
1897 Buchner兄弟证明发酵与细胞的活动无关,不含细胞的酵母汁也能进行乙醇发酵。
1913 Michaelis和Menten提出米氏学说—酶促动力学原理。
1926 Sumner首次从刀豆中提出脲酶结晶,并证明具有蛋白质性质。
1969 化学合成核糖核酸酶。
1967-1970 从E.coli中发现第I、第II类限制性核酸内切酶。
1986 Cech发现四膜虫细胞大核期间26S rRNA前体具有自我剪接功能。
ribozyme ,deoxyribozymeE.coRI5’——GAA TTC——3’3’——CTTAAG——5’限制作用修饰作用5’——GAATTC——3’5’——GAA TTC——3’3’——CTTAAG——5’ 3’——CTTAAG——5’第一节酶学概论一、酶的生物学意义大肠杆菌生命周期20分钟,生物体内化学反应变得容易和迅速进行的根本原因是体内普通存在生物催化剂—酶。
没有酶,生长、发育、运动等等生命活动就无法继续。
限制性核酸内切酶(限制-修饰)二、酶的概念及其作用特点1、酶是一种生物催化剂酶是一类具有高效率、高度专一性、活性可调节的高分子生物催化剂。
生物催化剂:酶(enzyme),核(糖)酶(ribozyme),脱氧核(糖)酶(deoxyribozyme)2、酶催化反应的特点(1)、催化效率高酶催化反应速度是相应的无催化反应的108-1020倍,并且至少高出非酶催化反应速度几个数量级。
(2)、专一性高酶对反应的底物和产物都有极高的专一性,几乎没有副反应发生。
(3)、反应条件温和温度低于100℃,正常大气压,中性pH环境。
(4)、活性可调节根据据生物体的需要,许多酶的活性可受多种调节机制的灵活调节,包括:别构调节、酶的共价修饰、酶的合成、活化与降解等。
第四章-酶PPT课件
.
3
第一节
酶分子的结构与功能
.
4
4'硫NDN+-COCC3酯只共体称体过酶一的磷HOH+OHAA酶HC2具价内为内程体些酶酸+DOOHO酰H泛CHCCHCO多有键有物,系多存βSCs基蛋2OO合H2SHSH-酰ey酮载白酶。三相些质这酶在OH成rC3氨脂HOO⑦⑧体酶β复级 连 酶 代 些 体 于H酰OC还基-CHCH酮CCOCH转原合结 组 彼 谢 酶 系 一乙乙OC丙脂2H移酶H酰CHCOH酰硫体构 成 此 的 不 在 条酮O酶OHCHOOCH3TP2C醇FO酸酶oP的 的 聚 各 同 进 多。丙酰还AOA烯脱二转TP原DS酶酶合条于化肽酰T酸移~酶氢①②③④⑤⑥⑦⑧单 酶称称在途多过链①⑥水柠 顺 异 α琥 琥 延 苹为为一径酶程上FCC3H-化AC酮o檬 乌 柠 珀 珀 胡 果SSH称起往复中,寡S酶AFH-O戊酸 头 檬 酰 酸 索 酸ANDF,往合由这聚单HO2AHSD二CHCHCC2+OC合 酸 酸 脱 酸 脱ACS(O组有体于类酶体OOH2C二o酸酶 酶 脱 氢 酶 氢.OH转AH成许,基酶酶。氢CHCHCHCOC脱合氢 酶 酶水乙二2OO22H硫一多在因被;)(OG化氢O酰成4C酶氢脱OHTC辛H酶H个酶结融称由⑤酶酶硫氢酶O丙 酰酸2物共构合为多辛酶二 转)复还CSG②4烯o酸 移原CD酸理同上,个多合酰A单 酶N+O酶PHO4~体的参无使相功+H'AOC转βHSHSFDH乙+D-结 与 彼 多同能还移H-ACCHCOCH磷酰酮H原酶OCHCHCOCCSH22合 , 此 种或酶脂酸OO酶O2H酰βOOH泛酰体 依 关 不不或H合CA-④CH(O酮Cs基蛋成oCHO酰SSHSH③, 次 联 同同串3脂Hy载白OCH酶e氨酰体r此 完 , 催亚联2)OC基N+4硫COCHCHC结 成 称 化基酶CND乙AONC酯22CHO+ADOoS合 反 为 功以。O硫酶AN+AH2D醇C5体 应 能非多HA++OCAD++H2oH+H+ S~
第四章 酶
3. 连接作用 :作为桥梁,将底物分子与酶蛋 白螯合起来。
小分子有机物: 其结构中常含有V或V类物质,它们的 作用是以辅酶或辅基的形式参与酶的催 化过程,可以传递电子、质子或转移基 团。
注意: 酶蛋白和辅助因子单独存在时,均无催 化活性,只有二者结合形成全酶才有活 性。 在酶促反应中,酶蛋白决定反应的特异 性;辅助因子决定反应类型。
酶的活性中心上的必需基团: 结合基团和催化基团
酶的活性中心外必需基团:
二、酶原与酶原的激活
酶原:无活性的酶的前身物质 酶原的激活:酶原转化成酶的过程。 酶原激活的实质: 活性中心的形成或暴露 。 酶原激活的过程: 以无活性的酶原形式存在的意义: 1、防止对细胞本身的破坏 2、保证在特定的部位发挥作用
B、多元催化: 同一种E分子中既可以进行酸催化,又 可以进行碱催化,这种多功能基团的协调 作用可大大提高反应速率。 C、表面效应: 酶蛋白分子内部存在一些疏水环境可排 除水分子对E和S功能基团的干扰性吸引或 排斥,有利于E与S的结合,使反应易于进 行。
第四节 影响酶催化作用的因素
影响酶促反应速度的因素: [E]、[S]、T、PH、+、-注意: A、酶促反应速度指初速度 B、在研究某一因素时,应保持体系中 的其它因素不变。
二、酶的命名和分类
酶的命名: 习惯命名法 系统命名法 酶的分类: 氧化还原酶类 转移酶类 水解酶类 裂合酶类或裂解酶类 异构酶类 合成酶类或连接酶类
第二节 酶催化作用的特点
酶与一般催化剂的共同点包括: ①能催化热力学上允许进行的化学反应,而 不能实现那些热力学上不能进行的反应 ②能缩短反应达到平衡所需的时间,而不能改 变 平 衡 点 ③一般情况下,对可逆反应的正反两个方向的 催化作用相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[S]=Km, V=Vmax/2
Km(米氏常数)定义:酶促反应速度达
到最大反应速度一半时的底物浓度。 米氏常数的单位:mol/L或mmol/L 。
米氏常数的意义
不同的酶具有不同Km值,它是酶的一个重要的 特征物理常数。 一个酶对不同的底物有不同的Km值。Km值最小的 为最适底物。 与酶的浓度无关。 Km值表示酶与底物之间的亲和程度: Km值大 表示亲和程度小,酶的催化活性低; Km值小表示 亲和程度大,酶的催化活性高。
三、酶的化学本质
绝大多数酶是蛋白质
证据:1. 酸水解的产物是氨基酸,能被蛋白 酶水解失活;2. 具有蛋白质的一切共性,凡 是能使蛋白质变性的因素都能使酶变性;3. 1969年,人工合成牛胰核糖核酸酶。
少数酶是RNA(核酶,ribozyme)
第二节 酶的组成和结构特点
酶的组成 单纯酶类:仅由蛋白质组成 结合酶类:包括酶蛋白(apoenzyme)和辅
因此:酶促反应的最初速度, 能反映酶促反应的情况。
• 动画2
二、底物浓度对酶促反应速度的影响
V与[S]呈双曲线关系
[S]很低时, V与[S]成正比关系,为一级 反应。 随着[S]增大, V与[S]不成正比关系,V增 加变慢,为混级反应。 [S]足够大时,V到达最大值Vmax,不再 增加。有饱和现象,为零级反应。
多酶复合体:多种酶靠非共价键相互嵌合催
化连续反应的体系。
大肠杆菌丙酮酸脱氢酶复合体由三种酶组成:
①丙酮酸脱氢酶(E1) 以二聚体存在 2×9600 ②二氢硫辛酸转乙酰基酶(E2) 70000 ③二氢硫辛酸脱氢酶(E3)以二聚体存在 2×56000 12个E1 二聚体 24×96000 24个E2 单体 24×70000 6个E3 二聚体 12×56000 总分子量:560万
CH3CHCOOH HOOCCH2CH2CCOOH NH2 CH3CCOOH O O HOOCCH2CH2CHCOOH NH2
3. 水解酶类 Hydrolase
水解酶催化底物的加水分解反应。
AB+H2O
A-H+B-OH
如:脂肪酶(Lipase)催化的脂的水解反应:
R COOCH2CH3 H2O RCOOH CH3CH2OH
如:丙酮酸羧化酶催化的反应。 丙酮酸 + CO2 草酰乙酸
每一大类酶又分为若干亚类
乳酸脱氢酶 EC1.1.1.27
EC:国际酶学委员会 第一个数字表示大类:氧化还原 第二个数字表示反应基团:醇基 第三个数字表示电子受体:NAD+ 第四个数字表示此酶底物:乳酸
二、酶的命名
(1)国际系统命名法(systematic name)
第五节
酶的作用机理
一、中间产物学说
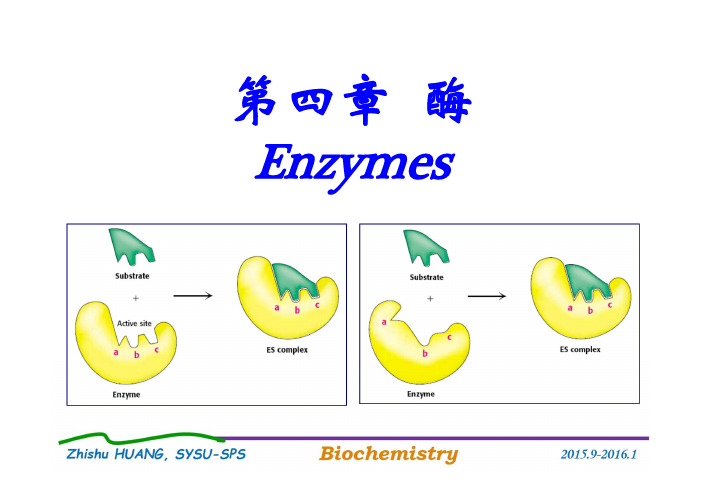
第一步是酶与底物形成酶-底物中间复合 物。
当底物分子在酶作用下发生化学变化后, 中间复合物再分解成产物和酶。
E+S
E-S
P+E
许多实验事实证明了E-S复合物的存在。 如:已获得ES结晶 X线衍射法描出ES图象 同位素标记底物实验 光谱分析分析
二、活化能降低
特殊性:
1. 酶催化效率高 比非催化高108~1020倍,比非生物催化剂 高107~1013倍。
2. 酶具有高度专一性 酶对反应的底物和产物都有极高的专一 性,几乎没有副反应发生。 3. 酶易失活 常温、常压,中性pH 环境下反应。 4. 酶的催化活性可被调节控制 酶抑制剂调节、反馈调节、酶原激活、共 价修饰、激素控制等。
静电斥力
根据酶蛋白质分子的特点,将酶分为:
单体酶:仅有一个活性中心,由一条或多
条共价相连的肽链组成的酶分子。
牛胰RNase
124 aa
单链
单链
鸡卵清溶菌酶 129 aa
胰凝乳蛋白酶 三条肽链
寡聚酶:由两个或多个相同或不同亚基组成
的酶。单独的亚基一般无活性。 ① 含相同亚基的寡聚酶: 苹果酸脱氢酶(鼠肝),2个相同的亚基 ② 含不同亚基的寡聚酶: 琥珀酸脱氢酶(牛心),αβ2个亚基
A
B
如:6-磷酸葡萄糖异构酶催化的反应。
CH2OH O OH OH OH OH OH OH CH2OH O CH2OH OH
6. 合成酶类 Synthetase
能够催化C-C、C-O、C-N 以及C-S 键的 形成反应。这类反应必须与ATP分解反应相 互偶联。
A+B+ATP
A-B+ADP+Pi
酶活性中心的基团属于必需基团,必需基 团还包括对酶表现活力所必需的基团,如Ser 的羟基、Cys的巯基、His的咪唑基等,它们 起维持酶分子空间构象的作用。
小结:
构成酶活性中心的这些基团在一级结构 上,可能相距很远, 甚至可能不再一条多肽链上, 但在蛋白质空间结构上(三级结构)彼 此很近, 形成具有一定空间结构的区域。
第四章 酶 Enzyme
• 动画1
第一节 酶的一般性质
一、酶是生物催化剂
酶是由活细胞产生的,具有催化活 性和高度专一性的特殊生物大分子。 包括蛋白质和核酸。
二、酶的催化特性
一般特性:
1. 加快反应速度,而本身在反应前后没结构 和性质的改变。 2. 只缩短反应达到平衡所需要的时间而不改 变反应平衡点。
是以酶所催化的整体反应为基础,规定 每一种酶的名称应当明确标明酶的底物及 催化反应的性质。
如:过氧化氢 : 过氧化氢氧化还原酶 2H2O2 = 2H2O+O2 丙氨酸:-酮戊二酸氨基转移酶 谷氨酸+丙酮酸 -酮戊二酸+丙氨酸
(2)习惯命名法(recommended name)
根据酶的作用底物及其所催化的反应 类型来命名。 如:琥珀酸脱氢酶,乳酸脱氢酶
反应方向: 即化学平衡方向,主要取决于 反应自由能变化。而反应速度快慢,则主 要取决于反应的活化能。
催化剂的作用是降低反应活化能,从而 起到提高反应速度的作用
酶的高效催化是因素 1)靠近和定向效应 2)底物分子的形变与诱导挈合 3) 酸碱催化作用 4)共价催化作用 5)酶活性中心是低介电区域
基团专一性:要求底物具有一定的化学
键,而且对键的某一端所连基团也有一定要 求。 如:α-D-Glc苷酶,水解蔗糖和麦芽糖
2. 立体异构专一性(stereo specificity)
几乎所有的酶对于立体异构体都具有高 度专一性。当底物具有立体异构体时,酶 只能作用于其中的一种。
如:L-氨基酸氧化酶只催化L-氨基酸的氧 化脱氨基。
Vmax [S] V= Km + [S]
Km 即为米氏常数
Vmax为最大反应速度
前提:1.在成不会明显降低底物的量。 3.ES保持动态平衡,即E+S E-S
当[S]<<Km, V=Vmax[S]/Km; 一级反应。 [S]>>Km, V=Vmax; 零级反应。
二、酶的专一性
1. 结构专一性(structure specificity)
绝对专一性:只能作用于一个底物, 或只催化一个反应。 如:麦芽糖酶只作用于麦芽糖,脲酶只催 化尿素水解。
键专一性:只对底物分子中其所作用键 要求严格。 O 酯酶 如:R-C-O-R’ RCOO- + R’OH+H+
100
80
Relative Activity (%)
60
40
20
0 10 20 30 40 50 60
结合部位:酶分子中与底物结合的部位。
决定酶的专一性。
催化部位:催化底物敏感键发生化学变化
的基团,决定酶的催化能力。
组成活性中心的氨基酸残基的侧链在一 级结构上可能相距很远,但在空间结构上相 互靠近,形成活性区域。
结合部位与催化部位并不是独立存在,构 成这两个功能部位的有关基团,有时同时兼 有结合底物和催化底物发生反应的功能。
三、酶专一性的假说
1. 1894年,Fisher提出“锁钥学说” 认为整个酶分子的天然构象是具有刚性结 构的,酶表面具有特定的形状。酶与底物的 结合如同一把钥匙对一把锁一样。
2. 1958年,Koshland提出“诱导契合假说”
该学说认为酶表面并没有一种与底物互补 的固定形状,而只是由于底物的诱导才形成 了互补形状.
• 而一种辅助因子往往可与多种酶结合
异柠檬酸脱氢酶
NAD+ 苹果酸脱氢酶 二氢硫辛酸脱氢酶 金属元素: Fe、Cu、Zn 辅 化学本质
助
因 子
小分子有机物:
辅酶 与酶结合牢固程度 辅基
主要维生素B类
•金属离子的作用:
① 参与酶活性中心的组成 ② 连接酶与底物的桥梁
③ 稳定酶蛋白的构象
④
中和阴离子,降低反应中的
谷丙转氨酶
谷氨酸+丙酮酸 -酮戊二酸+丙氨酸
第四节
酶的活性中心及专一性
一、酶的活性中心
酶的活性中心(active center):酶分 子上直接参与底物结合及催化作用的氨基酸 残基的侧链基团根据一定的结构组成的区域。
结合部位( Binding site ) 催化部位( catalytic site )
• 诱导契合学说(induced fit) 1)底物对酶的空间构象的诱导 2)底物与酶契合
诱导契合学说(Induced fit):
• 酶分子的活性部位结构原来并不与底物分 子的结构互补,但活性部位有一定的柔性, • 当底物分子与酶分子相遇时,可以诱导酶 蛋白的构象发生相应的变化,
• 使活性部位上各个结合基团与催化基团达 到对底物结构正确的空间排布与定向, • 从而使酶与底物互补结合,产生酶-底物 复合物,并使底物发生化学反应。
简单蛋白 组成成分 结合蛋白 酶蛋白 化学本质
