大学普通化学总复习资料大全PPT讲稿思维导图知识点归纳总结[PPT白板课件]
大学化学总结PPT课件

l
0/s 1/p
2/d …
n-1
m
0 0 ,±1 0,±1,±2 0,±1,±2…±(n-1)
ms
±1/2
l轨道形状,m轨道空间取向
- 40
指出2p,3d这些原子轨道相应的主量子数n,角量子数l
的值各为多少?每种轨道包含的轨道数目是多少?
n
l
轨道数
2p
2
1
3
- 41
核外电子的排布
1.电子在原子轨道中排布的基本原则
拉乌尔定律
沸点上升 Tb = kb . m = kb . n(质)/w(剂) 凝固点降低 Tf = kf . m = kf . n(质)/w(剂)
渗透压 Π(p) = cRT kpa
-8
将3.24g硫溶于40.0g苯中, 苯的沸点由80.15上升至80.96OC ,求单质硫由几个硫原子组成?(苯的Kb为2.53 K•kg/mol。)
• 电化学腐蚀分为:析氢腐蚀和吸氧腐蚀
金属的腐蚀
化学腐蚀 电化学腐蚀
负极——氧化反应——阳极 正极——还原反应——阴极
析氢腐蚀 吸氧腐蚀
- 33
• 吸氧腐蚀
阴极:O2 + 2H2O + 4e = 4OH阳极:2Fe - 4e = 2Fe2+
总反应: 2Fe + O2 + 2H2O = 2Fe(OH)2
的规则,而是遵循量子力学的规则。
微观粒子的运动特征: 量子化特征 + 波粒二象性
- 37 37
描述原子中的电子运动状态的波函数称为原子轨道。 应该特别强调的是,这里所称的“轨道”是指原
子核外电子的一种运动状态,是一种具有确定能量的 运动状态,而不是经典力学中描述质点运动的某种确 定的几何轨迹,也不是玻尔理论所指的那种固定半径、 园形的波尔轨道表达式。
教案化学总复习思维导图.ppt
意义
量的方面
配平方法
相关计算
读法
粒子方面
质量守恒定律 理论依据
计算步骤
已知反应物求生成物
常见类型 含杂质的计算
涉及溶液的有关计算
设、方、关、0比.0、算、答
4
下列叙述不适合用质量守恒定律解释的是: AE A.水加热变成水蒸气,变化前后质量相等 B.要得到18g水,则参加反应的氢气和氧气的总质量 一定为18g C.1g硫与1g氧气化合生成2g二氧化硫 D.煤燃烧后剩余残渣的质量减轻了 E.一定条件下,CH4燃烧生成H2O 和 CO2 ,反应前 后分子总数不变
相关计算
元素符号或 元素符号加小数字
根据化合价书写 三种以上含原子团
计算相对 分子质量
计算元素 0.0质量比
计算元素的
计算某
质量分数 元素的质量3
第五单元
化学方程式
内容
微观解释 原子的三不变
应用
质量守恒 定律
五个一定不变
变与不变 两个一定改变
二个可能改变
书写原则
依 据
定义
质的方面
书写步骤 书写 化学方程式
以上营养元 0.素0 (KNO3)
8
反应原理
产品
0.0
6
CO还原氧化铁的实验现象及注意事项
第九单元:溶液
仪器、操作
交点
线 溶解度曲线
应用
结晶方法
计算
溶液的配制、稀释
固体
浓 、 稀 定义、判断 溶 液
公式
饱和溶液 转化方法 不饱和溶液
溶解度
溶液
定义 定义
组成
气体 特征
影响因素
溶质
组成判断 质量关系 溶剂
化学总复习思维导图.ppt

”;此后十年间,航空事业获得较快发展。
筹办航空事宜
处
三、从驿传到邮政 1.邮政
(1)初办邮政: 1896年成立“大清邮政局”,此后又设
邮传部 邮传正式脱离海关。
,
(2)进一步发展:1913年,北洋政府宣布裁撤全部驿站; 1920年,中国首次参加 万国邮联大会 。
2.电讯 (1)开端:1877年,福建巡抚在 办电报的开端。 (2)特点:进程曲折,发展缓慢,直到20世纪30年代情况才发生变 化。 3.交通通讯变化的影响
一、近代交通业发展的原因、特点及影响 1.原因 (1)先进的中国人为救国救民,积极兴办近代交通业,促
进中国社会发展。
(2)列强侵华的需要。为扩大在华利益,加强控制、镇压
中国人民的反抗,控制和操纵中国交通建设。
(3)工业革命的成果传入中国,为近代交通业的发展提供 了物质条件。
2.特点 (1)近代中国交通业逐渐开始近代化的进程,铁路、水运和
防锈措施
物理性质
大多数呈银白色等
与氧气反应 化学性质
与盐酸、稀硫酸反应
纯金属
与盐溶液反应
金属活动性顺序 及其应用规律
金属和金属材料
金属资源的利用与保护
合金
生铁、钢
金属的存在形式 铁的冶炼
含杂质物质的化学 方程式的计算
原料
反应原理
产品
CO还原氧化铁的实验现象及注意事项
第九单元:溶液
线 应用 结晶方法 固体 溶解度 定义 气体 特征 转化方法 公式 不饱和溶液 定义 溶质 组成判断 质量关系 溶剂
依据材料概括晚清中国交通方式的特点,并分析其成因。
提示:特点:新旧交通工具并存(或:传统的帆船、独轮车, 近代的小火轮、火车同时使用)。 原因:近代西方列强的侵略加剧了中国的贫困,阻碍社会发 展;西方工业文明的冲击与示范;中国民族工业的兴起与发展;
2021高考化学大一轮复习课件:第十单元总结(共97张PPT)

高考总复习·化学
验进行改进。若实验中遇到新的问题,则可以提出新的问题 进行探究。
高考总复习·化学
案例示范 1 化学反应原理探究型
(2017 年北京理综,28)某小组在验证反应“Fe+2Ag+
Fe2++2Ag”的实验中检测到 Fe3+,发现和探究过程如下。
向硝酸酸化的 0.05 mol·L-1 硝酸银溶液(pH≈2)中加入过量
②Fe2+ (2)2Fe3++Fe 3Fe2+ ②4Fe2++O2+4H+ 4Fe3++2H2O;加入 KSCN 溶液后产生白色沉淀 ③0.05 mol·L-1 NaNO3;FeSO4 溶液;分别取电池工作前与工作 一段时间后左侧烧杯中的溶液,同时滴加 KSCN 溶液,后者红色更 深 (3)溶液中存在反应:①2Ag++Fe 2Ag+Fe2+,②Ag++Fe2+
Ag+Fe3+,③Fe+2Fe3+ 3Fe2+。反应开始时,c(Ag+)大,以反应①②为 主,c(Fe3+)增大,约 30 min 后,c(Ag+)小,以反应③为主,c(Fe3+)减
高考总复习·化学
单元总结
实验探究题解题技巧 探究性化学实验题在近几年的高考中频频出现,这类题具有 综合性和开放性强、试题创设的情境和设问比较新颖等特点,又 贴近学习与日常生活,趣味性较浓。选择的情境往往紧扣教材,能 很好地考查学生分析问题、解决问题和创新思维的能力,这种题 的区分度高,高考中具有很好的选拔功能。 探究性实验题一般设计成实验报告的形式,结构特点一般是 (1)探究的课题(目的);(2)提供的信息,必需的材料或限制条 件;(3)探究的过程,包括假设或猜想、探究方案、实验报告及一 系列的探究问题等;(4)结论及分析。
大学普通化学-课件

04
化学实验基础
实验安全与操作规范
01
实验安全须知
了解实验中可能存在的危险因素 ,遵守实验室安全规定,确保自 身和他人安全。
02
实验操作规范
03
实验器材使用
掌握实验操作流程,严格按照实 验步骤进行操作,避免因操作不 当引发事故。
正确使用实验器材,了解各类器 材的用途、使用方法和注意事项 。
实验设计与数据处理
有机化合物与高分子材料
01
02
03
04
有机化合物是指含碳元素的化 合物,其种类繁多,性质各异
。
有机化合物在工业、农业、医 药、环保等领域具有广泛的应 用,如塑料、合成纤维、农药
等。
高分子材料是指分子量较大的 有机化合物,其具有优良的力
学性能和化学稳定性。
高分子材料在工业、农业、交 通、通讯等领域具有广泛的应 用,如合成橡胶、合成纤维等
化学在工业生产中的应用
农业
化肥、农药、植物生长调节剂等。
制造业
材料合成、表面处理、电镀等。
能源
石油、天然气、太阳能等的开采和利用。
环保
污水处理、大气治理等。
化学前沿科技与发展趋势
纳米技术
纳米材料、纳米药物等。
绿色化学
环境友好型的合成方法、反应 条件等。
生物技术
基因工程、蛋白质工程等。
新能源
燃料电池、太阳能电池等。
大学普通化学-课件
目录
• 化学基本概念 • 化学反应原理 • 元素与化合物性质 • 化学实验基础 • 化学应用与前沿科技
01
化学基本概念
化学的定义与性质
总结词
理解化学的本质和特性是学习化学的基础。
化学基础知识思维导图

化学基础知识思维导图 Document number【AA80KGB-AA98YT-AAT8CB-2A6UT-A18GG】盐类的水解盐电离出的原理酸根离子结合水电离出的H+阳离子结合水电离出的OH-生成弱碱促进水的电离,使[H+]≠[OH-]。
特点:中和反应的逆反应微弱、吸热升温利于水解稀释利于水解规律有弱才水解无弱不水解都弱都水解谁强显谁性都强显中性越弱越水解含弱酸酸根CH3COO-、CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、PO43-、ClO-、SiO32-、[Al(OH)4]-含弱碱的阳离子NH4+、Mg2-、Fe3+、Al3+、Cu2+、Zn2+、Ag+电离程度:CH3COOH > H2CO3> HCN > HCO3-水解程度:CH3COO- < HCO3- < CN- < CO32-CH3COOH和NH3·H2O的电离程度相同,故CH3COONH4溶液呈中性。
影响加酚酞的CH3COONa溶液加热后,红色加深稀溶液水解程度大,浓溶液水解程度小加入强酸或强碱水解显酸性的,加酸抑制,加碱促进。
加入水解后酸碱性相反的盐相互促进水解方程式应用配制FeCl3溶液时常加入少量盐酸Fe3++3H2O Fe(OH)3+3H+写可逆号、不写↓和↑。
双水解彻底的,写等号、↓和↑。
多元弱酸酸根水解,要分步写,以第一步为主。
明矾净水 Al3++3H2O Al(OH)3(胶体)+3H+热的纯碱溶液去油污CO32-+H2O HCO3-+OH-、升温促进水解镁粉放到NH4Cl溶液中有刺激性气味 Mg + 2NH4+ = Mg2+ + NH3↑+ H2↑泡沫灭火器[用Al2(SO4)3与NaHCO3溶液混合] Al3++3HCO3-=Al(OH)3↓+3CO2↑不用复分解法制Al2S32Al3++3S2-+6H2O =2Al(OH)3↓+3H2S↑草木灰与铵态氮肥不混用NH4++H2O NH3·H2O+H+,CO32-+H2OHCO3-+OH-,H++OH-= H2O,二者相互促进,NH4+转化成NH3·H2O,NH3·H2O分解成NH3,损失氮肥。
大学化学 PPT
5、高分子化学是以高分子化合物为研究对象 的科学,包括高分子化合物的合成方法,反应 机理,反应热力学,反应动力学,高分子化合 物改行,高分子化合物材料的加工成型以及高 分子化合物的应用。 高分子化学的重要分支学 科有:无机高分子化学(Inorganic Polymers Chemistry),天然高分子化学(Natural Polymers Chemistry),功能高分子(Functional Polymers),高分子合成化学(Polymers Synthesis Chemistry),高分子物理化学(Physical Chemistry Of Polymers),高分子光化学 (Polymer Photochemistry)等。
1、 课前预习,浏览一遍今天老师要讲 什么,在心理上有个准备; 2、 课堂上,准备一笔记本,注意听记, 这是提高听课效率确保不走神,能跟上 讲课思路的最佳方法;其二,笔记内容 为课后复习以及期末的复习重要依据; 3、 下课时,请静坐1分钟时间,回顾一 下本节课讲了什么; 4、 课后复习总结,包括做习题、看参 考书等,希望对每一单元以自己的方法、 思路能总结一页,期末时只要看自己的 总结就能复习全书。
1,无机化学是一门研究无机物质[一般指除了炭以 外的化学元素及化合物的组成、结构、性质变化、 制备及相关理论和应用的科学。 现代无机化学的 主要分支学科有元素化学(Elemental Chemistry)、配位化学(Coordination Chemistry)、同位素化学(Isotope Chemistry)、 无机固体化学(Inorganic Solid Chemistry)、无 机分离化学(Inorganic Separate Chemistry)、无 机合成化学Inorganic Synthesis Chemistry]、物理 分离化学(Physical Inorganic Chemistry)、生物 无机化学(Biorganic Chemistry)、金属有机 (OrganoMet. Chemistry)等。
化学总复习思维导图PPT课件
已知反应物求生成物
常见类型 含杂质的计算
涉及溶液的有关计算
设、方、关、比、算、答
防锈措施
物理性质
大多数呈银白色等
与氧气反应
化学性质 与盐酸、稀硫酸反应
纯金属
金属和金属材料 合金
金属资源的利用与保护
金属活动性顺序 及其应用规律
与盐溶液反应
生铁、钢
铁的冶炼
金属的存在形式 原料
含杂质物质的化学 方程式的计算
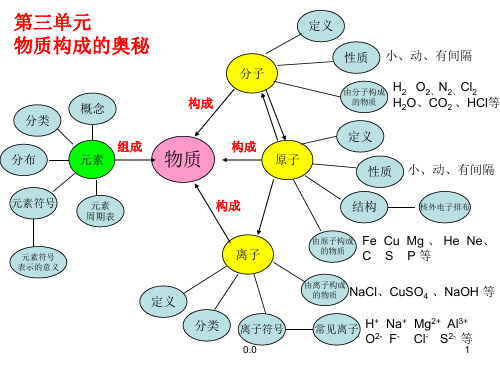
物质构成的奥秘
分类 分布
概念
构成
组成
物质
定义
分子
性质 小、动、有间隔 由分子构成 H2 O2、N2、Cl2
的物质 H2O、CO2 、HCl等
构成 原子
定义 性质 小、动、有间隔
构成
结构
核外电子排布
表示的意义
定义 分类
由原子构成 Fe Cu Mg 、 He Ne、 的物质 C S P 等
由离子构成 的物质
碱中都含OH-
+H2O 酸+碱=盐+H2O
碱+盐=新盐+新碱
性,处理工厂
常见的碱
废水,医药 溶液酸碱性 测定溶液
与PH的关系 PH=7 溶液呈中性
的PH
Ca(OH)2
NaOH
PH<7 酸性,PH越小, 课本P62,
酸性越强
实验10-9 俗名:熟石灰,消石灰
PH>7 碱性,PH越大, 碱性越强
常用于检验CO2的存在 建筑,配制波尔多液
防治措施
自然界的水
物理性质 化学性质
可燃性 还原性
第四单元 自然界的水
化学用语
一般规律
化合价
大学普通化学复习知识点
配浙大普通化学第五版复习,根据注册结构师考试摘选课本内容编辑。
.1物质的结构和物质状态原子结构的近代概念;原子轨道和电子云;原子核外电子分布;原子和离子的电子结构;原子结构和元素周期律;元素周期表;周期;族;元素性质及氧化物及其酸碱性。
离子键的特征;共价键的特征和类型;杂化轨道与分子空间构型;分子结构式;键的极性和分子的极性;分子间力与氢键;晶体与非晶体;晶体类型与物质性质。
3.2溶液溶液的浓度;非电解质稀溶液通性;渗透压;弱电解质溶液的解离平衡;分压定律;解离常数;同离子效应;缓冲溶液;水的离子积及溶液的pH值;盐类的水解及溶液的酸碱性;溶度积常数;溶度积规则。
3.3化学反应速率及化学平衡反应热与热化学方程式;化学反应速率;温度和反应物浓度对反应速率的影响;活化能的物理意义;催化剂;化学反应方向的判断;化学平衡的特征;化学平衡移动原理。
3.4氧化还原反应与电化学氧化还原的概念;氧化剂与还原剂;氧化还原电对;氧化还原反应方程式的配平;原电池的组成和符号;电极反应与电池反应;标准电极电势;电极电势的影响因素及应用;金属腐蚀与防护。
3.5 ;有机化学有机物特点、分类及命名;官能团及分子构造式;同分异构;有机物的重要反应:加成、取代、消除、氧化、催化加氢、聚合反应、加聚与缩聚;基本有机物的结构、基本性质及用途:烷烃、烯烃、炔烃、;芳烃、卤代烃、醇、苯酚、醛和酮、羧酸、酯;合成材料:高分子化合物、塑料、合成橡胶、合成纤维、工程塑料。
;第1章热化学与能源系统环境按照系统与环境之间有无物质和能量交换,可将系统分成三类:(1)敞开系统与环境之间既有物质交换又有能量交换的系统,又称开放系统。
(2)封闭系统与环境之间没有物质交换,但可以有能量交换的系统。
通常在密闭容器中的系统即为封闭系统。
热力学中主要讨论封闭系统。
(3}隔离系统与环境之间既无物质交换又无能量交换的系统,又称孤立系统。
绝热、密闭的恒容系统即为隔离系统。
大学化学知识点归纳 PPT
➢在氢原子中n值越大得电子层,电子得能量越高。但在多电子 原子中,核外电子得能量则由主量子数n与角量子数l两者决定。
2、角量子数 l
角量子数 l 可表示原子轨道或电子云得形状。
l= 0, 1, 2, 3, …, (n-1) ➢ l=0时(s轨道),原子轨道或电子云呈球形分布; ➢ l=1时(p轨道),原子轨道得角度分布图为双球面,电子云得角度 分布得图为两个交于原点得橄榄形曲面; ➢ l=2(d轨道)及3(称f轨道)时,原子轨道得形状更为复杂。 ➢ 角量子数就表示同一电子层n得不同“电子亚层”。 ➢ n, l相同得各原子轨道属于同一 “电子亚层”,简称“亚层”。
4、自旋量子数 ms
Silver atomic
kiln
ray
Small clearance space
Magnetic field
想象中得电子自旋
screen
两种可能得自旋方向:
正向(+1/2)与反向(-1/2)
自旋运动使电子具有类似于微磁体得行为,
产生方向相反得磁场
自旋相反得一对电子, 磁场相互抵消、
杂化轨道对称性分布原则
杂化后原子轨道在球形空间中尽量成对称性分布,因此,等 性杂化轨道间得键角相等。
杂化类型 sp sp2
杂化轨道构 型
直线形
三角形
sp3 四面体形
杂化轨道中 孤电子对数
0
0
0
1
2
分子几何构 型
直线形
三角形
正四面体
三角锥
V形
实例 键角
BeCl2 , HgCl2 C2H2,CO2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
rG⊝m(T) ≈ rH⊝m (298.15 K) T•rS⊝m (298.15 K)
9
(3) 由标准摩尔生成吉布斯函数(fG⊝m)计算ΔrGӨm
标准摩尔生成吉布斯函数与标准摩尔生成焓相似:
反应的标准摩尔焓变等于产物的标准摩尔生成焓之和减去反应物
的标准摩尔生成焓之和。
即:对于一般反应 dD + eE = fF + gG
r
H
m
[ff
H
m
(F)
gf
H
m
(G
)]
[df
H
m
(D)
ef
H
m
(E)]
7
3 吉布斯函数及反应的吉布斯函数变
(1) Gibbs函数定义:G = H - TS (2) Gibbs等温方程(Gibbs 公式) :
B. T ≠ 298.15 K
∆r G⊝m (T) = ∆r H⊝m - T · ∆r S⊝m
rH⊝m(T) ≈ rH⊝m (298.15 K) rS⊝m(T) ≈ rS⊝m (298.15 K),则 rG⊝m(T) ≈ rH⊝m (298.15 K) T•rS⊝m (298.15 K)
11
rG⊝m 是温度的线性函数
(4) 标态下反应自发性判据—Gibbs函数变判据
标准摩尔吉布斯函数变(ㅿrG⊝m)与标态下反应自发性判别 ㅿrG⊝m ≺ 0 自发(正反应方向); ㅿrG⊝m ≻ 0 非自发性(正反应方向); ㅿrG⊝m = 0 处于平衡状态.
在实际中,反应混合物很少处于相应的标准态,须根据rGm 来判断反应进行的方向。
总有一款PPT 适合您
【最新出品\精心整理\倾情奉献\敬请珍惜】
试卷结构
一 是非题(每小题1分,共10分) 二 单项选择题(每题2分,共20分) 三 填空题(每空1分,共20分) 四 简答题(每题3分,共6分) 五 完成并配平化学反应方程式:(每题2分,共8分) 六 计算题(共36分)
2
第一章
1 状态函数的特点:
10
对于一般化学反应式 A(l) + bB(aq) gG(s) + dD(g),
A. T = 298.15 K
若各物种均处于标准状态
r Gm (298.15 K) = B B fGm,(B, 298.15 K)
r G⊝m (298.15 K)= g f G⊝m (G, s, 298.15 K) + df G⊝m (D, g, 298.15 K) - a f G⊝m (A, l, 298.15 K) - b f G⊝m (B, aq, 298.15 K)
12
(5)反应方向转变温度的估算
反 应 实 例 ΔH ΔS ΔG = ΔH–T(s)+ CO2(g) 吸热熵增反应
+
+
温度升高至某值时由正 高温自发
值变负值
低温非自发
低温自发
④N2(g) + 3H2(g) = 2NH3(g) 放热熵减反应
—
—
降低至某温度时由正值 高温非自发 变负值
ㅿr Gm ≺ 0 ㅿr Gm ≻ 0 ㅿr Gm = 0
正向自发; 逆向自发; 处于平衡状态.
14
4 热力学等温方程 (1) ΔG与ΔGӨ关系---热力学等温方程式:
(2) 反应方向的判据----Gibbs函数变判据
15
5 化学平衡的移动及解释
吕•查德里(A. L. Le Chatelier)原理 如改变平衡系统的条件之一,如浓度、压力或温度,平衡就向能 减弱这个改变的方向移动。
ξ=
nB(ξ )- nB(0)
νB
(1) 对同一反应式,不论选用哪种物质表示反应进度均是相同的; (2) 反应进度与反应式写法有关; (3) ξ = 1 mol,表示各物质的物质的量的变化在数值上正好等于
各自的化学计量数,此时称进行了1 mol化学反应或简称摩尔 反应。
4
3 热、功以及符号的规定
系统吸热 q > 0,体系放热q < 0。
若反应在标态下进行,则
13
(6) 非标态下反应自发性判据—Gibbs函数变判据
ΔrGm (T) = ΔrGӨm (T) + RTlnQ
热力学等温方程:
对于一般化学反应式 A(l) + bB(aq) gG(s) + dD(g),
rGm
(T
)
rGm
(T
)
RT
ln
( pD (cB
/ /
p c
)d )b
16
思考题:P107 第2题(4)
为了减少汽车尾气中NO和CO染污大气,拟按下列反应进行催化 转化: NO(g) +CO(g) = (1/2)N2(g) + CO2(g), △rH⊝m (298.15 K) = -374kJ•mol-1。从化学原理考虑,下列措施 中有利于提高反应转化率的是
系统对环境作功 w < 0,环境对系统作功 w > 0。 体积功(膨胀功)w = - pΔV = - p(V2-V1) 。 热、功不是状态函数,数值与途径有关!
4 热力学第一定律
封闭系统发生状态变化时,其热力学能的变化等于变化过程中
环境与系统传递的热与功的总和。
ΔU = q + w
5
5 qP与qV的关系
6
7 反应的标准摩尔焓变的计算
(1) 标准状态 任意温度 气体: 压力为标准压力 pӨ = 100 kPa; 液、固体: 压力为标准压力pӨ的纯物质; 溶液: 溶质浓度为标准浓度cӨ = 1 mol dm-3 。 (2) 标准摩尔生成焓
稳定单质 f Hm = 0, f Hm (H+,aq)= 0
状态函数是用以确定系统状态的物理量,如气体的压力p、 体积V、温度T 、质量m、内能U、焓H、熵S、吉布斯函数G等。 (1)状态函数是状态的单值函数。 (2)当系统的状态发生变化时,状态函数的变化量只与系统的 始、终态有关。
3
2 反应进度(用以表示物质变化进展的程度)
按一般反应式
而言,作如下定义:
在恒容、只做体积功的条件下 定容反应热 = 热力学能变
H = U + pV 在恒压、只做体积功的条件下 定压反应热 = 反应焓变
6 盖斯定律
在恒容或恒压条件下,化学反应的反应热只与反应的始态和 终态有关,而与变化的途径无关。
根据盖斯定律,可以将化学方程式象代数方程式一样进行加减
运算,相应的热效应也加减。
