2007-2014年卫生部临检中心血细胞形态学检查室间质量评价(及答案)
卫生部临检中心室间质评常见问题

卫生部临检中心室间质评常见问题1.报结果时还没填完就发送了或者发送完后发现已上报数据有错误,要求重新下发报表的请拨打检验信息网电话010-********-17或010-********-152.找不到室内质控上报栏用实验室编码及密码登陆检验医学信息网后---点“室间质评”---进入主页---室内质控信息---信息上报表---选择卫生部临检中心选择相应专业及月份上报即可。
3. EMS单号查询用实验室编码及密码登陆检验医学信息网后---点“室间质评”---进入主页---质评活动---EMS号查询4.收到的质控品有问题(缺失或破损等)到检验医学信息网(不登陆)下载样品接收状态确认表(左边第二行)。
5.查找各专业的活动安排到检验医学信息网(不登陆)---2014年室间质评计划及通知---下载各专业的活动安排,编码表及回报表6.查找输血相容性的凝集强度对照表到检验医学信息网(不登陆)---2014年室间质评计划及通知---输血相容检测---下载凝集强度对照表。
7.查询已发放质控品专业及日期检验医学信息网(不登陆)---中间偏下位置---Clinet-EQA信息处下载。
8.所报结果与已上报数据小数位数不一致为系统默认情况,每个专业每个项目有不同的小数位数要求,请用户不用反复要求重新上报结果。
9.各科室联系电话临床生化室:010-******** 临床免疫室:010-********临床血液室:010-******** 临床微生物室:010-********分子生物室:010-******** 输血室:010-********临床药理室:010-******* 财务室:010-********中心办公室(发票邮寄):010-********。
室间质量评价

二.室间质量评价基本内容的介绍
4.进行EQA的目的,可归纳为以下 六点:
①确定实验室进行测量的能力,以及对实验室质 量进行持续监控的能力;
②识别实验室存在的问题,并制定相应的补救措 施。这些措施可能涉及诸如个别人员的行为或仪 器的校准等;
③确定新的测量方法的有效性和可比性,并对这 些方法进行相应的监控;
二.室间质量评价基本内容的介绍
4.进行EQA的目的可归纳为以下六 点:
④增加实验室用户的信心; ⑤识别实验室间的差异; ⑥确定某种检测方法的性能特征。
二.室间质量评价基本内容的介绍
5.对参加EQA的实验室有以下三个基本要求: ①有明确的职责以确保参加室间质量评价
二.室间质量评价基本内容的介绍
2.室间质量评价的起源与发展: 2.1国际(主要为三个阶(CDC)为 了保证不同实验室血清学梅毒检测的准确性和比较性,首 次在一定范围内开展了室间质量评价。
第二阶段:40年代,美国临床病理家学会(CAP)逐步发 展成全世界最大的室间质评组织者,开展了临床生化、免 疫、血液体液学、微生物学等多种室间质量评价计划,到 目前已上万家的实验室参加了它的计划。
室间质量评价基本内容的介绍
1.室间质量评价(EQA)的概念 2.室间质量评价的起源与发展 3.室间质量评价的作用 4.进行EQA的目的 5.对参加EQA的实验室有以下三个基本要
求 6.室间质量评价的纠正活动
二.室间质量评价基本内容的介绍
1.室间质量评价(EQA,external quality assessment)的概念:是多家实验室分析 同一标本并由外部独立机构收集和反馈实 验室上报的结果以此评价实验室操作的过 程。通过实验室间的比对判定实验室的校 准、检测能力以及监控其持续能力。(转自 卫生部临床检验中心 )
2007-2014年卫生部临检中心血细胞形态学检查室间质量评价(及答案)

请报告箭头所指细胞 的名称
浆细胞
请报告箭头所指细胞 的名称
球形红细胞
请报告箭头所指细胞 的名称
巨(中性)杆状核粒细胞
卫生部临床检验中心 2009 年第 2 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2009201
请报告箭头所指细胞 的名称
原幼淋巴细胞
胞的名称 成熟嗜碱粒性细胞
2007303
请报告箭头所指细胞的 名称
成熟嗜酸粒性细胞
2007304 2007305 2007306
请报告箭头所指细胞的 名称
上皮细胞
请报告箭头所指细胞的 名称
淋巴细胞
请报告箭头所指细胞的 名称
异型淋巴细胞
2007307 2007308 2007309 2007310
序号
图片
说明
2009301
请报告箭头所指细胞的 名称
原幼淋巴细胞
2009302
请报告箭头所指细胞的 名称
镰形红细胞
2009303
请报告箭头所指细胞的 名称
单核细胞
2009304 2009305 2009306 2009307
请报告箭头所指细胞排 列状况的名称
缗钱状红细胞
请报告箭头所指细胞的 名称
毛细胞
上皮细胞
请报告箭头所指细胞 的名称
多叶分核中性粒细胞
请报告箭头所指细胞 的名称
嗜碱性粒细胞 .
请报告箭头所指细胞 的名称
异型淋巴细胞
2010108 2010109 2010110
请报告箭头所指细胞 内结构的名称
卡波氏环(Cabot ring)
卫健委2019年血细胞形态学检查室间质量评价

国家卫生健康委临床检验中心
2019年第1次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号图片说明
2019101 请报告箭头所指细胞的名称
2019102 请报告箭头所指细胞的名称
2019103 请报告箭头所指细胞内结构的名称
2019104 请报告箭头所指细胞内结构的名称
2019105 请报告箭头所指细胞的名称
2019106 请报告箭头所指细胞的名称
2019107 请报告箭头所指细胞的名称
2019108 请报告箭头所指细胞的名称
2019109 请报告箭头所指细胞的名称
请报告箭头所指2019110
现象的名称
国家卫生健康委临床检验中心
2019 年第2 次血细胞形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
国家卫生健康委临床检验中心
2019年第3次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号图片说明
2019301 请报告箭头所指细胞的名称
2019302 请报告箭头所指细胞的名称
2019303 请报告箭头所指细胞的名称
2019304 请报告箭头所指细胞的名称
2019305 请报告箭头所指细胞的名称
2019306 请报告箭头所指细胞的名称
2019307 请报告箭头所指细胞的名称
2019308 请报告箭头所指细胞的名称
2019309 请报告箭头所指细胞的名称
2019310 请报告箭头所指细胞的名称。
关于四川省临床检验中心2014年形态学室间质评图谱下载方

关于四川省临床检验中心2014年形态学室间质评图谱下载方法的说明
各参比单位:
自2014年起,四川省临床检验中心形态学室间质评取消发放光盘,改由各单位自行从临检中心相应网页上下载,以下为下载方法的说明:
第一步:登录四川省临床检验中心网站()使用对应单位的用户名和密码登录
第二步:打开室间质评界面后选址“室间质评”选项后,再选择“质评实验上报”选项;
第三步:选择红色框选择中检验中心“四川省临床检验中心”,选择显示相应年限如年:“2014”系统将显示该年度需上报的质评项目清单;
第四步:如红框所示,选择进入质评项目如:“2014年血细胞形态学第1次质评上报表”;后如下一步显示:
第五步:弹出数据录入界面后,点击红框内显示“2014第一次血细胞形态学检查室间质量评价图片”即可下载图谱;
四川省临床检验中心
临检组
2014-4-15。
汇总2009-2018 四川省临检中心血细胞形态学图片 室间质量评价
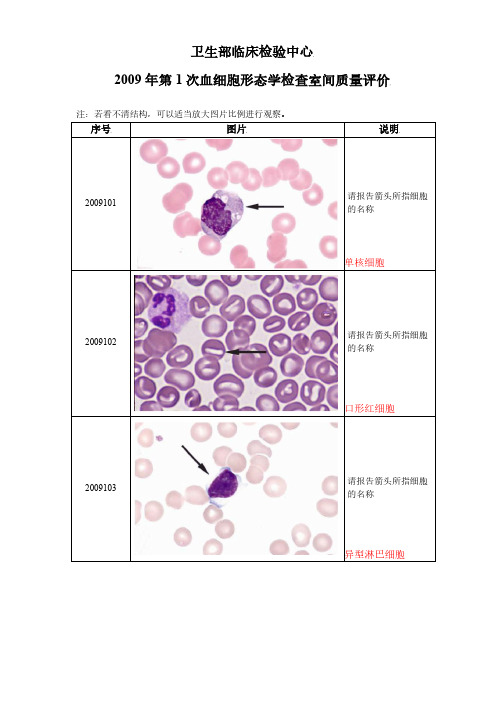
卫生部临床检验中心2009 年第 1 次血细胞形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
序号图片说明2009101请报告箭头所指细胞的名称单核细胞2009102请报告箭头所指细胞的名称口形红细胞2009103请报告箭头所指细胞的名称异型淋巴细胞染色质小体,为紫红色圆形小体,位于成熟红细胞或幼红细胞胞浆中,可1或多个一般见于脾切除后、无脾症、脾萎缩、脾功能低下、红白血病、某些贫血(例如巨幼红细胞性贫血)请报告箭头所指细胞 2009104 内结构的名称请报告箭头所指细胞 2009105 的名称请报告箭头所指细胞 2009106 的名称请报告箭头所指物的 2009107名称豪若小体含中毒颗粒中性粒细胞原/幼单核细胞血小板请报告箭头所指细胞 2009108 的名称请报告箭头所指细胞 2009109 的名称请报告箭头所指细胞 2009110 的名称浆细胞球形红细胞巨(中性)杆状核粒细胞卫生部临床检验中心2009 年第 2 次血细胞形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
序号 图片 说明请报告箭头所指细胞 2009201的名称请报告箭头所指细胞 2009202的名称请报告箭头所指细胞 2009203的名称原/幼淋细胞棘形红细胞巨多分叶中性粒细胞请报告箭头所指细胞 2009204 的名称请报告箭头所指细胞 2009205 的名称请报告箭头所指细胞 2009206 的名称请报告箭头所指细胞 2009207的名称椭圆形红细胞嗜碱性粒细胞嗜酸性粒细胞靶形红细胞请报告箭头所指细胞 2009208 内结构的名称请报告箭头所指细胞 2009209 的名称请报告箭头所指细胞 2009210 的名称中性粒细胞鼓槌巨核细胞早幼粒细胞卫生部临床检验中心2009 年第 3 次血细胞形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
序号图片说明2009301请报告箭头所指细胞的名称原幼淋巴细胞2009302请报告箭头所指细胞的名称镰形红细胞2009303请报告箭头所指细胞的名称单核细胞请报告箭头所指细胞排2009304列状况的名称请报告箭头所指细胞的2009305名称请报告箭头所指细胞的2009306名称请报告箭头所指细胞的2009307名称缗钱状红细胞毛细胞泪滴形红细胞赛塞利细胞请报告箭头所指物的名 2009308 称请报告箭头所指细胞的 2009309 名称请报告箭头所指细胞的 2009310 名称颗粒减少的血小板戈谢氏细胞中性晚幼粒细胞卫生部临床检验中心2010 年第 1 次血细胞形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
血细胞形态学检查室间质量评价
2020104 2020105 2020106 2020107
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
请报告箭头所指细胞的名称
山西省临床检验中心
2020 年第 1 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察
序号
图片
说明
2020101
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
2020102 2020103
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
2020108 2020109 2020110
请报告箭头所指细胞的名称
(骨髓,瑞-吉氏染色,×1000)
请报告箭头所指细胞的名称
(脑脊液,瑞-吉氏染色,×1000)
请报告箭头所指细胞的名称
(外周血,瑞-吉氏染色,×1000)
卫生部临检中心寄生虫形态学室间质评解读
因此,加强寄生虫形态学检查显得尤为重要,卫生部临检 中心开展其室间质评有利于促进寄生虫检验的发展
线虫
线虫广泛分布于水和土壤中,成虫多呈园柱形,体不分节, 前端钝园,后端逐渐变细,雌雄异体
要点:识别大便中污染的线虫,需与寄生于人体线虫的比较。
疟原虫裂殖体
晚期滋养体发育成熟,核开始分裂后即为裂殖体
由于多数寄生虫病在早期感染时无明显症状体征,临床表 现缺乏特异性,实验室诊断技术发展缓慢,再加上检验人 员缺少对寄生虫病原体形态学的了解。近年来,寄生虫所 致疾病占据了临床漏诊、误诊病例的首位,其次是结核病
2004年上半年,三医大寄生虫学教研室统计了重庆市确 诊的87例肺吸虫病患者,发现95%以上病人在初诊医院 有漏诊或误诊
牛带绦虫又称肥胖带绦虫由于吃生的或未加工熟的含有囊尾蚴的牛肉所致患者一般都有排节片史主要以消化道症状和肛门瘙痒为主要症状感染严重者还可致营养不良主要流行于牧区云南四川等地区特殊病历二20084184月18日西南医院眼科接诊了一名50多岁的女性患者患者自述右眼近来不明原因瘙痒异物感经医生检查后发现患者结膜充血分泌物增多诊断为结膜炎切开结膜囊后发现有5条约1厘米白色活动虫体遂送大学寄生虫教研室诊断为结膜吸吮线虫结膜吸吮线虫主要寄生于犬猫兔等动物眼部的线虫亦可寄生于人眼部引起结膜吸吮线虫病成虫主要在狗猫等动物的结膜囊及泪管寄生雌虫在眼眶内排出具有鞘膜的初产蚴当其中间宿主蝇类在宿主眼部舔食时初产蚴随眼部分泌物进入蝇的消化道穿过中肠侵入血腔经两次蜕皮发育为感染期幼虫并进入蝇的头部
受精蛔虫卵
受精蛔虫卵脱去壳外一层凹凸不平的蛋白质膜,卵细胞内虫体 发育,卵核浓集并出现空隙 要点:受精蛔虫卵的特殊形态,注意与钩虫卵鉴别
臭虫
2013年卫生部寄生虫形态学室间质评及正确答案
卫生部临床检验中心2013年寄生虫形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
序号 图片 说明2013401请报告图片中箭头所指细胞内结构的名称2013402请报告图片中箭头所指细胞内结构的名称2013403请报告图片中箭头所指物(大小约为15μm ×1.8μm )的名称页尾有正确答案及评述2013404请报告图片中箭头所指物的名称。
2013405请报告图片中箭头所指物的名称(卡红染色)2013406请报告图片中箭头所指物(大小约为90μm ×44μm )的名称2013407请报告图片中箭头所指物的名称(卡红染色)2013408 请报告图片中箭头所指物(大小约为240μm×5μm)的名称2013409 请报告图片中箭头所指物(大小约为50μm×20μm)的名称2013410 请报告图片中箭头所指物(大小约为110μm×50μm)的名称2013411 请报告图片中箭头所指物(大小约为30μm×12μm)的名称2013412 请报告图片中箭头所指物(大小约为70μm×40μm)的名称2013413 请报告图片中箭头所指物(直径约为10-30μm)的名称2013414 请报告图片中箭头所指物(大小约为90μm×60μm)的名称2013415 请报告图片中箭头所指物的名称(直径约为35μm)卫生部临床检验中心2013年全国医院寄生虫形态统计结果你室结果与参考答案是否相符结果编码结果编码样本编号参考答案35012013401疟原虫环状体是3501疟原虫环状体35032013402疟原虫裂殖体是疟原虫裂殖体350335062013403杜氏利什曼原虫是3506杜氏利什曼原虫2013404耻阴虱是3524耻阴虱352435372013405牛肉绦虫头节是3537牛肉绦虫头节35182013406蛔虫(虫卵)是蛔虫(虫卵)351835422013407华支睾吸虫成虫是华支睾吸虫成虫354235202013408马来丝虫(微丝蚴)是3520马来丝虫(微丝蚴)35152013409鞭虫(虫卵)是3515鞭虫(虫卵)35332013410肺吸虫(虫卵)是肺吸虫(虫卵)353335132013411华支睾吸虫(虫卵)是华支睾吸虫(虫卵)351335162013412钩虫(虫卵)是钩虫(虫卵)351635502013413结肠内阿米巴包囊是3550结肠内阿米巴包囊35102013414日本血吸虫(虫卵)是3510日本血吸虫(虫卵)35142013415绦虫(虫卵)是绦虫(虫卵)3514报表打印日期: 2 - 2 2013-07-02本次活动发放的15个寄生虫形态学质评图片中,除2013413、2013414批号图片外,大多数实验室的回报结果与参考答案基本一致,故只对上述2个批号图片的质评结果加以说明。
卫生部2015-2018年寄生虫形态学检查室间质量评价
卫生部临床检验中心2015年寄生虫形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
卫生部临床检验中心2016年寄生虫形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
卫生部临床检验中心2017年寄生虫形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
卫生部临床检验中心2018年寄生虫形态学检查室间质量评价注:若看不清结构,可以适当放大图片比例进行观察。
序号图片说明2018401 请报告图片中箭头所指对象的名称2018402 请报告图片中箭头所指对象(大小约为4~7μm ×2~4μm)的名称2018403 请报告图片中箭头所指对象(大小约为240μm ×5μm)的名称2018404 请报告图片中箭头所指对象(大小约为50μm×20μm)的名称2018405 请报告图片中箭头所指对象(大小约为30μm×12μm)的名称2018406 请报告图片中箭头所指对象(直径约为10μm ~30μm)的名称2018407 请报告图片中箭头所指对象(大小约为70μm ×40μm)的名称2018408 请报告图片中箭头所指对象(大小约为50μm ~60μm)的名称2018409 请报告图片中箭头所指对象(大小约为60μm×44μm)的名称2018410 请报告图片中箭头所指对象的名称(大小约为140μm×80μm)2018411 请报告图片中箭头所指对象的名称(90μm×70μm)2018412 请报告图片中箭头所指对象(大小约为10~25mm ×3~5mm)的名称2018413 请报告图片中箭头所指对象的名称2018414 请报告图片中箭头所指对象(大小约为30mm~50mm)的名称2018415 请报告图片中箭头所指对象(大小约为7.5~12mm×4~6mm)的名称。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2007 年第 1 次血细胞形态学室间质量评价
序号
2007101
图片
说明
患者,女性,76 岁, 查体发现脾大,伴上 腹痛,以往有骨髓增 生性疾病,血常规检 查 结 果 如 下 : WBC 11.7 × 109 / L ; Hb 10.1g/dL;Hct 46.0 %; Plt 400×109/ L。请报告箭头所指细
请报告箭头所指细胞的 名称
颗粒缺失中性粒细胞
卫生部临床检验中心 2009 年第 1 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2009101
请报告箭头所指细胞 的名称
单核细胞
2009102
请报告箭头所指细胞 的名称
口形红细胞
2009103
请报告箭头所指细胞 的名称
2007207 2007208 2007209 2007210
患者,女性,45 岁, 因贫血入院,血常规 检查结果如下:WBC 11.7 × 109 / L ; Hb 9.2g / dL ; Hct 26.2 %。请报告细胞内箭 头所指物的名称
豪乔氏小体
请报告箭头所指细胞 的名称
钝锯齿形(皱缩)红细胞
上皮细胞
请报告箭头所指细胞 的名称
多叶分核中性粒细胞
请报告箭头所指细胞 的名称
嗜碱性粒细胞 .
请报告箭头所指细胞 的名称
异型淋巴细胞
2010108 2010109 2010110
请报告箭头所指细胞 内结构的名称
卡波氏环(Cabot ring)
请报告箭头所指物的 名称
畸形血小板 大血小板、巨血小板
请报告箭头所指细胞 的名称
2009202
请报告箭头所指细胞
的名称
棘形红细胞
2009203
请报告箭头所指细胞
的名称
巨多分叶中性粒细胞
2009204 2009205 2009206 2009207
请报告箭头所指细胞 的名称
椭圆形红细胞
请报告箭头所指细胞 的名称
嗜碱性粒细胞
请报告箭头所指细胞 的名称
嗜酸性粒细胞
请报告箭头所指细胞 的名称
晚幼红细胞
卫生部临床检验中心 2010 年第 2 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2010201
请报告箭头所指细胞 的名称
中幼红细胞
2010202
请报告箭头所指细胞
内结构的名称
豪若小体(Howell-Jolly)
2010203
请报告箭头所指现象 的名称
请报告箭头所指细胞的 名称
嗜碱性点彩红细胞
请报告箭头所指现象的 名称
血小板卫星现象
请报告红细胞内箭头所 指物的名称
疟原虫
请报告箭头所指物的名 称
真菌
卫生部临床检验中心 2008 年第 1 次血细胞形态学室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2008101
请报告箭头所指结构 的名称
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2008301
请报告箭头所指细胞的 名称
成熟的嗜酸性粒细胞 颗粒缺失的嗜酸性粒细胞
2008302
请报告箭头所指细胞的 名称(适当放大图片比 例进行观察)
原幼淋巴细胞
2008303
请报告箭头所指细胞的 名称
原粒细胞 原单核细胞
2008304 2008305 2008306 2008307
Auer小体
2008102
请报告箭头所指细胞 的名称
成熟性嗜碱粒细胞
2008103
请报告箭头所指细胞 的名称
嗜碱性点彩红细胞
2008104 2008105 2008106 2008107
请报告箭头所指细胞 的名称
早幼红细胞
请报告箭头所指现象 的名称
血小板卫星现象
请报告箭头所指细胞 的名称
毛细胞
请报告箭头所指细胞 的名称(适当放大图 片比例进行观察)
靶形红细胞
2009208 2009209 2009210
请报告箭头所指细胞 内结构的名称
中性粒细胞核鼓槌 (核突起)
请报告箭头所指细胞 的名称
巨核细胞
请报告箭头所指细胞 的名称
早幼粒细胞
卫生部临床检验中心 2009 年第 3 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
请报告箭头所指 细胞内结构的名 称
Auer小体
2011102
请报告箭头所指 细胞内结构的名 称
豪焦氏小体
2011103
请报告箭头所指 细胞的名称
戈谢氏细胞
2011104 2011105 2011106 2011107
请报告箭头所指 细胞的名称
嗜酸性粒细胞
请报告箭头所指 细胞的名称
单核细胞
2008108 2008109 2008110
请报告箭头所指细胞 的名称
成熟性嗜酸粒细胞
请报告箭头所指细胞 的名称
成熟红细胞
请报告箭头所指细胞 的名称
异型淋巴细胞
卫生部临床检验中心 2008 年第 2 次血细胞形态学室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2010101
请报告箭头所指细胞 的名称
浆细胞
2010102
请报告箭头所指细胞 的名称
单核细胞
2010103
请报告箭头所指细胞 的名称
肥大细胞或组织嗜碱细胞
2010104 2010105 2010106 2010107
请报告箭头所指细胞 的名称
请报告箭头所指细胞的 名称
幼单核细胞
2010303
请报告箭头所指细胞的 名称
中性分叶核细胞
2010304 2010305 2010306 2010307
请报告箭头所指细胞的 名称
淋巴细胞
请报告箭头所指细胞的 名称
低色素性大红细胞
请报告箭头所指细胞的 名称
早幼粒细胞
请报告箭头所指细胞的 名称
未成熟嗜碱性粒细胞
异型淋巴细胞
请报告箭头所指细胞 的名称
缗钱状排列的红细胞
2007108 2007109 2007110
请报告箭头所指细胞 的名称
嗜多色性红细胞
请报告箭头所指细胞 的名称
大血小板 巨血小板
请报告箭头所指物的 名称
细菌
2007 年第 2 次血细胞形态学室间质量评价
序号
图片
说明
2007201
请报告箭头所指细胞 的名称
2010308 2010309畸形血小板
请报告箭头所指细胞的 名称
骨髓成纤维细胞
请报告箭头所指细胞的 名称
巨核细胞
卫生部临床检验中心 2011 年第 1 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2011101
请报告箭头所指细胞的 名称
泪滴形红细胞
请报告箭头所指细胞的 名称
赛塞利细胞
2009308 2009309 2009310
请报告箭头所指物的名 称
颗粒减少血小板 大血小板巨血小板
请报告箭头所指细胞的 名称
戈谢氏细胞
请报告箭头所指细胞的 名称
中性晚幼粒细胞
卫生部临床检验中心 2010 年第 1 次血细胞形态学检查室间质量评价
请报告箭头所指物的 名称
染料沉积物
请报告箭头所指物的 名称
正常血小板
2007 年第 3 次血细胞形态学室间质量评价
序号
图片
说明
2007301 2007302
请报告箭头所指细胞的 名称
异型淋巴细胞
患者,女性,71 岁,入 院时,血常规检查结果 如下:WBC 13.9×109 /L;RBC 2.28×1012/ L;Hb 8.8g/dL;Hct 26.7%;MCV 116.6fL; MCH 38.3pg ; MCHC 32.9g/dL;Plt 630×109 /L。请报告箭头所指细
请报告箭头所指细胞 的名称
浆细胞
请报告箭头所指细胞 的名称
球形红细胞
请报告箭头所指细胞 的名称
巨(中性)杆状核粒细胞
卫生部临床检验中心 2009 年第 2 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2009201
请报告箭头所指细胞 的名称
原幼淋巴细胞
胞的名称 成熟嗜碱粒性细胞
2007303
请报告箭头所指细胞的 名称
成熟嗜酸粒性细胞
2007304 2007305 2007306
请报告箭头所指细胞的 名称
上皮细胞
请报告箭头所指细胞的 名称
淋巴细胞
请报告箭头所指细胞的 名称
异型淋巴细胞
2007307 2007308 2007309 2007310
裂片红细胞
请报告箭头所指细胞 的名称
巨(中性)晚幼粒细胞
请报告箭头所指细胞 核上结构的名称
中性粒细胞核鼓槌(核突起)
卫生部临床检验中心 2010 年第 3 次血细胞形态学检查室间质量评价
注:若看不清结构,可以适当放大图片比例进行观察。
序号
图片
说明
2010301
请报告箭头所指细胞的 名称
