东北大学2017年硕士学位研究生入学考试物理化学试题
大连工业大学物理化学考研真题试题2017年

的偏摩尔体积将随浓度的改变而____。
A. 增加
B. 减少
C. 不变
D.不一定
9.反应
2NO + O2 ‡ˆ ˆ †ˆ
2NO2
的
r
H
m
<0,当此反应达平衡后,若要使平衡向产物方向移动,
应该_____。
A.升温升压
B.升温降压
C.降温升压
D.降温降压
10.对恒温恒压只做体积功的反应系统,若 r Gm >0,则___。
r
H
m
=
kJ·mol-1。
大连工业大学 2017 年硕士研究生入学考试自命试题
4.影响 KΘ大小的因素有 ______;影响化学平衡状态的因素有_________ _______________。 5.一定量的 NH4Cl(s)置于真空容器中,加热分解达平衡,系统的组分数为___ ,相数为 ___ ,
科目代码: 805 页
科目名称:
物理化学
共5页第3
自由度数为
。
6.某溶液含 LaCl3 和 NaCl 各为 0.025 mol·kg-1,该溶液离子强度 I = _______ mol·kg-1,25℃ 时 LaCl3 的离子平均活度系数γ± = _______ (用不考虑离子半径修正的德拜-许格尔极限公 式, 常数 A 的值取 0.509)。
D.不一定
A.零级反应
B.一级反应
C.二级反应
D.三级反应
19.下列几种运动中 ____对热力学函数 G 和 A 的贡献不同。
A.电子运动
B.振动运动
C.转动运动
D.平动运动
20.丁达尔效应的强度与入射光波长的_____次方成反比。
大连工业大学805物理化学2017年考研专业课真题初试

科目代码: 805 科目名称: 物理化学 共 5 页 第 1 页 选择题(20分,每小题1分):1.下列几种条件下的真实气体,最接近理想气体行为的是 。
A .高温高压B .高温低压C .低温高压D .低温低压2.某绝热系统在接受了环境所做的功后,其温度 。
A .一定升高B .一定降低C .一定不变D .不一定改变3.物质的温度越高,则 。
A .其所含热量越多B .其所含热能越少C .其热容越大D .其分子的热运动越剧烈4.下列物质中不查表就知其燃烧焓的物质是 ,不查表就知其生成焓的物质是 。
A .石墨B .二氧化碳C .甲烷D .金刚石5.从状态A 至状态B 不同的不可逆途径的熵变 。
A .各不相同B .都相等C .不一定相等D .不能确定6.真实气体进行绝热可逆膨胀,其熵变 。
A .ΔS > OB .ΔS < OC .ΔS = OD .不一定7.过饱和溶液中溶质的化学势与纯溶质的化学势比较,高低如何? ______。
A . 低B .高C . 相等D .不可比较8.恒温恒压下,在A 与B 组成的均相系统中,若A 的偏摩尔体积随浓度的改变而增加,则B 的偏摩尔体积将随浓度的改变而____。
A . 增加B . 减少C . 不变D .不一定9.反应 2NO +O 22NO 2的<0,当此反应达平衡后,若要使平衡向产物方向移动,应该_____。
ˆˆ†‡ˆˆr m H Θ∆ A .升温升压 B .升温降压 C .降温升压 D .降温降压10.对恒温恒压只做体积功的反应系统,若>0,则___。
r m G Θ∆A . 反应不能正向进行 B .反应能正向进行C .须用判断反应限度后才知反应方向D . 当J a < K Θ时仍能正向进行r m G ∆11.只受环境温度和压力影响的二组分平衡系统,可能出现的最多相数为______。
A . 2B . 3C . 4D .512.碳酸钠与水可形成下列几种水合物:Na 2CO 3·H 2O ,Na 2CO 3·7H 2O ,Na 2CO 3·10H 2O 在101.325k Pa ,与碳酸钠水溶液和冰共存的含水盐最多可以有 ____种。
东北大学2017年全日制硕士研究生电路原理考试真题与答案解析
机密★启用前
东北大学 2017 年全日制硕士研究生 招生入学考试试卷
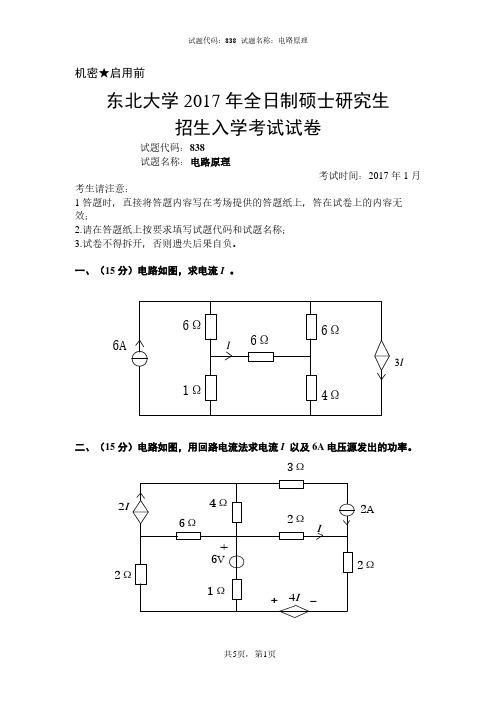
试题代码:838 试题名称:电路原理 考试时间:2017 年 1 月 考生请注意: 1 答题时,直接将答题内容写在考场提供的答题纸上,答在试卷上的内容无 效; 2.请在答题纸上按要求填写试题代码和试题名称; 3.试卷不得拆开,否则遗失后果自负。 一、(15 分)电路如图,求电流 I 。
I
+
•
•
U
UR
•
+ -
I1
•
I2
•
R L
+• -
C
UC
-
四、(15 分)图示正弦交流电路中,已知 is= 4cos100t (A) , us= 8cos100t (V)。 求 u (t)和 i (t)。
4Ω
40mH
4Ω
i + us _
·· is + u _
60mH 40mH
五、(15 分)对称三相交流电路如图,已知电流表的读数为 4A , 线路阻抗 Z1=2j2Ω 。 三相电源提供的总的有功功率为 1440W 、无功功率为 960var 。求图示 瓦特表的读数。
e- J*-l.ll “ • ñ‚‘g”â ‹— T˜ ¬ •_ ˆ ,•¡ ŽL•Œ • ),LƒÄ ,•¡ t g • Ó ‚ (1 Y ˆ× •À • J.ll?>L ô • 417? Lk \• \• *{htlWt,r-l*y A • =- [
—¹ ‚Ý 9ƒÆ ?ƒf 12 •R kt
éS •M •B lƒÕ •T ‹› ‰Ô . ‰» “d ‹@ Ž‘ •¡ ‚ Í •_ •\ ` ‹ )t2-•¡ 3‚ËŠô ƒW •Ï Ž è ƒÕ ƒB • R ¡ • ƒ • Œ E •m • d ‚ê Ž¯ƒz ‘Í •‘ “ñ _.ƒŒ • S Š¶ tE• •¡ˆê L2 2•‘ • • ƒ ƒ 1ƒV Œ ¡ Œ ” 2—‹ ¹ Ä • LƒÕ •‘ ” ½ =|ƒL M
东北大学硕士研究生入学考试复试科目参考书
120404社会保障
西方经济学
《现代西方经济学(宏观经济学)》宋承先著复旦大学出版社1997年以后各版均可
490100公共管理硕士
公共政策学
《公共政策学》娄成武主编东北大学出版社2003年版
070101基础数学
1、代数与几何2、分析与方程(两门选一)
1、《通信原理》第6版国防工业出版社
2、《高频电子线路》第三版张啸文主编高等教育出版社
081002信号与信息处理
1、数字信号处理50%;2、单片机原理50%
1、《数字信号处理教程》,程佩清编著,清华大学出版社,2001年,2、《单片机原理及接口技术》李朝青编著北京航空航天大学出版社简明修订版2001年
2、《单片机原理及接口技术》李朝青编著北京航空航天大学出版社简明修订版2001年
3、《单片机的C语言应用程序设计》(修订版)马忠梅、籍顺心、张凯、马岩主编北京航空航天大学出版社2003
080802电力系统及其自动化
综合知识(1、电路原理部分30%,2、微机原理部分30%,3、计算机控制系统部分40%)
《工程材料学》连法增东北大学出版社2005年1月
430106冶金工程
冶金学(2)
《冶金学》(钢铁冶金卷)朱苗勇冶金工业出版2005年《冶金学》(有色冶金部分)邱竹贤东北大学出2000年
080402测试计量技术及仪器
综合知识(1、自动化30%;2、单片机30%;3、逻辑与编程能力40%)
1、《过程控制仪表及控制系统》林德杰主编机械工业出版社2004
《近世代数》第二版扬子胥高等教育出版社2003年
《解析几何》第二版丘维声北京大学出版社1996年
研究生物理化学试题精选50道

研究生物理化学试题精选50道1.设地球大气的压力(高度的函数)和温度的关系服从理想气体绝热公式:求:(1)大气的高度为多少?(2)压力和温度随大气高度变化的规律。
(3)大气理论顶端温度为多少?(设海平面上t=10℃,空气分子量M=28.8kg/mol,空气绝热指数K=1.4,定压比热C p=3.5R)(15分,同济研究生试题,1997) 2.一个抽气泵联于一个需降压的容器上,容器容积为 2.4m3,抽气的容积流量为0.112m3/min,并保持不变,如容器内气温不变,试确定:(1)容器内气压自2.86bar降至1bar所需时间。
(2)容器内气体与周围环境的换热量及其方向(气体为理想气体)(1996,北航研究生试题,18分)3. 如题图所示,若压缩过程1—2为可逆绝热过程时,问该过程是吸热还是放热过程?它与不可逆绝热过程1—2有何区别?两者中哪个过程耗功量大,大多少?(1996,北航研究生试题,16分)4. 某热机工作于高温热源T1及低温热源T2之间,循环为1-2-3-4-1,其中1-2为等温吸热,2-3为绝热膨胀,3-4为等温吸热,4-1为定容吸热。
求:(1)画出循环的P-V及T-S图(2)写出循环热效率的计算式。
(1996,北航研究生试题,17分)5.5kg水与温度T o=295K的大气处于热平衡,若利用可逆热泵使水冷却到280K,求热泵需消耗的最小功量(水的比热4.1868kJ/kg·K)。
(1996,北航研究生试题,16分)6.一股1atm,20℃质量为1kg的空气流与另一股9atm,20℃质量为1kg的空气流进行可逆绝热混合,问:(1)混合过程气流有无熵的变化?(2)求出混合后空气流的压力。
(1996,北航研究生试题,24分)7.压力为4×105Pa,温度为25℃的空气不断通过阀门充入初始为真空态的储气罐,直到罐内压力达到4×105Pa时,关闭阀门。
若过程为绝热,空气为理想气体,环境温度为20℃,C p=1.0035kJ/kg·K。
辽宁大学848物理化学2017考研专业课真题

fA)总 表面能 o)比 表面 CC)液面下的附加压力 (D)表 面张力 6.定 义平均离子活度 饵 的原因是 ( )
fA)计 算方便
⒄)测 试方便
(C)单 种离子活度无法测量 (D)单 种离子活度无定义
7,理 想气体与温度为 Γ 的大热源接触作等温膨胀吸热 g,所 做 的功是变到相
同终态的最大功的乃%,则 系统的熵变为 ( )
共 (6)页 笫 (1)页
2.关 于偏摩尔量 ,下 面的叙述中错误的是 ( ) m)偏摩尔量 的数值可 以是正数 、负数和零;
CB)每 一种广度性质都有偏摩尔量 ,而 且都不等于其摩尔量 ;
(C)除偏摩尔 Gibbs自 由能外 ,其 它偏摩尔量都不等于化学势;
@)溶 液 中各组分 的偏摩尔量之间符合 Gibbs-Duhem关 系式。
辽宁大学 zO17年
攻 读硕 士学位研 究生招 生考 试试题
招生专业:无 机化学、分析化学、 考试科 目: 物理化学
高分 子化 学 与物理
应且生莹~业 学工程 (专 业学位 )
试题种类 : A卷
考试 时间: 12月 zs日 下午
(请 将 答案 写在 答题 纸上 ,写 在试 题 纸 上无 效 )
一。填空题 (每 空 1分 ,共 10分 )
为 NH3佗)不口HClfg),此 平衡系统的独立组分数 C=( ),自 由度数/=( )。
二。选择题 (每 小题 2分 ,共 15题 ,共 30分 )
1.BET/Ak爿讠( )
(A)只 能用于多层物理吸附;
o)只 能用于单层化学吸附;
(Cl能 用于单层的化学,物 理吸附; (⑵ 胄邕用于多层的化学,物 理吸附。
3.已 知某温度 下,一 定量 的 PC15rg)在 发生分解反应 PC15(g,=PC13fg)+C12(g)
2017年物理化学考研模拟试题及详解(二)【圣才出品】
2017年物理化学考研模拟试题及详解(二)一、选择题(每题3分,共30分)1.对于反应3A +2B→C,当A 耗掉0.6mol 时,反应进度改变值为( )。
A .0.6molB .0.2molC .0.3molD .0.1mol【答案】B【解析】计算如下:。
A 0.60.2 mol ξυ==2.下列中哪一点不能用来衡量液体对固体的润湿程度( )。
A .液体在固体表面铺展系数的大小B .固体在液体中的分散程度C .接触角的大小D .液体对固体粉末润湿热的大小【答案】B【解析】A 项,铺展系数越大,铺展性能越好,即润湿程度越大。
C 项,接触角越小越小,润湿性越好。
D 项,润湿热的大小反应了液固界面转变为液液界面的难易程度,润湿热越小,表明固体更容易溶解,即液体对固体润湿性越好。
3.定温定压下,液态水变为水蒸气,系统的热力学函数()。
A.熵增加,焓减小B.熵减小,焓增加C.熵和焓都减小D.熵和焓都增加【答案】D【解析】由热力学基本方程dH=TdS+Vdp可得,=T>0,即焓与熵同向变化。
液态水变为水蒸气吸热,熵增加,即焓也增加。
4.表面反应控制的气-固相催化反应A→B,其速率方程r=kb A P A/(1+b A P A),在通常压力下,若反应物的吸附很强,则表面为:()。
A.零级反应B.一级反应C.二级反应D.三级反应【答案】A【解析】零级反应特点为反应速率方程与时间无关,由题目中所给的速率方程形式可以看出,表面为零级反应。
5.反应CO(g)+Cl2(g)→COCl2(g)的=kc(CO)c(Cl2)α;当温度及CO的浓度保持不变而Cl2的浓度增至原来的2倍时,反应速率增至原来的2.83倍,则α=()。
B.2.0C.0.5D.0【答案】A【解析】温度及CO的浓度保持不变,即公式=kc(CO)c(Cl2)α(1式),式中K和c(CO)不变,由2.83=kc(CO)·(2C Cl2)α(2式),用(2)式除以(1)式得α=1.5。
历年物理化学考研题
物理化学考研题华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题(适用专业:应化类含制糖工程,化工类,未注明的为两类共用题)1.苯的正常沸点为353K ,摩尔汽化焓为30.77kJ•mol -1,现将353K ,标准压力下的1摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽(设为理想气体)。
A .计算该过程苯吸收的热量与做的功;B .求过程的 G 与S ;C .求环境的熵变;D .可以使用何中判据判断过程的性质。
(12分)解A .因真空蒸发, p 环=0⎰=-=∴0dV p W 环 Q =U =H - (pV )压力变化不大时,压力对凝聚系统的焓、熵影响不大,所以H 1=0、S 1=0。
又理想气体恒温 H 3=0 ,所以H =H 1+H 2+H 3=H 2= n vap H m则 Q =n vap H m - p (V g -V l )= n vap H m - p V g ≈ n vap H m - nRT= 1×30770 J - 1mol×8.3145 J·K -1·mol -1 ×353K= 27835JB. S =S 1+S 2+S 3=S 2+S 2= (H 2/T )+ nR ln(p /p )= (30770J/353K)+1×8.3145J·K -1×ln(101.325kPa/100kPa)= 87.28J·K -1G =H - T S = 30770J - 353K×87.28J·K -1= -39.84JC. 环境熵变 :设系T =环TS 环= -Q 系/T 环= -27835J/353K =-78.85 J·K -1D . 可用熵判据判断过程的性质,此过程S 隔=S 系+S 环= 87.28J·K -1+(-78.85J·K -1)= 8.43J·K -1 > 0故为不可逆过程。
2017年硕士学位研究生入学考试大学物理试题北京市联合命题
2017年攻读硕士学位研究生入学考试北京市联合命题大学物理试题(请将答案写在答题纸上,写在试题上的答案无效)一、选择题(每题4分,共60分)1.质点作曲线运动,r 表示位矢,s 表示路程,υ 表示速度,υ表示速率,a表示加速度,t a表示切向加速度。
则以下表达式中正确的是(A) υ=t r d d; (B) υ=t s d d ; (C) a t=d d υ; (D) t d d a t =υ。
2.以下物理量中,是矢量的是(A) 转动惯量; (B) 重力势能; (C) 电流密度; (D) 电位移通量。
3.下列说法中错误的是 (A) 质点作匀速率圆周运动时,其加速度为零; (B) 质点系总动量的改变与内力无关; (C) 质点系总动能的改变与内力有关; (D) 质点系机械能的改变与保守内力无关。
4.一人站在转盘中央,两臂侧平举,人和转盘的转动惯量为I 。
当整个系统绕转轴以某一角速度匀速旋转时,系统的转动动能为E k 。
这时此人将两臂收回,使得系统的转动惯量变为I /3,则此时系统的转动动能变为 (A) 9E k ;(B) 3E k ;(C) √3 E k ;(D) E k 。
5.密闭容器中的理想气体,当其温度升高时,下列表述中错误的是 (A) 分子的热运动变得剧烈; (B) 分子的无规则运动变得剧烈; (C) 分子的平均平动动能增大; (D) 分子间的相互作用势能增加。
6.下列说法中正确的是(A) 功可以全部变为热,但热不能全部变为功;(B) 可逆过程就是可以向相反方向进行的准静态过程;(C) 不可逆过程就是不能向相反方向进行的准静态过程; (D) 系统某一状态的熵值是其所对应的宏观状态的无序性的量度。
7.下列说法中正确的是(A) 电势为零处,场强一定为零; (B) 场强为零处,电势一定为零;(C) 通过闭合曲面的电通量仅由该曲面内的电荷决定;(D) 点电荷在电场中某点受力的方向,即为该点的电场强度的方向。
研究生入学物理化学考试题答案
研究生入学物理化学考试卷A 答案一、判断题(正确的填上“√”,错误的填上“×”)(每题1分,共20分)1、A 、B 两组分构成溶液,当其对拉乌尔定律产生较大正偏差时,在p~x 图上具有最高点, 在T~x 图上具有最低点(√)2、对正溶胶,以下一价负离子聚沉能力的顺序为 NO -3<Cl -<Br - <I -(×)3、以∑≤0iiμν作判据,条件仅限于等温等压 (×)4、离子的迁移速率与电解质溶液的温度、浓度及离子的本性有关 (√ )5、在恒容反应中,体系能量的增减全部用于内能的增减。
(√ )6、气体在固体表面的吸附分为物理吸附和化学吸附。
物理吸附的吸附层为单分子层, 化学吸附的吸附层为单分子层或多分子层。
(×)7、A 、B 两组分构成理想溶液,当P B 0>P A 0时,在p~x 图上,气相线总在液相线上方。
( × ) 8、盐桥的作用是沟通第二类导体,消除液接电势 (√ ) 9、在平行反应中,不论什么情况下速率常数k 1/k 2值总是常数。
(× ) 10、只有被物系吸收的光,对于发生光化学变化才是有效的(√ )11、活化能是指使寻常分子变成活化分子所需要的最少能量 (√ ) 12、∵BA iB A T Q S →-∑>∆)(*δ,∴可逆过程的熵变大于不可逆过程的熵变(× )13、任意热机效率η=(T 2-T 1)/T 2(× )14、冷机从低温热源吸热,必须体系对环境作功才能实现 (× )15、Helmholtz 自由能A 是等压条件下体系作功的本领 ( × ) 16、双原子理想气体的C v.m =5/2R (√ )17、非理想气体,不指明途径时△H=⎰21T T P dTC ( × )18、气体的绝热节流过程为恒焓过程 (√ ) 19、封闭体系是体系与环境之间有物质交换,无能量交换。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
东北大学2017年硕士学位研究生入学考试试题(物理化学)■需使用计算器 □不使用计算器一、选择题(每小题 2 分,共 60 分)1、从热力学基本关系式得知(∂A /∂V )T 等于( )(A )(∂H /∂S )p (B )(∂G /∂T )p(C )(∂H /∂T )S (D )(∂U /∂V )S2、某化学反应在恒压、绝热和只作体积功的条件下进行,体系的温度由T 1升高到T 2, 则此过程的焓变ΔH ( )(A) 小于零 (B) 等于零 (C) 大于零 (D) 不能确定3、等温等压下进行的化学反应,其方向由Δr H m 和Δr S m 共同决定,自发进行的反应满足下列关系中的是 ( ) A 、TH S mr m r ∆=∆ B 、T H S m r m r ∆>∆C 、T H S m r m r ∆<∆ D 、THS m r m r ∆≤∆4、已知某可逆反应的 (∂Δr H m /∂T )p = 0,则当反应温度降低时其熵变Δr S m ( )(A) 减小 (B) 增大 (C) 不变 (D) 难以判断5、在一简单的(单组分,单相,各向同性)封闭体系中,恒压只做膨胀功的条件下,吉布斯自由能值随温度升高如何变化? ( )(A) (∂G /∂T )p > 0 (B) (∂G /∂T )p < 0 (C) (∂G /∂T )p = 0 (D) 视具体体系而定6、关于亨利定律,下面的表述中不正确的是 ( )(A)若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B 必遵从亨利定律(B)温度越高、压力越低,亨利定律越正确 (C)因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律 (D)温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关7、298 K时,HCl(g,M r=36.5)溶解在甲苯中的亨利常数为245 kPa⋅kg⋅mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为( )(A) 138 kPa (B) 11.99 kPa (C) 4.9 kPa (D) 49 kPa8、在373.15 K 时,某有机液体A 和B 的蒸气压分别为p和3p,A和B 的某混合物为理想液体混合物,并在373.15 K,2p时沸腾,那么A 在平衡蒸气相中的摩尔分数是多少?( )(A) 1/3 (B) 1/4 (C) 1/2 (D) 3/49、在一个密封的容器中装满了温度为373.15 K的水,一点空隙也不留,这时水的蒸气压()(A)等于零(B)等于101.325 kPa (C)小于101.325 kPa (D)大于101.325 kPa10、某一物质X在三相点时的温度是20℃,压力是2pϴ。
下列哪一种说法是不正确的。
( )(A) 在20℃以上X 能以液体存在(B) 在20℃以下X 能以固体存在(C) 在25℃,pϴ下液体X 是稳定的(D) 在25℃时,液体X 和固体X 具有相同的蒸气压11、如图所示,物系处于容器内,容器中间的半透膜AB只允许O2(g)通过,当物系建立平衡时,则当达渗透平衡时,该体系的自由度为( )(A) 1 (B) 2 (C) 3 (D) 412、H3COOH(l)+C2H5OH(l)=CH3COOC2H5(l)+H2O(l)在25℃平衡常数K c为 4.0,今以CH3COOH及C2H5OH各1 mol混合进行反应,则达平衡常数最大产率为()(A) 0.334% (B) 33.4% (C) 66.7% (D) 50.0%13、下的气相反应,在T=200K时K p=8314×102Pa, 则K c/(mol·dm-3)是( )(A) 5×102(B) 14×106(C) 14×103(D) 0.514、非理想气体是( )(A) 独立的全同粒子体系(B) 相依的粒子体系(C) 独立的可别粒子体系(D) 定域的可别粒子体系15、在分子运动的各配分函数中与压力有关的是( )(A) 电子运动的配分函数 (B) 平均配分函数 (C) 转动配分函数 (D) 振动配分函数16、在其它条件不变时,电解质溶液的摩尔电导率随溶液浓度的增加而 ( ) (A) 增大 (B) 减小 (C) 先增后减 (D) 不变17、在298K 时,浓度为0.1和10.01mol kg -⋅的HCl 溶液的液接电势为(1)j E ,浓度相同而换用KCl 溶液,其液接电势为(2)j E ,两者关系为( )。
(A) (1)j E >(2)j E (B) (1)j E <(2)j E (C) (1)j E =(2)j E (D) 无法判断18、Al 2(SO 4)3的化学势 μ 与Al 3+ 和 SO 42-离子的化学势 μ + ,μ-- 的关系为( ) (A) μ = μ + + μ-- (B) μ = 3μ + + 2μ-- (C) μ = 2μ ++ 3μ--- (D) μ = μ +·μ---19、在298 K 将两个 Zn(s)极分别浸入 Zn 2+ 活度为0.02和0.2的溶液中, 这样组成的浓差电池的电动势为( )(A)0.059 V (B)0.0295 V (C)-0.059 V (D) (0.059lg0.004) V20、电池在下列三种情况:(1)I→0;(2)有一定电流;(3)短路。
忽略电池内电阻,下列说法正确的( )(A)电池电动势改变 ; (B) 电池输出电压不变 ; (C)对外输出电能相同 ; (D) 对外输出电功率相等 。
21、在 Hittorff 法测定迁移数实验中,用 Pt 电极电解 AgNO 3溶液,在 100 g 阳极部的溶液中,含 Ag +的物质的量在反应前后分别为 a 和 b mol ,在串联的铜库仑计中有c g 铜析出, 则 Ag +的迁移数计算式为( M r(Cu) = 63.546 ) ( ) (A) [ (a - b)/c ]×63.6 (B) [ c - (a - b) ]/31.8 (C) 31.8 (a - b)/c (D) 31.8(b - a)/c22、关于反应分子数的不正确说法是( )(A) 反应分子数是个理论数值 (B) 反应分子数一定是正整数(C) 反应分子数等于反应式中的化学计量数之和(D) 现在只发现单分子反应、双分子反应、三分子反应23、光气 COCl 2 热分解的总反应为: COCl 2 →CO+Cl 2 该反应分以下三步完成: Cl 2 ⇌ 2Cl 快速平衡 Cl +COCl 2 → CO +Cl 3 慢 Cl 3 ⇌ Cl 2 +Cl 快速平衡总反应的速率方程为:-d c (COCl2) /d t= kc (COCl2)·{c (Cl2)}1/2此总反应为()(A)1.5级反应,双分子反应;(B)1.5级反应,不存在反应分子数;(C)1.5级反应,单分子反应;(D)不存在反应级数与反应分子数。
24、绝对反应速率理论的假设不包括()(A) 反应物分子在碰撞时相互作用的势能是分子间相对位置的函数(B) 反应物分子与活化络合物分子之间存在着化学平衡(C) 活化络合物的分解是快速步骤(D) 反应物分子的相对碰撞动能达到或超过某个值时才发生反应25、在相同温度下,固体冰和液体水的表面张力哪个大? ( )(A) 冰的大(B) 水的大(C) 一样大(D) 无法比较26、把细长不渗水的两张白纸互相靠近(距离为d ),平行地浮在水面上, 用玻璃棒轻轻地在两纸中间滴一滴肥皂液, 两纸间的距离将( )(A) 增大(B) 减小(C) 不变(D) (A)、(B)、(C)都有可能27、气固相反应CaCO3(s)⇌CaO(s) + CO2(g) 已达平衡。
在其它条件不变的情况下,若把CaCO3(s) 的颗粒变得极小,则平衡将( )(A) 向左移动(B) 向右移动(C) 不移动(D) 来回不定移动28、溶胶的动力性质是由于粒子的不规则运动而产生的, 在下列各种现象中, 不属于溶胶动力性质的是( )(A) 渗透法(B) 扩散(C) 沉降平衡(D) 电泳29、关于胶粒的稳定性, 下面的说法中正确的是()(A) 溶胶中电解质越少, 溶胶越稳定(B) 胶粒的布朗运动越激烈, 溶胶越稳定(C) 胶团中扩散层里反号离子越多, 溶胶越稳定(D) 胶粒的表面吉布斯能越大, 溶胶越稳定30、下面的说法与DLVO理论不符的是( )(A) 胶粒间的引力本质上是所有分子的范德华引力的总和(B) 胶粒间的斥力本质上是双电层的电性斥力(C) 每个胶粒周围都有离子氛, 离子氛重叠区越大, 胶粒越不稳定(D) 溶胶是否稳定决定于胶粒间吸引作用与排斥作用的总效应二、计算证明题(每小题9 分,共90 分)1、(本题12分)0.5 mol氮气(理想气体)经下列三步可逆变化回复到原态:A) 从2 pϴ,5 dm3在恒温T1下压缩至1dm3B) 恒压可逆膨胀至5 dm3,同时温度T1变至T2C) 恒容下冷却至始态T1,2 pϴ,5 dm3试计算: (1) T1,T2;(2) 途径2变化中各步的ΔU,Q,W, ΔH;(3) 经此循环的∆U总, ΔH总,Q总,W总。
2、(本题8分)纯净的氮以足够慢的速率通过一由3.0 g非挥发性有机物(2)溶于200 g苯(1)构成的溶液后,再通过纯苯,此时得知溶液减轻了2.1540 g,同时苯减轻了0.0160 g,求该有机物的分子量。
已知苯的摩尔质量为0.078 kg⋅mol-1。
3、(本题12分)p 下,NaCl和水的固液平衡相图如下。
已知NaCl和水可生成水合物NaCl·2H2O,各物质在固相完全不互溶,NaCl·2H2O在-9°C分解为NaCl和质量分数为27%的水溶液,NaCl与水之低共熔温度为-21.1°C,溶液组成为23.3%(质量分数)的NaCl。
(1)根据以上描述指明A,B,C各为何物质,在相图上标注出A的熔点和C的转熔温度。
并完成下表。
(2)画出从a点开始沿虚线降温时的步冷曲线,并标出转折点及平台处的相变化情况。
(3)北极爱斯基摩人根据季节的变换,从海水中取出淡水,根据相图分析其科学依据,如果能从海水中取淡水,试计算1000kg海水中能取出淡水的最大量是多少?已知海水为含NaCl 2.5%(质量分数)的溶液。
4、(本题10分)一氧化氮晶体是由形成的二聚物N2O2分子组成,该分子在晶格中可以有两种随机取向用统计力学方法求298.15 K 时,1 mol NO气体的标准量热熵数值。
已知NO分子的转动特征温度Θr=2.42 K,振动特征温度Θv=2690 K,电子第一激发态与基态能级的波数差为121 cm-1,g e,0= 2,g e,1= 2。
