(2020年7月整理)《中华人民共和国药典》四部 通则0921崩解时限检查法.doc
0101片剂(2020版中国药典四部)

0101 片剂片剂系指原料药物或与适宜的辅料制成的圆形或异形的片状固体制剂。
中药还有浸膏片、半浸膏片和全粉片等。
片剂以口服普通片为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片、肠溶片与口崩片等。
含片系指含于口腔中缓慢溶化产生局部或全身作用的片剂。
含片中的原料药物一般是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部麻醉等作用。
舌下片系指置于舌下能迅速溶化,药物经舌下黏膜吸收发挥全身作用的片剂。
舌下片中的原料药物应易于直接吸收,主要适用于急症的治疗。
口腔贴片系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
口腔贴片应进行溶出度或释放度(通则0931) 检查。
咀嚼片系指于口腔中咀嚼后吞服的片剂。
咀嚼片一般应选择甘露醇、山梨醇、庶糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片系指在水中能迅速崩解并均匀分散的片剂。
分散片中的原料药物应是难溶性的。
分散片可加水分散后口服,也可将分散片含于口中吮服或吞服。
分散片应进行溶出度(通则0931)和分散均匀性检查。
可溶片系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
可溶片应溶解于水中,溶液可呈轻微乳光。
可供口服、外用、含漱等用。
泡腾片系指含有碳酸氢钠和有机酸,遇水可产生气体而呈泡腾状的片剂。
泡腾片不得直接吞服。
泡腾片中的原料药物应是易溶性的,加水产生气泡后应能溶解。
有机酸一般用枸橼酸、酒石酸、富马酸等。
阴道片与阴道泡腾片系指置于阴道内使用的片剂。
阴道片和阴道泡腾片的形状应易置于阴道内,可借助器具将其送入阴道。
阴道片在阴道内应易溶化、溶散或融化、崩解并释放药物,主要起局部消炎杀菌作用,也可给予性激素类药物。
具有局部刺激性的药物,不得制成阴道片。
阴道片应进行融变时限检查(通则0922)。
阴道泡腾片还应进行发泡量检查。
缓释片系指在规定的释放介质中缓慢地非恒速释放药物的片剂。
缓释片应符合缓释制剂的有关要求(指导原则9013)并应进行释放度(通则0931)检查。
崩解时限检查法

目的:建立崩解时限检查法的标准操作程序,规范崩解时限检查法的操作范围:适用于崩解时限检查法职责:检验科主管、检验员规程:1 简述1.1 本法(中国药典2000年版二部附录X A)适用于片剂(包括普通片,薄膜衣片,糖衣片,肠溶衣片及泡腾片),胶囊剂(包括硬胶囊剂,软胶囊及肠溶胶囊剂),以及丸剂的溶散时限检查.凡规定检查溶出度,释放度或融变时限的制剂,不再进行崩解时限检查。
1.2 片剂口服后,需经崩散,溶解,才能为机体吸收而达到治疗目的;胶囊剂的崩解是药物溶出及被人体吸收的前提,而囊壳常因所用囊材的质量,久贮或与药物接触等原因,影响溶胀或崩解;尺剂中不含有崩解剂,故在水中不是崩解而是逐渐溶散,且基质的种类与尺剂的溶解性能有密切关系,为控制产品质量,保证质量,保证疗效,药内规定本检查项目。
1.3 本检查法中所称“崩解”,系指固体制剂于规定条件下在检查时限内全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应通过筛网。
2 仪器与用具2.1 崩解仪(见中国药典2000年版二部附录X A的仪器装置)。
2.2 滴丸剂专用吊篮,按2.1项下所述仪器装置,但不锈钢丝筛网的筛孔内径改为0.425mm。
2.3 烧杯1000ml2.4 温度计,分度值1℃3试药与试液3.1人工胃液(供办胶囊剂和以明胶为基质的滴丸剂检查用),取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释成1000ml,即得.临用前制备。
3.2人工肠液(从肠溶胶囊剂检查用)取磷权二氢钾6.8g,加水500ml使溶解,用0.4%氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释成1000ml,即得,临用前制备。
4 操作方法4.1 将吊篮通过上端的不锈钢轴悬持于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使共下降时筛网距烧杯底部25mm,烧杯内盛有温度为37±1℃的水(或规定的溶液),调节液面高度使吊篮上升时筛网在液面下15mm处.除另有规定外,取药片6片,分别置上述吊篮的玻璃管中,每管各加1片,立即启动崩解仪进行检查。
新药典4部

编号 9000
9001 9011 9013 9015 9101 9102 9103 9203 9204 9205 9206 9601 9621 9622 9901
通则名称 指导原则 原料药物与制剂稳定性试验指导原则 药物制剂人体生物利用度和生物等效性试验指导原则 缓释、控释和迟释制剂指导原则 药品晶型研究及晶型质量控制指导原则 药品质量标准分析方法验证指导原则 药品杂质分析指导原则 药物引湿性指导原则 药品微生物实验室质量管理指导原则 微生物鉴定指导原则 药品洁净实验室微生物监测和控制指导原则 无菌检查用隔离系统验证指导原则 药用辅料功能性指标研究指导原则 药包材通用要求指导原则 药用玻璃材料和容器指导原则 国家药品标准物质制备指导原则
口腔贴片应进行溶出度(通则0931)或释放度(通则9031)检查 分散片应进行溶出度(通则0931)和分散均匀性检查 缓释片应符合缓释制剂的有关要求(通则9013)并进行释放度(通则0931)
检查 肠溶片除另有规定外,应进行释放度(通则0931)检查 除冷冻干燥法制备的口崩片外,口崩片应进行崩解时限检查(通则0921)。
除另有规定外,片剂应进行以下相应检查 【重量差异】 【崩解时限】
崩解时限检查法(通则0921) 凡规定检查溶出度、释放度的片剂,一般不再进行崩解时限检查 【分散均匀性】 照崩解时限检查法(通则0921)检查,不锈钢丝网的筛孔内径为710μm,水 温为15~25℃;取供试品6片,应在3分钟内全部崩解并通过筛网。 【微生物限度】 照非无菌产品微生物限度检查:微生物计数法(通则1105)和控制菌检查法 (通则1106)及非无菌药品微生物限度标准(通则1107)检查,应符合规定。
2020版中国药典—羟丙甲纤维素空心胶囊国家药用辅料标准

羟丙甲纤维素空心胶囊本品系由羟丙甲纤维素加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂)、半透明(仅一节含遮光剂)、不透明(两节均含遮光剂)三种。
【鉴别】(1)取本品1.0g,加沸水100ml,使用25mm 长的磁力搅拌子搅拌使溶解,应有悬浊液形成。
搅拌下冷却至10℃,溶液应澄清或略有浑浊,如澄清,取溶液为供试品溶液,如浑浊,取适量,每分钟2500 转速下离心2 分钟,取上清液为供试品溶液。
(2)取鉴别(1)项下供试品溶液0.1ml,加90%的硫酸溶液9ml,振摇,水浴加热3 分钟,立即冰浴冷却,小心加入茚三酮试液0.6ml,振摇,室温放置,溶液应先呈红色,并在100 分钟内变成紫色。
(3)精密量取鉴别(1)项下供试品溶液50ml,置于烧杯中,加水50ml,磁力搅拌,加热,升温速度为2∼5℃/min,记录溶液形成浑浊时的温度,絮凝温度应高于50℃。
【检查】松紧度取本品10 粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合并锁合,逐粒于1m 的高度处直坠于厚度为2cm 的木板上,应不漏粉;如有少量漏粉,不得超过1 粒。
如超过,应另取10 粒复试,均应符合规定。
脆碎度取本品50 粒,置表面皿中,移入盛有硝酸镁饱和溶液的干燥器内,置25±1℃ 恒温24 小时,取出,立即分别逐粒放入直立在木板(厚度2cm)上的玻璃管(内径为24mm,长为200mm)内,将圆柱形砝码(材质为聚四氟乙烯,直径为22mm,重20g±0.1g)从玻璃管口处自由落下,视胶囊是否破裂,如有破裂,不得超过2 粒。
崩解时限取本品6 粒,装满滑石粉,照崩解时限检查法(通则0921)胶囊剂项下的方法,加挡板进行检查,各粒均应在15 分钟内崩解,除破碎的胶囊壳外,应全部通过筛网。
崩解时限检查法
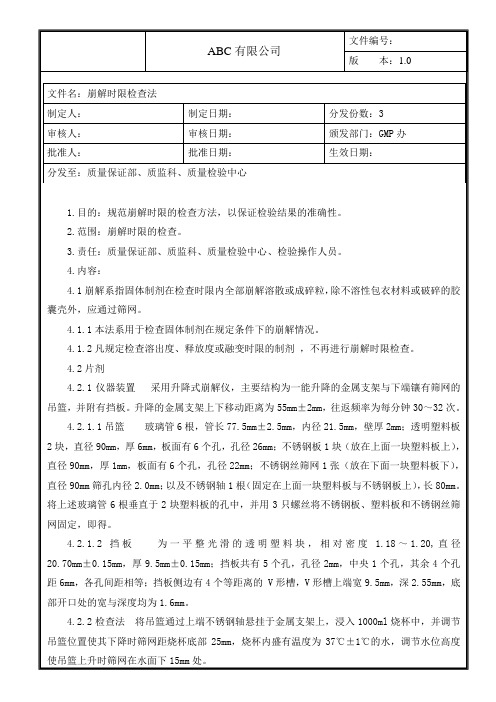
4.3.1硬胶囊剂或软胶囊剂 ,除另有规定外,取供试品6粒,按上述装置与方法(漂浮在液面的胶囊剂可加挡板)检查。硬胶囊剂应在30分钟内、软胶囊剂应在1小内全部崩解并通过筛网(囊壳碎片除外)。软胶囊剂可改在人工胃液中进行检查。如有1粒不能完全崩解,应另取6粒按上述方法复试,均应符合规定。
4.3.2肠溶胶囊剂,除另有规定外,取供试品6粒,按上述装置与方法(漂浮在液面的胶囊剂 可加挡板)检查。先在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象;继将吊篮取出,用少量水洗涤后,每管各加挡板一块,再按上述方法在磷酸盐缓冲液(PH6.8)中进行检查,1小内应全部崩解并通过筛网(囊壳碎片除外)。如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
文件名:崩解时限检查法
制定人:
制定日期:
分发份数:3
审核人:
审核日期:
颁发部门:GMP办
批准人:
批准日期:
生效日期:
分发至:质量保证部、质监科、质量检验中心
1.目的:规范崩解时限的检查方法,以保证检验结果的准确性。
2.范围:崩解时限的检查。
3.责任:质量保证部、质监科、质量检验中心、检验操作人员。
4.内容:
4.2.2检查法 将吊篮通过上端不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37℃±1℃的水,调节水位高度使吊篮上升时筛网在水面下15mm处。
4.2.2.1除另有规定外,取供试品6片,分别置上述吊篮的玻璃管中,启动崩解仪进行检查,药材原粉片各片均应在30分钟内全部崩解;浸膏(半浸膏)片、糖衣片各片均应在1小时内全部崩解。如有1片不能完全崩解,应另取6片复试,均应符合规定。
崩解时限检查法(通则0921)培训试题及答案

依据:中国药典分析检测技术指南(2017年7月)崩解时限检查法(通则0921)培训试题及答案2018.09姓名:成绩:一、单选题(每题4分,共24分)A、取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释成1000ml,即得。
B、取稀盐酸10ml,加水约800ml与胃蛋白酶16.4g,摇匀后,加水稀释成1000ml,即得。
C、取胃蛋白酶10g,加水约800ml,摇匀后,加水稀释成1000ml,即得。
D、取稀盐酸16.4ml,加水约800ml,摇匀后,加水稀释成1000ml,即得。
2、人工肠液是:。
(B)A、稀盐酸B、磷酸盐缓冲液(含胰酶)C、胃蛋白酶水溶液D、磷酸盐缓冲液(不含胰酶)3、介质用量:调节液面高度使吊篮上升时筛网在液面下mm处。
(C)A、5B、10C、15D、20A、30℃±5℃B、30℃±2℃C、20℃±2℃D、20℃±5℃5、在测试过程中,烧杯内的水温应保持在:。
(C)A、20℃±5℃B、30℃±5℃C、37℃±1℃D、37℃±5℃6、在结果判定时,除另有规定外,如有1片(粒)不能完全崩解,应另取片(粒)复式,均应符合规定。
(D)A、3B、4C、5D、6二、多选题(每题4分,共16分)1、崩解时限记录包括:。
(ABCD)A、仪器型号、制剂类型B、测试条件C、介质配制D、崩解或溶散时间2、2015版药典规定了胶囊剂包括:。
(ABC)A、硬胶囊剂B、软胶囊剂C、肠溶胶囊剂D、滴丸剂3、2015版药典规定了片剂包括:。
(ABCD)A、口服普通片、薄膜衣片、糖衣片B、肠溶衣片、肠溶片C、含片、舌下片、可溶片D、泡腾片、口崩片4、在崩解时限检查方法与仪器发展的历史中,出现的检查方法和仪器包括:。
(ABCD)A、手工法B、吊篮式崩解仪C、介质流动的崩解仪D、溶解性总固体崩解仪三、判断题(每题4分,共20 分)1、崩解时限检查法是一项重要的常规检测方法,是注射剂质量监控的重要手段。
0103胶囊剂(2020版中国药典四部)

0103 胶囊剂胶囊剂系指原料药物或与适宜辅料充填于空心胶囊或密封于软质囊材中制成的固体制剂。
胶囊剂可分为硬胶囊和软胶囊。
根据释放特性不同还有缓释胶囊、控释胶囊、肠溶胶囊等。
硬胶囊(通称为胶囊)系指采用适宜的制剂技术,将原料药物或加适宜辅料制成的均匀粉末、颗粒、小片、小丸、半固体或液体等,充填于空心胶囊中的胶囊剂。
软胶囊系指将一定量的液体原料药物直接密封,或将固体原料药物溶解或分散在适宜的辅料中制备成溶液、混悬液、乳状液或半固体,密封于软质囊材中的胶囊剂。
可用滴制法或压制法制备。
软质囊材一般是由胶囊用明胶、甘油或其他适宜的药用辅料单独或混合制成。
缓释胶囊系指在规定的释放介质中缓慢地非恒速释放药物的胶囊剂。
缓释胶囊应符合缓释制剂(指导原则9013)的有关要求,并应进行释放度(通则0931)检查。
控释胶囊系指在规定的释放介质中缓慢地恒速释放药物的胶囊剂。
控释胶褒应符合控释制剂(指导原则9013)的有关要求,并应进行释放度(通则0931)检查。
肠溶胶囊系指用肠溶材料包衣的颗粒或小丸充填于胶囊而制成的硬胶囊,或用适宜的肠溶材料制备而得的硬胶囊或软胶囊。
肠溶胶囊不溶于胃液,但能在肠液中崩解而释放活性成分。
除另有规定外,肠溶胶囊应符合迟释制剂(指导原则9013)的有关要求,并进行释放度(通则0931)检查。
胶囊剂在生产与贮藏期间应符合下列有关规定。
一、胶囊剂的内容物不论是原料药物还是辅料,均不应造成囊壳的变质。
二、小剂量原料药物应用适宜的稀释剂稀释,并混合均匀。
三、硬胶囊可根据下列制剂技术制备不同形式内容物充填于空心胶囊中。
(1)将原料药物加适宜的辅料如稀释剂、助流剂、崩解剂等制成均匀的粉末、颗粒或小片。
(2)将普通小丸、速释小丸、缓释小丸、控释小丸或肠溶小丸单独填充或混合填充,必要时加入适量空白小丸作填充剂。
(3)将原料药物粉末直接填充。
(4)将原料药物制成包合物、固体分散体、微囊或微球。
(5)溶液、混悬液、乳状液等也可采用特制灌囊机填充于空心胶囊中,必要时密封。
查阅并记录片剂崩解时限检查方法及标准

查阅并记录片剂崩解时限检查方法及标准查阅并记录片剂崩解时限检查方法及标准1. 引言片剂崩解时限检查是药品质量控制中不可或缺的一环。
正确而准确地评估片剂崩解时限可以为药品生产企业提供重要的质量保证。
在本文中,我们将深入探讨片剂崩解时限检查的方法和标准,以帮助读者更好地理解这一重要的质量控制指标。
2. 片剂崩解时限的定义和意义片剂崩解时限是指在一定的试验条件下,药物通过崩解释放活性成分所需的时间。
正确评估片剂崩解时限可以验证药物是否按照设计要求释放活性成分。
片剂崩解时限还可以衡量药物的生物利用度和治疗效果。
3. 片剂崩解时限检查方法(1)理论基础片剂崩解时限检查方法主要基于药典规定,其中包括中国药典、美国药典等。
这些药典为片剂崩解时限提供了详细的试验条件和评估指标。
(2)试验条件片剂崩解时限检查通常需要在模拟生理条件下进行。
常见的试验条件包括温度、溶液pH值、搅拌速度等。
这些条件的选择应基于药物的特性和适应对象。
(3)试验设备常用的片剂崩解时限检查设备包括崩解度仪、电子天平、恒温槽等。
这些设备可以提供稳定和准确的试验条件。
(4)试验步骤片剂崩解时限检查的试验步骤包括样品准备、试验条件设定、试验操作、数据记录等。
通过严格按照试验步骤进行操作,可以准确评估片剂崩解时限。
4. 片剂崩解时限的评估标准(1)国家标准不同国家和地区对于片剂崩解时限的评估标准可能存在差异。
中国药典对于常见药物的崩解时限给出了具体的评估标准,生产企业应根据国家标准进行评估。
(2)药企自主标准一些大型药企可能根据自身需求和技术水平制定了更为严格的片剂崩解时限评估标准。
这些标准可以更好地满足企业的质量控制需求。
5. 个人观点和理解片剂崩解时限是药品质量控制过程中非常重要的一项指标。
通过准确评估片剂崩解时限,可以保证药物的质量和疗效。
片剂崩解时限还可以为药企提供重要的质量控制数据和生产指导。
在实际操作中,我认为需灵活运用片剂崩解时限检查方法和标准。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0921 崩解时限检查法
本法系用于检查口服固体制剂在规定条件下的崩解情况。
崩解系指口服固体制剂在规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶襄壳外,应全部通过筛网。
如有少量不能通过筛网,但已软化或轻质上漂且无硬心者,可作符合规定论。
除另有规定外,凡规定检查溶出度、释放度、融变时限或分散均匀性的制剂,不再进行崩解时限检查。
一、片剂
仪器装置采用升降式崩解仪,主要结构为一能升降的金属支架与下端镶有筛网的吊篮,并附有挡板。
升降的金属支架上下移动距离为55mm±2mm,往返频率为每分钟30〜32次。
(1) 吊篮玻璃管6根,管长77.5mm± 2.5mm,内径21.5mm,壁厚2mm;透明塑料板2块,直径90mm,厚6mm,板面有6个孔,孔径26mm;不锈钢板1块(放在上面一块塑料板上),直径90mm ,厚lmm,板面有6个孔,孔径22mm;不锈钢丝筛网1张(放在下面一块塑料板下),直径90mm,筛孔内径2.0mm;以及不锈钢轴1根(固定在上面一块塑料板与不锈钢板上),长80mm。
将上述玻璃管6根垂直置于2块塑料板的孔中,并用3只螺丝将不锈钢板、塑料板和不锈钢丝筛网固定,即得(图1)。
(2) 挡板为一平整光滑的透明塑料块,相对密度1.18〜1.20,直径20.7mm±0.15mm,厚9.5mm±0.15mm;挡板共有5个孔,孔径2mm,中央1个孔,其余4个孔距中心6rmn,各孔间距相等;挡板侧边有4个等距离的V形槽,V形槽上端宽9.5mm,深2.55mm,底部开口处的宽与深度均为1.6mm(图2)。
检査法将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸人1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37°C ±1".的水,调节水位高度使吊篮上升时筛网在水面下15mm处,调节吊篮顶部不可浸没于溶液中。
除另有规定外,取供试品6片,分别置上述吊篮的玻璃管中,启动崩解仪进行检查,各片均应在15分钟内全部崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
中药浸膏片、半浸膏片和全粉片,按上述装置吊篮的玻璃管中,启动崩解仪进行检查,全粉片各片均应在30分钟内全部崩解;浸膏(半浸膏)片各片均应在1个小时内全部崩解。
如有供试品黏附挡板,应另取6片,不加挡板按上述方法检查,应符合规定。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
薄膜衣片,按上述装置与方法检査,并可改在盐酸溶液(9—1000)中进行检查,化药薄膜衣片应在30分钟内全部崩解。
中药薄膜衣片,则每管加挡板1块,各片均应在1个小时内全部崩解,如有供试品黏附挡板,应另取6片,不加挡板按上述方法检查,应符合规定。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
糖衣片,按上述装置与方法检查,化药糖衣片应在1个小时内全部崩解。
中药糖衣片则每管加挡板1块,各片均应在1个小时内全部崩解,如有供试品黏附挡板,应另取6片,不加挡板按上述方法检查,应符合规定。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
肠溶片,按上述装置与方法,先在盐酸溶液(9— 1000)中检査2小时,每片均不得有裂缝、崩解或软化现象;然后将吊篮取出,用少量水洗涤后,每管加人挡板1块,再按上述方法在磷酸盐缓冲液(PH6.8)中进行检查,1小时内应全部崩解。
如有1片不能
完全崩解,应另取6片复试,均应符合规定。
结肠定位肠溶片,除另有规定外,按上述装置照各品种项下规定检查,各片在盐酸溶液(9→1000)及pH6.8以下的磷酸盐缓冲溶液中均应不得有裂缝、崩解或软化现象;在PH7.5~8.0的磷酸盐缓冲液中1小时内应完全崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
含片,除另有规定外,按上述装置和方法检査,各片均不应在10分钟内全部崩解或溶化。
如有1片不符合规定,应另取6片复试,均应符合规定。
舌下片,除另有规定外,按上述装置和方法检査,各片均应在5分钟内全部崩解并溶化。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
可溶片,除另有规定外,水温为20℃±5℃,按上述装置和方法检査,各片均应在3分钟内全部崩解并溶化。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
泡腾片,取1片,置250ml烧杯中(内有200ml温度为20℃±5℃的水)中,即有许多气泡放出,当片剂或碎片周围的气体停止逸出时,片剂应溶解或分散在水中,无聚集的颗粒剩留。
除另有规定外,同法检查6片,各片均应在5分钟内崩解。
如有1片不能完全崩解,应另取6片复试,均应符合规定。
口崩片,除另有规定外,照下述方法检查。
仪器装置主要结构为一能升降的支架与下端镶有筛网的不锈钢管。
升降的支架上下移动距离为10mm±1mm,往返频率为每分钟30次。
崩解篮不锈钢管,管长3 0m m ,内径13. 0mm,不锈钢筛网(镶在不锈钢管底部)筛孔内径710微米(图3) 。
检查法将不锈钢管固定于支架上,浸入1000ml杯中,杯内盛有温度为3 7 *C ± 1*C 的水约900ml,调节水位髙度使不锈钢管最低位时筛网在水面下15mm士1m m。
启动仪器。
取本品1 片,置上述不锈钢管中进行检査,应在6 0秒钟内全部崩解并通过筛网,如有少量轻质上漂或黏附于不锈钢管内壁或筛网,但无硬心者,可作符合规定论。
重复测定6片,均应符合规定。
如有1 片不符合规定,应另取6 片复试,均应符合规定。
二、胶囊剂
硬胶囊剂或软胶囊剂,除另有规定外,取供试品6粒,按片剂的装置与方法(如胶囊漂浮于液面,可加挡板)检査。
硬胶囊应在30分钟内全部崩解,软胶囊应在1小时内全部崩解。
软胶囊可改在人工胃液中进行检査。
如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
肠溶胶囊剂,除另有规定外,取供试品6粒,按上述装置与方法,先在盐酸溶液
(9—1000)中不加挡板检査2小时,每粒的囊壳均不得有裂缝或崩解现象;继将吊篮取出,用少量水洗涤后,每管加人挡板,再按上述方法,改在人工肠液中进行检查,1小时内应全部崩解。
如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
结肠肠溶胶囊剂,除另有规定外,取供试品6粒,按上述装置与方法,先在盐酸溶液(9—1000)中不加挡板检査2小时,每粒的囊壳均不得有裂缝或崩解现象;将吊篮取出,用少量水洗涤后,再按上述方法,在磷酸盐缓冲液(pH6. 8)中不加挡板检查3小时,每粒的囊壳均不得有裂缝或崩解现象;续将吊篮取出,用少量水洗涤后,每管加人挡板,再按上述方法,改在磷酸盐缓冲液(PH7. 8)中检查,1小时内应全部崩解。
如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
三、滴丸剂
按片剂的装置,但不锈钢丝网的筛孔内径应为0.425mm;除另有规定外,取供试品6粒,按上述方法检查,应在30分钟内全部溶散,包衣滴丸应在1小时内全部溶散。
如有1粒不能完全溶散,应另取6粒复试,均应符合规定。
以明胶为基质的滴丸,可改在人工胃液中进行检査。
【附注】
人工胃液取稀盐酸16. 4ml ,加水约800ml与胃蛋白酶10g ,摇匀后,加水稀释成1000ml,即得。
人工肠液即磷酸盐缓冲液(含胰酶)(pH 6.8)(通则8004)。
