同分异构体同系物同位素同素异形体区别
同位素 同系物 同素异形体 同分异构的概念

同位素同系物同素异形体同分异构的概念《同位素、同系物、同素异形体、同分异构:化学世界里的奇妙概念》嘿,同学们!今天我想和大家聊聊化学里超级有趣的几个概念,就是同位素、同系物、同素异形体和同分异构。
这几个东西就像魔法一样,让化学的世界变得超级神秘又好玩呢!先说说同位素吧。
我就把同位素想象成是一群长得特别像的兄弟姐妹。
大家都知道原子吧,原子就像一个小小的世界,里面有原子核,原子核里有质子和中子。
同位素呢,就是质子数相同,但是中子数不一样的原子。
这就好比是同一家族里的兄弟姐妹,虽然长得很像,都姓同一个姓(质子数相同嘛,就像同一个家族的姓),可是体重不一样(中子数不同,就像体重不同啦)。
比如说氢元素,就有氕、氘、氚这几种同位素。
氕就像是最瘦的那个小弟弟,只有一个质子,没有中子;氘呢,就像是稍微胖一点的哥哥,有一个质子和一个中子;氚就像是最胖的那个哥哥,有一个质子和两个中子。
这些同位素啊,虽然有点小差别,但是它们的化学性质几乎是一样的呢。
我就想啊,这是不是就像双胞胎或者多胞胎,虽然有点细微差别,可还是很相似呢?你们说,这是不是很神奇?再来说说同系物。
同系物就像是一列长长的火车,一节一节的车厢很相似。
在化学里,同系物是指结构相似,分子组成上相差一个或若干个“CH₂”原子团的有机化合物。
就好比我们搭积木,每多一块“CH₂”的积木,就像是多了一节车厢。
比如说甲烷(CH₄)和乙烷(C₂H₆),乙烷就比甲烷多了一个“CH₂”,它们就像同系物这个大家族里的两个成员。
这些同系物呢,它们的化学性质也很相似,就像同一列火车的车厢都有相似的功能一样。
我想啊,这就好像是我们的家族里,一辈一辈的人有相似的地方。
爷爷和爸爸很像,爸爸和我也很像,但是每一代又有一点小变化,就像同系物之间相差“CH₂”一样。
同素异形体可就更有趣啦!我把同素异形体想象成是超级英雄的不同变身。
同素异形体就是由同一种元素组成的不同单质。
比如说碳元素,它就有金刚石、石墨和C₆₀这几种同素异形体。
同系物同位素同素异形体同分异构体的举例

同系物同位素同素异形体同分异构体的举例同系物、同位素、同素异形体、同分异构体是化学中常用的概念,用来描述化学物质在分子结构上的差异。
下面将以具体实例为例,细致解释这四个概念的含义和应用。
同系物是指具有相同或相近分子式的化合物。
它们在分子构造上有着相似但不完全相同的特点。
例如,酚类化合物对苯酚、间酚和邻酚,它们的分子式都是C6H6O,但它们的分子结构和性质有所不同。
另一个例子是醇类化合物,如乙醇、异丙醇等都是同系物。
同位素是指原子核中质子数相同、中子数不同的同位素体系。
例如,氢气的同位素有氘(氢的同位素,质子数为1,中子数为1)和氚(质子数为1,中子数为2)。
同一元素的不同同位素有时会导致其物理和化学性质的差异。
同素异形体是指由同一组原子组成,但分子结构不同的同素体。
常见的例子是热带硬脂酸的两种异构体。
正硬脂酸和癸二酸,化学式都是C17H34O2,但它们的分子结构和物理性质有所不同。
另一个例子是异构烯烃,如顺式-丁烯和反式-丁烯都是C4H8的同素异形体。
同分异构体是指分子式相同,但结构略有不同的化合物。
例如,异丁烷和2-甲基丁烷,它们的分子式都是C4H10,但它们的分子结构不同。
另一个例子是异构酮,如丙酮和乙酸酯,它们的分子式都是C3H6O,但它们在分子结构上有所不同。
这四个概念在化学中有着广泛的应用。
首先,通过研究同系物,可以了解不同化合物之间的相似性和差异性,为合成新的化合物提供参考。
其次,同位素的使用在放射性同位素示踪、核能利用和碳定年等方面具有重要意义。
同素异形体和同分异构体的研究可以深入了解化学反应机制,对有机合成和药物设计有着重要的指导作用。
总结起来,同系物、同位素、同素异形体和同分异构体是用来描述化学物质在分子构造上的差异的重要概念。
通过研究和区分这些概念,我们能够更好地理解化学物质的性质和行为,从而为新化合物的合成和应用提供指导。
同位素同分异构体的比较 (2)

同位素,同素异形体,同系物,同分异构体的异同一、定义同位素:质子数相同,中子数不同的原子(核素)同素异形体:由同一种元素组成的不同单质同系物:结构相似,分子组成相差一个或若干个CH2基团的物质同分异构体:分子式相同,结构不同的化合物二、不同点1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
例如:乙醇与乙醚它们的通式都是CnH2n+2O,但他们官能团类别不同,不是同系物。
又如:乙烯与环丁烷,它们的通式都是CnH2n,但不是同系物。
(3) 在分子组成上必须相差一个或若干个CH2原子团。
有机物同分异构体知识点,都在这儿了!

有机物同分异构体知识点,都在这儿了!一、有机物的同分异构体1. 同分异构体的概念化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
2. 同系物、同分异构体、同素异形体和同位素的比较概念同系物同分异构体同素异形体同位素研究范围有机物化合物单质原子限制条件结构相似分子式相同同一元素质子数相同组成相差CH2原子团结构不同性质不同中子数不同【技巧归纳】①分子式相同则相对分子质量必然相同,但相对分子质量相同而分子式不一定相同。
如:H3PO4与H2SO4 、C2H6O与CH2O2的相对分子质量相同,但分子式不同。
最简式相同的化合物不一定是同分异构体,如:HCHO、CH3COOH、HCOOCH3、C6H12O6的最简式相同,但分子式不同。
②分子结构不同是由分子里原子或原子团的排列方式不同而引起的,如:CH3CH2OH和CH3OCH3、CH3CH2CHO和CH3COCH3等。
③同分异构现象在有机化合物中广泛存在,既存在于同类有机物中,又存在于某些不同类有机物中,如:CH3CH2 CH2 CH2CH3、CH3CH2 CH(CH3)CH3、C(CH3)4;CH3COOH、HCOOCH3。
同分异构现象在某些无机化合物中也存在,如:CO(NH2)2与NH4OCN、HOCN(氰酸)和HNCO(异氰酸)。
④化合物的分子组成、分子结构越简单,同分异构现象越弱。
反之,化合物的分子组成、分子结构越复杂,同分异构现象越强。
如甲烷、乙烷、丙烷等均无同分异构现象,而丁烷、戊烷的同分异构体分别为2种、3种。
⑤同分异构体之间的化学性质可能相同也可能不同,但它们的物理性质一定不同。
各同分异构体中,分子里支链越多,熔沸点一般越低。
例1、下列化学式只表示一种物质的分子组成的是( )。
A.C4H8 B.C3H8 C.SiO2 D.P例2、下列说法正确的是()A. 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物。
高中化学 同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析 新人教版
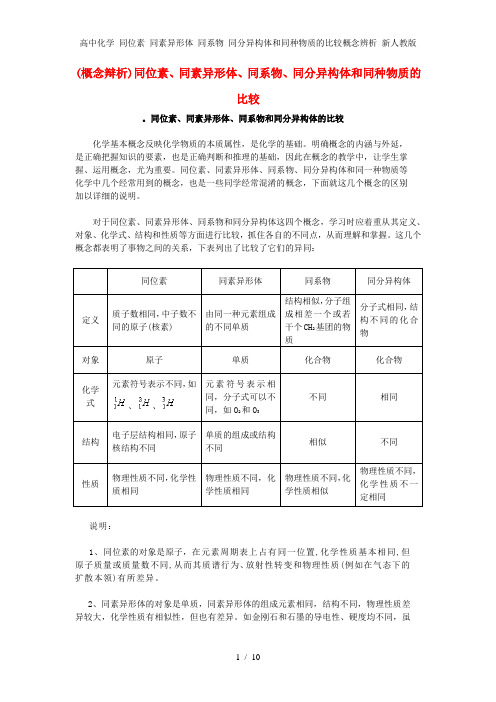
(概念辩析)同位素、同素异形体、同系物、同分异构体和同种物质的比较。
同位素、同素异形体、同系物和同分异构体的比较化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素同素异形体同系物同分异构体定义质子数相同,中子数不同的原子(核素)由同一种元素组成的不同单质结构相似,分子组成相差一个或若干个CH2基团的物质分子式相同,结构不同的化合物对象原子单质化合物化合物化学式元素符号表示不同,如、、元素符号表示相同,分子式可以不同,如O2和O3不同相同结构电子层结构相同,原子核结构不同单质的组成或结构不同相似不同性质物理性质不同,化学性质相同物理性质不同,化学性质相同物理性质不同,化学性质相似物理性质不同,化学性质不一定相同说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
正确理解几个有机概念

正确理解几个有机概念化学基本概念反映化学事实的本质属性,是学习的基础。
明确概念的内涵与外延,是正确思维的要素,也是判断和推理的基础,因此在概念的学习中,让学生掌握、运用概念,尤为重要。
同系物、同分异构体、同一物质、同素异形体、同位素有机化学中几个经常用到的概念,也是同学们经常混淆的概念。
下面就对这几个概念的区别加以详细的论述。
一、同系物:分子式不同,结构相似,在分子组成上相差若干个—CH2—原子团的化合物互称同系物。
1、思考讨论:下列物质互为同系物的是① CH3CH3 与CH3CH(CH3)② CH3CH2OH 与CH3CH(OH)CH3③C2H与C3H④CH4O 与C2H6O⑤CH2O与C2H4O2⑥CH3OH 与HOCHCH2OH⑦C2H与CH2=CH—CH=CH⑧与⑨与与⑩CH3Cl 与HCl2、对同系物的理解要注意以下几点:①必须是符合同一通式同一类物质,,化学式一定不同,而且符合同一通式的并不一定就是同系物。
②结构相似,是结构特点相似,并不是完全相同。
如异丁烷与正戊烷,前者有支链,后者没有。
③结构相似,但性质却有时相差较大,甲苯与苯。
④官能团一定要相同,并且官能团数目也要相同。
二、同分异构体:分子式相同,结构不同的化合物互为同分异构体。
1、对“分子式相同”的理解:①分子量相同的有机物一定有相同的分子式吗?不一定,如甲酸和乙醇、乙酸和丙醇、丙酸和丁醇、壬烷和萘等。
②组成元素相同且最简式也相同的有机物一定有相同的分子式吗?不一定,如环丙烷和乙烯、乙炔和苯、甲醛和乙酸和葡萄糖等。
③分子量相同、元素百分含量相同的有机物一定有相同的分子式吗?一定。
2、对“结构不同”的理解:这里的结构是指空间构型不同,要注意结构简式书写的等效性。
如就是同一种结构,只是书写方式不同罢了。
3、对“化合物”的理解:①有机化合物之间可以互为同分异构体;有机化合物和无机化合物之间可以互为同分异构体,如NH4CNO和CO(NH2)2,前者为无机化合物,后者为有机化合物;无机化合物之间也可以互为同分异构体,如②既不是单质,也不是混合物,也不是原子,如O2和O;H、T、D就不可以互称同分异构体。
同素异形体同位素同系物同分异构体
同素异形体同位素同系物同分异构体在化学的世界里,有些概念听上去就像是外星语言,特别是那些叫做同素异形体、同位素、同系物和同分异构体的东西。
乍一听,可能让人觉得有点晕,但其实它们并没有想象中那么复杂,嘿,我们来聊聊这些有趣的小家伙吧。
我们得提到同素异形体。
你知道什么是同素异形体吗?简单来说,就是同一种元素,长得却不一样。
想象一下,碳可以是钻石,闪闪发光,耀眼无比;也可以是石墨,黑乎乎的,像铅笔里的那个东西。
二者都是碳,但它们的形状和性质完全不一样。
钻石可是坚硬得像个小霸王,而石墨就像个温柔的绅士,易于滑动。
生活中,我们常常会碰到这种现象。
就像同一个人,可能在不同的场合中表现出截然不同的个性,难怪大家都说,冰冻三尺非一日之寒嘛!接下来是同位素。
说到同位素,可能会让人联想到科学实验室里的那些神秘试管。
实际上,同位素就是元素的小伙伴,它们有相同的原子序数,但中子数不同。
就像是家里的兄弟姐妹,虽然同父同母,但性格、爱好各有不同。
以氢为例,它有三种同位素:普通氢、重氢和超重氢。
普通氢最常见,重氢那可是水中少见的“贵族”,用在核聚变里,超重氢就更少了,简直是珍稀动物。
听起来是不是很酷?同位素在科学研究和医学上可大有用处,简直是“万金油”啊!再来说说同系物。
这种东西听起来有点高深,其实也很简单。
它们是一类化合物,拥有相似的化学性质,但分子结构不同。
打个比方,像是家里兄弟姐妹的风格,虽然都是同一个爸妈生的,但每个人都有自己的特色。
比如说,乙醇和醇类化合物,都是酒精的一种,但它们的结构和用途各有千秋。
乙醇可以用来喝,醇类则可能在工业上派上用场。
这种多样性真是让人感到惊奇,化学就像是一场无尽的派对,各种化合物齐聚一堂,大家都在各显神通。
我们得聊聊同分异构体。
这可是个非常有趣的概念,同分异构体是指分子式相同,但结构不同的化合物。
就好像两个人都有一样的名字,但性格和兴趣爱好却截然不同。
比如说,丁烷和异丁烷,虽然它们的化学式都是C4H10,但分子结构却大相径庭,性质也不同。
同分异构现象
同分异构现象二、同分异构现象有机化合物的同分异构现象与碳原子的成键特点和成键方式有关。
同分异构现象是由于组成有机化合物分子中的原子具有不同的结合顺序和结合方式产生的,这也是有机化合物数量庞大的原因之一。
有机化合物的分子结构包括三个层次,即构造、构型、构象。
构造是指有机物分子中各原子或原子团之间的结合顺序或排列顺序;构型是指有机物分子中的各个原子或原子团在空间的排列方式;构象是指在有机物分子中,由于围绕单键旋转而产生的原子或原子团在空间的不同排列形象。
(一)构造异构构造异构就是指那些具有相同的分子式,而分子中的原子或原子团相互结合的顺序不同而产生的异构现象。
构造异构主要有碳链异构、位置异构与官能团异构。
①碳链异构由于碳链骨架不同而产生的异构现象。
例如:与环己烷甲基环戊烷②位置异构由于取代基或官能团在碳链或碳环上的位置不同而产生的异构现象。
例如:CH3CH2CH2CH2OH 与CH3CH2CHCH3OH1-丁醇 2-丁醇邻溴甲苯间溴甲苯对溴甲苯或2-溴甲苯或3-溴甲苯或4-溴甲苯③官能团异构具有相同的分子组成,由于官能团不同而产生的异构现象,例如:具有相同分子式的烯烃与环烷烃之间也存在异构现象:CH3CH=CH2 (丙烯)与环丙烷(二)构型异构构型异构是指分子中的原子或原子团在空间的排列方式不同而产生的异构现象,有顺反异构和对映异构两类。
1、顺反异构烯烃的同分异构现象比烷烃的要复杂,除碳链异构外,还有由于双键的位置不同引起的位置异构、分子式相同化合类别不同引起的官能团异构和双键两侧的基团在空间的位置不同引起的顺反异构。
例如:丁烷只有正丁烷和异丁烷两个异构体,而丁烯就有三个异构体:CH 3CH 2CH=CH 2 CH 3CH=CHCH 3 CH 3C=CH 2CH 31-丁烯 2-丁烯 2-甲基丙烯 双键位置异构 碳架异构由于双键不能自由旋转又产生了另一个异构现象--顺反异构,如:2-丁烯有两个:CCCCHHHHCH 3CH 3CH 3CH 3顺-2-丁烯 反-2-丁烯 单烯烃的分子通式为C n H 2n ,它与环烷烃(通式为C n H 2n )互为同分异构体,如丁烯和环丁烷(甲基环丙烷)互为同分异构体。
同位素同分异构体同素异形体同系物的比较
有机化学1、有机化合物的基本特征2、简单分类3、命名4、同分异构体同位素、同分异构体、同素异形体、同系物的比较定义化学式结构或分子特点性质式同位素同素异形体同系物同分异构体同系物:结构相似,相差n 个 CH2原子团。
同分异构体:分子式相同,结构不同的有机物。
请同学们设计一个表格,小结官能团异构通式物质类别举例C n H2nC n H2n-2C n H2n-6C n H2n+2OC n H2n OC n H2n O2C n H2n-6 OC6H12O6C12H22O11C n H2n+1NO21.已知二甲苯有三种同分异构体,则四氯苯有______ 种同分异构体 .2.一氯戊烷中含有两个“— CH3”的结构为____ 种 .3. C11H16的苯的同系物中 ,只含有一个支链 , 且支链上含有两个“—CH3”的结构有四种 , 写出其结构简式 .4.已知将中的c与d 原子交换位置 ,可以得到另一种物质 :.的烯烃同分异构体有____种.5.下列有机物与溴(Br 2) 发生成反应 ,加成产物各有多少种1 : 1.C4H8的加6.与 H2发生 1:4加成反应时 , 其产物有 ______ 种 .7.C4H4有多种同分异构体 , 它们分别具有以下特征 , 试写出相应的同分异构体的结构简式 .(1)A 为链状结构 , 可以由两分子的乙炔加成而得 , A 为 ________.(2)B 为平面结构 , 与溴水发生 1 : 1 加成反应 , 加成方式有两种 , 但加成产物只有一种 . B 为__________ .(3)C为正四面体,每个C原子分别与另三个 C 原子通过单键相连. 则 C 为_________ .8.C6H6有两种常见的同分异构体, A为苯 , B 是具有空间立体结构的图形 , 写出它们的结构简式 .C 8H8有两种同分异构体 , A 是具有空间立体结构的立方烷 , B 是芳香烃 , 写出它们的结构简式 .9.在下列物质中:属于同系物的是答:---------- 属于同种物质的是 --------- ,属于同分异构体的是--------10.篮烷的化学式为C10H 12,其结构如图,则其一氯代物有【】种。
同位素-同素异形体-同系物-同分异构体的异同
张浩祥对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素:质子数相同,中子数不同的原子(核素)对象原子同素异形体:由同一种元素组成的不同单质。
对象单质同系物; 结构相似,分子组成相差一个或若干个CH2基团的物质对象化合物同分异构体: 分子式相同,结构不同的化合物对象化合物说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如:O2和O3 。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同素异形体
同系物
同分异构体
适用对象
原子
单质
有机物
有机物、无机物
判断依据
①质子数相同,中子数不同
②原子之间
①属同一种元素
②单质之间
①结构相似的同一类物质
②符合同一通式
③相对分子质量不同(相差14n)
①分子式相同
②结构不同
③不一定是同一物质
性质
化学性质几乎一样,物理性质有差异
化学性质相似,物理性质差别较大
化学性质相似,熔沸点、密度呈规律性变化
化学性质可能相似也可能不同,物理性磷、
金刚石与石墨
甲烷与丁烷
正丁烷与异丁烷
同位素、同素异形体、同系物、同分异构体区别
