高一年级下册化学5.2氮及其化合物(2)人教版 (共62张PPT)
合集下载
《氮及其化合物》课件下学期高一化学人教版必修第二册

与酸、碱指示剂作用
与金属作用
H+
与金属氧化物作用
与碱作用
与某些盐作用
2、硝酸的不稳定性: ① 常用浓硝酸为何呈黄色? ② 实验室应怎样贮放浓硝酸?
△
4HNO3 或光照 O2↑ +2H2O + 4NO2↑
久置硝酸分解产生的NO2溶于溶液中,使得溶液变黄!
保存:
密封于棕色瓶中,并放在阴暗处!
3、硝酸具有强氧化性:
•
3.书院除了要求学生熟读“四书五经”, 还锻炼 学生们 写八股 文的能 力,熟 悉八股 文的格 律、步 骤等。 唐朝和 宋朝的 科举考 试,策 问一科 是学生 们的重 点复习 对象。
•
4.文章通过对比,论证了只有完成由 传统经 济模式 到新动 能模式 的转型 升级, 中国经 济才有 无可限 量的未 来这一 观点。
Na2SO4 C.
浓硝酸和稀硝酸都具有氧化性
NH3→NO: _______________________。
下列关于硝酸的认识中,正确的是( )
Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O
战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。
你知道其中的硝酸具有怎样的化学性质吗?
感谢观看,欢迎指导! •
7.小说结尾聚焦于父亲与林掌柜的三 举杯, 这一情 景极具 仪式感 ,既是 雪夜酒 叙情节 的收束 ,也是 全文的 升华, 带给读 者无限 遐想。
•
8.作者指出人之所以能适应人生境遇 的种种 变化, 就是因 为这些 变化是 在相当 长的时 间里达 到的。
•
9.时间之所以让人感到渺茫和不可思 议,是 因为和 空间相 比,时 间既无 法把握 ,又无 法挽留 。
与金属作用
H+
与金属氧化物作用
与碱作用
与某些盐作用
2、硝酸的不稳定性: ① 常用浓硝酸为何呈黄色? ② 实验室应怎样贮放浓硝酸?
△
4HNO3 或光照 O2↑ +2H2O + 4NO2↑
久置硝酸分解产生的NO2溶于溶液中,使得溶液变黄!
保存:
密封于棕色瓶中,并放在阴暗处!
3、硝酸具有强氧化性:
•
3.书院除了要求学生熟读“四书五经”, 还锻炼 学生们 写八股 文的能 力,熟 悉八股 文的格 律、步 骤等。 唐朝和 宋朝的 科举考 试,策 问一科 是学生 们的重 点复习 对象。
•
4.文章通过对比,论证了只有完成由 传统经 济模式 到新动 能模式 的转型 升级, 中国经 济才有 无可限 量的未 来这一 观点。
Na2SO4 C.
浓硝酸和稀硝酸都具有氧化性
NH3→NO: _______________________。
下列关于硝酸的认识中,正确的是( )
Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O
战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。
你知道其中的硝酸具有怎样的化学性质吗?
感谢观看,欢迎指导! •
7.小说结尾聚焦于父亲与林掌柜的三 举杯, 这一情 景极具 仪式感 ,既是 雪夜酒 叙情节 的收束 ,也是 全文的 升华, 带给读 者无限 遐想。
•
8.作者指出人之所以能适应人生境遇 的种种 变化, 就是因 为这些 变化是 在相当 长的时 间里达 到的。
•
9.时间之所以让人感到渺茫和不可思 议,是 因为和 空间相 比,时 间既无 法把握 ,又无 法挽留 。
氮及其化合物ppt课件

无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气 体溶于水,若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
二、一氧化氮和二氧化氮
4. 氮氧化物对环境的污染 (1)NOx在紫外线作用下与碳氢化合物发生 一系列光化学反应,产生光化学烟雾。 (2)NOx排入大气中后,与水反应生成HNO3 和HNO2,随雨雪降到地面形成酸雨。 (3)破坏臭氧层:NO2可使平流层中的臭氧减 少,导致地面紫外线辐射量增加。 (4)NO与血红蛋白结合使人中毒。
硝酸的酸性比磷酸强
化合价: -3、 0、 +2、 +3、 +4、 +5
一、氮气及氮的固定
1.氮气的物理性质
颜色 无色
气味 无味
状态 气体
液氮
密度 密度比空气稍小
水溶解 难溶
一、氮气及氮的固定
2.氮气的化学性质
化学式
N2
电子式
N
N
结构式
NN
共价三键、键能大,性质稳定,难与其他物质反应
N2 表现氧化性
课堂导入
“死亡谷”之谜 青藏高原上的那棱格勒峡谷,每当牧民和牲畜进入后,风和
日丽的晴天顷刻电闪雷鸣,狂风大作,人畜常遭雷击而倒毙。奇 怪的是这里牧草茂盛,水草肥美,被当地牧民称为“死亡谷”。
考察队测定后发现,这里的磁场强度非常高。这里的地层, 除了分布着大面积的三叠纪火山喷发的强磁性玄武岩外,还有大 大小小30多个磁铁矿脉及石英闪长岩体。正是这些岩体和磁铁矿 产生了强大的地磁异常带。夏季,它使因昆仑山的阻挡而沿山谷 东西分布的雷、雨、云中的电荷常常在此汇集,形成超强磁场。 一旦遇到异物,便会发生尖端放电即产生雷击现象,使人和畜瞬 间死亡。巨大的磁力还导致了指南针失灵,仪器不准。
第五章第二节氮及其化合物课件2023-2024学年下学期高一化学人教版(2019)必修第二册

氮及其化合物
课时2 氨和氮肥
1996年到2010年底全国耕地面积净减少3049万亩
年代
粮食产量
2001年
45264万吨
2002年
45706万吨
2004年
46947万吨
2006年
49746万吨
2008年
52850万吨
பைடு நூலகம்
农作物生长离 不开氮元素
氮肥种类
氨水 (NH3▪H2O) 铵态氮肥 NH4Cl (NH4)2SO4 NH4HCO3 硝态氮肥: KNO3
——2004.11 北京环境与发展国际合作委员会年度会议
长江、黄河和珠江每年输出的溶解态无机氮达到97.5万 吨,其中90%来自农业,化肥氮占了50%。
——中科院南京土壤研究所数据2006年4月7日科技日报
一、氨气的物理性质
①无色, 有刺激性气味的气体; ②密度比空气小 ③易液化; ④极易溶于水(1:700)
二、氨气的化学性质
①碱性 ②还原性
三、铵盐的化学性质
制氮肥
制硝酸 纯碱
氨的用途
食品厂氨气泄露
有机合成 工业原料
尿素[CO(NH2)2]。
致冷剂
太湖蓝藻危机:一曲唇亡齿寒的环保悲歌
太湖蓝藻危机:一曲唇亡齿寒的环保悲歌
太湖蓝藻危机:一曲唇亡齿寒的环保悲歌
蓝藻爆发的原因主要是水体的富营养化。总氮总磷 量过多是导致蓝藻爆发的主要原因
有机氮肥: 尿素(CO(NH2)2)
N
高温、高压
N2 + 3H2 催化剂
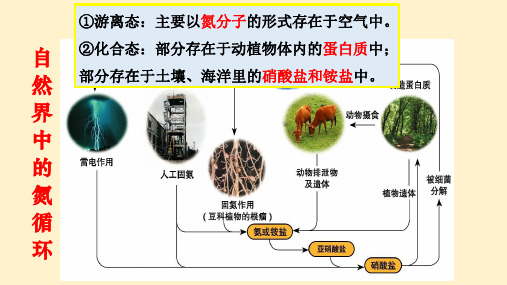
人工固氮
N
大气中的氮
2NH3
氨或铵盐
N
自然界中氮的循环
硝酸盐
请大家在二维图上标出NH3、 氨水(NH3▪H2O)、NH4Cl、和 KNO3的位置。
课时2 氨和氮肥
1996年到2010年底全国耕地面积净减少3049万亩
年代
粮食产量
2001年
45264万吨
2002年
45706万吨
2004年
46947万吨
2006年
49746万吨
2008年
52850万吨
பைடு நூலகம்
农作物生长离 不开氮元素
氮肥种类
氨水 (NH3▪H2O) 铵态氮肥 NH4Cl (NH4)2SO4 NH4HCO3 硝态氮肥: KNO3
——2004.11 北京环境与发展国际合作委员会年度会议
长江、黄河和珠江每年输出的溶解态无机氮达到97.5万 吨,其中90%来自农业,化肥氮占了50%。
——中科院南京土壤研究所数据2006年4月7日科技日报
一、氨气的物理性质
①无色, 有刺激性气味的气体; ②密度比空气小 ③易液化; ④极易溶于水(1:700)
二、氨气的化学性质
①碱性 ②还原性
三、铵盐的化学性质
制氮肥
制硝酸 纯碱
氨的用途
食品厂氨气泄露
有机合成 工业原料
尿素[CO(NH2)2]。
致冷剂
太湖蓝藻危机:一曲唇亡齿寒的环保悲歌
太湖蓝藻危机:一曲唇亡齿寒的环保悲歌
太湖蓝藻危机:一曲唇亡齿寒的环保悲歌
蓝藻爆发的原因主要是水体的富营养化。总氮总磷 量过多是导致蓝藻爆发的主要原因
有机氮肥: 尿素(CO(NH2)2)
N
高温、高压
N2 + 3H2 催化剂
人工固氮
N
大气中的氮
2NH3
氨或铵盐
N
自然界中氮的循环
硝酸盐
请大家在二维图上标出NH3、 氨水(NH3▪H2O)、NH4Cl、和 KNO3的位置。
【化学课件】氮及其化合物 2022-2023学年高一下学期化学人教版(2019)必修第二册
光化学烟雾是由于汽车尾气和工业废气排放造成的,一般发生在湿度 低、气温在24-32℃的夏季晴天的中午或午后。汽车尾气中的碳氢化合物 和氮氧化合物(NOx)被排放到大气中后,在强烈的阳光紫外线照射下, 会吸收太阳光所具有的能量。这些物质的分子在吸收了太阳光的能量后, 变得不稳定起来,原来的化学键遭到破坏,形成新的物质,这种化学反应 被成为光化学反应,其产物为含剧毒的光化学烟雾
结构式:N≡N 断开该化学键需要较多的能量,所以氮气化学性质很稳定
点燃
N2 + 3Mg
Mg3N2(黄绿色粉末) 游离态的氮
放电/高温
N2 + O2
2NO(无色气体)
高温、高压
N2 + 3H2 催化剂 2NH3
高温条件下才能反应
化合态的氮
氮的固定
氮的固定
概念:将大气中 游离态 的氮转化为 氮的化合物 的过程
氮 的
高能固氮(如雷雨天气N2转化为NO)
固
自然固氮
定
生物固氮(如豆科植物的根瘤菌固氮)
分类
合成氨(工业上合成氨)
人工固氮 仿生固氮(某些金属有机化合物可起
到根瘤菌的作用)
氮气的用途:
(1)合成氨气 合成氨工业很大程度上解决了地球上因粮食不足而导致的饥饿问题 (2)惰性保护气: 瓜果、食品、粮仓、灯泡等填充气 (3)冷冻剂: 速冻和食品运输、低温超导、低温麻醉、低温保存生物组织等
F中氯气与铁粉反应制备无水氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100摄氏度左右升华。双通管F中玻璃纤维的(不参与反应)的作用是__________, 在F和H装置之间安装G装置的目的是_________________。
26. 某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成.称取天然碱样 品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标 准状况)如下表:
结构式:N≡N 断开该化学键需要较多的能量,所以氮气化学性质很稳定
点燃
N2 + 3Mg
Mg3N2(黄绿色粉末) 游离态的氮
放电/高温
N2 + O2
2NO(无色气体)
高温、高压
N2 + 3H2 催化剂 2NH3
高温条件下才能反应
化合态的氮
氮的固定
氮的固定
概念:将大气中 游离态 的氮转化为 氮的化合物 的过程
氮 的
高能固氮(如雷雨天气N2转化为NO)
固
自然固氮
定
生物固氮(如豆科植物的根瘤菌固氮)
分类
合成氨(工业上合成氨)
人工固氮 仿生固氮(某些金属有机化合物可起
到根瘤菌的作用)
氮气的用途:
(1)合成氨气 合成氨工业很大程度上解决了地球上因粮食不足而导致的饥饿问题 (2)惰性保护气: 瓜果、食品、粮仓、灯泡等填充气 (3)冷冻剂: 速冻和食品运输、低温超导、低温麻醉、低温保存生物组织等
F中氯气与铁粉反应制备无水氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100摄氏度左右升华。双通管F中玻璃纤维的(不参与反应)的作用是__________, 在F和H装置之间安装G装置的目的是_________________。
26. 某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成.称取天然碱样 品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标 准状况)如下表:
【课件】氮及其化合物++课件高一下学期化学人教版(2019)必修第二册

汽车尾气(N2O2在内燃机内反应生成NO,NO 遇空气转化为NO2)
硝酸工业废气中含有NO、NO2等
五、酸雨及防治
2、SO2和NOx的危害 (1)引起大气污染,引起呼吸道疾病,危害人体健康,严重 时会使人死亡。
(2)形成酸雨。
(3)产生光化学烟雾(氮氧化物与碳氢化合物在阳光(紫外线)作 用下,发生化学反应,产生一种有毒的烟雾)。
两式加 得总式3FFra bibliotek(过)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
四、硝酸 ①与金属反应——与Fe的反应
Fe+HNO3(浓)→钝化(常温下) Fe+6HNO3(浓)=∆=2Fe(NO3)3+3NO2↑+3H2O Fe(少量)+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O 3Fe(过量)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
即:n(HNO3)=xn(硝酸盐)+yn(还原产物)
拓展:硝酸与金属反应的计算
例、将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解, 产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请 回答下列问题: (1)参加反应的HNO3的物质的量是________。
解析:参加反应的HNO3分两部分: 一部分显酸性生成Cu(NO3)2;另一部分被还原成NO2和NO
拓展:SO2和NOx的吸收、处理方法 1、常见的SO2吸收、处理方法 (1)“钙基固硫法”脱硫原理
CaO+SO2=CaSO3 2CaSO3+O2=2CaSO4 (2)“石灰石/石灰−石膏法”脱硫原理 CaCO3+SO2=CaSO3+CO2 Ca(OH)2+SO2=CaSO3+H2O
(3)产生的气体全部释放后10,−3向aV溶+液0中.5加入V mL a mol/L的 N的a浓OH度溶__液__,__恰__好m使ol/溶L。液中的0C.1u42+全部转化成沉淀,则原硝酸
高一下学期化学人教版必修第二册5.2氮及其化合物课件

比空气的__小__
气味
强烈__刺__激___性_气味
水溶性
__极___易_溶于水(1∶700)
2、氨的化学性质
(1)与水的反应
NH3 +H2O
NH3 • H2O
NH4+ +OH— ,氨溶于水得氨水。
①氨水中含有的粒子有__N_H__3_·__H_2_O_、__N__H_3_、__H__2O__、__N_H__+4_、__O_H__-_、__H_+___________。
传递神经信息的“信使分子”,在使血管扩张、免疫、增强记忆力 等方面有极其重要的作用
NO2: 使织物褪色
一氧化氮和二氧化氮
☂知识拓展
(1)NO 能与血红蛋白结合而使人中毒。 (2)NO、NO2 均能与 NH3 反应生成 N2:
催化剂 4NH3+6NO ==△=== 5N2+6H2O;
催化剂 8NH3+6NO2 ==△=== 7N2+12H2O。
(3)与盐溶液的反应 如过量氨水与 AlCl3 溶液反应的离子方程式:A__l3_+_+__3_N__H_3_·__H_2_O__=_=_=_A_l_(O__H__)3_↓__+__3_N_H__+ 4。
(4)氨的还原性——氨的催化氧化 催化剂
化学方程式:_4_N_H__3_+__5_O_2_=_=_△=_=__=_4_N_O__+__6_H__2O_______。
3、氮的固定
(1)定义: 将大气中游离态的氮转化为氮的化合物 的 过程叫氮的固定,简称固氮。 (2)分类: 自然固氮豆科植物根瘤菌固氮雷雨天产生NO气体 人工固氮:工业合成氨。
一 氧 化 氮 和 雄桐心山壮 万志里是丹茫山茫路黑,夜雄中风的清北于斗老星风。声
志母之鸡所 的向理,想金不石过为是开一,把谁糠能。御之? 死一犹个未 人肯如输果心胸去无,大贫志亦,其既能使奈再我有何壮丽! 的举动也称不上是伟人。
5.2.2氮及其化合物 课件 高一下学期化学人教版(2019)必修第二册
一、氨气-----NH3
1、氨分子的电子式和结构式:
电子式:
结构式:
氨分子的空间结构: 分子形状:三角锥形 分子极性:极性分子
一、氨气-----NH3
2、物理性质
氨是无色、有刺激性气味的气体,密度比空气的小。
氨很容易液化,液化时放热。 液氨汽化时要吸收大量的热,使周围温度急剧降低。
氨气
因此,液氨可用作制冷剂
气体
NH3 HCl
CO2 SO2 Cl2
吸收剂 水
原理
NH3、HCl均属于极易溶于水 (常温下,NH3—1:700,HCl—1:500)
NaOH溶液 三种气体均为酸性气体,均能与强碱溶液反应
城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?
相似点: 不同点:
都是利用内外压强差
前者压强小于大气压 后者压强大于大气压
四、实验室制取氨气
思考与讨论:
图5-13为实验室制取氨的简易 装置示意图。请仔细观察实验装置, 思考如何检验试管中已收集满氨, 如何吸收处理实验中多余的氨。
实验室制取氨气实验:
四、实验室制取氨气
1.装置要点
①药品: 氯化铵晶体、熟石灰固体 ②装置: 固固加热型 ③原理方程式: 2NH4Cl+Ca(OH)2====CaCl2+2NH3↑+2H2O ④干燥: 用碱石灰(CaO 与NaOH固体混合物) ⑤收集: 向下排空气法,并在试管口塞上棉花
一、氨气-----NH3
3、化学性质
氨是一种极易溶于水的气体,
在常温常压下,1体积水大约可溶解700体积氨。
氨气溶于水时 ,大部分的NH3分子与 H2O分子结合成NH3·H2O(一水合氨) NH3·H2O是弱碱,为弱电解质,可以部分电离。
5.2氮及其化合物 课件 (共34张PPT) 高一下学期化学人教版必修第二册
NO2能使湿润的淀粉KI试纸变蓝
正确理解NO和NO2所属物质的类别 NO和NO2都不是酸性氧化物,NO与碱、酸都不能反应生成盐和水,属 于不成盐氧化物;NO2与碱溶液发生氧化还原反应生成两种盐,也不属 于酸性氧化物。2NO2+2NaOH=NaNO2+NaNO3+H2O。
雷雨发庄稼所涉及的反应:
放电 N2+O2=======2NO,2NO+O2===2NO2, 3NO2+H2O===2HNO3+NO。
②NO2→NO: ____3_N_O_2_+_H_2O_=_2_H__N_O_3+_N_O_(工业制取硝酸)。
思考与讨论:如何除去NO气体中混有的少量NO2气体 杂质?
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入 其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
可表示为n(HNO3)酸性=x·n(Mx+)=n(转移电子)。
[关键能力]
金属与硝酸反应的计算——四个守恒
(1)得失电子守恒:金属失电子数=n(NO2)+3n(NO)。 (2) 氮 原 子 守 恒 : n(HNO3) 总 = x·n[M(NO3)x] + n(NO2) + n(NO) 。 (3)电荷守恒:反应后溶液中c(NO)=x·c(Mx+)+c(H+)。
密度
现象
浓H2SO4 放出大量热 黏稠状液体
稀H2SO4 无明显现象 黏稠度较小的液体
浓H2SO4密度较大,相同体积时,浓H2SO4 质量大
化学性质
铁片
因铁被钝化而无明 显现象
产生大量气泡
铜片(加热)
有气泡产生,溶液 变蓝
无明显现象
白纸 胆矾
立即变黑 蓝色变为白色
无明显现象 无颜色变化
正确理解NO和NO2所属物质的类别 NO和NO2都不是酸性氧化物,NO与碱、酸都不能反应生成盐和水,属 于不成盐氧化物;NO2与碱溶液发生氧化还原反应生成两种盐,也不属 于酸性氧化物。2NO2+2NaOH=NaNO2+NaNO3+H2O。
雷雨发庄稼所涉及的反应:
放电 N2+O2=======2NO,2NO+O2===2NO2, 3NO2+H2O===2HNO3+NO。
②NO2→NO: ____3_N_O_2_+_H_2O_=_2_H__N_O_3+_N_O_(工业制取硝酸)。
思考与讨论:如何除去NO气体中混有的少量NO2气体 杂质?
提示:根据NO2与H2O反应能生成NO,既能除去NO2杂质,又不引入 其他杂质,故可将混合气体通入盛有水的洗气瓶,然后重新收集气体。
可表示为n(HNO3)酸性=x·n(Mx+)=n(转移电子)。
[关键能力]
金属与硝酸反应的计算——四个守恒
(1)得失电子守恒:金属失电子数=n(NO2)+3n(NO)。 (2) 氮 原 子 守 恒 : n(HNO3) 总 = x·n[M(NO3)x] + n(NO2) + n(NO) 。 (3)电荷守恒:反应后溶液中c(NO)=x·c(Mx+)+c(H+)。
密度
现象
浓H2SO4 放出大量热 黏稠状液体
稀H2SO4 无明显现象 黏稠度较小的液体
浓H2SO4密度较大,相同体积时,浓H2SO4 质量大
化学性质
铁片
因铁被钝化而无明 显现象
产生大量气泡
铜片(加热)
有气泡产生,溶液 变蓝
无明显现象
白纸 胆矾
立即变黑 蓝色变为白色
无明显现象 无颜色变化
5.2+氮及其化合物1++课件+++2023-2024学年高一下学期化学人教版(2019)必修第二册
-196 ℃
溶解度 难溶于水
N +7 2 5
•
N• •
第二周期,第 VA族
•• ••
不容易得失电子,一般通过共用电子对与其他原子结合。
电子式
N •••••• N
••
结构式 N
N 球棍模型
4、化学性质:
思考:请从化合价角度预测N2可能具有哪些性质?
氧化性
还原性
-3 还原性 N2+O2
0 N2
放电或高温
+2 2NO
+4
+5
自然固氮
氧化性 3Mg+N2 点燃 Mg3N2
催化剂
N2 + 3H2
高温、高压
2NH3 工业合成氨
人工固氮
氮的固定 将大气中游离态的氮转化为含氮化合物的过程
N价态
5、用途:
电灯泡、食品包装 ——保护气
稀有的书卷保存 ——延缓代谢
合成氨和工业制硝酸的重要原料
降温手术刀 ——冷刀做手术
在新疆和青海交界处有一狭长山谷,每当牧民和牲畜进入后, 风和日 丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭雷击 倒下。奇怪的是 这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。
你能解释“魔鬼谷”牧草茂盛、四季常青的原因吗?
【实验5-5】
实验 装置
实验 操作
在一支50 mL的注射器里充入20 mL NO,然后吸入5mL水,用乳胶管和 弹簧夹封住管口,振荡注射器
思考:上述实验对工业生产硝酸有什么启示?
工 溶业解生,工产可业硝充生酸分产,利硝将用酸尾原的气料启(,示并NO减)少吸N收O通的入排适放量,的保氧 护气环后境再。溶解于水,经过多次循环氧化、
① NO与O2同时通入水中
溶解度 难溶于水
N +7 2 5
•
N• •
第二周期,第 VA族
•• ••
不容易得失电子,一般通过共用电子对与其他原子结合。
电子式
N •••••• N
••
结构式 N
N 球棍模型
4、化学性质:
思考:请从化合价角度预测N2可能具有哪些性质?
氧化性
还原性
-3 还原性 N2+O2
0 N2
放电或高温
+2 2NO
+4
+5
自然固氮
氧化性 3Mg+N2 点燃 Mg3N2
催化剂
N2 + 3H2
高温、高压
2NH3 工业合成氨
人工固氮
氮的固定 将大气中游离态的氮转化为含氮化合物的过程
N价态
5、用途:
电灯泡、食品包装 ——保护气
稀有的书卷保存 ——延缓代谢
合成氨和工业制硝酸的重要原料
降温手术刀 ——冷刀做手术
在新疆和青海交界处有一狭长山谷,每当牧民和牲畜进入后, 风和日 丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭雷击 倒下。奇怪的是 这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。
你能解释“魔鬼谷”牧草茂盛、四季常青的原因吗?
【实验5-5】
实验 装置
实验 操作
在一支50 mL的注射器里充入20 mL NO,然后吸入5mL水,用乳胶管和 弹簧夹封住管口,振荡注射器
思考:上述实验对工业生产硝酸有什么启示?
工 溶业解生,工产可业硝充生酸分产,利硝将用酸尾原的气料启(,示并NO减)少吸N收O通的入排适放量,的保氧 护气环后境再。溶解于水,经过多次循环氧化、
① NO与O2同时通入水中
人教版《氮及其化合物》优秀课件PPT2
(1) 不稳定性
△
4HNO3 或光照 4NO2↑ + O2↑ + 2H2O
纯硝酸 久置硝酸
溶于浓硝酸致使溶液变黄
贮存:一般将浓硝酸保存在棕色试剂瓶中, 并避光放置于阴凉处。
(2) 强酸性(具有酸的通性)
谁不向前看,谁就会面临许多困难。
电离方程式:HNO == H + NO - 志不立,如无舵这舟,无衔之马,漂荡奔逸,终亦何所底乎。
硫的金属矿物的冶炼
硝酸型酸雨:汽车尾气以及硝酸工业废气等
2、酸雨的危害
使湖泊中鱼虾死亡
腐蚀文物建筑
破坏土壤结构使植物死亡 导致水质酸化使水生物死亡
3、酸雨的防治
①调整能源结构,发展清洁能源; ②研究煤的脱硫技术,改进燃烧技术,减少SO2的排放; ③加强工业废气的回收处理; ④改进汽车尾气的处理技术,提高汽车尾气排放标准。
2、下列在酸性溶液中能大量共存的离子组是( B ) A.
Fe2+、NO3-、Na+、Cl-
B. K+、Cl-、SO42-、Al3+ C. S2-、Na+、NH4+、NO3-
二、酸雨及防治
1、酸雨的形成及分类 主要是大气中的SO2与NOx溶于水形成酸,使
pH小于正常雨水5.6。 硫酸型酸雨:煤、石油等化石燃料的燃烧和某些含
1、掌握硝酸的性质,能从氮元素化合价的角 度认识硝酸的强氧化性; 2、认识硫、氮的氧化物对生态环境的影响, 了解酸雨的产生及其防治。
一、硝酸
1、物理性质: 硝酸是无色、易挥发、有刺激性气味的液体,能
与水以任意比互溶,质量分数为95%以上的硝酸在空 气中会产生“发烟”现象,因此也叫“发烟硝酸”。
2、化学性质: 【思考】久置的浓硝酸为何会变黄?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化剂:O2
还原剂:NO
收集方法:排水法(NO与O2常温下反应)
二、二氧化氮的性质
1.物理性质 红棕色有刺激性气味气体,密度比空气 的大,易液化,易溶于水。
二、二氧化氮的性质
1.物理性质 红棕色有刺激性气味气体,密度比空气 的大,易液化,易溶于水。
2.化学性质 实验二:NO2和H2O的反应
2.化学性质 实验二:NO2和H2O的反应 实验现象:液面逐渐上升,气体的红棕色消失,剩余的气体为
__________。 (4)化合物A的化学式是__________。
例5.如图是氮循环的一部分:
(1)NO2的颜色是__红__棕__色____。 (2)反应①的化学方程式是______________。 (3)NO2易溶于水,并和水发生化学反应,该反应中,氧化剂是
__________。 (4)化合物A的化学式是__________。
用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。
现象:无明显现象 原因:NO气体不能溶于水
思考: ②快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注
射器,再观察现象。
思考: ②快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注
射器,再观察现象。
现象:吸入空气中气体变为红棕色;再振荡后气体又变为无色,同 时注射器的活塞向内移动。
2.化学性质 研究物质性质的角度:
物质类别通性角度、氧化还原角度、特性
物质类别通性角度 不成盐氧化物
+2
氧化还原角度
NO
实验一:NO和O2的反应
2.化学性质
实验一:NO和O2的反应
现象:气体颜色由无色变为红棕色
2.化学性质
实验一:NO和O2的反应
现象:气体颜色由无色变为红棕色
化学方程式:2NO+O2 2NO2
原因:吸入空气后,NO与O2反应生成NO2,气体变为红棕 色;振荡后,NO2溶于水生成HNO3和NO,气体又变 为无色,同时气体的总体积有所减少。
思考: ③如果要将注射器中的NO充分转化,可以采取什么措施?
思考: ③如果要将注射器中的NO充分转化,可以采取什么措施?
吸入空气,振荡,重复操作。
思考: ③如果要将注射器中的NO充分转化,可以采取什么措施?
2NO
2NO+O2 2NO2
3NO2+H2O 2HNO3+NO
2.工业制硝酸
H2
O2
O2
H2O
N2
NH3
NO
NO2
HNO3
2.工业制硝酸
H2
O2
O2
H2O
N2
NH3
NO
NO2
HNO3
N2+3H2
4NH3+5O2 2NO+O2
3NO2+H2O
2NH3
4NO+6H2O 2NO2 2HNO3+NO
五、氮氧化物(NOX)的来源、危害和治理
例4.不能实现下列物质间直接转化的元素是( D )
A.C
B.N
C.S
D.Mg
单质 氧化物 氧化物 酸或碱 A. C → CO → CO2 → H2CO3 B. N2 → NO → NO2 → HNO3 C. S → SO2 → SO3 → H2SO4
例5.如图是氮循环的一部分:
(1)NO2的颜色是__________。 (2)反应①的化学方程式是______________。 (3)NO2易溶于水,并和水发生化学反应,该反应中,氧化剂是
+4
+2 +5
化学方程式:3NO2+H2O NO+2HNO3
例2.在NO2与水的反应中,( D )
A.氮元素的化合价不发生变化 B.NO2只是氧化剂 C.NO2只是还原剂 D.NO2既是氧化剂又是还原剂
+4
+2 +5
化学方程式:3NO2+H2O NO+2HNO3
例3.下列关于自然界中氮循环(如图)的说法不正确的是( )
例5.如图是氮循环的一部分:
(1)NO2的颜色是__红__棕__色____。 (2)反应①的化学方程式是_N_2_+_O_2 ______2_N_O_。 (3)NO2易溶于水,并和水发生化学反应,该反应中,氧化剂是
__________。 (4)化合物A的化学式是__________。
例5.如图是氮循环的一部分:
吸入空气,振荡,重复操作。
2NO+O2 2NO2 3NO2+H2O NO+2HNO3
4NO+3O2+2H2O 4HNO3
思考: ④上述实验对工业上生产硝酸有什么启示?
思考: ④上述实验对工业上生产硝酸有什么启示?
向生产硝酸的尾气中通入氧气,利用氧 气将NO氧化为NO2实现循环利用。
三、含氮氧化物
+1
+2 +3
+4
N2O
NO N2O3
NO2
+5 N2O5
三、含氮氧化物
+1
+2 +3
+4
N2O
NO N2O3
NO2
+5 N2O5
牙科麻醉剂
火箭燃料系 统中氧化剂
氧化剂
四、一氧化氮和二氧化氮性质的应用
1.“雷雨肥田”
四、一氧化氮和二氧化氮性质的应用
1.“雷雨肥田”
农谚“雷雨肥田”的化学原理
N2+O2
(1)NO2的颜色是__红__棕__色____。 (2)反应①的化学方程式是_N_2_+_O_2 ______2_N_O_。 (3)N_O_2_易__N溶_O_2于__水_。,并和水发生化学反应,该反应中,氧化剂是 (4)化合物A的化学式是__________。
例5.如图是氮循环的一部分:
(1)NO2的颜色是__红__棕__色____。 (2)反应①的化学方程式是_N_2_+_O_2 ______2_N_O_。 (3)N_O_2_易__N溶_O_2于__水_。,并和水发生化学反应,该反应中,氧化剂是 (4)化合物A的化学式是____H_N_O_3___。
NO
无色气体
不溶于水 排水法
NO2
红棕色气体
易溶于水 向上排空气法
2NO+O2 3NO2+H2O
2NO2 NO+2HNO3
思考: ①在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,
用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。
思考: ①在一支50 mL的注射器里充入20 mL NO,然后吸入5 mL水,
无色。
2.化学性质 实验二:NO2和H2O的反应
实验现象:液面逐渐上升,气体的红棕色消失,剩余的气体为
无色。 NO2
NO 氮元素化合价由+4降至+2 HNO3 氮元素化合价由+4升至+5
2.化学性质 实验二:NO2和H2O的反应
实验现象:液面逐渐上升,气体的红棕色消失,剩余的气体为
无色。
NO 氮元素化合价由+4降至+2
第五章 第二节 氮及其化合物(2)
高一年级 化学
诺贝尔生理学或医学奖(1998年)
发现在心血管 系统中起信号 分子作用的一
氧化氮。
一氧化氮在治疗疾病中的突出应用
一、一氧化氮的性质
1.物理性质
无色气体,不溶于水,密度比空气的略大。 (NO相对分子质量约为30)
一、一氧化氮的性质
1.物理性质 无色气体,不溶于水,密度比空气的略大。 (NO相对分子质量约为30)
相同条件下,气体的密度之比等于其相对分子质 量之比
例6.利用如图所示装置收集以下7种气体 ①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦SO2
若烧瓶是干燥的,则由B口进气收集的气体有 ________(写序号)。
相同条件下,气体的密度之比等于其相对分子质 量之比 相对分子质量:H2 2 Cl2 71 CH4 16 HCl 36.5
NH3 17 SO2 64
例6.利用如图所示装置收集以下7种气体 ①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦SO2
若烧瓶是干燥的,则由B口进气收集的气体有 __②__④__⑦__(写序号)。
相同条件下,气体的密度之比等于其相对分子质 量之比 相对分子质量:H2 2 Cl2 71 CH4 16 HCl 36.5
方法2:碱液吸收法 方法3:NSR(NOX储存还原)
方法4:汽车尾气催化转化器
六、典型例题
例1.二十四节气是中国历法的独特创造,四月农谚“雷雨肥 田”“雨生百谷”描述的都是节气谷雨。下列元素在自 然界中的转化与“雷雨肥田”有关的是( )
A.K
B.N
C.P
D.C
六、典型例题
例1.二十四节气是中国历法的独特创造,四月农谚“雷雨肥 田”“雨生百谷”描述的都是节气谷雨。下列元素在自 然界中的转化与“雷雨肥田”有关的是( )
5.追求一种具体生活之上的普遍原则很容易,所以很多人选择“活得正确”而放弃“活得丰富”。 6.不论是正确性标准的形成,还是正确性标准的修正,都离不开生活实践的丰富性,二者密切相关。 7.生活中个体的人,追求“活得丰富”并不意味着对“活得正确”的放弃,仍应体现出对既有规则的尊重。
8.成熟社会的成熟公民不必刻意选择生活,“活得丰富”与“活得正确”是自然而然形成的结果。 9.中国人对自然的态度是亲和、“不隔”的,对用具器皿的制作不单是为了控制自然,满足生存所需,还希望以此表现对自然的敬爱,反映自然所给予的启示。
A.K
B.N
C.P
D.C
N2+O2 2NO+O2
