第三章 硅酸盐分析
硅酸盐分析项目及分析方法

在pH=3左右的溶液中,加热,使TiO2+水解为TiO
(OH)2沉淀,以Cu-PAN 1-(2-吡啶偶氮)-2-萘酚)为指 示剂,用EDTA 标液直接滴定溶液中的 Al3+。
Al3+ pH = 3
Al3+
(TiO2+) 煮沸 TiO(OH)2
EDTA PAN + Cu-EDTA
AlY
Al3+ + H2Y2- = AlY + 2H+ Cu2+ + PAN = Cu-PAN (红色) Cu-PAN + H2Y2- = CuY + PAN(黄色)
(2)HNO3、H2SO4、H3PO4
在系统分析中很少用HNO3、H2SO4溶样 但在单项测定中HNO3、H2SO4、H3PO4都广泛应用
H3PO4(缩合的H3PO4)200 ~ 300˚C溶解能力很 强,能溶解一些难溶于HCl、H2SO4的样品,如铁矿 石、钛铁矿等,但只适用于单项测定。
2020/5/15
KMnO4法 氧化还原滴定法
K2Cr2O7
化学分析法
直滴法 SS指示剂
铁
的
络合滴定法 EDTA法
测 定
返滴法 铋盐返滴 XO指示剂
仪器分析法 光度分析法 微量铁测定
2020/5/15
15
EDTA滴定法
(一)磺基水杨酸(钠)SS为指示剂,用EDTA直接滴定法
1、体系组成 Fe3+ Al3+ Ca2+ Mg2+ 等
lg K 25.1 16.3 10.69 8.7 理论上讲,对混合离子测定有两种方法:
方法掩 控蔽 制方 酸法 度分 分步 步滴 滴定 定
硅酸盐分析(2)
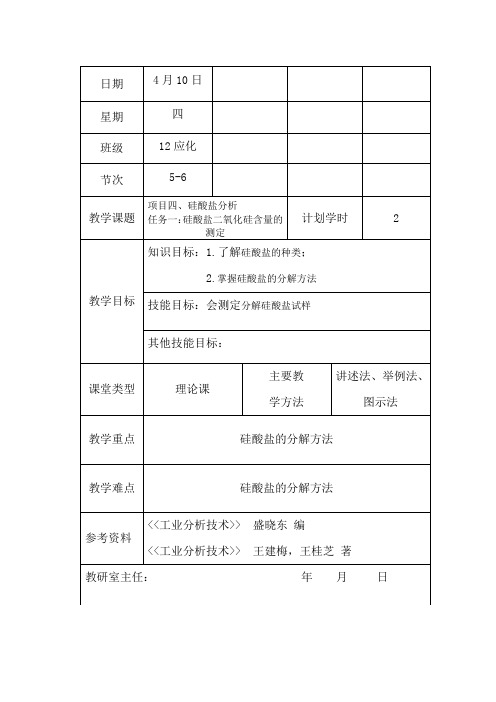
日期4月10日星期四班级12应化节次5-6教学课题项目四、硅酸盐分析任务一:硅酸盐二氧化硅含量的测定计划学时 2教学目标知识目标:1.了解硅酸盐的种类;2.掌握硅酸盐的分解方法技能目标:会测定分解硅酸盐试样其他技能目标:课堂类型理论课主要教学方法讲述法、举例法、图示法教学重点硅酸盐的分解方法教学难点硅酸盐的分解方法参考资料<<工业分析技术>> 盛晓东编<<工业分析技术>> 王建梅,王桂芝著教研室主任:年月日教学内容及过程设计一、水分的测定水分可分为吸附水和化合水。
1、吸附水吸附水在105 ~110℃下烘2h,称重测定。
2、化合水化合水包括结晶水和结构水两部分。
结晶水是以H2O分子状态存在于矿物晶格中,如石膏CaSO4·2H2O。
结晶水通常在300 ℃以下灼烧即可排出。
结构水是以化合状态的氢或氢氧根存在于矿物的晶格中,需加热到300 ~1300℃才能分解而放出。
化合水的测定方法有重量法、气相色谱法、库仑法等。
二、烧失量的测定烧失量又称为灼烧减量,是试样在1000 ℃灼烧后所失去的质量。
烧失量主要包括化合水、二氧化碳、和少量的硫、氟、氯、有机质等。
烧失量是试样中各组分在灼烧时的各种化学反应所引起的质量增加和减少的代数和。
因此,当试样较为复杂时,一般不测烧失量。
三、二氧化硅含量的测定1、氯化铵重量法(1)原理试样用无水Na2CO3烧结,使不溶的硅酸盐转化为可溶性的硅酸钠,用盐酸分解熔融块。
Na2SiO3+2HCl=H2SiO3+2NaCl再加入固体氯化铵,在沸水浴上加热蒸发,使硅酸脱水析出,沉淀用滤纸过滤后,灼烧,得到含有铁、铝等杂质的不纯二氧化硅。
用HF处理沉淀,使其中的SiO2以SiF4形式挥发,失去的质量即为纯SiO2的质量。
SiO2 + 6HF = H2SiF6 + 2H2OH2SiF6 = SiF4 ↑+ 2HF再用分光光度法测定滤液中可溶性的SiO2的量,二者之和即为SiO2的总量(GB/T176-1996中规定的基准法)。
硅酸盐分析

由一石是灰符石、合粘比土值、铁要矿求石,按一二定是比它例配是合一(种混合新)的,硅
× 酸盐(S石iO2灰%石: 12、%粘C土aO、%生: 40料%、以上熟,料),而不单
是石灰酸石溶、粘?土、铁矿石的组合。
因为酸溶可溶石灰石,部分铁矿石,粘土不溶, 这样制成的试液不能与生料的主成分一致(生料性质上不是均匀体)
盐的所有氧化物的分子式分开来写,如: 正长石:K2AlSi6O16或 K2O ·Al2O3 ·6 SiO2 高岭土: H4Al2Si2O9或Al2O3 ·2 SiO2 ·2 H2O
分开写清晰
2、硅酸盐制品(即人造硅酸盐) 以硅酸盐矿物的主要原料,经高温处理,
可生产出硅酸盐制品。
制品:水泥、玻璃、陶瓷、耐火材料等非金属
分 解 方 法 选 择
干 扰 元 素 的 清 除
采 样 制 样 溶 样 ( 熔 样 )
测 定 报 结 果
为使结果准确必须控制好每一步
本节中掌握些什么内容? 试样的分解方法选择的依据(为什么)?
什么熔剂使用什么坩埚,什么熔剂使用 什么器皿?
并结合我们要做的各类试样,如水泥熟料、 生料、粘土等的溶样(熔样)方法选择什么 样的器皿或坩埚证明道理,方法。
水泥生料
水泥原料按一定比例配料,粉磨而成。即水
泥未烧前。
生产过程
原 料 适 当 比 例 配 料 生 料 预 热 1 4 5 0 o C 煅 烧 熟 料 配 以 石 膏 及 石 膏 水 泥
粉 磨
硅 酸 盐 分 析
粉 磨
熟料矿物组成及作用(见硅酸盐工艺)
水泥中混合材料
石膏CaSO4 ·2 H2O 用作缓凝剂 SO3分析测定由其引入
比值越小,碱性越强,越易被酸溶解
硅酸盐分析与检验控制分析流程

1 3 硅酸盐系统分析方法
TiO2+ + H2O2 → TiOH2O22+ TiOH2O22+ + H2Y2 → TiOH2O2Y2 +
2H+ Bi3+ H2Y2剩余 → BiY + 2H+ 终点时: Bi3+ SXO 黄色 → BiSXO 红色
Company Logo
Company Logo
1 3 硅酸盐系统分析方法
用苦杏仁酸置换滴定钛含量;对某些成分比较复杂的样品;如粘土
粉煤灰 页岩等;滴定终点褪色较快 措施:在滴定之前;将溶液冷却至50C左右;加13mL无水乙醇
则可减缓褪色;改善滴定终点
Company Logo
1 3 硅酸盐系统分析方法
苦杏仁酸掩蔽法: 同时取两份溶液: 一份用铜盐返滴定法测定铝钛合量; 另一份用苦杏仁酸将TiO2+掩蔽;然后再以铜盐返滴定法测定 Al3+含量 最后;根据两者消耗EDTA体积之差计算TiO2含量
矿渣的系统分析中多采用此方法
Company Logo
1 3 硅酸盐系统分析方法
6 氧化钙和氧化镁的测定
pH=10;K·B指示剂;EDTA测定Ca2+和Mg2+总量 pH>12;CMP或MTB指示剂;EDTA测定Ca2+ 在碱溶氟硅酸钾系统中;测Ca2+应消除硅酸的干扰
Company Logo
Company Logo
1 3 硅酸盐系统分析方法
一 分析方法综述
测定项目:SiO2 Fe2O3 Al2O3 CaO MgO 烧失量 水泥样品→TiO2 MnO SO3 F Na2O K2O等; 石膏→ SO3; 粘土 矾土→ TiO2; 矿渣→ MnO; 而萤石仅需测定CaF2 CaCO3 F Fe2O3
硅酸盐的快速分析法

硅酸盐的快速分析法硅酸盐是非常常见的硅氧化合物之一,主要广泛分布于地壳当中,它不但是化工原料,而且是大部分岩石矿物的主要构成成分,广泛应用于科研领域和工业生产领域。
本文中,主要分析了硅酸盐的化学成分,并针对如何系统分析岩石矿物中的硅酸盐提出新的研究和设计方法,即微波消解法,这种方法可以迅速分析和分解岩石试样,一方面确保分析的准度和精度,另一方面有效提升分析效率。
通过实验可以发现,微波消解法不但简单高效,而且有助于提升工业生产水平,可以在工业生产中大量适用。
【关键词】岩石矿物;硅酸盐;微波消解法;研究设计在分析岩石矿物中硅酸盐成分的过程中,需要对非常多的元素项目进行测定,而且分析过程相当复杂,通常情况下,在判断和分析矿物中硅酸盐成分时,需要采用屏蔽、分离以及分解等各种手段,以在保证分析效率的同时降低矿物试样用量,同时避免测定结果收到干扰元素的影响。
目前而言,分析硅酸盐的主要方法是以重量法为基础,只经过一次样品就能够测定三氧化二铁、三氧化二铝以及二氧化硅等各种成分,主要有四个步骤:一是分解试样;二是分离成分;三是测定成分;四是依次重复测定多种成分。
一般而言,以原子吸收分光光度法为基础的快速分析、酸溶快速分析以及碱溶快速分析是比较常见的快速分析方法。
这三种方法的优势各不相同,以原子吸收分光光度法为基础的快速分析法能够对五氧化二磷和二氧化钛等化合物进行分析和测试;酸溶快速分析法能够第一时间测定和分离二氧化硅;而碱溶快速分析法能够第一时间测定和分离氧化钠与氧化钾。
但是,这三种方法都具备相同的缺点,就是流程比较复杂繁琐,不适用于工业生产和控制。
因此,笔者提出微波消解法,一方面能够进一步提升分析岩石矿物中硅酸盐成分的水平和效率,另一方面也有助于推动盐酸盐分析技术在工业中的发展。
一、实验仪器及材料(一)实验仪器本实验的实验仪器主要是家用微波炉,功率最好为1200瓦,可以选用苏泊尔和美的等知名品牌。
(二)实验材料实验材料主要包括实验岩石樣本、实验试剂以及实验器材三大部分:具体而言,实验岩石样本方面,主要包括水泥生料、普通硅酸盐水泥以及水泥熟料;实验试剂方面,主要包括EDTA标样、浓度为90%的KOH溶液,CMP指示剂、三乙醇胺以及浓度为36%的盐酸,其中,CMP指示剂是指甲基百里香酚蓝——钙黄绿素——酚酞混合物;实验器材主要包括混合搅拌机、离心机以及水晶玻璃试管等。
第三章 硅酸盐分析

4. 试样的分解方法
溶解法:水溶,酸溶,其它溶剂
分为熔融法:酸熔K
2S
2
O
7
,
碱熔KNa2C2COO3,3,KNOaHO,H,NaN2Oa 22B,4OLi7BO
2
半熔法:K 2CO3,Na 2CO3
§3.2 硅酸盐系统分析
经典分析系统 快速分析系统
酸溶 碱熔 锂硼酸盐熔融
一. 经典分析系统 硅酸盐经典分析系统基本上是建立在沉淀分离和重量
NH3·H2O沉淀 过滤
沉淀 Fe2O3·nH2O、 Al2O3·nH2O、
、 TiO2·nH2O
灼烧、称重
R2O3
K2S2O7熔融 稀H2SO4提取 过滤
溶液 Fe3+、Al3+、Ti4+
溶液 Ca2+、Mg2+…
(NH4)2C2O4 沉淀 过滤
沉淀
Ca2CO4 灼烧 称重
溶液 Mg2+…
(NH4)2HPO4 沉淀 过滤
Na2CO3熔融(铂坩埚)、水 提取,HCl酸化,两次HCl蒸 干脱水, HCl浸取,过滤
沉淀 SiO2·nH2O+杂质
灼烧、称重
HF+H2SO4处理 灼烧、称重
SiO2
残渣 K2S2O7熔融 稀H2SO4提取
沉淀 SiO2·nH2O
灼烧 称重
SiO2
溶液 Al3+、Fe3+、Ti3+、Ca2+、Mg2+…
的煅烧和粉磨,才能得到优质量水泥。 1. 任务:
硅酸盐分析是分析化学在硅酸盐生产中的 应用。主要研究硅酸盐生产中的原料、材料、 成品、半成品的组成的分析方法及其原理。
第三章 硅酸盐分析

精选2021版课件
27
4.1.1.2 硅酸脱水重量法
硅酸在pH=1~3和>13的低浓度(<1mg/mL)中 以单分子形式存在,当pH<1或>3时即胶体化, 且迅速聚合。聚合体的水溶性很小,在含有EDTA、 柠檬酸等络合剂络合Fe3+、Al3+等离子以抑制它们 沉淀的介质中,滴加氨水至pH=4~8,硅酸可基本 沉淀完全,这是硅与其它元素分离的方法之一。
器皿:铂坩埚
温度:950~1000℃ 时间:30~40min 熔剂用量:试样量的8~10倍 熔融反应:正长石
KAlSi3O8+3Na2CO3 =3Na2SiO3+ KAlO2 +3CO2 石英:SiO2+Na2CO3 =Na2SiO3+ CO2 熔融物用HCl处理。
精选2021版课件
8
1.4.2 NaOH熔融 NaOH熔点:328℃ 分解条件: 器皿:银或镍坩埚 时间:10~20min 温度:650~700℃,需从室温开始 熔剂用量:试样量的8~10倍 熔融反应:橄榄石 MgSiO3+2NaOH =Na2SiO3+ Mg(OH)2 熔融物同样可用HCl溶解。 缺点:某些难分解的天然硅酸盐分解不完全。
硅酸盐分解后转变为硅酸钠,提取液酸化时形 成的硅酸存在三种状态:一部分呈白色片状的水凝 聚胶析出;一部分呈水溶胶,以胶体形式存在溶液 中;还有一部分以单分子溶解状存在,逐渐转变为 溶胶状态。
精选2021版课件
28
硅酸溶胶胶粒带有负电荷:
[(SiO2)m•yH2SiO3•nSiO32-•2(n-x)H+]2-•2xH+
密闭容器中 HF分解, AlCl3络合F-, 硅钼黄光度法
SiO2定量
13附录四 试样分析实例——硅酸盐的分析

2
一、试样的分解 根据试样中 SiO2 含量多少的不同, 在分解试样时,可采用两种不同的方 法来分解: ⑴SiO2含量低时,用酸溶法分解。
酸溶法通常用 HCl 或 (HF+H2SO4) 为溶剂。 当用 (HF+H2SO4) 分解 SiO2 时,对 SiO2 的测 定应另取试样进行。
2016年5月25日星期三7时29分39秒
2016年5月25日星期三7时29分39秒
2016年5月25日星期三7时29分39秒
4
二、SiO2的测定
P194第六章 第八节、四
测定SiO2的方法有重量法和氟硅酸钾容 量法,前者准确度高但太费时间,后者虽 然准确度稍差但测定的速度较快。 ㈠重量法 试样经碱熔法分解后,使 SiO2 转变成硅 酸盐。
继续处理(用流程图表示)
2016年5月25日星期三7时29分39秒
溶液 NH 3 H 2O
沉淀 [ Fe(OH )3、Al (OH )3、Ti (OH ) 4 ]
HCl溶解
中和、过滤
不纯SiO2、称量ຫໍສະໝຸດ HF - H 2 SO4 处理、灼烧
溶液
残渣、称量
K 2 S 2O7 熔融 水浸取
溶液
络合滴定法 测定 ( CaO、MgO)
溶液
光度法测定Fe2O3 光度法测定TiO4 EDTA连续测定法测定Fe2O3、Al2O3、TiO2
苦杏仁酸 Al 、Ti(IV )的含量 滴定后的溶液 AlY TiL Y
3
Ti含量 二者含量之差为Al3+的含量
2016年5月25日星期三7时29分39秒
Cu标液
8
分析Ti(IV)的吸光光度法
TiO H 2O2 [TiO( H 2O2 )] (黄色)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析系统应具备的条件:
①称样次数少。 ②尽可能避免分析过程的介质转换和引入分 离方法。 ③所选用的分析方法必须有良好的准确度和 精密度。 ④适用范围广。 ⑤称样、试样分解、分液、测定等操作易与 计算机联机,实现自动分析。
1.3 硅酸盐的组成和分析项目 1.3.1 组成 组成复杂,元素众多,从结构上可以简单看 成是由SiO2和金属氧化物组成: iM2O• mMO• nM2O3• gSiO2 根据SiO2的含量,可将硅酸盐划分为五类:。 ①极酸性岩:SiO2>78%; ②酸性岩:SiO2 65~78%; ③中性岩:SiO2 55~65%; ④基性岩:SiO2 38~55%; ⑤超基性岩:SiO2 <38%~40%。
沉淀洗涤后置于铂坩埚中,在由低温升起的 高温炉中干燥、炭化、灰化,至950~1000℃灼烧 1h,取出冷却后称重,即可求得SiO2的含量。 ②硅酸凝聚重量法
使用最广泛的凝聚剂是动物胶。动物胶是含 氨基酸的蛋白质,为两性物质,等电点为pH= 4.7,在pH<4.7时以带正电荷的胶体粒子形式存 在。动物胶凝聚硅酸的完全程度与酸度、温度及 动物胶的用量有关:酸度高,胶体水化程度小, 聚合能力强;温度应控制在60~70℃并保温10min; 动物胶用量一般控制在25~100mg。
从结构上看,基本结构单元是SiO4硅氧四面体。 这些硅氧四面体以单个或通过共用氧原子连接存在 于小的基团、小的环状、无限的链或层中。 依结构不同,硅酸盐可分为:简单正硅酸盐矿 物、缩合硅酸盐矿物、环状硅酸盐矿物、无限链状 硅酸盐矿物、无限层型硅酸盐矿物和骨架型硅酸盐 矿物。 主要组成元素:Si、O、Fe、Al、Ca、Mg、K、 Na。 其次组成元素:Mn、Ti、B、Zr、Li、H、F、 Cl、S、P、C等。
分解条件: 器皿:铂、金、石墨坩埚
温度:800~1000℃
熔融物用HCl溶解。
时间:20~30:熔块较难脱离坩埚,较难溶解,且在 酸性溶液中硅酸易发生聚合而影响到SiO2的测定。
氢氟酸分解 氢氟酸是分解硅酸盐惟一最有效的溶剂。硅 酸盐矿物中,除斧石、锆石、尖晶石、绿柱石、 石榴石外可分解完全;绿柱石、石榴石通过容器 加盖和延长分解时间(2~4h)可以分解完全,其它 难溶物也可以通过加压使之分解完全。 分解需用铂皿,有时可通过加数滴HNO3、 H2SO4或HClO4使分解效果更好。 分解液可用于测定除SiO2外的其它项目。 1.4.5
试样(第一次称样)
碱熔,水浸,HCl酸 化,蒸至湿盐状, 动物胶凝聚,过滤
沉淀
灼烧, 硅 称重 钼 蓝 SiO2 光 定量 度 法 磺 基 水 杨 酸 光 度 法
滤液定容250mL
氧 络 络 络 H2O2 还 合 合 合 光 或 滴 滴 滴 度 络 定 定 定 法 差减 法 合 法 差减 法 TiO2 滴 Al2O3 CaO 定 定量 定量 MgO 定量 法 定量
1.4.3 混合熔剂熔融
①(1+1)~(5+1)K2CO3-Na2CO3 优点:熔点降低(~700℃)。 缺点:K2CO3易吸湿;钾盐较易被吸附。 ②Na2CO3加适量硼酸或Na2O2、KNO3、 KClO3等 优点:分解能力强。 ③NaOH-KNO3 KNO3代替Na2O2,可减轻对坩埚的侵蚀。
1.4.4 锂硼酸盐熔融
B2O3是各种金属氧化物、硅酸盐等难溶物的 强有力熔剂。过去多用硼砂,但不能用于钾、钠 的测定。后发展用锂硼酸盐,不仅分解能力强, 且熔融物固化后可直接进行X-射线荧光分析,或 把熔块研磨成粉末后直接进行发射光谱分析,也 可以将熔融物溶解后制备成溶液,进行包括钾和 钠在内的多元素的化学分析。 常用的锂盐熔剂有:偏硼酸锂、四硼酸锂、 (2+1+1)碳酸锂-氢氧化锂-硼酸、(7~10+1)碳酸锂硼酸、(7~10+1)碳酸锂-硼酸酐等。
K2Cr2O7或 KMnO4滴定 差 减 法
H2O2光度法
Fe2O3 定量
Al2O3 定量
TiO2 定量
经典分析系统只能测定六个项目,Na2O、 K2O、MnO、P2O5等须另取试样测定。
试样含其它重金属时,应先分离。 试样
王水分解,过滤
酸不溶物
Na2CO3分解,HCl提取
溶液
HCl蒸干脱 水,过滤
溶液
调节酸度,通 H2S,过滤
SiO2等
按普通硅酸盐 系统分析进行
溶液
重金属硫化物 沉淀,弃去
3 硅酸盐快速分析系统
随时代的需要,科技的发展,各种分解及测定 方法的出现,分析仪器及计算机的发展和应用,硅 酸盐分析系统不断改进和完善,分析速度越来越快。 这些快速分析系统按分解方法不同进行分类:
3.1 碱熔快速分析系统 用Na2CO3、NaOH或N2O2为熔剂进行高温熔 融分解;熔融物用热水提取,HCl或HNO3酸化, 无需分离,可分液进行硅、铁、铝、钙、镁、钛、 磷等的测定。钾和钠需另取样测定。
⑤H2O-、H2O+和FeO在所有分析系统中都必 须单独取样测定。
4 硅酸盐主要成分分析 4.1 SiO2的测定 4.1.1 重量法 可分为HF挥发重量法和硅酸脱水灼烧重量法 两类。 4.1.1.1 HF挥发重量法 将试样置于铂器皿中灼烧至恒重,加H2F2H2SO4或H2F2-HNO3处理,使样品中的SiO2转变为 SiF4逸出: 2H2F2+SiO2=SiF4+2H2O 再灼烧至恒重,差减计算SiO2的含量。该法只适 用于较纯的石英样品中SiO2的的测定。
4.1.1.2 硅酸脱水重量法
硅酸在pH=1~3和>13的低浓度(<1mg/mL)中 以单分子形式存在,当pH<1或>3时即胶体化, 且迅速聚合。聚合体的水溶性很小,在含有EDTA、 柠檬酸等络合剂络合Fe3+、Al3+等离子以抑制它们 沉淀的介质中,滴加氨水至pH=4~8,硅酸可基本 沉淀完全,这是硅与其它元素分离的方法之一。 硅酸盐分解后转变为硅酸钠,提取液酸化时形 成的硅酸存在三种状态:一部分呈白色片状的水凝 聚胶析出;一部分呈水溶胶,以胶体形式存在溶液 中;还有一部分以单分子溶解状存在,逐渐转变为 溶胶状态。
硅酸盐岩石矿物是非常重要的工业原料。水泥、 玻璃、陶瓷等均是硅酸盐制品,许多有用元素如Li、 Be、B、Zr、Rb、Cs等也大多取之于硅酸盐矿物中。
1.2 系统分析和分析系统
单项分析:一份称样中只测定一、二个项目。 系统分析:一份称样分解后,通过分离或掩蔽 消除干扰,系统地、连贯地进行数个项目的依次测 定。 分析系统:在系统分析中从试样分解、组分分 离到依次测定的程序安排。 分析系统是由相互联系、相互作用的诸要素组 成的具有一定功能的有机整体。科学的分析系统可 减少试样用量,避免重复工作,加快分析速度,降 低成本,提高效率。
SiO2定量
试样
密闭容器中HF 分解,HClH2BO3提取 H 2O2 光 度 法 差减 络 合 滴 定 法
TiO2 定量
AAS SiO2、 Fe2O3、 CaO、MgO、 K2O、Na2O、 MnO定量
Al2O3 定量
磷 钒 钼 黄 光 度 法
P2O5 定量
3.3 锂盐熔融快速分析系统 用偏硼酸锂或碳酸钠–硼酸酐熔融分解,熔块 用HCl提取后以重量法测硅,其它项目的测定方法 与前面各分析系统相同。
1.3.2 分析项目 13项: SiO2、Al2O3、Fe2O3、FeO、CaO、 MgO、 Na2O、K2O、MnO、P2O5、H2O-和烧失 量。 16项:上述13项去掉烧失量,加H2O+、CO2、 S和C。 依据组成和需要:F、Cl、V2O5、Cr2O3、 BaO及其它各种微量元素。 硅酸盐全分析的测定结果,要求各项的百分 含量总和~100%: Ⅰ:99.3~100.7%; Ⅱ:98.7~101.3%。
试样
分解, HCl提取, CTMAB凝聚, 过滤
沉淀
灼烧,称重
Te3+、Al3+、Ti4+、Ca2+、 Mg2+、K+、Na+等
SiO2 定量
硅酸盐快速分析系统及各组分测定方法的特
点: ①选用新的试样分解方法。 ②分取溶液进行各个组分的测定。 ③在分析方法中大量使用AAS、ICP-AES, 加快分析速度。 ④系统分析取样量逐渐减少。
SiO2
Fe2O3 定量
KIO4-(NH4)2S2O8光度法
前定容滤液
MnO定量
钼蓝萃取光度法
P2O5定量
试样(第二次称样)
H2F2+H2SO4分解, HNO3溶液, 火焰光度法或原子吸 收分光光度法测定
K2O、Na2O 定量
3.2 酸溶快速分析系统 用H2F2或H2F2-HClO4、H2F2-H2SO4等分解试 样,测定铁、铝、钙、镁、钾、钠、锰等,硅的 测定则须另称样,测定方法与碱熔系统相同。
试样(第一次称样)
酸溶,水浸,H2SO4 酸化,NH3•H2O沉 淀,过滤 沉淀用H2SO4溶解
Te3+、Al3+、Ti4+ Mn2+、HPO42-
Ca2+、Mg2+ K+、Na+
试样(第二次称样)
HF分解,氟 硅酸钾滴定法
SiO2定量
试样(第二次称样)
密闭容器中 HF分解, AlCl3络合F-, 硅钼黄光度法
试样
分解,酸溶, 脱水,浸取, 过滤
SiO2沉淀+杂质
灼烧,称重, 驱硅,灼烧, 称重,求失重 分解,酸溶
残渣
滤液,用于测 定Al2O3、 Fe2O3、CaO、 MgO、Na2O、 K2O等
Fe3+、Al3+、Ti4+、Ca2+、Mg2+…
NH3•H2O,过滤
Fe2O3•nH2O、 Al2O3•nH2O、 TiO2•nH2O、
1.4.2
NaOH熔融 NaOH熔点:328℃ 分解条件: 器皿:银或镍坩埚 时间:10~20min 温度:650~700℃,需从室温开始 熔剂用量:试样量的8~10倍 熔融反应:橄榄石 MgSiO3+2NaOH =Na2SiO3+ Mg(OH)2 熔融物同样可用HCl溶解。 缺点:某些难分解的天然硅酸盐分解不完全。
