无机含氧酸的酸性及氧化性的比较与影响因素
物质结构化学简答题
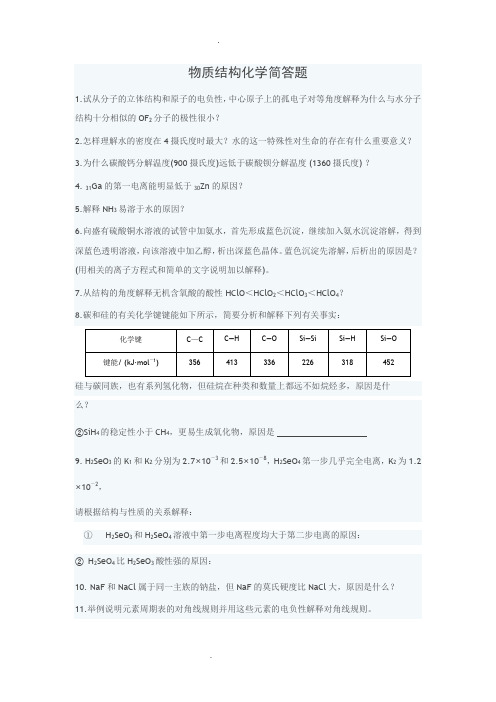
物质结构化学简答题1.试从分子的立体结构和原子的电负性,中心原子上的孤电子对等角度解释为什么与水分子结构十分相似的OF2分子的极性很小?2.怎样理解水的密度在4摄氏度时最大?水的这一特殊性对生命的存在有什么重要意义?3.为什么碳酸钙分解温度(900摄氏度)远低于碳酸钡分解温度 (1360摄氏度) ?4. 31Ga的第一电离能明显低于30Zn的原因?5.解释NH3易溶于水的原因?6.向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。
蓝色沉淀先溶解,后析出的原因是?(用相关的离子方程式和简单的文字说明加以解释)。
7.从结构的角度解释无机含氧酸的酸性 HClO<HClO2<HClO3<HClO4?8.碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是什么?②SiH4的稳定性小于CH4,更易生成氧化物,原因是9. H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:① H2SeO3和H2SeO4溶液中第一步电离程度均大于第二步电离的原因:②H2SeO4比H2SeO3酸性强的原因:10. NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是什么?11.举例说明元素周期表的对角线规则并用这些元素的电负性解释对角线规则。
12.已知N—N、N≡N、N≡N键能之比为1.00:2.17:4.90,而C—C、C=C、C≡C键能之比为1.00:1.77:2.34。
如何用这些数据理解氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应?16.什么是电子气理论?它怎样定性地解释金属晶体的延展性、导电性和导热性?17.结合事实判断CO和N2相对更活泼的是______________,试用下表中的键能数据解释其相对更活泼的原因:___________________________________________________________________。
无机含氧酸分子的酸性与结构——高三复习

➢ 不同元素的含氧酸有:弱酸 n=0;中强酸 n=1;强酸n=2或3。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
练习
1. [2012全国1 T37改]解释酸性: H2SeO4>H2SeO3 2. [2014全国1 T27 改] 次磷酸(H3PO2)是一种精细化工产品,它 是一元中强酸。(1) 推测它的结构简式;(2) 写出它的电离方程式; (3) NaH2PO3是正盐还是酸式盐?
HPO3
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
练习
海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某 种多聚磷酸根的结构如图.
① 磷原子的杂化类型为 sp3 . ② 这种多聚磷酸钠的化学式为 Na5P3O10 .
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
可以看出这些含氧酸均可以表示为(HO)mROn的形式:
H2SO4 = (HO)2SO2 HClO = (HO)Cl HClO3 = (HO)ClO2 H3PO4 = (HO)3PO HNO2 = (HO)NO
H2SO3 = (HO)2SO HClO2 = (HO)ClO HClO4 = (HO)ClO3
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系网站或本人删除。
多聚磷酸
多聚磷酸是一种无色透明黏稠状液体,具有腐蚀性。它能溶解 多种低分子及高分子有机化合物。在有机合成中用作失水剂、环化 剂、酰化剂,是缩合、环化、重排、取代等反应的催化剂或溶剂。 试根据磷酸(H3PO4)的结构,推测多聚磷酸的结构及其化学式。
无机含氧酸的氧化还原性及其影响因素

3.其他过程的能量效应
❖在氧化过程中常伴随其他一些非氧 化还原反应。
❖使熵增大或者使焓减小都有利于反 应的进行。如非电解质的形成,沉 淀或者配合物的形成,溶剂化或者 去溶剂化都将影响含氧酸的酸性
元素最高氧化数的氧化性增强
还无 原机 性含 及氧 影酸 响的 因氧 素化
曾巽凌 董思琦 叶美玲
Contents
含氧酸氧化还原性强弱的规律 2 影响含氧酸氧化能力的因素
Click to add title in here
1.同一周期元素高氧化数的 氧化性随原子序数的增加而增强
❖如H2SiO4<H3PO4<H2SO4<HClO4 ❖如HClO>HBrO>HIO
4.含氧酸的氧化性强于含氧酸盐, 在酸性介质中的氧化性强于碱性介质
❖ 如KMn04在酸性溶液中可以氧化Cl-离子,在碱
性溶液中无法氧化
从电极电势上看,增大酸根或氢离子的浓度,氧化能力 增强,这可由Nernst方程解释:
E=Eθ+0.0592/n lg(ox)m/(red)n, 对于有 H+ 参加的反应,氧化态物质应包括 H+ ,由此方 程式可知:增大H+浓度,可提高电极电势,从而使酸的 氧化性增强。
Reason2 中心原子X与氧原子之间键的强度
❖当X-O键越强,X-O键数越多时,所 需能量越多,含氧酸越稳定,氧化能力 越弱
❖so 稳定性
HClO4>HClO3>HClO3>HClO
On the other hand X-O键的强度与中心原子X的电子层结构,成键情况
,温度及H离子的反极化作用有关
无机含氧酸分子的酸性

无机含氧酸分子的酸性
无机含氧酸分子是有机化学中至关重要的一类物质,具有独特的特性和性质。
它们被广泛用于医学、农业、材料科学和其他领域。
本文将就无机含氧酸分子的酸性及其影响因素进行分析和研究。
无机含氧酸分子的酸性是指其具有质子交换性的特性。
因此,它们具有很高的溶解性,能与其他物质形成溶液。
此外,它们能将氢离子与其他离子结合起来,帮助生物体构建细胞结构、维持酸-碱平衡等。
然而,由于无机含氧酸分子的酸性特性,它们也可能引起环境污染、腐蚀金属和引发人体皮肤疾病。
无机含氧酸分子的酸性受到多种因素的影响,其中包括电子结构、氧化态、元素组成和分子结构等。
首先,电子结构是影响无机含氧酸分子酸性最主要的因素。
通过仔细检查它们的电子结构,能够识别它们是否是碱性或酸性。
其次,氧化态是影响无机含氧酸分子酸性的重要因素。
当无机含氧酸分子的氧化态发生变化时,它们的性质也会发生变化,从而影响它们的酸性。
此外,化学元素的组成也会影响无机含氧酸分子的酸性。
如果包含有碱性元素,则其有机含氧酸分子会产生较高的酸性。
最后,无机含氧酸分子的分子结构也会影响它们的酸性。
如果分子结构更加紧凑,则分子的酸性就更强。
无机含氧酸分子的酸性是有机化学重要的一个方面,它们不仅可以用于多种应用,而且还可能引发环境污染和人体疾病。
因此,研究无机含氧酸分子的酸性和它们的影响因素是非常重要的。
通过研究无机含氧酸分子的酸性,我们可以更好地利用它们,并避免它们对环境
和人体健康的不良影响。
无机含氧酸的酸性与分子结构

无机含氧酸的酸性与分子结构已知元素有不同化合价的多种含氧酸,从理论上讲,几乎没有什么指导性原理能帮助我们理解这些含氧酸的相对强度。
但是,如果把所有的含氧酸用通式(HO)mXOn来表示,则很快就可以看到一些规律性,式中m和n取决于中心原子的化合价。
例如,氯的含氧酸,即HClO、HClO2 、HClO3 、HClO4可以表示為(OH)Cl、(OH)ClO、(OH)ClO2、(OH)ClO3。
在这个系列中,m 是常数,n从0增加到3,这反映了氯的化合价从+1增加到+7。
当n值从0增加到3时,含氧酸酸性逐渐变强。
在考虑这些含氧酸的酸强度时,OH基团的数目也有一定的影响,但在酸性的强弱方面不起决定性的作用。
含氧酸电离时形成的阴离子的相对稳定性也是影响含氧酸的酸性的重要因素。
含氧酸所形成阴离子上的电荷可以分散到这个非羟基的氧原子上。
因此,非羟基氧原子的数目越大(n值越大),电荷越容易分散。
根据上述理论和已知磷酸(H3PO4)、亚磷酸(H3PO3)均为中强酸,亚砷酸(H3AsO3)是一个极弱酸。
试写出H3PO3、H3PO4、H3AsO3的结构式________、________、________;并指出它们各是几元酸________、________、________。
解析:这道概念、理论、元素综合试题的特点是:理论是大纲和教材里没有的,是试题题干中提供的,要求考生通过自学理解给出的理论知识;亚磷酸、亚砷酸的结构和性质,对于考生而言是全新的。
对于本题而言,理解含氧酸的有关规律至关重要。
写出HC1O、H2SO3、H2SO4、HCIO4的结构式有助于理解和运用理论。
HC1O的结构式为H——O——Cl,其分子中有一个——OH,是一元酸,非羟基氧原子数是0,HC1O是极弱酸;H2SO3的结构简式为,在H2SO3分子中有2个——OH,所以H2SO3是二元酸,H2SO3分子中有一个非羟基氧原子,H2SO3是一个中强酸;H2SO4的结构式为:,在H2SO4分子中有2个——OH,所以,是二元酸。
无机化学经典知识点

一,含氧酸强度1,R-O-H规则:含氧酸在水溶液中的强度决定于酸分子中质子转移倾向的强弱,质子转移倾向越大,酸性越强,反之则越弱。
而质子转移倾向的难易程度,又取决于酸分子中R吸引羟基氧原子的电子的能力,当R的半径较小,电负性越大,氧化数越高时,R吸引羟基氧原子的能力强,能够有效的降低氧原子上的电子密度,使O-H键变弱,容易放出质子,表现出较强的酸性,这一经验规律称为R-O-H 规律。
1)同一周期,同种类型的含氧酸(如HnRO4),其酸性自左向右依次增强。
如:HClO4>H2SO4>H3PO4>H4SiO42)同一族中同种类型的含氧酸,其酸性自上而下依次减弱。
如:HClO>HBrO>HIO 3)同一元素不同氧化态的含氧酸,高氧化态含氧酸的酸性较强,低氧化态含氧酸的酸性较弱。
如:HClO4>HClO3>HClO2>HClO2,Pauling规则:含氧酸的通式是RO n(OH)m,n为非氢键合的氧原子数(非羟基氧),n值越大酸性越强,并根据n值把含氧酸分为弱酸(n=0),中强酸(n=1),强酸(n=2),极强酸(n=3)四类。
因为酸分子中非羟基氧原子数越大,表示分子中R→O配键越多,R的还原性越强,多羟基中氧原子的电子吸引作用越大,使氧原子上的电子密度减小的越多,O-H键越弱,酸性也就越强。
注意:应用此规则时,只能使用结构式判断,而不能使用最简式。
3,含氧酸脱水“缩合”后,酸分子内的非氢键合的氧原子数会增加,导致其酸性增强,多酸的酸性比原来的酸性强。
二,含氧酸稳定性1,同一元素的含氧酸,高氧化态的酸比低氧化态的酸稳定。
如:HClO4>HClO3>HClO2>HClO2,氧化还原性:1)同一周期主族元素和过渡元素最高价含氧酸氧化性随原子序数递增而增强。
如:H4SiO4<H3PO4<H2SO4<HClO4,V2O5<Cr2O72-<MnO4-2)相应价态,同一周期的主族元素的含氧酸氧化性大于副族元素。
无机含氧酸的酸性及氧化性的比较与影响因素

无机含氧酸的酸性及氧化性的比较与影响因素1 无机含氧酸的酸性无机含氧酸可以的分子式为HmROn,其通式可以写成Hl-Rm--〔O-H〕n,〔其中l,m可以为0,n≥0〕,也可写成ROm-nOHn,其中R称为成酸元素,.无机含氧酸在水溶液中的酸强度取决于酸分子中羟基-O-H的电离程度,也可以用Pka值来衡量。
酸分子羟基中的质子在电离过程中脱离氧原子,转移到水分子中的孤对电子对上,其转移的难易程度取决于成酸元素R吸引羟基氧原子电子的能力。
如果成酸无素R的电负性越大,R周围的非羟基氧原子数目越多,则其酸性越强。
原因是成酸元素R的电负性越大,则其偏移O的电子越少,从而减小了O原子周围的电子密度增大的趋势,使得其对质子的吸引减弱,有利于质子的转移;非羟基氧原子越多,则分子周围越易形成离域π键,这种键将成酸R原子及O原子包裹在其中,一方面增强了羟基-O-H键的极性,有利于质子的转移,其次使得整个酸基团周围的空间减小,阻碍了质子与O原子上孤对电子的结合,从而使得酸性增强。
含氧酸的酸性一般存在如下规律[1]:(1) 同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如HClO4>HClO3>HClO2>HClO〔原因:从HClO 到HClO4非羟基氧原子逐渐增多,羟基-O-H键的极性增强,质子转移程度增强,故酸性增强〕(2) 在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自上而下减弱。
如H ClO>HBrO>HIO,HClO2>HBrO2>HIO2、HClO3>HBrO3>键HIO3、HClO4>HBrO4>HIO4〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原子半径增大,吸引羟基氧原子的能力依次减小,羟基-O-H键的极性依次减小,所以酸性依次减弱。
〕(3) 在同一周期中,处于最高氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如HClO4>H2SO4>H3PO4〔原因:同一周期中,从左至右元素的非金属性逐渐增强,成酸元素的电负性逐渐增大,吸引电子对的能力逐渐减小,电子偏向成酸元素R一方的程度增大,含氧酸分子中的氢原子的极化程度增大,所以酸性增强.〕查阅相关资料可知此类酸的酸性强弱可以有鲍林规则来初步判断,具体规则如下:鲍林规则[2]:规则Ⅰ:多元酸的逐级电离常数Ka1、Ka2、Ka3…其数值之比为1∶1×10-5∶1×10-10…如:H3PO4 Ka1=7.6×10-3 Ka2=6.3×10-8 Ka3= 4.4×10-13在P区元素中,其它含氧酸如H2SO3,H2CO3,H3AsO4等均符合规则Ⅰ,其它如H5IO6、H6TeO6、H2SiO3不符合规则Ⅰ。
[新版]各类无机酸和无机的酸性性强弱
![[新版]各类无机酸和无机的酸性性强弱](https://img.taocdn.com/s3/m/e15889c581eb6294dd88d0d233d4b14e85243e30.png)
酸性强弱与分子结构的关系一、含氧酸的酸性与分子结构的关系含氧酸的分子中,原子的排列顺序是H—O—R,(有的含氧酸有配位键H—O—R→O)。
含氧酸的酸性强弱主要取决于结构中的两个因素:1.比较中心原子跟氧的化学键的极性和氢氧键的极性,如果R—O键的极性越小,对于氢氧键来说极性就越大,就越容易发生H—O键的断裂,酸性就越强。
我们知道,同周期元素中,随R的电荷数的增大,半径变得越小,R—O键的极性就越小,R—O间的引力加大,含氧酸的酸性就越强。
因此,Si、P、S、Cl的电荷数从4到7,而原子半径减小,所以H4SiO4、H3PO4、H2SO4、HClO4的酸性依次增强。
2.含氧酸分子中未被氢化的氧原子数越多,含氧酸的酸性就越强。
因为,未被氢化的氧原子数越多,因氧的电负性大,中心原子电向未被氢化的氧原子转移,中心原子从O—H键中吸引的电子也就越多,更易离解出H+。
所以,酸性HClO4> HClO3> HClO,因为HClO4分子中有三个未被氢化的氧原子,而次氯酸分子中没有未被氢化的氧原子。
二、无氧酸的酸性强度无氧酸的酸性强度是指氢化物水溶液的酸性强度。
同主族元素的氢化物水溶液的酸性自上而下增强。
如酸性HF<HCl<HBr<HI,H2O<H2S<H2Se<H2Te。
同主族自左至右酸性增强,如H2O<HF,H2S<HCl。
那么又该如何理解?从热力学循环计算可知无氧酸的酸性强度。
无氧酸HX的离解过程分解为:HX 电离过程的总能量可表示为:ϑϑϑϑ321ΔH Y ΔH I D ΔH H +++++=∆从以上分解可知,HX 的电离程度主要与以下因素有关:①离解能D ;②电子亲合能Y ;③阴离子水合能ϑ3ΔH 。
在HF 、HCl 、HBr 、HI 分子中,HF 分子的化学键极性最强,因此,离解能D 特别大,说明吸热多,虽然F 原子的电子亲合能Y 和F 离子水合能ϑ3ΔH 也稍大,但总的热效应仍以离解能D 为主,因此,HF 更难电离,酸性也在同类中最弱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机含氧酸的酸性及氧化性的比较与影响因素摘要:本文讨论了无机含氧酸的氧化性、酸性以及含氧酸的氧化性与酸性的关系。
关键词:金属离子生命活动作用无机含氧酸的酸性及氧化性一直都是我们学习中的一个盲点和难点。
中学时代,我们往往把无机含氧酸与氧化性酸混淆。
通过学习,我们了解到,在不同的环境中,无机含氧酸的酸性及其氧化性不同,不同元素的含氧酸的酸性及氧化性亦不同等等问题,这一直都是我们学习中一个难以攻克的重点,下面让我们一起来探讨这类问题吧。
1无机含氧酸的酸性无机含氧酸可以的分子式为HmROn,其通式可以写成Hl-Rm--〔O-H〕n,〔其中l,m可以为0,n≥0〕,也可写成ROm-nOHn,其中R称为成酸元素,.无机含氧酸在水溶液中的酸强度取决于酸分子中羟基-O-H的电离程度,也可以用Pka值来衡量。
酸分子羟基中的质子在电离过程中脱离氧原子,转移到水分子中的孤对电子对上,其转移的难易程度取决于成酸元素R吸引羟基氧原子电子的能力。
如果成酸无素R的电负性越大,R周围的非羟基氧原子数目越多,则其酸性越强。
原因是成酸元素R的电负性越大,则其偏移O的电子越少,从而减小了O原子周围的电子密度增大的趋势,使得其对质子的吸引减弱,有利于质子的转移;非羟基氧原子越多,则分子周围越易形成离域π键,这种键将成酸R原子及O原子包裹在其中,一方面增强了羟基-O-H键的极性,有利于质子的转移,其次使得整个酸基团周围的空间减小,阻碍了质子与O原子上孤对电子的结合,从而使得酸性增强。
含氧酸的酸性一般存在如下规律[1]:(1)同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如HClO4>HClO3>HClO2>HClO〔原因:从HClO到HClO4非羟基氧原子逐渐增多,羟基-O-H键的极性增强,质子转移程度增强,故酸性增强〕(2)在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自上而下减弱。
如H ClO>HBrO>HIO,HClO2>HBrO2>HIO2、HClO3>HBrO3>键HIO3、HClO4>HBrO4>HIO4〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原子半径增大,吸引羟基氧原子的能力依次减小,羟基-O-H键的极性依次减小,所以酸性依次减弱。
〕(3)在同一周期中,处于最高氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自左至右增强。
如HClO4>H2SO4>H3PO4〔原因:同一周期中,从左至右元素的非金属性逐渐增强,成酸元素的电负性逐渐增大,吸引电子对的能力逐渐减小,电子偏向成酸元素R一方的程度增大,含氧酸分子中的氢原子的极化程度增大,所以酸性增强.〕查阅相关资料可知此类酸的酸性强弱可以有鲍林规则来初步判断,具体规则如下:鲍林规则[2]:规则Ⅰ:多元酸的逐级电离常数Ka1、Ka2、Ka3…其数值之比为1∶1×10-5∶1×10-10…如:H 3PO 4Ka1=7.6×10-3Ka2=6.3×10-8Ka3=4.4×10-13在P 区元素中,其它含氧酸如H 2SO 3,H 2CO 3,H 3AsO 4等均符合规则Ⅰ,其它如H 5IO 6、H 6TeO 6、H 2SiO 3不符合规则Ⅰ。
规则Ⅱ:具有ROm-n (OH )n 形式的酸,其Ka 值与n 的关系是Ka1=105(m-n )-7,m-n 为非羟基氧原子的数目。
第一类:当m-n=0,是很弱的酸,Ka1<10-7;第二类:当m-n=1,是弱酸,Ka1=10-2~10-3;第三类:当m-n=2,是强酸,Ka1=102~103;第四类:当m-n=3,是极强的酸,Ka1>108。
m-n 与酸的强度关系见下表:①表中例外的是H3PO3和H3PO2,对亚磷酸来说,若取P(OH)3的形式,则m-n=0估算其Ka1≈10-7,这是因为亚磷酸是二元酸,其结构简式为HPO(OH)2,它有二个羟基,一个非羟基氧原子,亦即m-n=1,于是:Ka1≈105(m-n)-7=10-2②同理次磷酸(H3PO2)的结构简式为H2PO(OH)为一元酸,它有一个羟基和一个非羟基氧原子,亦即(m-n)=1,所以Ka1≈10-2。
另外,H2CO3的Ka1值过去测得为4.16×10-7,现经纠正后为2×10-4。
③碳酸(H2CO3)违背上述的理由则不同,按它的结构简式Co(OH)2,预计H2CO3的Ka1≈10-2,但实验测得的Ka1≈10-7,原因是溶质CO2在溶液中所形成的“碳酸”是松驰的水化CO2,不是以Co(OH)2形式存在的。
查阅相关资料[3]可知:298K时,1L水中溶1.45克约〔0.033mol〕,溶解在水中CO2的大部分以弱的水合分子存在,只有1%~4%的CO2与H2O 反应生成H2CO3,实验测得:「CO2」/「H2CO3」=600..经改进实验所测得的Ka1≈2×10-4,这与预料的结果相接近。
④H3BO3R的结构结构简式可以写成B〔OH〕3,每个硼原子用3个SP3杂化轨道与3个羟基中的氧原子以共价键结合,但硼酸是一元弱酸也有人认为其为三元弱酸,但它的酸性不是由它本身给出的质子,而是由于它是缺电子分子,接受了来自H2O分子上的孤对电子,而释放出质子,所以才显微弱酸性,所以其不符合上述规则。
补充说明:(不同周期元素的含氧酸之间的关系)纵观p区同族元素最高氧化态含氧酸的酸性,通过不同周期的对比可得出结论[4]:a.第二周期最高氧化态含氧酸的酸性比同族第三周期要强。
如硝酸(103)大于磷酸(10-2);b.第四周期最高氧化态含氧酸的酸性比同族第三周期有的略强如H4GeO4(10-9)大于H4SiO4(10-10);有的相近如H3PO4与H3AsO4(10-2)。
c.第五周期最高氧化态含氧酸的酸性明显地弱于第三、四周期。
如H5IO6(10-3)、H6TeO6(10-7)均为弱酸;2无机含氧酸的氧化性(1)无机含氧酸的氧化性反映的实质是指其成酸元素得电子的能力,成酸元素得电子能力越强,则其氧化性越强。
(2)氧化性酸的强氧化性表现在如下几个方面:①能与排在常见金属活动性顺序表中氢后面的金属单质反应。
如:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O3Ag+4HNO3(稀)=3AgNO3+NO↑+O2↑②能将变价金属从零价氧化成较高的价态。
如:2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O③能与不太活泼的非金属单质反应。
如:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2OC+4HNO3(浓)=CO2↑+4NO2↑+2H2OP+5HNO3(浓)=H3PO4↑+5NO2↑+H2OI2+10HNO3(浓)=2HIO3↑+10NO2↑+4H2O④能多种元素从较低价态氧化到较高介态。
例如:4HNO3(稀)+FeS=Fe(NO3)3+S↓+NO↑+2H2OHClO+H2SO3=HCl+H2SO4(3)氧化性酸的氧化性强弱,一般情况下存在以下规律:①对于同一氧化性酸,浓度越大(或溶液中氢离子浓度越大)氧化性越强。
例如:浓硝酸比稀硝酸氧化性强,稀的高氯酸氧化性很弱,但浓高氯酸却有很强的氧化性。
从电极电势上看,增大酸根或氢离子的浓度,氧化能力增强,例如:硝酸根及氢离子浓度增大(尤其是氢离子浓度)电极电势的值变大。
这可由Nernst方程解释:E=Eθ+0,0591/n lg(ox)m/(red)n〔对于有H+参加的反应,氧化态物质应包括H+和酸根,否则不用考虑H+〕由此方程式可知:增大H+和酸根离子的浓度,均可提高电极电位,从而使酸的氧化性增强。
②同一种元素形成的不同价态的含氧酸,一般低价态的比高价态的氧化性强。
例如:HClO>HClO2>HClO3>HClO4HNO2>HNO3③同周期主族元素形成的最高价含氧酸或相对应的低价含氧酸,从左到右,氧化性依次增强。
例如,高氯酸常温下氧化性很强,硫酸浓度大加热时才表现出强氧化性,磷酸则几乎无氧化性。
HClO3>H2SO3④同族副族元素含氧酸的氧化性随原子序数Z的增加而略有下降。
⑤同主族元素形成的同价态含氧酸,氧化性强弱的规律复杂,一些常见各族元素含氧酸的氧化性强弱顺序如下:HBrO4≈H5IO6>HClO4HBrO3>HClO3>HIO3HClO>HBrO>HBrOH2SeO4≈H6TeO6>H2SO4HNO3>H3AsO4>H3PO4(4)影响含氧酸氧化能力强弱的因素一种含氧酸被还原的难易程度主要取决于四方面的因素[4]:①中心原子(即成酸元素的原子,用R表示)结合电子的能力中心原子电负性愈大,愈容易获得电子而被还原,因而氧化性愈强。
该因素可说明主族元素含氧酸氧化还原能力强弱。
如:HNO3>H2SO4>H3PO4例外情况H2SeO3≈H6TeO6>H2SO4HBrO3>H ClO3>HIO3②中心原子和氧原子之间键(R-O键)的强度含氧酸还原为低氧化态或单质的过程包括R-O键的断裂。
影响R-O键强度的因素有中心原子的电子层结构、成键情况、H+离子反极化作用等。
下面是一些含氧酸根的分子构型及成键情况:分子构型实例孤电子对成键情况直线ClO-、BrO-、IO-3不等性sp3杂化V型ClO2-、BrO2-、IO2-2不等性sp3杂化三角锥形ClO3-、BrO3-、IO3-1不等性sp3杂化正四面体ClO4-、BrO4-0等性sp3杂化SO42-、PO43-、SiO44-0等性sp3杂化,d←pπ键B(OH)44-0不等性sp3杂化,缺电子平面三角形NO3-、CO32-0不等性sp2杂化,∏46正八面体IO65-0sp3d2杂化③在含氧酸还原过程中伴随发生的其它过程的能量效应在实际的反应中常伴随有一些非氧化还原过程的发生,如水的生成、溶剂化和去溶剂化作用、离解、沉淀的生成、缔合等。
这些过程的能量效应有时在总的能量效应中占有很大比重。
如果这些过程放出的净能量愈多,则总反应进行趋势愈大,即含氧酸的氧化性愈强。
④含氧酸根自身的稳定性(其稳定性与酸根的结构构型,对称性及R-O键强度有关)。
如:硫酸根比亚硫酸根稳定,硝酸根比亚硝根稳定,所以氧化性:H2SO4(稀)<H2SO3;HNO3(稀)<HNO2。
3含氧酸的氧化性与酸性的关系(1)同一族过渡元素随周期增加其含氧酸的R-O键增强,使酸稳定性增大,酸性依次增强,氧化性逐渐减弱。
原因:含氧酸中心原子和氧原子之间存在着配位键和d-pπ键,相当于一个双键。
根据组成分子轨道的能量近似原则,生成的d-pπ键的倾向顺序是3d<4d<5d。
,。
