热量衡算
物料衡算和热量衡算

物料衡算和热量衡算1. 引言物料衡算和热量衡算是在工程设计和过程优化中常用的方法和工具。
物料衡算是指通过对物料的进出量、质量和组成等参数的分析,计算出物料的平衡以及物料流动过程中的相关参数。
热量衡算是指通过对热量的进出量、热平衡等参数的分析,计算出热量在系统中的平衡和流动情况。
本文将介绍物料衡算和热量衡算的基本概念、方法和应用。
2. 物料衡算2.1 物料平衡物料平衡是对物料流动系统中物料的进出量进行分析和计算的过程。
物料平衡的基本原理是质量守恒定律,即在封闭系统中,物料的质量不会发生净变化。
物料平衡可用于分析物料的流动路径、损耗情况以及优化物料的使用和回收。
2.2 物料衡算的方法常用的物料衡算的方法包括输入-输出法和组分衡算法。
- 输入-输出法:通过记录系统中物料的进出量,计算出物料的平衡情况。
该方法适用于物料流动较简单且没有复杂反应的系统。
具体步骤包括确定进料和产出物料的量和质量,计算进出物料的差值,并检查误差,使其趋近于零。
- 组分衡算法:通过对物料组分的平衡进行计算,得到物料的进出量。
该方法适用于需要考虑物料成分变化的系统。
具体步骤包括确定进料和产出物料的组分及其相对含量,计算进出物料组分的差值,并检查误差。
2.3 物料衡算的应用物料衡算在化工、冶金、环境工程等领域有广泛的应用,例如: - 在化工生产中,物料衡算可以用于优化原料的使用和能源的消耗,减少产品的损耗和废物的排放。
- 在冶金过程中,物料衡算可以用于优化矿石的选矿和冶炼过程,提高生产效率和产品质量。
- 在环境工程中,物料衡算可以用于分析和优化废物处理和排放过程,减少对环境的污染。
3. 热量衡算3.1 热量平衡热量平衡是对热量在系统中的分布和流动进行分析和计算的过程。
热量平衡的基本原理是热力学第一定律,即能量守恒定律。
热量衡算可以用于分析热量的传递、损失和利用情况,以及优化热能的使用和节约。
3.2 热量衡算的方法常用的热量衡算的方法包括输入-输出法和能量平衡法。
化工原理物料衡算和热量衡算

化工原理物料衡算和热量衡算引言化工工程涉及许多物料的处理和转化过程,同时也需要考虑热量的平衡。
物料衡算和热量衡算是化工原理的重要内容,对于工程实践和过程优化具有重要的意义。
本文将介绍化工原理中的物料衡算和热量衡算的基本原理和计算方法。
物料衡算物料衡算是指对于化工工程中物料流动和转化过程的计算和分析。
在化工工程中,物料的流动和转化是实现各种反应和分离操作的基础,因此正确的物料衡算是保证工程设计和操作的关键。
在物料衡算中,我们通常需要考虑以下几个方面: 1. 物料的质量衡算:即对物料的质量输入和输出进行计算和分析。
对于物料的质量衡算,我们需要注意物料流动的平衡原则,即质量的输入必须等于输出。
2. 物料的能量衡算:即对物料的能量输入和输出进行计算和分析。
能量的输入和输出会影响物料的温度和相变过程,因此在能量衡算中需要考虑物料的热力学性质。
3. 物料的流动速度衡算:即对物料流动速度进行计算和分析。
物料的流动速度决定了反应和分离操作的效率,因此在物料衡算中需要合理地确定流量和速度的关系。
4. 物料的浓度衡算:即对物料中组分浓度的计算和分析。
物料的浓度会影响其反应和分离的速率和效果,因此在物料衡算中需要考虑不同组分浓度的变化规律。
物料衡算通常使用质量守恒和能量守恒等基本原理进行计算。
同时,还可以利用化学反应平衡的原理和质量流动的平衡原则进行衡算过程中的参数确定。
热量衡算热量衡算是化工工程中热力学过程的计算和分析。
在化工工程中,热量的平衡是保证反应和分离操作能够正常进行的基础。
热量衡算需要考虑以下几个方面: 1. 热量的输入和输出:即对于热量的输入和输出进行计算和分析。
在化工工程中,我们通常需要对热量的输入和输出进行平衡,以保证工程操作的稳定性。
2. 热量的传递和转化:即对于热量的传递和转化过程进行计算和分析。
热量的传递可以通过传导、对流和辐射等方式进行,因此在热量衡算中需要考虑传热方式的影响。
3. 热平衡的计算:即对于反应和分离过程中热量平衡的计算和分析。
热量衡算

热量衡算1计算方法与原则1.1热量衡算的目的及意义热量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小、所处理物料的性质及工艺要求再选择传热面的形式、计算传热面积、确定设备的主要工艺尺寸。
传热所需的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
1.2热量衡算的依据及必要条件热量衡算的主要依据是能量守恒定律,其数学表达式为Q1+ Q2+Q3=Q4+Q5+Q6 式1其中:Q1——物料带入到设备的热量,kJQ2——加热剂或冷却剂传给设备和所处理物料的热量,kJQ3——过程热效应,kJQ4——物料离开设备所消耗的热量,kJQ5——加热或冷却设备所消耗的热量,kJQ6——设备向环境散失的热量,kJQ1(Q4)=Σ mC P(t2- t0) kJ式2m——输入或输出设备的物料质量,kgC P——物料的平均比热容,kJ/(kg•℃)t2——物料的温度,℃t0——基准温度,℃Q5=Σ C P M (t2-t1) kJ式3M——设备各部件的质量,kgC P——设备各部件的比热容,kJ/(kg•℃)t1——设备各部件的初始温度,℃t——设备各部件的最终温度,℃2Q5+Q6=10%Q总式4热量衡算是在车间物料衡算的结果基础上而进行的,因此,车间物料衡算表是进行车间热量衡算的首要条件。
其次还必须收集有关物质的热力学数据,例如比热容,相变热,反应热等。
本设计还将涉及到的所有物料的热力学数据汇总成表4,以便于后期的计算。
1.3热量衡算基准因为物料衡算计算的是各个岗位的天处理量,所以热量衡算计算的也是某个设备天换热介质消耗量,同时温度基准采用的是0℃做基准。
当然,进行传热面积校核时,是根据批处理量计算。
2全车间物料热力学数据的估算2.1所用纯化合物比热的推算0i i pMc n C ∑=式 5式中M ——化合物分子量;n i ——分子中同种元素原子数; c i ——元素的原子比热容,kJ/(kg•℃)查《制药工程工艺设计》P111,得到原子的摩尔热容相关数据,见表1表1 元素原子的摩尔热容单位:kcal/( kmol•℃)(当物质为固体时,各原子的C a 取值近似值)原子 C a 原子 C a 原子 C a 碳C 2.8 氧O 6.0 氮N 2.6 氢H4.3硫S7.4其他8.0(当物质为液体时,各原子的C a 取值近似值)而在实际生产的过程中遇到的物质大多是混合物,极少数的混合物有实验测定的热容数据,一般都是根据混合物内各种物质的热容和组成进行推算的,其中杂质的含量极少,热效应可以忽略不计。
热量衡算

热量衡算主要依据是能量平衡方程ΣQ in=ΣQ out +ΣQ其中ΣQ in输入设备流量ΣQ out +输出设备流量ΣQ为损失流量对于连续系统:Q+W=ΣH out +ΣH其中。
Q为设备热负荷W为输入系统的机械能ΣH out 离开设备的各物料焓之和ΣH进入设备的各物料焓之和在进入全厂能量横算时,是以单位设备为基本单位,考虑由机械能转换、化学反应释放和单纯的物理变化带来的能量变化,最终对全工艺段进行系统级的能量平衡计算,进而用于指导节能降耗设计工作。
热量衡算任务1、确定加热剂和冷却剂的用量2、计算有设备传递的热量,为设备设计提供依据3、提高热量应用水平4、最终确定总需求能量和能量费用各工段其热量衡算如下萃取精馏段:第一萃取精馏塔物流焓变一览表流股名反应前物流反应后物流温度(℃)60/6044/110压力(Kg/sqcm)7.767/6.118 5.099/6.099质量流量(Kg/hr)41600/2710017320/295280焓值(KW)-2575.31068.09热负荷一览表Q热负荷(Kw)—8296.9热量平衡一览表Q IN OUT Error -8296.9 -2575.3 1068.09 -1.241汽提塔物流焓变一览表流股名反应前物流反应后物流温度(℃)118.1/110.1/135.0108.4/134.4压力(Kg/sqcm)7.000/6.099/5.166 5.166/5.167质量流量(Kg/hr)37970.026/295280.000/7.04087E+623999.999/7.35012E+6焓值(KW)14050311412557热负荷一览表Q热负荷(Kw)—9789.0065热量平衡一览表Q IN OUT Error -9789.0065 1405031 1412557 -0.00533闪蒸塔物流焓变一览表流股名反应前物流反应后物流压力(Kg/sqcm) 5.167 5.166/5.166质量流量(Kg/hr)7.35012E+6202622.872/7.04087E+6焓值(KW)1407162.091435001.24热负荷一览表Q热负荷(Kw)46985.4228热量平衡一览表Q IN OUT Error 46985.4228 1407162.09 1435001.24 -0.0194第二萃取精馏塔物流焓变一览表流股名反应前物流反应后物流压力(Kg/sqcm) 5.000/5.160 3.071/3.059质量流量(Kg/hr)36000.000/23999.99937970.026/22030.029焓值(KW)3895.678174103.97348热负荷一览表Q热负荷(Kw)-4281.0457热量平衡一览表Q IN OUT Error -4281.0457 3895.67817 4103.97348 -0.0507545第一精馏塔物流焓变一览表流股名反应前物流反应后物流温度(℃)92.241.6/55.8压力(Kg/ sqcm) 3.059 5.099/5.099质量流量(Kg/hr)22030.029990.029/21040.000焓值(KW)12503.739251.09429热负荷一览表Q热负荷(Kw)-516.35568热量平衡一览表Q IN OUT Error -516.35568 12503.73 9251.09429 0.26013323第二精馏塔物流焓变一览表流股名反应前物流反应后物流(顶/釜)温度(℃)70.143.1/55.4压力(atm) 5.92 4.74/5.42质量流量(Kg/hr)19758.483419087.1667/671.3167焓值(KW)11111.0668 8876.86583热负荷一览表(KW)Q热负荷-9642.5248热量平衡一览表(KW)Q IN OUT Error -9642.524811111.06688876.86583-0.201079。
热量衡算

热量衡算与热交换计算热量衡算与热交换计算一、热量衡算传热计算根据总传热方程进行:Q=KA△tm对于一个热交换器,传热计算的内容有两种,一为设计计算,即根据给定的传热量,确定热交换器的几何尺寸和结构参数;二为校核计算,即对某些热交换器,根据它的尺寸和结构进行校核,看其能否满足传热量的要求。
这两种计算的关键都在于传热面积是否合适,计算的基本依据是总传热方程以及与之相关的热量衡算式,在第四节中,已对总传热方程进行了较为详细的讨论,下面介绍热交换中的热量衡算式。
当热损失为零时,对热交换器作热量衡算可得到单位时间的传热量,此传热量又叫热负荷,即式3-20中的传热速率Q。
热负荷分为两种,即工艺热负荷和设备热负荷,工艺热负荷是指工艺上要求的在单位时间内需要对物料加入或取出的热量,用QL表示,单位为W。
设备热负荷是热交换器所具备的换热能力,所以设备热负荷也就是热交换器的传热速率Q。
当热损失不可忽略时,为满足工艺要求,Q应大于QL。
由热量衡算得到的是工艺热负荷QL。
如果流体不发生相变化,比热取平均温度下的比热,则有:QL=whcph(T1-T2)=wccpc(t2-t1) ( 3-29)式中w----流体的质量流量,kg/s;cp----流体的平均定压比热,kJ/(kg•K);T----热流体温度,K;t----冷流体温度,K;(下标h和c分别表示热流体和冷流体,下标1和2表示热交换器的进口和出口)式3-29是热交换器的热量衡算式,也称为热平衡方程。
若流体在换热过程中有相变,例如饱和蒸汽冷凝成同温度冷凝液时,则有:QL=whr=wccpc(t2-t1) (3-30)式中wh----饱和蒸汽的冷凝速率,kg/s;r----饱和蒸汽的冷凝潜热,kJ/kg;当饱和蒸汽在热交换器中冷凝后,冷凝液液温度继续下降到T2,两部分热量(即潜热和显热)要加起来计算,这时:QL=wh[r+cph(Ts-T2)]=wccpc(t2-t1)式中cph-----冷凝液的比热,kJ/kg•K;Ts------冷凝液饱和温度,K。
热量衡算
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
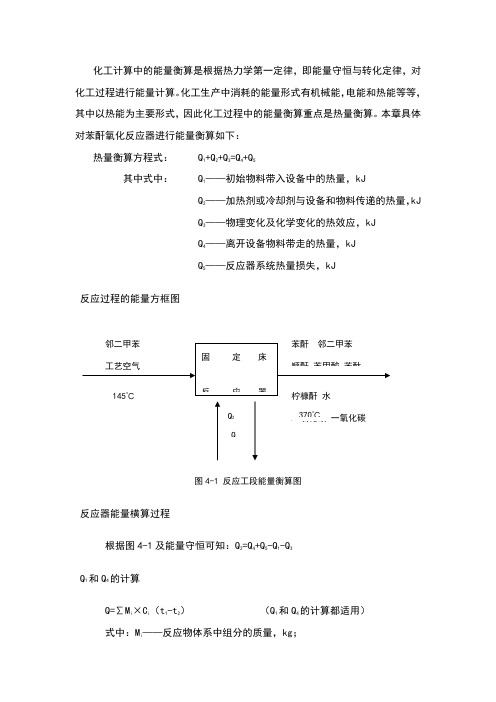
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q1+Q2+Q3=Q4+Q5其中式中: Q1——初始物料带入设备中的热量,kJQ2——加热剂或冷却剂与设备和物料传递的热量,kJQ3——物理变化及化学变化的热效应,kJQ4——离开设备物料带走的热量,kJQ5——反应器系统热量损失,kJ反应过程的能量方框图图4-1 反应工段能量衡算图反应器能量横算过程根据图4-1及能量守恒可知:Q2=Q4+Q5-Q1-Q3Q1和Q4的计算Q=∑Mi×Ci(t1-t2)(Q1和Q4的计算都适用)式中:Mi——反应物体系中组分的质量,kg;C i ——组分i 在0-T℃时的平均比热容,KJ/; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)表4-1 各物相平均比热容所以: ()21i i 4t C M Q t -=∑=××(370-145)+××225+××225+××225+××225+××225+××225+××225+××225+××225+××225=.4kJ 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
物料化学变化过程,除化学反应外,往往伴随着物料状态变化热效率,但本工艺流程中物理过程热效率较低,可以忽略不计,该过程皆为放热反应,则过程热效率可以由下式计算:主反应:C 8H 10+3O 2→C 8H 4O 3+3H 2O + Q 3-1=×103×=×103kJ/h副反应:CH 3C 6H 4CH 3+→C 4H 2O 3(顺酐)+4CO 2+4H 2O + Q 3-2=×103×=×103kJ/hCH 3C 6H 4CH 3+3O 2→C 6H 5COOH (苯甲酸)+CO 2+2H 2O +Q3-3=×103×=×103kJ/hCH3C6H4CH3+2O2→C8H6O2(苯酞)+2H2O +Q3-4=×103×=×103kJ/hCH3C6H4CH3+→C5H5O3(柠槺酐)+3CO+3H2O +Q3-5=×103×=×103kJ/hCH3C6H4CH3+→8CO+5H2O +Q3-6=×103×=×103kJ/hCH3C6H4CH3+→8CO2+5H2O +Q3-7=×103×=×103kJ/h 继而得到:Q 3 = Q3-1+Q3-2+Q3-3+Q3-4+Q3-5+Q3-6+Q3-7 =×103kJ/hQ5的计算该反应中的热损失按5%计算,即:Q 5=5%×(Q1+Q3)=5%×(0+×103)=×103kJ/hQ2的计算Q2为熔岩移出反应器的热量,由反应器热量守恒可知:Q 2=Q4+Q5-Q1-Q3=.8kJ/h反应器能量衡算表根据以上计算列出氧化反应工段能量衡算表格如下:表4-2 反应工段能量衡算表(吸收热量为“+”,释放热量为“-”)。
热量衡算

i dAi
1
1
b
1
KdA0
0dA0 dAm
i dAi
若以外表面为基准
1 1 bdA0 dA0
K
0
dAm
i dAi
dA d dl
1 1 bd0 d0
K 0 dm i di
或K
1
1 bd0 d0
0 dm idi
同理:
——基于外表面积总传热系数计算公式
Ki
1
1 bd0
d0
i dm i di
五、传热面积
Q A
K tm
其中:
Q WCCP,C (t2 t1) WhCP,h (T1 T2 )
六、壁温的计算
已知:管内、外流体的平均温度ti、to,忽略管壁热阻
求:壁温tW
to tw tw ti
1 Rs0
0
1 Rsi
i
例:在列管换热器中,两流体进行换热。若已知管内、
外流体的平均温度分别为170℃和135℃;管内、外流体的对
依据:总传热速率方程和热量恒算
一、热量衡算
热量衡算是反映两流体在换热过程中温度变化的相互关系 对于间壁式换热器,假设换热器绝热良好,热损失可忽略 则在单位时间内的换热器中的流体放出的热量等于冷流体吸 收的热量。即:
Q WhcphT1 T2 Wccpct2 t1
——换热器的热量衡算式 应用:计算换热器的传热量
(2)逆流可以节省冷却介质或加热介质的用量。 所以,换热器应当尽量采用逆流流动,尽可能避免并流流动。 在某些生产工艺有特殊要求时,如要求冷流体被加热时不得超过
某一温度或热流体冷却时不得低于某一温度,应采用并流操作。 当换热器有一侧流体发生相变而保持温度不变时,就无所谓并流
第5章 热量衡算

27
②积分稀释热 恒温恒压下,将一定量的溶剂加入到含1摩尔溶质的溶液 中,形成较稀的溶液时所产生的热效应 称为积分稀释热,简称稀释热。 显然, 溶液由一种浓度稀释至另一种浓度的积分稀释热
= 两种不同浓度下的积分溶解热之差
定设备的主要工艺尺寸。
∵在药品生产中,无论是进行物理过程的设备,还是进 行化学过程的设备,大多存在一定的热效应, ∴通常要进行能量衡算
2 热量衡算。
* 通过热量衡算确定如下设计参数:
⑴设备的热负荷Q
包括:换热器、反应器、塔设备等
进一步确定换热面积 F
⑵ 加热剂、冷却剂的用量 能量衡算的依据: ⑴ 物料衡算结果 ⑵ 物料的热力学数据: 定压比热、相变热、反应热等 3
稀释过程的浓度变化热或积分稀释热为
Qp 60.79 28.09 32.70kJ
29
例5-1 在25℃和1.013105Pa下,用水稀释78%的硫酸水 溶液以配制 25% 的硫酸水溶液。拟配制 25% 的硫酸水 溶液1000kg,试计算: (1) 78%的硫酸溶液和水的用量; (2) 配制过程中H2SO4的浓度变化热。 解:(1)78%的硫酸溶液量和水的用量 设GH2SO4为78%的 (a) 硫酸溶液的用量,GH2O为水的用量,则
19
蒸发、熔融、升华过程要克服液体或固体分子间的相互 吸引力∴这些过程均为吸热过程,按式(5-1)中的符号规 定,其相变热为负值;
反之,冷凝、结晶、凝华过程的相变热为正值。
各种纯化合物的相变热可从有关手册、文献中查得。
20
⑵ 浓度变化热
恒温恒压下,溶液因浓度发生改变而产生的热效应,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 能量衡算2.1 能量衡算概述物料衡算完成后,对于没有传热要求的设备,可以由物料处理量,物料的性质及工艺要求进行设备的工艺设计,以确定设备的型式,台数,容积以及重要尺寸。
对于有传热要求的设备则必须通过能量衡算,才能确定设备的主要工艺尺寸。
无论进行物理过程的设备或是化学过程的设备,多数伴有能量传递过程,所以必须进行能量衡算。
2.2 能量衡算目的对于新设计的生产车间,能量衡算的主要目的是为了确定设备的热负荷。
根据设备热负荷的大小,所处理物料的性质及工艺要求在选择传热面的型式,计算传热面积,确定设备的主要尺寸。
传热所需要的加热剂或冷却剂的用量也是以热负荷的大小为依据而进行计算的。
对于有些伴有热效应的过程,其物料衡算也要通过与能量衡算的联合求解才能得出最后的结果。
2.3 能量衡算依据能量衡算的主要依据是能量守恒定律。
能量守恒定律是以车间物料衡算的结果为基础而进行的。
2.4 能量衡算过程 2.4.1 反应釜的热量衡算反应工段的热量衡算主要体现在反应釜和夹套。
对于有传热要求的的设备,其热量衡算为:654321Q Q Q Q Q Q ++=++;式中 1Q —物料带入到设备的热量kJ ; 2Q —加热剂传给设备的热量kJ ; 3Q —物理变化及化学反应的热效应kJ ; 4Q —物料离开设备所带走的热量kJ ; 5Q —消耗于提高设备本身温度的热量kJ ; 6Q —设备向环境散失的热量kJ 。
物料热量衡算以天为单位。
1Q 与4Q 的计算1Q 与4Q 均可按照下式计算:()tkJ mc Q Q p ∑=41式中m —输入或输出设备的物料量,kgp c —物料的平均比热容,()C kg kJ ︒⋅/t —物料的温度,℃。
该式的计算标准是标准状态,即Pa C 3101013.10⨯︒及为计算标准。
固体和液体的比热容可以采用下式计算:Mn c c p∑⋅=α184.4; []1式中:αc —元素的原子比热容,()C kg kJ ︒⋅/ ;n —分子中同一原子的原子数;M —化合物的分子量,kmol kg /。
相关元素的原子比热容值: []1 碳C )/(8.21C kg kJ c ︒⋅=α; 氢H C kg kJ c ︒⋅=/3.42α; 氧O C kg kJ c ︒⋅=/0.63α 计算比热容得到:丙烯酸正丁酯 C kg kJ c p ︒⋅=⨯+⨯+⨯⨯=/720.2128.623.4128.27184.41甲基丙烯酸甲酯 C kg kJ c p ︒⋅=⨯+⨯+⨯⨯=/527.2100.623.488.25184.42醋酸乙烯酯 C kg kJ c p ︒⋅=⨯+⨯+⨯⨯=/384.286.623.468.24184.43丙烯酸 C kg kJ c p ︒⋅=⨯+⨯+⨯⨯=/185.272.623.448.23184.44同理计算出水的比热容 C kg kJ c p ︒⋅=/394.35。
有前面物料平衡计算可知kg m 6.146301=,kg m 7.147022=,kg m 40003=,kg m 7.6664=,kg m 500005=。
反应前的温度为C T ︒=251,反应后的温度为C T ︒=402。
1551441331221111T c m T c m T c m T c m T c m Q p p p p p ++++=)394.350000185.27.666384.2400025527.27.14702720.26.14630(⨯+⨯+⨯+⨯⨯+⨯=kJ 710528.1⨯=同理:kJ Q 7410139.440394.350000403.33333595.2⨯=⨯⨯+⨯⨯=。
过程热效应的计算聚合反应的聚合热可按聚合过程中双键的断裂和单键的形成,即π键的断裂和σ键的形成。
π键的键能为mol kJ E /2.608=π,σ键的键能为mol kJ E /352=σ。
故π键断裂后形成喷雾干燥阶段热量衡算σ键后释放的能量为:mol kJ E E H /8.952.60835222=-⨯=-=∆-πσ []2参与聚合反应的反应物的物质的量为:丙烯酸正丁酯 kmol n BA n 1141286.14630==-; 甲基丙烯酸甲酯 kmol n MMA 1471007.14702==;醋酸乙烯酯 kmol n 47864000==醋;丙烯酸 kmol n p 3.9727.666==;该反应是以上单体进行的无规共聚反应,单体本身都含有一个双键,反应后都形成了单键。
()()kJ H n Q 731004.38.953.947147114⨯=⨯+++=∆-=∑ 消耗在加热或冷却设备上的热量5Q ,对于间歇反应可忽略。
设备向环境散失的热量6Q 可按下式计算:()t T T A Q W ∑-=α6 []1式中A —表示散热面积,2m ;α—表示散热系数,()C h m kJ ︒⋅⋅2/; W T —表示设备表温,C ︒; T —表示环境温度,C ︒; t —表示反应时间,h 。
22268.256.26.29.214.3297.0297.0m D D H A =⎪⎭⎫ ⎝⎛⨯+=⎪⎭⎫ ⎝⎛+=π;()C h m kJ T W ︒⋅⋅=⨯+=+=2/364018.08.2805.08α()kJ Q 561092.8820403668.256⨯=⨯-⨯⨯⨯=;加热剂传给设备的热量,2Q 值为正表示需要对设备进行加热,负值为冷却。
kJQ Q Q Q Q 67757316421040.31004.310528.11092.810139.4⨯-=⨯-⨯-⨯+⨯=--+=即 需要冷却。
利用夹套通冷凝水冷却。
冷却水常温进水C T ︒=20'1,出水温度C T ︒=40'2; 水的比热容 C kg kJ c p ︒⋅=/394.35; 所需冷却水的量 ()kg T T c Q p 3'1'252101.50⨯=--=; 即每天需要的冷却水量为kg 3101.50⨯。
表2-1 反应釜工段能量衡算一览表2.4.2 喷雾干燥工段能量衡算喷雾干燥阶段的热量衡算,主要是体现在喷雾干燥塔和空气加热器上。
1 喷雾干燥塔的热量衡算。
以小时为计量单位。
取湿物料进口温度 401=θ℃,物料出口温度=2θ90℃; 空气进加热器前温度0t =25℃,热空气进口温度3001=t ℃; 热空气出口温度1002=t ℃。
产品进料量 h kg GG /1047.32431⨯==,设空气需要量为L 。
由物料热量衡算得 损补Q Q Q Q Q +++=321 []2 式中 补Q —需补充能量; 1Q —汽化水分耗热 2Q —物料升温耗热 3Q —废气带走热量 损Q —热量损失 需补充能量补Q 的计算()()011t t H c c L Q pv pg -+=补 []2;式中 pg c —干气比热容,空气为()C kg kJ ︒⋅/01.1; pv c —水蒸气比热容,水汽为)/(88.1C kg kJ ︒⋅; 1H —空气进口处的湿含量干气kg O kgH /2;()()()()L H L t t H c c L Q pv pg .32932030088.101.11011=-+=-+=补汽化水分耗热1Q 的0计算1Q =)())((1201202θθpl pv pl pv c t c r W c t c r H H L -+=-+-式中 W —水分蒸发量h kg /;0r —0℃水的汽化热,取()C kg kJ ︒⋅/2500; pv c —水蒸气比热容,水汽为)/(88.1C kg kJ ︒⋅; pl c —水的比热容,取()C kg kJ ︒⋅/18.41Q =)4018.410088.12500(1008.23⨯-⨯+⨯⨯=5.24W 610⨯;物料升温耗热2Q 的计算 2Q =)(1221θθ-pm c G ;其中2pm c 为物料的比热容 22X c c c pl ps pm +==2.595kJ/kg;2Q =595.2)4090(1047.33⨯-⨯⨯=W 51050.4⨯;废气带走热量3Q 的计算))((1213t t H c c L Q pv pg -+==L ×(1.01+1.88×0.02)×(100-25)=83.8L ; 热损失损Q 的计算按预热器热量的10%计算 1.10Q Q ⨯=损=W 51024.5⨯;损补Q Q Q Q Q +++=321;得 L L 8.831024.51050.41024.53.293556+⨯+⨯+⨯=; 空气消耗量 h kg L /1096.24干气⨯=; 出口空气湿含量 干气kg O kgH H LWH /091.0212=+=。
空气加热热量衡算 2 翅片式加热器 []3利用翅片式加3热器将干空气由C t ︒=251加热到C t ︒=1302所需的热量为()()h kJ c H L Q pl /102.3105009.102.12960025130160'1⨯=⨯⨯⨯⨯=-+==kW 889;耗能为kW 889燃气加热器 []4用燃气加热器将空气由C t ︒=1302加热到C t ︒=3003所需的热量()()kWh kJ c H L Q p 3620'21047.1/1029.517003.102.1296001303001⨯=⨯=⨯⨯⨯=-+=即燃气消耗功率为kW 31047.1⨯[]1 杨基和,蒋培华主编.化工工程设计概论.北京:中国石化出版社.2005.8 []2潘祖仁主编.高分子化学.北京:化学工业出版社.2007.4 []3 王喜忠,余才渊主编.喷雾干燥.北京:化学工业出版社.2004,3[]4匡国柱,史启才主编.化工单元过程及设备课程设计.北京:化学工业出版.2005.1。
