大学化学原理 第十四章
大学无机化学第十四章试题及答案

第十五章氮族元素总体目标:1.掌握氮和磷单质、氢化物、卤化物、氧化物、含氧酸及其盐的结构、性质、制备和用途2.了解砷、锑、铋单质及其化合物的性质递变规律各节目标:第一节氮的单质掌握N2的结构;氮与非金属、金属的反应;氮气的实验室制法和工业制法第二节氮的成键特征通过氮的价层电子结构,了解它的成键特征第三节氮的氢氧化物1.掌握NH3的工业制法和实验室制法以及它的结构2.了解NH3的物理性质;掌握它的配位反应、取代反应、氨解反应和氧化反应以及用途;铵盐的水解性和热稳定性。
3.了解联氨、羟胺、叠氨酸的结构和性质第四节氮的氧化物—氧化图2.掌握氮的氧化物〔N2O、NO、N2O3、NO2、N2O4、N2O5〕的结构和重要性质2及其盐的制备、结构、性质3及其盐的结构和性质;硝酸盐热分解的一般规律;王水的成分和性质第五节磷单质1.掌握磷原子的价电子层结构;磷的成键特征2.掌握磷的工业制法、同素异形体、化学性质及用途第六节磷的化合物4O6、P4O10和H3PO4的结构、制备、性质和用途;磷酸盐的溶解性3.了解次磷酸、亚磷酸、焦磷酸、偏磷酸化学式的书写、命名和主要性质;卤化磷、硫化磷的重要性质第七节砷、锑、铋了解砷、锑、铋单质及其化合物的性质递变规律习题一选择题1. 氮气制备的方法是〔〕A. 将硝酸氨NH4NO3加热B. 将亚硝酸氨NH4NO2加热C. 将氯气与氨气混合D. B和C2. 以下化合物中与水反应放出HCl的是〔〕A. CCl4B. NCl3C. POCl3D. Cl2O73. NO2溶解在NaOH溶液中可得到〔〕A. NaNO2和H2OB. NaNO2、O2和H2OC. NaNO3、N2O5和H2OD. NaNO3、NaNO2和H2O4. 硝酸盐加热分解可以得到单质的是〔〕A. AgNO3B. Pb〔NO3〕2C. Zn〔NO3〕2D. NaNO35. 以下分子中具有顺磁性的是〔〕A. N2OB. NOC. NO2D. N2O3π离域键的是〔〕(吉林大学《无机化学例题与习题》) 6. 以下分子中,不存在43NA. HNO3B. HNO2C. N2OD. -37. 分子中含d—p反馈π键的是〔〕(吉林大学《无机化学例题与习题》)A. HNO3B. HNO2C. H3PO2D. NH38. 以下物质中酸性最强的是〔〕A. N2H4B. NH2OHC. NH3D. HN39. 以下酸中为一元酸的是〔〕(吉林大学《无机化学例题与习题》)A. H4P2O7B. H3PO2C. H3PO3D. H3PO410. 以下各物质按酸性排列顺序正确的选项是〔〕(吉林大学《无机化学例题与习题》)A. HNO2>H3PO4>H4P2O7B. H4P2O7>H3PO4>HNO2C. H4P2O7>HNO2>H3PO4D. H3PO4>H4P2O7>HNO211. 以下物质中,不溶于氢氧化钠溶液的是〔〕(吉林大学《无机化学例题与习题》)A. Sb(OH)3B. Sb(OH)5C. H3AsO4D. Bi(OH)312. 加热分解可以得到金属单质的是〔〕(吉林大学《无机化学例题与习题》)A. Hg(NO3)2B. Cu(NO3)2C. KNO3D. Mg(NO3)213. NH4NO3受热分解产物为〔〕A. NH3+HNO2B. N2+H2OC. NO+H2OD. N2O+H2O14. 以下物质中受热可得到NO2的是〔〕A. NaNO3B. LiNO3C. KNO3D. NH4NO315. 以下氢化物中,热稳定性最差的是〔〕A. NH3B. PH3C. AsH3D. SbH316. 遇水后能放出气体并有沉淀生成的是〔〕(吉林大学《无机化学例题与习题》)A. Bi(NO3)2B. Mg3N2C. (NH4)2SO4D. NCl317. 以下物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是〔〕A. K2Cr2O7B. NaBiO3C. (NH4)2S2O8D. H5IO618. 以下化合物中,最易发生爆炸反应的是〔〕A. Pb(NO3)2B. Pb(N3)2C. PbCO3D. K2CrO419. 欲制备NO气体,最好的实验方法是〔〕A. 向酸化的NaNO2溶液中滴加KI溶液B. 向酸化的KI溶液中滴加NaNO2溶液C. Zn粒与2mol·dm-3HNO3反应D. 向双氧水中滴加NaNO2溶液20. N2和C2H2分子中都含有 键,但的化学性质不活泼。
(完整版)大学分析化学知识点总结

分析化学第一章绪论【基本内容】本章内容包括分析化学的任务和作用;分析化学的发展;分析化学的方法分类(定性分析、定量分析、结构分析和形态分析;无机分析和有机分析;化学分析和仪器分析;常量、半微量、微量和超微量分析;常量组分、微量组分和痕量组分分析);分析过程和步骤(明确任务、制订计划、取样、试样制备、分析测定、结果计算和表达);分析化学的学习方法。
【基本要求】了解分析化学及其性质和任务、发展趋势以及在各领域尤其是药学中的作用;分析方法的分类及分析过程和步骤。
第二章误差和分析数据处理【基本内容】本章内容包括与误差有关的基本概念:准确度与误差,精密度与偏差,系统误差与偶然误差;误差的传递和提高分析结果准确度的方法;有效数字及其运算法则;基本统计概念:偶然误差的正态分布和t分布,平均值的精密度和置信区间,显著性检验(t检验和F检验),可疑数据的取舍;相关与回归。
【基本要求】掌握准确度与精密度的表示方法及二者之间的关系,误差产生的原因及减免方法,有效数字的表示方法及运算法则;误差传递及其对分析结果的影响。
熟悉偶然误差的正态分布和t分布,置信区间的含义及表示方法,显著性检验的目的和方法,可疑数据的取舍方法,分析数据统计处理的基本步骤。
了解用相关与回归分析处理变量间的关系。
第三章滴定分析法概论【基本内容】本章内容包括滴定分析的基本概念和基本计算;滴定分析的特点,滴定曲线,指示剂,滴定误差和林邦误差计算公式,滴定分析中的化学计量关系,与标准溶液的浓度和滴定度有关的计算,待测物质的质量和质量分数的计算;各种滴定方式及其适用条件;标准溶液和基准物质;水溶液中弱酸(碱)各型体的分布和分布系数;配合物各型体的分布和分布系数;化学平衡的处理方法:质子平衡、质量平衡和电荷平衡。
【基本要求】掌握滴定反应必须具备的条件;选择指示剂的一般原则;标准溶液及其浓度表示方法;滴定分析法中的有关计算,包括标准溶液浓度的计算、物质的量浓度和滴定度的换算、试样或基准物质称取量的计算、待测物质质量和质量分数的计算;水溶液中弱酸(碱)和配合物各型体的分布和分布系数的含义及分布系数的计算;质子平衡的含义及其平衡式的表达。
大学有机化学重点知识总结第十四章β-二羰基化合物

2C2H5OH H2SO4
O
COOC2H5 COOC2H5
1 C2H5ONa 2 H
COOC2H5
CH2CH2COOC2H5 CH2CH2COOC2H5
1 C2H5ONa 2 H
O COOC2H5
下列化合物能发生Claisen酯缩合反应的为 (b
COOC2H5 a c CH3CH2COOC2H5 b
CH2Br CH2Br + 2 Na [CH(COOC2H5)2]
+
CH2CH(CO2C2H5)2 CH2CH(CO2C2H5)2
①NaOH / H2O ②H 3+O
CH2CH2CO2H CH2CH2CO2H
3. 环烷酸的合成
O
3~6元环
O
H5C2OC H5C2OC ①C2H5O Na+ H2C ② BrCH CH CH Br CHCH2CH2CH2Br C2H5O Na+ 2 2 2 H5C2OC H5C2OC O O
O O
烷基化试剂:卤代烃
CH3CCH2COC2H5
① C2H5ONa ② CH3CH2CH2Br CH3CCHCOC2H5
CH2CH2CH3
① C2H5ONa ② CH3I
OCH3 CH3CCCOOC2H5 CH2CH2CH3
取代丙酮
OCH3 CH3CCCOOC2H5 CH2CH2CH3
① 稀OH ,②H+, ③△ 酮式分解 ① 40% OH ,②H+ 酸式分解
O CH3CCHCH2CH2CH3 CH3 CH3CH2CH2CHCOOH CH3
乙酸衍生物
与二卤代烃反应:
CH3COCH2COOC2H5
有机化学_第14章糖类化合物

HOH2C HO HO
4
O OH
1
OH
β-D-(+)-吡喃葡萄糖的构象中,体积大的取代基-OH和CH2OH,都在 键;而在α-D-(+)-吡喃葡萄糖中有一个-OH在a键上。故β型的构象更 稳定,因而在平衡体系中的含量多于α-D-(+)-吡喃葡萄糖。 所有的 D-吡喃己醛糖的优势构象为4C1 型椅式构象。 因此β-D-葡萄糖在自然界有最广泛的存在 !
第二节
单糖
1、根据分子中所含碳的个数,单糖可分为己糖、戊糖等。 2、分子中含醛基的糖称为醛糖,含有酮基的糖称为酮糖。 例:
CHO 2 CHOH
3 4 1 1 2 3 4
CH2OH C=O CHOH CHO 2 CHOH
3 4 1
CHOH
CHOH 5 CHOH 6 CH2OH
己醛糖 4个* C
16个对映异构
5、脱水及显色反应
了解
单糖与醇一样在浓酸的作用下可发生分子内的脱水反应生 成α-呋喃甲醛(也称糠醛)类化合物
呋喃甲醛类化合物可以和酚或芳胺类缩合,生成有色化 合物,经常用于糖类的鉴定
莫利胥反应 (了解):
所有糖
浓H2SO4 α-萘酚
紫色或紫红色
阴性反应是糖类化合物肯定不存在的确证, 而阳性反应则不一定说明含有糖类化合物
变旋现象 由变旋现象说明,单糖并不仅仅以开链式存在 ,还有其它的存在形式。 1925-1930年,由X射线等现代物理方法证明,葡萄糖主要 以氧环式(环状半缩醛结构)存在。
1.氧环式结构
六元氧环(吡喃型)
H 1 OH C O
5
H
1C
O
HO 1 H C O
OH
5
α-D-(+)-吡喃葡萄糖
大学有机化学课件第十四章 杂环化合物

邢其毅主编 基础有机化学 下册 高等教育出版社 1983 年 花文廷编著 杂环化学 北京大学出版社 1995 年
青霉素 V
磺胺噻唑(ST)是磺胺类药物的一种,用作肠道消炎药。2-巯基苯并噻唑是一种重要的 橡胶硫化促进剂。
H2N
N
SO2NH
S
磺胺噻唑
N SH
S
2-巯基苯并噻唑
第三节 六元杂环
一、吡啶的结构和性质
1.吡啶的结构 在吡啶分子中,碳原子与氮原子均以sp2杂化,形成了六个σ链,每个原子还均有一个
含一个电子的p轨道,相互交差形成一个闭合的共轭体系,此体系的π电子数为 6,符合 4n+2 规律,故具有芳香性,但是氮原子上还有一个sp2杂化轨道上有一对未成键电子,易与质子 结合,所以吡啶具有碱性。吡啶的pKb=8.75,碱性比苯胺(pKb=9.40)强。
O
CHO Zn4O0-0。CCr2O3
H2 , Ni O
O
呋喃
四氢呋喃(THF)
五、噁唑、噻唑、咪唑和吲哚的性质
N
N
N
O
S
N H
N H
噁唑
噻唑
咪唑
吲哚
(oxazole)
(thiazole)
(imidazole)
(indole)
以咪唑为例来讨论含二个杂原子的五元环的结构,咪唑环上五个原子都采用sp2杂化,
糠醛
糠醛是重要的化工原料,它的主要反应和用途有:
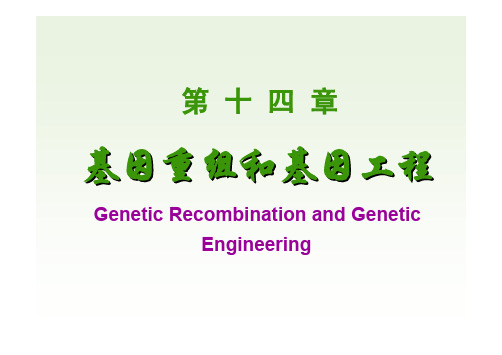
中国医科大学-生物化学-14 基因重组与基因工程
Holliday模型中,同源重组主要4个关键步骤
①两个同源染色体DNA排列整齐 ②一个DNA的一条链断裂、并与另一个DNA
对应的链连接,形成Holliday中间体 ③通过分支移动产生异源双链DNA ④Holliday中间体切开并修复,形成两个双链
重组体DNA,分别为: 片段重组体(patch recombinant)
5´ 3´
5´
3´ DNA 5´
3´
3´
5´ 连接酶 3´
5´
3´
5´
3´
5´
5´
3´
5´
3´
Holiday中间体
5´ 3´ 3´ 5´
3´ 5´
3´ 5´ 5´ 3´
3´ 5´
3´
3´
5´
5´
内切酶 (ruvC)
5´ 3´
5´ 3´
Hale Waihona Puke 3´5´5´ 3´
5´ 3´ 5´ 3´
5´ 3´
3´ 5´
DNA连接酶
Ⅰ类酶由三种不同的亚基组成,需要Mg2+、 S-腺苷酸甲硫氨酸(SAM)和ATP为辅助因子。这 类酶识别部位复杂,特异性差,通常在识别部位 周围400~7000bp范围内切割DNA。
Ⅲ类酶由二种亚基组成,需要Mg2+、ATP为辅 助因子,DNA切割发生在识别部位周围25~27bp 范围内。
Ⅱ类酶由一种亚基构成,切割DNA仅需要 Mg2+作为辅助因子,DNA切割就发生在特异识 别部位范围内。Ⅱ类酶切割DNA的特异性强, 被分子生物学家广泛研究,通常所指的限制性内 切酶,即指此类酶而言。
例 (一)λ噬菌体DNA的整合
λ噬菌体的整合酶识别噬菌体DNA和宿主 染色体的特异靶位点发生选择性整合;反转 录病毒整合酶可特异地识别、整合反转录病 毒 cDNA 的 长 末 端 重 复 序 列 (long terminal repeat, LTR)。
大学有机化学杂环化合物和维生素

第十四章 杂环化合物和维生素 第一节 芳香杂环化合物(二、六元杂环)
人民卫生电子音像出版社
2. 碱性
碱性比较:脂肪胺 >> > ≈ 苯胺
pKb: 3~ 4.5 8.8 9.3
前面学过的环氧化合物、环状酸酐、内酯、内酰胺等:
因其性质与相应的脂肪族化合物较相似,因此并入脂肪族化合物中讨论, 而不列为杂环化合物。
第十四章 杂环化合物和维生素
人民卫生电子音像出版社
本章讨论的杂环化合物主要指环系较稳定,包括杂原子在内的环是平面型,环内有4n+2个p电子处于环状共轭体系中,统称为芳(香)杂环化合物。
第十四章 杂环化合物和维生素 第一节 芳香杂环化合物(二、六元杂环)
人民卫生电子音像出版社
π电子云向电负性较大的N原子转移,使N带部分负电荷, C带部分正电荷,π电子云出现的几率密度如下:
吡啶环中C上p电子密度比苯低,这类芳杂环亦称为“缺p芳杂环”。表现在性质上,亲电取代变难,亲核取代变易;氧化变难,还原变易;另外 sp2 杂化 N 上的孤电子对具有一定程度的碱性,可成盐。
第十四章 杂环化合物与维生素
芳香六元杂环 稠杂环化合物 维生素概述 脂溶性维生素 水溶性维生素
第二节 维生素
三 芳香五元杂环
一 分类和命名
第一节 芳香杂环化合物
第十四章 杂环化合物和维生素
*
“杂环”就是组成环的原子除 C 外,还含有其它元素的原子,这些非碳原子统称为杂原子。原则上二价以上的元素都可成为杂原子, 但最常见的是 O、S和N。
第十四章 杂环化合物和维生素 第一节 芳香杂环化合物(一、分类和命名)
大学无机化学第14章 卤素
4
ø2
(0.4556 1 1.0774 1)V 0.7665 V 2
ø3
(0.6126 6 - 1.0774 1)V 0.5196 V 5
12
(2)
0.7665
BrO
3
0.5357
BrO
-
0.4556
Br2
1.0774
Br
-
0.5196
Br2、BrO 可以歧化。
13
电解液中,常加入少量的氟化物如LiF、 AlF3等,以降低电解质的熔点,减少HF的挥 发。阳极和阴极用隔板隔开,气体氟经过 净化后,以17.7~17.8 MPa的压力压入特 22 制钢瓶中。
2-3
2、合成法 1986年Karl Chrite 首次 用化学方法合成了F2: (1)4KMnO4+4KF+20HF==4K2MnF6+10H2O+3O2 ↑ (2)SbCl5+5HF====SbF5+5HCl 423K (3)2K2MnF6+4SbF5 ==== 4KSbF6+2MnF3+F2 ↑
注意: 氟与稀碱反应是 2F2+2OH-=2F-+OF2+H2O 氟与浓碱反应是 2F2+4OH-=4F-+O2+2H2O 卤素与碱反应是制备次卤酸盐和卤酸盐的 常用方法,在酸性条件下均可发生反岐化反 应
3Br2+2OH-=5Br-+BrO3-+3H2O
5Br-+BrO3-+6H+= 3Br2+3H2O
-
(3) 因为 BrO 能歧化 ,不稳定。 所以 Br 2 (l) 与 NaOH 混合最稳定的产物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 1 735K,30MPa H 2 (g)+ N 2 (g) NH 3 (g) 2 2
(2)氢气同活泼金属在高温下反应生成离子型氢 化物。 653K
2Na(s)+H 2 (g) 2NaH
SiCl4 +2H 2 Si+4HCl
(3)氢具有较强的还原性。
N 2 H 4 (l) O 2 (g) N 2 (g) 2H 2 O(l)
1 r H m 622kJmol
联氨(或烷基肼)或液氧、与N2O4、与H2O2的混合物都可 用作火箭喷射燃料。
联氨在碱性溶液中的还原性比酸性溶液中强得多,如:
N 2 (g) 5H ( 4 e N H aq ) 2 5( aq )
(2)电解水制氢
14.2 氢化物
氢与某元素所生成的二化合物叫做氢化物。典型的 氢化物有离子型、共价型和金属型三大类。(见P4 表 14-3)
14.2.1
氢化物的类型和性质
s区元素 (M=碱金属) (M=Ca、Sr、Ba)
1、离子型氢化物
2M+H2→2M+HM+H2→M2+H-2
过渡金属的氢化物常常在加压和中等高的温度条件下直接 由金属与氢化合而成,温度再升高就会分解。利用这种可逆反 应可以制备出非常纯净的氢气。
因而,金属氢化物的一个十分有意义的潜在应用就是作为 轻便的和相对安全的储氢材料。
4、配位氢化物
14.2.2 过氧化氢
过氧化氢H2O2俗称双氧水。分子中有一个过氧 键─O─O─,每个氧原子各连着一个氢原子。 纯净的过氧化氢是无色粘稠的液体。 1、不稳定性 H2O2(l) = H2O(l)+O2(g) 纯的过氧化氢可作火箭燃料的氧化剂
14.1.1 氢的同位素 2 3 1 H ( 氘 ) 氢有三种同位素: 、 1 1 H (氚) 。 1 H (氕) 、 D(氘)和O(氧)组成的水D2O叫重 氢,重水在原子能工业中大量地用来作 为反应堆的减速剂、冷却剂,也用于制 造氢弹的热核材料──氘或氘化锂 。
氢的三种同位素的组成及丰度见表14-1
纯净的过氧化氢是无色粘稠的液体。
1、不稳定性 H2O2(l) = H2O(l)+O2(g) 纯的过氧化氢可作火箭燃料的氧化剂
2、弱酸性 H2O2 H ++HO-2 H2O2+Ba(OH)2→BaO2+2H2O
所以,过氧化钡可以看成是H2O2的盐。
过氧化氢是个极性分子,H2O2可以微弱地电离出H+。
H2O2(3%或更稀的)作为消毒杀菌剂。要注意30%以上
H2O2水溶液会灼伤皮肤。 工业上制备过氧化氢主要采取电解—水解法。
14.2.3 氮的氢化物──联氨和羟氨 联氨N2H4和羟氨NH2OH中氮原子的氧化态分别为-2和1,并互为等电子体。结构见P398 联氨在工业上是用NaClO(或氯气)氧化NH3的方法制取:
硼烷的 f H m 和 f G m 都是正值,只能采用间接方 法进行制备,以乙硼烷为例。 3LiAlH4+4BX3→3LiX+3AlX3+2B2H6
Biblioteka 2、硼烷的结构 硼氢化合物的结构一可能完全用通常的二中心 二电子链来表示。 在B2H6中,两个硼原子之间缺乏互相结合的电 子,恰有两个氢原子在两个硼原子之间搭桥,把 两个硼原子间接地结合到一起,称为“氢桥”。 在B-H-B的桥状结合中,三个原子只靠2个电子互 相结合成键,这是缺电子原子的一种特殊结合形 式,在结构理论中称为三中心二电子键(简称三 中心键)。具有这种缺电子键的化合物称为缺电 子化合物。
(4) 氢气可以参与一些重要的有机反应
氢气与CO反应时根据条件不同可以制取烃或醇类:
也可用于不饱和烃、植物油的加氢、不饱和脂肪酸的氢化等.
2. 氢的制备方法 (1)由天然气或煤制氢
1273K C(s)+H 2O(g) CO(g)+H 2 (g) 水煤气
1073~1173K CH 4 (g)+H 2O(g) CO(g)+3H 2 (g) Δ,催化剂
14.1.2 氢的性质及制备方法 1. 氢的性质 氢在常温下是无色无味无臭的气体,其 物理性质如表14-2所示。 氢分子中的H-H键能(436kJ· mol-1)较 大,通常要在加热或增压甚至需催化剂参 与下才能同其它物质发生化学反应;
(1)氢气同非金属元素直接反应生成相应的氢化 1 1 燃烧 物。 H 2 (g)+ Cl 2 (g) HCl(g)
2、共价型氢化物 p区元素(除稀有气体、In、Tl外)一般都与氢形成共 价型氢化物。 性质递变规律 P6
(1)热稳定性
共价型氢化物的热稳定性差别很大, 有的在室温下就能分解,如SnH4、PbH4; SnH4→Sn+2H2↑ 2AsH3 → 2As + 3H2 ↑(马氏试砷法)
有的在缺氧条件下,受热分解为单质,例如AsH3:
这是古氏试砷法的主要反应。 共价型氢化物也能被含氧酸盐所氧化: 6HI+KCl03 → 3I2+KCl+3H2O 5H2S+2MnO4 +6H+ → 2Mn 2+ +5S + 8H20
_
(3)与水的作用及酸碱性
它们和水作用的情况,与元素在周期表中的位置有一定 联系,可分为五种情况列于表14-4(P8)。
3、金属型氢化物
氢与过渡金属、s区的Be,Mg和p区的In,Tl可生成金属 型氢化物。这类氢化物的组成大多不固定,通常是非整比化合 物,例如TaH 0.76、LaH 2.76、LaH 5.7、等。对这类氢化物曾 有两种看法:①氢原子间充于金属晶体中的间隙位置而形成间 充化合物;②氢溶在金属中形成固熔体,氢原子在晶格中占据 与金属原子相应的位置。现已查明这些金属型氢化合物都有明 确的物相,其晶体结构与原金属的晶体结构是完全不相同的。 金属型氢化物大多数为脆性固体(金属氢化后变脆,称为氢 脆),具有深色或似金属的外貌,基本上保留着金属的一些物 理性质,如都,具有类似于金属的导电性和磁性等,但是它们 的密度比相应的金属低。
自燃 点燃
P2O5+3H2O 2SO2+2H2O
上述事实说明,氢化物的还原性次序为
同周期: 同族: PH3>H2S>HCl HCI<HBr<HI
AsH3 是一种很强的还原剂,除了能与一般常见的氧化剂反应 外,还能将重金属的盐还原为金属,例如:
2ASH3+12AgNO3+3H2O =As2O3+12HNO3+12Ag
第十四章
氢和氢的化合物
14.1 氢
氢是宇宙中最丰富的元素。在地壳 中氢的含量也相当丰富,约占地壳质量 的1%,但自然界中的氢主要以化合态存 在于水和有机化合物中。
氢是周期表的第一个元素,核外只有一个电子, 处在1s轨道上。它可以失去一个电子成为H+,如像IA 族元素;可以获得一个电子成为H-,使价轨道全充满, 如像ⅦA族元素。氢在元素周期表中的位置,有人将 它排在ⅦA族,但氢的电离性能(I)值和电子亲和能 (A)值均与碱金属元素显示出一致的变化趋势,在低 温高压下,氢气可以转变成黑色晶体 — 金属氢。因 而,一般将氢排在周期表IA族的第一个位置上。
3、氧化性和还原性
既具有氧化性,又具有还原性。H2O2在水溶液中 的标准电极电势如P11。
例如,在酸溶液中H2O2将I- 氧化成单质I2:
H2O2+2I- +2H+→I2+2H2O H2O2可使黑色PbS氧化成白色的PbSO4: 4H2O2+PbS→PbSO4+4H2O 稀的或30%的H2O2溶液被广泛用作氧化剂。医药上用稀
离子型氢化物的性质: (1)热稳定性 离子型氢化物的热稳定性,大多 较差,加热还不到熔点,就分解成金属和氢。 MH+HCl→MCl+H2↑
(2)还原性 离子型氢化物都是优良的还原剂 2LiH+TiO2→Ti+2LiOH (3)在非质子溶剂中与缺电子化合物形成配位氢 化物:
E A 0.23V (pH 0) E B 1.16V (pH 14)
N 2 (g) 4H 2 O(l) 4e N 2 H 4(aq ) 4OH ( aq )
14.2.4 硼的氢化物— 硼烷
硼和氢可形成组成和结构都很特殊的化合物。
1、硼氢化物的制备
2NH 3(aq ) OCl ( N H Cl aq ) 2 4(aq ) (aq ) H 2 O(l)
N2H4分子中的N原子上也有弧对电子,可以同H+结 合而显碱性,但其碱性不如NH3强,是一个二元弱碱。
联氨是一种无色高度吸湿性液体,熔点275K、 沸点 386.5K ,其,在空气中燃烧产生 N2 ,并放 出大量热:
2ASH3 → 2As +3H2 ↑ 这一反应是医学上鉴定砷的马氏试砷法的根据。 有的在高温下也不分解(如1273K时,HF也不分解)。 元素的电负性越大,则此元素与氢形成键的键能越大,氢 化物就越稳定。
(2)还原性
除了HF外,其它共价型氢化物都有还原性,其变化 规律如上面所示:同一周期从左到右还原性减弱;同一族 自上而下还原性增强。例如: 2PH3+4O2 2H2S+3O2 注意古氏试砷法 HCl 在常温时,不能被空气中的氧所氧化,但 HBr 和 HI 可发 生下列反应: 4HBr+O2 → 2Br2+2H20 4HI+O2 → 2I2+2H2O
