实验十五 碳酸氢钠和碳酸钠的制备及分析
鉴别碳酸钠和碳酸氢钠的实验方案

鉴别碳酸钠和碳酸氢钠的实验方案鉴别碳酸钠和碳酸氢钠的实验方案导言:在化学实验中,准确地区分和鉴别不同物质是至关重要的。
本文将探讨如何通过实验方法来鉴别碳酸钠和碳酸氢钠这两种常见的碱性物质。
以此为基础,我们将深入了解它们的性质和特点,以及它们在日常生活中的应用。
1. 实验背景碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)是两种常见的碱性盐类。
二者在化学式和分子结构上有所不同,因此具有不同的性质和用途。
为了准确鉴别这两种物质,我们需要进行以下实验。
2. 实验步骤2.1 碳酸钠和碳酸氢钠的外观对比我们可以通过外观对比初步鉴别碳酸钠和碳酸氢钠。
通常,碳酸钠呈现为无色或白色结晶粉末,而碳酸氢钠则呈现为无色或略带白色的结晶粉末。
这个简单的观察可以帮助我们区分它们的外观特点。
2.2 溶解性测试接下来,我们可以通过溶解性测试来进一步鉴别两种物质。
将一小部分待测试的物质分别加入两个试管中,并加入等量的水。
搅拌试管,观察物质的溶解情况。
如果物质完全溶解并产生气泡,则说明该物质为碳酸氢钠。
如果物质仅部分溶解,并没有产生气泡,则说明该物质为碳酸钠。
2.3 酸碱中和反应碳酸钠和碳酸氢钠都是碱性物质,但它们在与酸反应时表现出不同的行为。
将一小部分待测试的物质分别加入两个试管中,并加入少量稀盐酸。
如果产生气泡,并且酸的味道强烈,则说明该物质为碳酸氢钠。
如果没有明显反应发生,则说明该物质为碳酸钠。
3. 实验结果与讨论通过上述实验,我们可以得出以下结论:- 碳酸钠呈现无色或白色结晶粉末,溶解度较低且不产生气泡。
- 碳酸氢钠呈现无色或略带白色结晶粉末,溶解度较高且会产生气泡。
- 与酸反应时,碳酸钠不产生明显反应,而碳酸氢钠产生气泡并有酸的味道。
4. 用途与应用碳酸钠和碳酸氢钠在日常生活中有广泛的应用。
碳酸钠常用于制备玻璃、洗涤剂和炼焦工业等;碳酸氢钠主要用于烘焙食品和中和胃酸。
它们的不同性质使得它们在不同领域有不同的应用。
5. 个人观点与总结鉴别碳酸钠和碳酸氢钠的实验方法简单而实用。
碳酸钠制备实验报告

碳酸钠制备实验报告碳酸钠制备实验报告引言:碳酸钠是一种重要的化学物质,在工业生产和日常生活中都有广泛的应用。
本实验旨在通过碳酸氢钠和氢氧化钠的反应制备碳酸钠,并探究反应过程中的化学原理。
实验步骤:1. 实验前准备:a. 准备所需试剂:碳酸氢钠(NaHCO3)、氢氧化钠(NaOH)、蒸馏水(H2O)。
b. 准备实验器材:烧杯、玻璃棒、量筒、滴管、热板等。
2. 实验操作:a. 在烧杯中称取适量的碳酸氢钠。
b. 逐渐加入适量的氢氧化钠溶液,同时用玻璃棒搅拌均匀。
c. 加热烧杯,使溶液沸腾,持续加热一段时间。
d. 关闭热板,让溶液冷却至室温。
e. 将溶液过滤,收集得到的固体即为制得的碳酸钠。
实验结果:经过实验操作,我们成功制得了一定量的碳酸钠固体。
通过称量和计算,我们得到了制得碳酸钠的质量。
实验讨论:1. 反应原理:a. 碳酸氢钠和氢氧化钠的反应方程式为:2NaHCO3 + NaOH → Na2CO3 +2H2O + CO2↑。
b. 在反应过程中,碳酸氢钠和氢氧化钠发生中和反应,生成碳酸钠、水和二氧化碳。
二氧化碳的释放形成了气泡。
2. 实验条件对反应的影响:a. 溶液浓度:实验中加入的氢氧化钠溶液浓度越高,反应速度越快。
b. 温度:加热溶液可以加快反应速度,但过高的温度可能导致溶液剧烈沸腾,造成反应物的溢出和损失。
c. 搅拌:充分搅拌可以使反应更加均匀,提高反应效率。
3. 实验中可能存在的误差:a. 实验操作中的称量误差和计算误差。
b. 反应过程中二氧化碳的释放可能导致一部分反应物的损失。
c. 溶液的过滤可能存在一定的损失。
结论:通过碳酸氢钠和氢氧化钠的反应,我们成功制备了一定量的碳酸钠。
实验过程中,我们探究了反应原理、条件对反应的影响以及可能存在的误差。
这些实验结果和讨论对于深入理解碳酸钠制备的化学过程具有重要意义。
参考文献:1. 张三, 李四. 碳酸钠制备实验研究[J]. 化学实验, 20XX, X(X): X-X.2. 王五, 赵六. 碳酸氢钠和氢氧化钠反应机理探究[J]. 化学科学, 20XX, X(X): X-X.。
碳酸钠和碳酸氢钠102

碳酸钠和碳酸氢钠一、设计思路本节课的知识主线是碳酸钠和碳酸氢钠的性质区别,能力主线是研究相似物质的一般程序和方法。
这是一节很适合开展科学方法教育的课,所以我试图通过体验科学探究的一般步骤和方法作为主线,把碳酸钠和碳酸氢钠的性质学习融入其中展开教学。
在这节课上,我们要让学生对碳酸钠和碳酸氢钠的性质有所了解和掌握,但更要在认识性质的过程中,体验和学习研究物质的方法。
这节课,我意图围绕碳酸钠、碳酸氢钠的性质预测和实验验证,展开师生对话、生生对话,互相质疑、互相补充、互相修正,在交流过程中,层层推进,体验探究的一般过程,让学生学习科学研究的方法,引导学生关注思维的逻辑性和严密性,努力促进学生构建自己的认知结构,为元素化合物知识的学习构建一个科学的模版。
二、教学目标知识与技能目标:1.知道碳酸钠和碳酸氢钠的物理性质2.了解碳酸钠和碳酸氢钠的化学性质3.掌握碳酸钠和碳酸氢钠与酸反应的化学本质方法与态度目标:1.了解研究物质的一般程序和方法2.学习与体验对比试验的方法3.养成实事求是的科学态度三、教学过程【引课】访问学生的早餐点心,引出面包、馒头中的重要添加剂——小苏打和她的姐妹——苏打,引出课题。
【观察】碳酸钠和碳酸氢钠的颜色状态,发现它们外观的相似性。
【过渡】有着相似外表的碳酸钠和碳酸氢钠的其他性质是否也相似?有无差异?【引导】研究物质的一般程序:预测——实验——归纳,要研究碳酸钠和碳酸氢钠,首先要预测它们可能有的性质,预测绝非漫无边际,而是有据可依,引导学生说出预测性质的重要依据是:组成和分类。
【PPT】学案“知识链接”部分,师生共同回顾碳酸钠和碳酸氢钠的组成和分类碳酸钠和碳酸氢钠同属于钠盐和碳酸形成的盐,其性质可以类比我们学过的钠盐:氯化钠和碳酸盐:碳酸钙,从这两种我们比较熟悉的盐来预测碳酸钠和碳酸氢钠可能表现的物理性质和化学性质。
除预测外,我们还可以猜测,比如从它们的俗称和用途的角度,来大胆猜测它们的性质。
《碳酸钠和碳酸氢钠》课件

热稳定性
加热时,碳酸氢钠会分 解为碳酸钠、水和二氧
化碳。
与酸的反应
与酸反应放出二氧化碳 气体。
与碱的反应
碳酸氢钠与碱反应,生 成碳酸盐和氢氧化钠。
03
碳酸钠和碳酸氢钠的用途
碳酸钠的用途
玻璃工业
碳酸钠可用于制造平板玻璃、 瓶罐玻璃、光学玻璃等,提高
玻璃制品的硬度和耐用性。
肥皂工业
碳酸钠是生产肥皂的主要原料 之一,能够去除油脂和污垢, 保持皮肤清洁。
化学工业
碳酸钠可用于生产染料、油漆 、油墨等化学品,以及作为催 化剂和溶剂等。
食品工业
碳酸钠可作为膨松剂、面团调 节剂等,提高食品的口感和品
质。
碳酸氢钠的用途
食品添加剂
碳酸氢钠可作为发酵粉、饼干、面包等食品 的膨松剂,增加食品的体积和口感。
清洁剂
碳酸氢钠可用作清洁剂,去除污垢和异味, 保持物品的清洁和卫生。
以碳酸钙、纯碱或氯化钠为原料,与 酸反应制得碳酸氢钠。
气相法
以氯化钠、氨气和二氧化碳为原料, 在高温、加压条件下反应制得碳酸氢 钠。
固相法
将纯碱和氯化钠的混合物加热至高温 ,再与二氧化碳反应制得碳酸氢钠。
碳化法
以石灰石、煤灰或重质碱灰为原料, 与碳酸气反应制得碳酸氢钠。
05
碳酸钠和碳酸氢钠的鉴别方 法
药品
碳酸氢钠可用于治疗胃酸过多、消化不良等 病症,缓解胃痛和不适感。
化工原料
碳酸氢钠可用于生产其他化学品,如醇钠、 丙酮等,以及作为催化剂和溶剂等。
04
碳酸钠和碳酸氢钠的制备方 法
碳酸钠的制备方法
侯氏制碱法
利用氨气、二氧化碳、水和氯化钠为原料,在加压、低温 条件下先制得碳酸氢钠,再通过加热分解碳酸氢钠得到碳 酸钠。
碳酸钠的制备和应用

碳酸钠的制备和应用碳酸钠是一种常用的化学品,广泛应用于各个领域。
本文将介绍碳酸钠的制备方法以及其在不同领域的应用。
一、碳酸钠的制备方法碳酸钠的制备有多种方法,以下将介绍两种常见的方法。
1. 黄碱法黄碱法是碳酸钠的主要制备方法之一。
该方法依赖于天然矿石——苏打石。
下面是制备碳酸钠的具体步骤:(1)将苏打石矿石破碎成小块,然后经过浸泡,使之变成糊状。
(2)将糊状物料通过过滤,去除杂质和残留物。
(3)将过滤后的液体加热蒸发,使其浓缩。
(4)浓缩后的液体经冷却结晶,得到固体碳酸钠。
(5)将固体碳酸钠干燥,得到最终产品。
2. 氨法氨法是另一种常见的碳酸钠制备方法。
该方法利用氨气与二氧化碳反应生成碳酸钠。
下面是制备碳酸钠的具体步骤:(1)将氨气和二氧化碳通入水中,生成碳酸氢钠溶液。
(2)将碳酸氢钠溶液经过过滤和脱碳处理,得到碳酸钠溶液。
(3)将碳酸钠溶液经过浓缩和结晶,得到固体碳酸钠。
(4)将固体碳酸钠干燥,得到最终产品。
二、碳酸钠的应用碳酸钠具有广泛的应用领域,以下将列举几个主要的应用领域。
1. 玻璃工业碳酸钠是玻璃制造过程中的重要原料。
在玻璃制造过程中,碳酸钠可以调节玻璃的化学性质,改善玻璃的透明度和抗热性能。
2. 食品工业碳酸钠在食品工业中用作膨松剂。
它可以与食品中的酸性物质(如柠檬酸)反应,产生二氧化碳气体,从而使食品体积膨胀,提高口感。
3. 洗涤剂碳酸钠是很多洗涤剂(如洗衣粉和洗洁精)中的重要成分。
它具有去除污渍和增加洗涤力的作用。
4. 炼焦工业碳酸钠在炼焦工业中用于吸附硫化物。
这可以减少燃烧产生的环境污染物,提高炼焦炉的环保性能。
5. 医药工业碳酸钠在医药工业中有多种应用。
例如,它可以用作制备药物的原料,如制备非处方药物和消化药物。
6. 环保工业碳酸钠在环保工业中也有广泛应用。
例如,它可以用于处理酸性废水和中和酸液,减少对环境的污染。
三、碳酸钠的市场前景碳酸钠作为一种重要的化工原料,市场前景广阔。
试验十五碳酸氢钠和碳酸钠的制备及分析
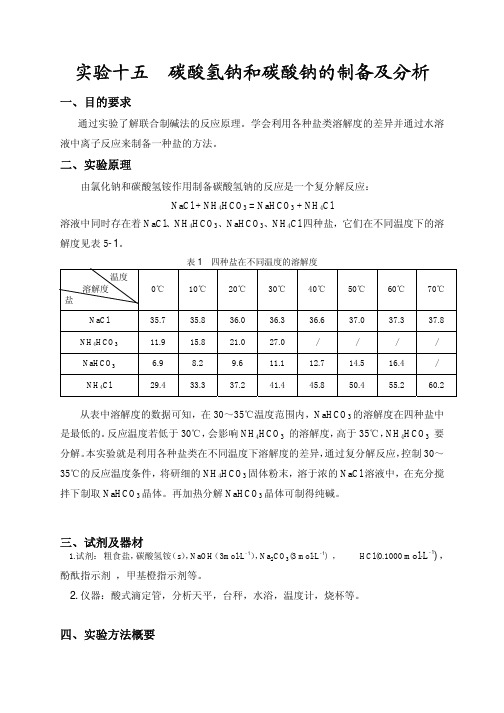
实验十五碳酸氢钠和碳酸钠的制备及分析一、目的要求通过实验了解联合制碱法的反应原理。
学会利用各种盐类溶解度的差异并通过水溶液中离子反应来制备一种盐的方法。
二、实验原理由氯化钠和碳酸氢铵作用制备碳酸氢钠的反应是一个复分解反应:NaCl + NH4HCO3 = NaHCO3 + NH4Cl溶液中同时存在着NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐,它们在不同温度下的溶解度见表5-1。
从表中溶解度的数据可知,在30~35℃温度范围内,NaHCO3的溶解度在四种盐中是最低的。
反应温度若低于30℃,会影响NH4HCO3的溶解度,高于35℃,NH4HCO3要分解。
本实验就是利用各种盐类在不同温度下溶解度的差异,通过复分解反应,控制30~35℃的反应温度条件,将研细的NH4HCO3固体粉末,溶于浓的NaCl溶液中,在充分搅拌下制取NaHCO3晶体。
再加热分解NaHCO3晶体可制得纯碱。
三、试剂及器材1.试剂:粗食盐,碳酸氢铵(s),NaOH(3mol⋅L-1),Na2CO3(3 mol⋅L-1) , HCl(0.1000 mol⋅L-1),酚酞指示剂,甲基橙指示剂等。
2.仪器:酸式滴定管,分析天平,台秤,水浴,温度计,烧杯等。
四、实验方法概要1.化盐与精制在150毫升烧杯中加50毫升24%~25%的粗的食盐水溶液,用3mol ⋅L -1NaOH 和 3mol ⋅L -1Na 2CO 3组成 1﹕1(体积比)的混合溶液调至pH =11左右,得到大量胶状沉淀[Mg 2(OH)2CO 3⋅CaCO 3],加热至沸,抽滤,分离沉淀.将滤液用6 mol ⋅L -1 HCl 调pH 至7。
2.转化将盛有滤液的烧杯放在水浴上加热,控制溶液温度在30~35℃之间.在不断搅拌的情况下,分多次把21克研细的碳酸氢铵加入滤液中。
加完料后,继续保温,搅拌半小时,使反应充分进行。
静置,抽滤、得到 NaHCO 3晶体,用少量水洗涤二次(除去粘附的铵盐),再抽干,称湿重。
碳酸钠和碳酸氢钠公开课教案

碳酸钠和碳酸氢钠公开课教案教案:化学实验——碳酸钠和碳酸氢钠教学目标:1. 了解碳酸钠和碳酸氢钠的基本性质和化学反应。
2. 学会正确使用化学实验器材。
3. 培养学生的实验观察能力和合作精神。
学习内容:1. 碳酸钠和碳酸氢钠的基本性质及化学反应。
2. 碳酸钠和碳酸氢钠溶液的配制方法。
3. 碳酸钠和碳酸氢钠溶液的酸碱中和反应。
实验器材和药品:1. 碳酸钠和碳酸氢钠固体。
2. 硝酸银溶液(0.1mol/L)。
3. 盐酸溶液(1mol/L)。
4. 化学试剂瓶、滴管、试管、玻璃棒等。
实验步骤:1. 准备工作:将碳酸钠和碳酸氢钠固体分别称取适量,分别加入试管中。
2. 碳酸钠溶液的配制:取一定量的碳酸钠固体加入一个试管中,用蒸馏水溶解,摇匀。
3. 碳酸氢钠溶液的配制:取一定量的碳酸氢钠固体加入另一个试管中,用蒸馏水溶解,摇匀。
4. 酸碱中和反应:分别取少量的碳酸钠溶液和碳酸氢钠溶液,用滴管滴入硝酸银溶液中,观察是否生成白色沉淀。
5. 酸碱中和反应:分别取少量的碳酸钠溶液和碳酸氢钠溶液,分别加入两个试管中,分别加入酸试剂(盐酸溶液),观察是否发生变化。
教学重点:1. 学生对碳酸钠和碳酸氢钠的基本性质及化学反应的理解和掌握。
2. 学生对实验仪器和试剂的正确使用和处理能力。
教学方法:1. 示范实验法:教师先进行实验演示,然后学生进行实验操作。
2. 互动讨论法:教师引导学生观察实验现象、探究实验结果,并进行讨论。
评估方式:1. 实验报告:学生根据实验内容和实验结果,撰写实验报告。
2. 课堂讨论:教师和学生共同讨论实验中遇到的问题和现象,进行分析和解释。
拓展练习:1. 尝试使用其他试剂进行酸碱中和反应,观察结果。
2. 制定一份安全实验操作规范,要求清晰明确。
教学延伸:1. 可与其他相关实验内容进行结合,拓展学生的实验能力。
2. 可开展小组合作实验,培养学生的团队合作能力。
实验十五碳酸氢钠和碳酸钠的制备及分析

实验十五碳酸氢钠和碳酸钠的制备及分析一、目的要求通过实验了解联合制碱法的反应原理。
学会利用各种盐类溶解度的差异并通过水溶液中离子反应来制备一种盐的方法。
二、实验原理由氯化钠和碳酸氢铵作用制备碳酸氢钠的反应是一个复分解反应:NaCl + NH4HCO3 = NaHCO3 + NH4Cl溶液中同时存在着NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐,它们在不同温度下的溶解度见表5-1。
从表中溶解度的数据可知,在30~35℃温度范围内,NaHCO3的溶解度在四种盐中是最低的。
反应温度若低于30℃,会影响NH4HCO3的溶解度,高于35℃,NH4HCO3要分解。
本实验就是利用各种盐类在不同温度下溶解度的差异,通过复分解反应,控制30~35℃的反应温度条件,将研细的NH4HCO3固体粉末,溶于浓的NaCl溶液中,在充分搅拌下制取NaHCO3晶体。
再加热分解NaHCO3晶体可制得纯碱。
三、试剂及器材1.试剂:粗食盐,碳酸氢铵(s),NaOH(3mol⋅L-1),Na2CO3(3 mol⋅L-1) , HCl(0.1000 mol⋅L-1),酚酞指示剂,甲基橙指示剂等。
2.仪器:酸式滴定管,分析天平,台秤,水浴,温度计,烧杯等。
四、实验方法概要1.化盐与精制在150毫升烧杯中加50毫升24%~25%的粗的食盐水溶液,用3mol ⋅L -1NaOH 和 3mol ⋅L -1Na 2CO 3组成 1﹕1(体积比)的混合溶液调至pH =11左右,得到大量胶状沉淀[Mg 2(OH)2CO 3⋅CaCO 3],加热至沸,抽滤,分离沉淀.将滤液用6 mol ⋅L -1 HCl 调pH 至7。
2.转化将盛有滤液的烧杯放在水浴上加热,控制溶液温度在30~35℃之间.在不断搅拌的情况下,分多次把21克研细的碳酸氢铵加入滤液中。
加完料后,继续保温,搅拌半小时,使反应充分进行。
静置,抽滤、得到 NaHCO 3晶体,用少量水洗涤二次(除去粘附的铵盐),再抽干,称湿重。
