原子个数n对碳分子线C n(n=3~10)基态结构特性的影响
湖南省长沙市湖南师范大学附属中学2024-2025学年高三上学期月考(一)化学试题及答案

2025届师大附中高三月考化学试卷(一)本试题卷分选择题和非选择题两部分,共10页。
时量75分钟,满分100分。
可能用到的相对原子质量:H:1 C:12 O:16 Sb:122一、选择题:本题共14小题,每小题3分,共42分。
每小题只有一个选项符合题目要求。
1. 化学与生活、生产密切相关,下列说法正确的是A. “酒香不怕巷子深”体现了熵增的原理B. 船体上镶嵌锌块,是利用外加电流法避免船体遭受腐蚀C. 烟花发出五颜六色的光是利用了原子的吸收光谱D. “太阳翼”及光伏发电系统能将太阳能变为化学能2. 下列化学用语或化学图谱不正确的是NH的VSEPR模型:A. 3CH CH OCH CHB. 乙醚的结构简式:3223C. 乙醇的核磁共振氢谱:D. 邻羟基苯甲醛分子内氢键示意图:3. 实验室中,下列实验操作或事故处理不合理的是A. 向容量瓶转移液体时,玻璃棒下端应在容量瓶刻度线以下B. 苯酚不慎沾到皮肤上,先用抹布擦拭,再用65C°水冲洗C. 用二硫化碳清洗试管内壁附着的硫D. 对于含重金属(如铅、汞或镉等)离子的废液,可利用沉淀法进行处理4. 下列有关有机物的说法正确的是A. 聚乙烯塑料的老化是由于发生了加成反应B. 二氯丁烷的同分异构体为8种(不考虑立体异构)C. 核酸可视为核苷酸的聚合产物D. 乙醛和丙烯醛()不是同系物,它们与氢气充分反应后的产物也是同系物5. 下列反应方程式书写不正确的是A. 将223Na S O 溶液与稀硫酸混合,产生浑浊:2-+2322S O +2H =SO +S +H O ↑↓B. 用浓氨水检验氯气泄漏:32428NH +3Cl =6NH Cl+NC. 稀硫酸酸化的淀粉-KI 溶液在空气中放置一段时间后变蓝:-2-+42222I +SO +4H =I +SO +2H O ↑D. ()32Ca HCO 溶液与少量NaOH 溶液反应:-2+-332HCO +Ca +OH =CaCO +H O ↓6. 内酯Y 可以由X 通过电解合成,并可在一定条件下转化为Z ,转化路线如图所示。
04 原子结构——练习(教师版)

原子结构一、选择题1.(2022秋·福建福州·高二福建省福州第一中学校考期末)下列说法中,正确的是A.1s电子云轮廓图呈球形,处在该轨道上的电子只能在球壳内运动B.电子云轮廓图中的小黑点密度大,说明该原子核外空间电子数目多C.ns能级的原子轨道的电子云轮廓图如图所示D.3d6表示3d能级有6个原子轨道【答案】C【解析】A.电子云表示电子在核外空间某处出现的概率,不代表电子的运动轨迹,A错误;B.小黑点的疏密表示电子出现概率的大小,密则概率大,疏则概率小,B错误;C.s轨道为球形,则ns能级的电子云轮廓图可表示为,C正确;D.3d6表示3d能级有6个电子,D错误;故选C。
2.(2023秋·吉林·高二吉林一中校考期末)下列现象或应用与电子跃迁无关的是A.激光B.焰色试验C.丁达尔效应D.原子光谱【答案】C【解析】A.电子跃迁产生光子与入射光子具有相关性,即入射光与辐射光的相位相同,如果这一过程能够在物质中反复进行,并且能用其他方式不断补充因物质产生光子而损失的能量,那么产生的光就是激光,与电子跃迁有关,A项不选;B.当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁有关,B项不选;C.丁达尔效应是当一束光线透过胶体,从垂直入射光方向可以观察到胶体里出现的一条光亮的“通路”,与电子跃迁无关,C项选;D.原子光谱的产生是原子核电子发生能级跃迁的结果,与电子跃迁有关,D项不选;答案选C。
3.(2022春·湖北十堰·高二统考期末)下列有关原子核外电子排布的表达中错误的是A.-F的结构示意图:B .基态镁原子的核外电子排布的轨道表示式:C .基态铬原子的核外电子排布式:22626511s 2s 2p 3s 3p 3d 4sD .基态2+Fe 的外围电子排布式:423d 4s【答案】D 【解析】A .氟的原子序数为9,-F 是氟原子得到一个电子,则核外电子数为10,故A 正确;B .镁的原子序数为12,电子排布式为1s 22s 22p 63s 2,则基态镁原子的核外电子排布的轨道表示式正确,故B 正确;C .铬的原子序数为24,则基态铬原子的核外电子排布式为:22626511s 2s 2p 3s 3p 3d 4s ,故C 正确;D .铁的原子序数为26,铁原子的核外电子排布式为22626261s 2s 2p 3s 3p 3d 4s ,4s 为最外层两个电子容易失去,则基态2+Fe 的外围电子排布式:2262661s 2s 2p 3s 3p 3d ,故D 错误;故选D 选项。
路易斯酸碱理论电子论

2p轨道
P轨道为哑铃形,有方向性,沿x、y、z三个方 向伸展,三个轨道能量相同。
+
_
+
_
Px轨道
Py轨道
Pz轨道
注:轨道图中的 “ + “ “ - “表示波位相
电子排布规律
►保里不相容原理 两个形成共价键的电子,必 须自旋方向相反。
►能量最低原理 电子首先占据能量最低的轨道, 当此种轨道填满后,才依次占据能量较高的 轨道。
原子间通过电子转移产生正、负离子,二者 相互吸引所形成的化学键称为 ~
凯库勒式
和 路易斯式
H HC
H
H
C
H
H
HH HC C H
HH
路易斯的“八隅学说”:除氦仅有两个价电子外,其他 惰性气体在价电子层中均为八个电子(八隅体)。绝 大多数其他元素之间键合成分子,也是达到外层电子 满足八隅体电子结构。
现代共价键理论包括价键理论和分子轨道理论 ►(三)原子轨道(用波函数Ψ表示)
三、结构概念和结构理论
► (一)碳原子的四面体结构 荷兰化学家范霍夫和法国化学家勒贝尔分别独立提 出。现用X射线衍射法验证。
甲 烷 正 四 面 体 结 构
►(二)共价键
在原子间通过共用一对电子而形成的化学键 称为~
►配位键是一种特殊的共价键,其特点是形成 共价键的一对电子由一个原子提供。
►离子键
CH
C + H +338.9kJ mol-1
甲烷分子中C—H键的键能则为上述四个C—H键离解能 的平均值(415.3kJ•mol-1)。
(四)键的极性和极化性
► 非极性键:两个相同的原子形成的共价键,由于成键 电子云对称地分布在两个原子核之间,正电荷中心和 负电荷中心重合,这样的共价键没有极性,称为~
第2章 微粒间相互作用与物质性质 测试题-高二下学期鲁科版(2019)化学选择性必修2

第2章 微粒间相互作用与物质性质 测试题一、单选题(共15题)1.碳原子的杂化轨道中s 成分的含量越多,则该碳原子形成的C-H 键键长会短一些。
下列化合物中,编号所指三根C-H 键的键长正确的顺序是A .①>①>①B .①>①>①C .①>①>①D .①>①>①2.下列关于化学键的说法中正确的是( ) A .22H O 中既有极性键又有非极性键B .凡是有化学键断裂的过程一定发生了化学反应C .非金属元素之间只能形成共价化合物D .所有盐、碱和金属氧化物中都含有离子键3.纳米TiO 2是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是A .化合物甲、乙均为手性分子B .化合物甲中最多有8个原子共平面C .化合物乙中采取sp 3杂化的原子只有N 、CD .化合物甲的沸点明显高于化合物乙4.在新型催化剂2RuO 作用下,2O 氧化HCl 可获得2Cl ,反应为()()()()2224HCl g O g 2Cl g 2H O g ++ H 0∆<。
下列说法正确的是A .该反应中反应物键能总和大于生成物键能总和B .反应中()HCl g 和()2O g 的总能量大于()2Cl g 的总能量C .上述反应过程中有极性键和非极性键的断裂和形成D .2RuO 的使用能降低该反应的焓变 5.下列物质中,酸性最强的是 A .2CH ClCOOHB .2CH FCOOHC .2CHF COOHD .2CHBr COOH6.下列说法正确的是A .硫难溶于水,微溶于酒精,易溶于CS 2,说明极性:H 2O>C 2H 5OH>CS 2B .BF 3、CCl 4中每个原子都满足8电子稳定结构C .分子晶体中一定存在共价键D .I 2低温下就能升华,说明碘原子间的共价键较弱 7.溴单质在四氯化碳中的溶解度比在水中大,这是因为 A .溴单质和四氯化碳中都含有卤素原子 B .Br 2是单质,CCl 4是化合物C .Br 2是非极性分子,CCl 4也是非极性分子,而水是极性分子D .Br 2、CCl 4都是有机物,而H 2O 是无机物8.短周期元素W 、X 、Y 、Z 的原子序数依次增加。
贵州省遵义市第四中学2022年高考化学高考化学压轴题 晶胞的相关计算专项训练分类精编含答案
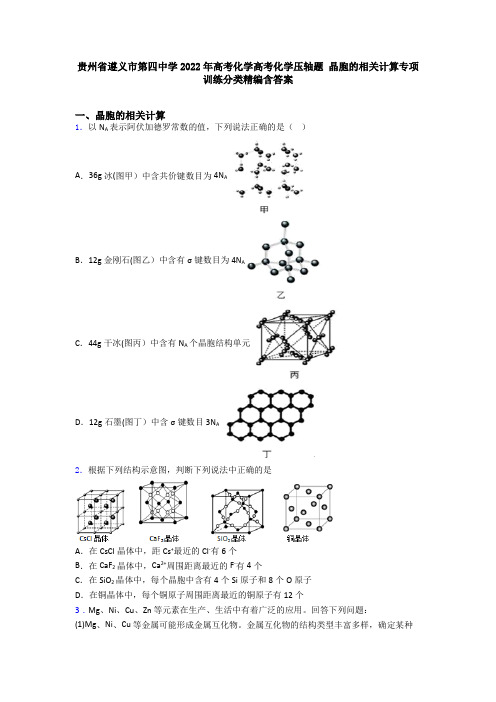
贵州省遵义市第四中学2022年高考化学高考化学压轴题晶胞的相关计算专项训练分类精编含答案一、晶胞的相关计算1.以N A表示阿伏加德罗常数的值,下列说法正确的是()A.36g冰(图甲)中含共价键数目为4N AB.12g金刚石(图乙)中含有σ键数目为4N AC.44g干冰(图丙)中含有N A个晶胞结构单元D.12g石墨(图丁)中含σ键数目3N A2.根据下列结构示意图,判断下列说法中正确的是A.在CsCl晶体中,距Cs+最近的Cl-有6个B.在CaF2晶体中,Ca2+周围距离最近的F-有4个C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个3.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
(3)[Ni(NH3)6](NO3)2中不存在的化学键为___________(填序号)。
a.离子键 b.金属键 c.配位键 d.氢键(4)镍基合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。
该合金储氢后,H2与 Ni 的物质的量之比为___________。
②Mg2NiH4 是一种储氢的金属氢化物。
在 Mg2NiH4晶胞中,Ni 原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。
Mg2+位于 Ni 原子形成的___________ (填“八面体空隙”或“四面体空隙”)。
晶体的密度为ρg·cm-3,N A表示阿伏加德罗常数,Mg2+和 Ni 原子的最短距离为__________cm(用含ρ和 N A的代数式表示)。
结构化学习题详解

结构化学习题习题类型包括:选择答案、填空、概念辨析、查错改正、填表、计算、利用结构化学原理分析问题;内容涵盖整个课程,即量子力学基础、原子结构、分子结构与化学键、晶体结构与点阵、X射线衍射、金属晶体与离子晶体结构、结构分析原理、结构数据采掘与QSAR等;难度包括容易、中等、较难、难4级;能力层次分为了解、理解、综合应用。
传统形式的习题,通常要求学生在课本所学知识范围内即可完成,而且答案是唯一的,即可以给出所谓“标准答案”。
根据21世纪化学演变的要求,我们希望再给学生一些新型的题目,体现开放性、自主性、答案的多样性,即:习题不仅与课本内容有关,而且还需要查阅少量文献才能完成;完成习题更多地需要学生主动思考,而不是完全跟随教师的思路;习题并不一定有唯一的“标准答案”,而可能具有多样性,每一种答案都可能是“参考答案”。
学生接触这类习题,有助于培养学习的主动性,同时认识到实际问题是复杂的,解决问题可能有多钟途径。
但是,这种题目在基础课中不宜多,只要有代表性即可。
以下各章的名称与《结构化学》多媒体版相同,但习题内容并不完全相同。
第一章量子力学基础1.1 选择题(1) 若用电子束与中子束分别作衍射实验,得到大小相同的环纹,则说明二者(A) 动量相同(B) 动能相同(C) 质量相同(2) 为了写出一个经典力学量对应的量子力学算符,若坐标算符取作坐标本身,动量算符应是(以一维运动为例)(A) mv (B) (C)(3) 若∫|ψ|2dτ=K,利用下列哪个常数乘ψ可以使之归一化:(A) K(B) K2 (C) 1/(4) 丁二烯等共轭分子中π电子的离域化可降低体系的能量,这与简单的一维势阱模型是一致的,因为一维势阱中粒子的能量(A) 反比于势阱长度平方(B) 正比于势阱长度(C) 正比于量子数(5) 对于厄米算符, 下面哪种说法是对的(A) 厄米算符中必然不包含虚数(B) 厄米算符的本征值必定是实数(C) 厄米算符的本征函数中必然不包含虚数(6) 对于算符Ĝ的非本征态Ψ(A) 不可能测量其本征值g.(B) 不可能测量其平均值<g>.(C) 本征值与平均值均可测量,且二者相等(7) 将几个非简并的本征函数进行线形组合,结果(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变(C) 仍是原算符的本征函数,但本征值改变1.2 辨析下列概念,注意它们是否有相互联系, 尤其要注意它们之间的区别:(1) 算符的线性与厄米性(2) 本征态与非本征态(3) 本征函数与本征值(4) 本征值与平均值(5) 几率密度与几率(6) 波函数的正交性与归一性(7) 简并态与非简并态1.3 原子光谱和分子光谱的谱线总是存在一定的线宽,而且不可能通过仪器技术的改进来使之无限地变窄. 这种现象是什么原因造成的?1.4 几率波的波长与动量成反比. 如何理解这一点?1.5 细菌的大小为微米量级, 而病毒的大小为纳米量级. 试通过计算粗略估计: 为了观察到病毒, 电子显微镜至少需要多高的加速电压.1.6 将一维无限深势阱中粒子的波函数任取几个, 验证它们都是相互正交的.1.7 厄米算符的非简并本征函数相互正交. 简并本征函数虽不一定正交, 但可用数学处理使之正交.例如,若ψ1与ψ2不正交,可以造出与ψ1正交的新函数ψ’2ψ’2=ψ2+cψ1试推导c的表达式(这种方法称为Schmidt正交化方法).1.8 对于一维无限深势阱中粒子的基态, 计算坐标平均值和动量平均值, 并解释它们的物理意义.1.9 一维无限深势阱中粒子波函数的节点数目随量子数增加而增加. 试解释: 为什么节点越多, 能量越高. 再想一想: 阱中只有一个粒子, 它是如何不穿越节点而出现在每个节点两侧的?1.10 下列哪些函数是d2/dx2的本征函数: (1) e x (2) e2x(3) 5sin x(4) sin x+cos x(5)x3. 求出本征函数的本征值.1.11 对于三维无限深正方形势阱中粒子, 若三个量子数平方和等于9, 简并度是多少?1.12 利用结构化学原理,分析并回答下列问题:纳米粒子属于介观粒子,有些性质与宏观和微观粒子都有所不同. 不过,借用无限深势阱中粒子模型,对纳米材料中的“量子尺寸效应”还是可以作一些定性解释.例如: 为什么半导体中的窄能隙(<3eV)在纳米颗粒中会变宽, 甚至连纳米Ag也会成为绝缘体?第二章原子结构2.1 选择题(1) 对s、p、d、f 原子轨道进行反演操作,可以看出它们的对称性分别是(A) u, g, u, g (B) g, u, g, u (C) g, g, g, g(2) H原子的电离能为13.6 eV, He+的电离能为(A) 13.6 eV (B) 54.4 eV (C) 27.2 eV(3) 原子的轨道角动量绝对值为(A) l(l+1)2(B) (C) l(4) p2组态的原子光谱项为(A) 1D、3P、1S(B) 3D、1P、3S(C) 3D、3P、1D(5) Hund规则适用于下列哪种情况(A) 求出激发组态下的能量最低谱项(B) 求出基组态下的基谱项(C) 在基组态下为谱项的能量排序(6) 配位化合物中d→d跃迁一般都很弱,因为这种跃迁属于:(A) g←/→g(B) g←→u(C) u←/→u(7) Cl原子基态的光谱项为2P,其能量最低的光谱支项为(A) 2P3/2(B) 2P1/2(C) 2P02.2 辨析下列概念,注意它们的相互联系和区别:(1) 复波函数与实波函数(2) 轨道与电子云(3) 轨道的位相与电荷的正负(4) 径向密度函数与径向分布函数(5)原子轨道的角度分布图与界面图(6)空间波函数、自旋波函数与自旋-轨道(7)自旋-轨道与Slater行列式(8)组态与状态2.3 请找出下列叙述中可能包含着的错误,并加以改正:原子轨道(AO)是原子中的单电子波函数,它描述了电子运动的确切轨迹. 原子轨道的正、负号分别代表正、负电荷. 原子轨道的绝对值平方就是化学中广为使用的“电子云”概念,即几率密度. 若将原子轨道乘以任意常数C,电子在每一点出现的可能性就增大到原来的C2倍.2.4(1) 计算节面对应的θ;(2) 计算极大值对应的θ;(3) 在yz平面上画出波函数角度分布图的剖面, 绕z轴旋转一周即成波函数角度分布图. 对照下列所示的轨道界面图, 从物理意义和图形特征来说明二者的相似与相异.2.5 氢原子基态的波函数为试计算1/r的平均值,进而计算势能平均值<V>, 验证下列关系:<V> = 2E= -2<T>此即量子力学维里定理,适用于库仑作用下达到平衡的粒子体系(氢原子基态只有一个1s电子,其能量等于体系的能量) 的定态, 对单电子原子和多电子原子具有相同的形式.2.6 R. Mulliken用原子中电子的电离能与电子亲合能的平均值来定义元素电负性. 试从原子中电子最高占有轨道(HOMO)和最低空轨道(LUMO)的角度想一想,这种定义有什么道理?2.7 原子中电子的电离能与电子亲合能之差值的一半, 可以作为元素化学硬度的一种量度(硬度较大的原子,其极化率较低). 根据这种定义,化学硬度较大的原子,其HOMO与LUMO之间的能隙应当较大还是较小?2.8 将2p+1与2p-1线性组合得到的2p x与2p y, 是否还有确定的能量和轨道角动量z分量?为什么?2.9 原子的轨道角动量为什么永远不会与外磁场方向z重合, 而是形成一定大小的夹角? 计算f轨道与z轴的所有可能的夹角. 为什么每种夹角对应于一个锥面, 而不是一个确定的方向?2.10 快速求出P原子的基谱项.2.11 Ni2+的电子组态为d8, 试用M L表方法写出它的所有谱项, 并确定基谱项. 原子光谱表明, 除基谱项外, 其余谱项的能级顺序是1D<3P<1G<1S, 你是否能用Hund规则预料到这个结果?2.12 d n组态产生的谱项, 其宇称与电子数n无关, 而p n组态产生的谱项, 其宇称与电子数n有关. 为什么?2.13 试写出闭壳层原子Be的Slater行列式.2.14 Pauli原理适用于玻色子和费米子, 为什么说Pauli不相容原理只适用于费米子?第三章双原子分子结构与化学键理论3.1 选择题(1) 用线性变分法求出的分子基态能量比起基态真实能量,只可能(A) 更高或相等(B) 更低(C) 相等(2) N2、O2、F2的键长递增是因为(A) 核外电子数依次减少(B) 键级依次增大(C) 净成键电子数依次减少(3) 下列哪一条属于所谓的“成键三原则”之一:(A) 原子半径相似(B) 对称性匹配(C) 电负性相似(4) 下列哪种说法是正确的(A) 原子轨道只能以同号重叠组成分子轨道(B) 原子轨道以异号重叠组成非键分子轨道(C) 原子轨道可以按同号重叠或异号重叠,分别组成成键或反键轨道(5) 氧的O2+ , O2 , O2- , O22-对应于下列哪种键级顺序(A) 2.5,2.0, 1.5, 1.0(B) 1.0, 1.5,2.0, 2.5(C) 2.5,1.5, 1.0 2.0(6) 下列哪些分子或分子离子具有顺磁性(A) O2、NO (B) N2、F2(C) O22+、NO+(7) B2和C2中的共价键分别是(A)π1+π1,π+π(B)π+π,π1+π1 (C)σ+π,σ3.2 MO与VB理论在解释共价键的饱和性和方向性上都取得了很大的成功, 但两种理论各有特色. 试指出它们各自的要点(若将两种理论各自作一些改进, 其结果会彼此接近).3.3 考察共价键的形成时, 为什么先考虑原子轨道形成分子轨道, 再填充电子形成分子轨道上的电子云,而不直接用原子轨道上的电子云叠加来形成分子轨道上的电子云?3.4 “成键轨道的对称性总是g, 反键轨道的对称性总是u”. 这种说法对不对? 为什么?3.5 一般地说, π键要比σ键弱一些. 但在任何情况下都是如此吗? 请举实例来说明.3.6 N2作为配位体形成配合物时, 通常以2σg电子对去进行端基配位(即N ≡ N→), 而不以1πu电子对去进行侧基配位。
原子物理学作业习题1
原子物理学作业习题1原子物理学习题第一章原子的核式结构1.选择题:(1)原子半径的数量级是:A .10-10cm; B.10-8m C. 10-10m D.10-13m(2)原子核式结构模型的提出是根据α粒子散射实验中A. 绝大多数α粒子散射角接近180?B.α粒子只偏2?~3?C. 以小角散射为主也存在大角散射D. 以大角散射为主也存在小角散射(3)进行卢瑟福理论实验验证时发现小角散射与实验不符这说明:A. 原子不一定存在核式结构B. 散射物太厚C. 卢瑟福理论是错误的D. 小角散射时一次散射理论不成立(4)用相同能量的α粒子束和质子束分别与金箔正碰,测量金原子核半径的上限. 问用质子束所得结果是用α粒子束所得结果的几倍?A. 1/4 B . 1/2 C . 1 D. 2(5)动能E K =40keV 的α粒子对心接近Pb(z=82)核而产生散射,则最小距离为(m ):A.5.91010-?B.3.01210-?C.5.9?10-12D.5.9?10-14(6)如果用相同动能的质子和氘核同金箔产生散射,那么用质子作为入射粒子测得的金原子半径上限是用氘核子作为入射粒子测得的金原子半径上限的几倍?A.2B.1/2C.1 D .4(7)在金箔引起的α粒子散射实验中,每10000个对准金箔的α粒子中发现有4个粒子被散射到角度大于5°的范围内.若金箔的厚度增加到4倍,那么被散射的α粒子会有多少?A. 16B..8C.4D.2(8)在同一α粒子源和散射靶的条件下观察到α粒子被散射在90°和60°角方向上单位立体角内的粒子数之比为:A .4:1 B.2:2 C.1:4 D.1:8(9)在α粒子散射实验中,若把α粒子换成质子,要想得到α粒子相同的角分布,在散射物不变条件下则必须使:A.质子的速度与α粒子的相同;B .质子的能量与α粒子的相同;C .质子的速度是α粒子的一半;D .质子的能量是α粒子的一半2.简答题:(1)简述卢瑟福原子有核模型的要点.(2)简述α粒子散射实验. α粒子大角散射的结果说明了什么?(3)什么是微分散射截面?简述其物理意义.(4)α粒子在散射角很小时,发现卢瑟福公式与实验有显著偏离,这是什么原因?(5)为什么说实验证实了卢瑟福公式的正确性,就是证实了原子的核式结构?(6)用较重的带负电的粒子代替α粒子作散射实验会产生什么结果?中性粒子代替α粒子作同样的实验是否可行?为什么?(7)在散射物质比较厚时,能否应用卢瑟福公式?为什么?(8)普朗光量子假说的基本内容是什么?与经典物理有何矛盾?(9)为什么说爱因斯坦的光量子假设是普朗克的能量子假设的发展.(10)何谓绝对黑体?下述各物体是否是绝对黑体?(a)不辐射可见光的物体;(b)不辐射任何光线的物体;(c)不能反射可见光的物体;(d)不能反射任何光线的物体;(e)开有小孔空腔.3.计算题:(1)当一束能量为4.8Mev 的α粒子垂直入射到厚度为4.0×10-5cm 的金箔上时探测器沿20°方向上每秒记录到2.0×104个α粒子试求:①仅改变探测器安置方位,沿60°方向每秒可记录到多少个α粒子?②若α粒子能量减少一半,则沿20°方向每秒可测得多少个α粒子?③α粒子能量仍为4.8MeV,而将金箔换成厚度的铝箔,则沿20°方向每秒可记录到多少个α粒子?(ρ金=19.3g/cm 3 ρ铅=27g /cm 3;A 金=179 ,A 铝=27,Z 金=79 Z 铝=13)(2)试证明:α粒子散射中α粒子与原子核对心碰撞时两者之间的最小距离是散射角为900时相对应的瞄准距离的两倍.(3)10Mev 的质子射到铜箔片上,已知铜的Z=29, 试求质子散射角为900时的瞄准距离b 和最接近于核的距离r m .(4)动能为5.0MeV 的α粒子被金核散射,试问当瞄准距离分别为1fm 和10fm 时,散射角各为多大?(5)假设金核半径为7.0fm ,试问:入设质子需要多大能量,才能在对头碰撞时刚好到达金核表面?(6)在α粒子散射实验中,如果用银箔代替金箔,二者厚度相同,那么在同样的偏转方向,同样的角度间隔内,散射的α粒子数将减小为原来的几分之几?银的密度为10.6公斤/分米3,原子量为108;金的密度为19.3公斤/分米3,原子量197。
4、中南大学无机化学题库(是非题)
2
(二) 原子结构 1. ( 2. ( 3. ( 4. ( 5. ( 6. ( 7. ( )原子核外电子的能量,按照其离核的远近呈现连续增大的变化。 )各元素原子核外电子的能量大小均由主量子数 n 所决定。 )所有电子的原子轨道都有特定的空间取向。 )主量子数 n 为 4 时,可能的原子轨道总数为 16,可容纳的电子总数为 32。 )所有非金属元素(H 除外)都在 p 区,但 p 区元素并不都是非金属元素。 )原子半径是指单独存在的自由原子的半径。 )一个元素的原子,核外电子层数与该元素在周期表中所处的周期数相等;最外层 电子数与该元素在周期表中所处的族数相等。 8. ( )硅原子的最外层电子有 4 个,根据洪特规则,这 4 个电子的排布轨道图如下:
24. (
)波动性是微观粒子的普遍特征,但一个电子短时间的运动并不能显示波动性,只 有长时间运动的统计性结果才显示出波动性。
25. ( 26. ( 27. ( 28. ( 29. ( 30. ( 31. ( 32. ( 33. ( 34. ( 35. ( 36. ( 37. ( 38. ( 39. ( 40. ( 41. ( 42. ( 43. ( 44. ( 45. ( 46. ( 47. ( 48. ( 49. (
19. ( 20. ( 21. (
)核外电子的自旋有顺时针和反时针两种方向。 )对于氢原子的 1s 电子,其玻尔半径就是它的界面图的半径。 )对于氢原子的 1s 电子,其玻尔半径小于它的界面图的半径。
3
22. ( 23. (
)氢原子光谱是最简单的,它总共只有四条谱线。 )核外电子的运动会消耗能量,其速度会逐渐变慢,因此只要时间足够长,电子最 终会掉进原子核里去。
27. (
)气体分子可以看作一些小的弹性颗粒,其理由是压力减小气体可以膨胀,压力增 大气体可以压缩。
第07章 原子结构 习题解答
第07章习题解答第07章(02484)原子轨道就是原子核外电子运动的轨道,这与宏观物体运动轨道的含义相同。
()。
解:错第07章(02485)以电子概率(几率)密度表示的空间图象即为原子轨道,波函数的空间图象即为电子云。
()解:错第07章(02486)电子云是核外电子分布概率(几率)密度的空间图象。
.()解:对第07章(02487)波函数表明微观粒子运动的波动性,其数值可大于零也可小于零,2表示电子在原子核外空间出现的概率(几率)密度。
.()解:对第07章(02488)所谓某原子轨道是指.()。
(A)一定的电子云;(B)核外电子出现的概率(几率);(C)一定的波函数;(D)某个径向分布函数。
解: C第07章(02489)与波函数视为同义语的是()。
(A)概率(几率)密度;(B)电子云;(C)原子轨道;(D)原子轨道的角度分布图。
解: C第07章(02490)氢原子的原子轨道能量取决于量子数()。
(A)n;(B)n和l;(C)l;(D)m。
解: A第07章(02491)下列有关电子云的叙述中,错误的是()。
(A)电子云形象地表示了电子在核外某处单位微体积内出现的概率(几率);(B)电子云形象化地表示了电子在核外空间某处出现的概率(几率)密度;(C)1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率(几率)为零;(D)电子云是电子运动的统计结果,它好象形成了一团带负电荷的云,包围在原子核的外边。
解: C第07章(02492)某原子轨道用波函数表示时,下列表示中正确的是()。
(A)n;(B)n,l;(C)n,l,m;(D)n,l,m,ms解: C第07章(02493)在氢原子光谱的能量关系式中,当处于基态时n1=______________,当核外电子电离时,n2=______________。
解:1;。
第07章(02494)氢原子光谱在可见光区有__________条谱线,可表示为_________________。
北师大无机化学习题解答]_《无机化学》(第四版,吴国庆,高等教育出版社)习题答案
第一章物质的结构1-1 在自然界中氢有三种同位素,氧也有三种同位素,问:总共有种含不同核素的水分子?由于3H太少,可以忽略不计,问:不计3H时天然水中共有多少种同位素异构水分子?1-2 天然氟是单核素(19F)元素,而天然碳有两种稳定同位素(12C和13C),在质谱仪中,每一质量数的微粒出现一个峰,氢预言在质谱仪中能出现几个相应于CF4+的峰?1-3 用质谱仪测得溴得两种天然同位素的相对原子质量和同位素丰度分别为79Br 789183占50。
54%,81Br 80。
9163占49。
46%,求溴的相对原子质量(原子量)。
1-4 铊的天然同位素203Tl和205Tl的核素质量分别为202。
97u和204。
97u,已知铊的相对原子质量(原子量)为204。
39,求铊的同位素丰度。
1-5 等质量的银制成氯化银和碘化银,测得质量比m(AgCl):m(AgBr)=1。
63810:1,又测得银和氯得相对原子质量(原子量)分别为107。
868和35。
453,求碘得相对原子质量(原子量)。
1-6 表1-1中贝采里乌斯1826年测得的铂原子量与现代测定的铂的相对原子质量(原子量)相比,有多大差别?1-7 设全球有50亿人,设每人每秒数2个金原子,需要多少年全球的人才能数完1mol金原子(1年按365天计)?1-8 试讨论,为什么有的元素的相对质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-9 太阳系,例如地球,存在周期表所有稳定元素,而太阳却只开始发生氢燃烧,该核反应的产物只有氢,应怎样理解这个事实?1-10 中国古代哲学家认为,宇宙万物起源于一种叫“元气”的物质,“元气生阴阳,阴阳生万物”,请对比元素诞生说与这种古代哲学。
1-11 “金木水火土”是中国古代的元素论,至今仍有许多人对它们的“相生相克”深信不疑。
与化学元素论相比,它出发点最致命的错误是什么?1-12 请用计算机编一个小程序,按1.3式计算氢光谱各谱系的谱线的波长(本练习为开放式习题,并不需要所有学生都会做)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[Article]物理化学学报(Wuli Huaxue Xuebao )June Acta Phys.鄄Chim.Sin .,2006,22(6):701~705Received:December 30,2005;Revised:February 21,2006.∗Correspondent,E ⁃mail:xugliangll@.河南师范大学博士科研启动项目(051003)资助ⒸEditorial office of Acta Physico ⁃Chimica Sinica原子个数n 对碳分子线C n (n =3~10)基态结构特性的影响徐国亮∗(河南师范大学物理与信息工程学院,河南新乡453007)摘要利用密度泛函B3LYP 方法,在6⁃311++g ∗∗基组水平上对碳分子线C n (n =3~10)体系的基态电子结构特性等作了理论计算.计算结果表明,当n 为奇数时,碳分子线C n 基态都为单重态,反之,当n 为偶数时,三重态为其稳定的基态.同时在得到碳分子线基态构型的基础上,对其极化率、电荷分布和能级分布进行了研究,确定了碳分子线体系最高占据轨道HOMO 能量E H ,最低未占据轨道LUMO 能量E L 与n 的关系式,即E H n -2<E H n <E Hn +2,E L n -2>E L n >E L n +2.因而碳分子线C n (n =3~10)体系的费米能级会表现出特有的奇偶振荡,本文也对该现象出现的原因进行了讨论.关键词:碳分子线,电子结构,离域效应,费米能级中图分类号:O641,O561The Effect of Number on the Structural Properties for Carbon MolecularWires C n (n =3~10)in Ground StateXU,Guo ⁃Liang ∗(College of Physics and Information Engineering,Henan Normal University,Xinxiang 453007,P.R.China )AbstractThe electronic structural properties of C n (n =3~10)molecular wires are investigated systemically using theB3LYP density functional method under the basis set 6⁃311++g ∗∗level.By the analysis about the calculated results,it can be found that because of the effect of delocalization,the ground state of carbon molecular wires C n is singlet as n is odd number,whereas the triplet is the stable ground state of carbon molecular wires C n as n is even number.Meanwhile,based on the obtained equilibrium structures in ground state,the polarizability,charge distribution and energy level distribution of carbon molecular wires have been investigated.At the same time,the relationship between high occupied molecular orbits E H (HOMO),low virtual molecular orbits E L (LOMO)and the number n of carbonmolecular wires is determined,i.e.,E H n -2<E H n <E H n +2,E L n -2>E L n >E Ln +2.Therefore,the fermi levels of carbon molecularwires display their own brand of odd ⁃even alternation properties.The reason for these properties of carbon molecular wires is explained in present work.Keywords :Carbon molecular wires,Electronic structure,Delocalization effect,Fermi level随着分子自组织生长的化学合成技术和扫描隧道电子显微镜(STM)测量技术的共同应用,人们可以精确测量通过单分子或分子簇的遂穿电流[1⁃2],并从原理上获得一些具有特殊功能的分子器件.因此如何利用分子的电学特性来制备分子器件成为分子电子学的重要研究领域之一[3⁃7].Reed 等人[8]采用两电极法在实验上第一次直接测量了有机分子(C 6H 4S 2)的电流⁃电压曲线,这是实验上第一次直接测量一个分子的伏安特性.实验结果显示出两个主要特征:(1)在电压很小时,无电流流过分子;(2)当电压增加701Acta Phys.鄄Chim.Sin.(Wuli Huaxue Xuebao ),2006Vol.22时,电导增加并呈现出平台特性.李英德等[9]利用弹性散射格林函数方法研究了共轭分子2⁃氨基⁃5⁃硝基⁃1,4⁃二乙炔⁃4′⁃苯硫醇基苯,表明分子吸附于金表面上,形成以共价键为主的混合键,为电子的转移提供了通道.同样,对纳米碳管进行拉伸也可以产生类似金原子线的碳分子线.作为一类特殊的低维有机分子,碳分子线的性质成为广泛关注的对象[10⁃15].在理论研究方面,人们发展了多种方法来理解分子器件的工作原理,寻找分子结构和分子电学性质的关系.由于分子器件的特性主要是由分子本身的电子结构和分子与金属表面的相互作用两个因素决定的,因此准确描述分子的电子结构显得十分重要.本文采用密度泛函B3LYP 方法,选用6⁃311++g ∗∗基组,对碳分子线C n (n =3~10)体系的电子结构进行了系统研究,该工作对进一步研究碳分子线与金属电极之间的电子传输,及其伏安特性具有重要的参考价值.1碳分子线C n (n =3~10)基态特性采用杂化的密度泛函理论B3LYP 方法[16⁃17],选用6⁃311++g ∗∗作为基组对碳分子线C n (n =3~10)体系的几何结构进行优化和电子结构计算.优化结果表明,碳分子线C n (n =3~10)结构属于D ∞h 群.当n 为奇数时,其基态为单重态,当n 为偶数时,其基态为三重态.为了便于比较,分别将n 为奇数、偶数的碳分子线C n (n =3~10)体系的键长r 、能量E 、原子平均能量E (=E /n )及单、三态能量差ΔE 列于表1、表2中.图1为碳分子线的结构示意图.优化所得各碳分子线的键长与文献值[18]符合得很好,分别比较n 为奇数、偶数时的键长r 1可知,随表1碳分子线C n (n =3,5,7,9)的键长、能量、原子平均能量和单、三态能量差Table 1Bond length,total energy,atomic average energy,and energy difference ΔE between singlet and triplet for C n (n =3,5,7,9)C n r /nmE (a.u.)E (a.u)△E /eV 1Σg Σg Σg1ΣgC 3r 1=0.12908-114.076853-113.996170-38.0256 2.195503C 5r 1=0.12857r 2=0.12812-190.254541-190.168444-38.0509 2.342815C 7r 1=0.12851r 2=0.12859r 3=0.12712-266.430523-266.350145-38.06152.187225C 9r 1=0.12846r 2=0.12885r 3=0.12694r 4=0.12755-342.6072568-342.561243-38.0675 1.2521013Σgr 1=0.12939r 1=0.12618r 2=0.12945r 1=0.12531r 2=0.13056r 3=0.12702r 1=0.12995r 2=0.12887r 3=0.12760r 4=0.12789Based on the symmetry,a part of bond is listed,i.e.r n -1=r 1,r n -2=r 2,r n -3=r 3,…….表2碳分子线C n (n =4,6,8,10)的键长、能量、原子平均能量和单、三态能量差Table 2Bond length,total energy,atomic average energy and energy difference ΔE between singlet and triplet for C n (n =4,6,8,10)n -11n -22n -33C n r /nmE (a.u.)E (a.u.)ΔE /eV 1Σg 3Σg1Σg 1Σg1ΣgC 4r 1=0.13097r 2=0.12928r 1=0.13086r 2=0.12891-152.103573-152.131944-38.03300.772031C 6r 1=0.12979r 2=0.12887r 3=0.12740r 1=0.12989r 2=0.12864r 3=0.12734-228.296857-228.318046-38.05300.57657C 8r 1=0.12927r 2=0.12898r 3=0.12720r 4=0.12811r 1=0.12944r 2=0.12877r 3=0.12721r 4=0.12791-304.483290-304.500382-38.06250.465101C 10r 1=0.12897r 2=0.12908r 3=0.12706r 4=0.12809r 5=0.12725r 1=0.12915r 2=0.12892r 3=0.12710r 4=0.12794r 5=0.12727-380.666802-380.681104-38.0681702No.6徐国亮:原子个数n 对碳分子线C n (n =3~10)基态结构特性的影响n 的增加,r 1值变小,这与体系能量降低相一致.由计算结果可以看出,随碳原子数目的增加,体系能量降低,各个碳原子的平均能量亦降低,下降趋势是以平缓、陡直相间隔(图2所示),且陡直程度逐渐平缓.从表2可以看出,当n 为偶数,碳分子线C n (n =4,6,8,10)的三重态与单重态能量差值ΔE 是逐渐减小的,C 4的能量差是C 10的2倍,这与文献[18]所说的变化趋势完全一致.当n 为奇数时,除C 5外,三重态与单重态能量差值ΔE 也具有同样的减小趋势.根据碳分子线成键性质与稳定性分析可知[19],当n 为偶数时,在三重态情况下,其价键结构具有单⁃三键交替形成式,或存在多中心共轭π键,因此其三重态比相应的单重态稳定.当n 为奇数时,体系含有较多的多中心键,存在较强的共轭,因而其单重态应为稳定的基态结构.从另一角度来考虑,文献[20]曾指出,对重元素分子,如Pu,Pu 2,Pu 3和Pu 4,存在明显的自旋极化效应,分别有6,12,18和24个未配对的自旋电子,其多重性分别为2S +1=7,13,19和25重态.平行自旋电子的交换积分不为零而为正值,因而可降低分子系统的能量.然而,电子配对亦可降低分子系统的能量.对重元素系统,平行自旋效应大于电子配对效应.在碳分子线C n (n =3~10)体系中,当n =偶数时,存在的单⁃三键交替现象引起明显的离域效应,这个离域效应主要由相邻原子的交换积分所引起,即是由平行自旋电子的交换积分所致,因为反平行自旋电子的交换积分为零.另一方面,当n =奇数时,如n =3或5时,在分子线的一端必然存在两个三中心三电子键,即两个π33,其中两个电子必须反平行,才能使系统稳定,因而必为单重态.这时π22和π33之间由于离域效应进一步增加了分子系统的稳定性.这些效应同样导致碳分子线中每个碳原子平均能量单调下降,这一结论与图2完全一致.因而可以说在碳分子线C n (n =3~10)体系中,离域效应也会导致自旋极化效应,使系统能量最低.2碳分子线C n (n =3~10)的极化率和电荷分布在得到碳分子线体系基态结构的基础上,选用B3LYP/6⁃311+g ∗∗方法,计算了碳分子线的极化率和电荷分布情况,其结果如表3所示.从表3的结果可以看出,随碳原子数n 的增加,碳分子线的极化率急剧增加(如图3所示),C 10的极化率是C 4的12倍多.在电荷分布方面,当n =3~6时,只有分子线两端的碳原子带负电荷,其余碳原子带正电荷;而当n =7~10时,除两端碳原子带负电荷外,在分子线的中心也有成对碳原子带负电荷.因而不同长度的碳分子线所表现出的伏安特性也将是不相同的,这也是在制备具有特殊功能的分子器件时需要注意的.3碳分子线C n (n =3~10)的轨道能级分布根据量子化学前线轨道理论,对分子和金属电极的共价键形成起主要作用的轨道是前线轨道.即最高占据分子轨道(HOMO)和最低的未占据分子轨道(LUMO)附近的轨道.本文在不涉及金属电极,得到碳分子线基态结构的基础上,采用B3LYP/6⁃311+g ∗∗方法计算了碳分子线C n (n =3~10)轨道能级.碳分子线C n (n =3~10)体系的能级计算结果见图4,其中长横线代表占据轨道,短横线代表未占据轨道.最高占据轨道能级反映了分子失去电子能力的强弱,HOMO 能级越高,该分子越易失去电子.而LUMO 能级在数值上与分子的电子亲和势相当,LUMO 能级越低,该分子越易得到电子.HOMO 与LUMO 能隙差的大小反映了电子从占据轨道向空轨道发生跃迁的能力,在一定程度上代表了分子参与化学反应的能力.由图4及计算结果可以得出,随图1碳分子线示意图Fig1Scheme of carbon molecular wires C n (n =3~10)system图2碳分子线原子平均能量E 与碳原子个数(n )的关系Fig.2The relation between the atomic averageenergy and the number (n )of carbon molecular wires C n (n =3~10)703Acta Phys.鄄Chim.Sin.(Wuli Huaxue Xuebao ),2006Vol.22着碳分子线长度的增加,HOMO 能量E H 随之升高,而LUMO 能量E L 随之降低,存在关系式E H n -2<E H n <E Hn +2,E L n -2>E L n >E L n +2.对于费米能级的确定,一种合理的近似是设费米能级在禁带的中部[9],即E F =E L +(E H -E L )/2.将计算所得碳分子线C n (n =3~10)费米能级绘制成图5,可以看出,碳分子线费米能级表现出特有的奇偶振荡性,即n 为奇数时的E F 小于n 为偶数时的E F ,且E F 随着碳原子数的增加而有升高趋势,这是由碳分子线的离域效应所致.4结论采用密度泛函B3LYP 方法,选用6⁃311++g 鄢鄢基组,对碳分子线C n (n =3~10)体系的电子结构进行了系统研究.对其基态特性、平均能量、极化率、电荷分布和能级分布系统分析后得出如下结论.(1)由于碳分子线体系离域效应的存在,使得碳图3碳分子线极化率与碳原子个数n 的关系Fig.3The relation between the polarizability andthe number of carbon molecular wires C n (n =3~10)C n p Charge distributionC 350.3181C -0.0558182C 0.1116363C -0.055818C 492.7951C -0.2581082C 0.2581083C 0.2581084C -0.258108C 5140.6151C -0.1796472C 0.0757223C 0.2078514C 0.0757225C -0.179647C 6215.0451C -0.4587416C -0.4587412C -0.3705293C 0.0882124C 0.0882125C 0.370529C 7288.5911C -0.2233116C 0.0988952C 0.0988957C -0.2233113C -0.0703114C 0.3894555C -0.070311C 8402.9971C -0.6437246C 0.1822162C 0.4750077C 0.4750073C 0.1822168C -0.6437244C -0.0134995C -0.013499C 9503.3701C -0.3604946C -0.4349402C 0.1273097C 0.3850453C 0.3850458C 0.1273094C -0.4349409C -0.3604945C0.566160C 10666.9611C -0.9648146C0.1946972C 0.6840707C-0.2775593C 0.3636068C0.3636064C -0.2775599C0.6840705C 0.19469710C -0.964814表3碳分子线C n (n =3~10)的极化率(P )和电荷分布Table 3The polarizability (P )and charge distribution of carbon molecular wires C n (n=3~10)图4碳分子线C n (n =3~10)体系的轨道能级Fig.4The orbital levels of carbon molecular wiresC n (n =3~10)—:occupied molecular orbit;-:rirtual molecularorbit图5碳分子线C n (n =3~10)体系的费米能级Fig.5The fermi levels of carbon molecular wiresC n (n =3~10)704No.6徐国亮:原子个数n对碳分子线C n(n=3~10)基态结构特性的影响分子线的碳原子数n为偶数时,基态均为三重态,且有单⁃三键交替形式存在,而n为奇数时,基态均为单重态.系统能量随n的增大而减小,导致碳分子线中每个碳原子的平均能量单调下降.(2)随碳原子数n的增加,碳分子线的极化率急剧增加.不同长度的碳分子线中其电荷分布的规律是不同的,因而不同长度的碳分子线所表现出的伏安特性也将是不相同的.(3)随着碳分子线长度的增加,HOMO能量E H 随之升高,而LUMO能量E L随之降低,存在关系式E H n-2<E H n<E H n+2,E L n-2>E L n>E L n+2.碳分子线费米能级会出现特有的奇偶振荡现象.References1Bumm,L.A.;Arnold,J.J.;Cygan,M.T.Science,1996,271:1705 2Adam,R.M.;Theresa,H.J.Applied Phys.Lett.,2002,81(16):3042 3Damle,P.S.;Ghosh,A.W.;Datta,S.Chem.Phys.,2002,281:171 4Damle,P.S.;Ghosh,A.W.;Datta,S.Phys.Rev.B,2001,64:2014035Wang,C.K.;Li,H.H.;Li,Y.D.Science in China A,2002,32(8):704[王传奎,李红海,李英德.中国科学A(ZhonguoKexue A),2002,32(8):704]6Collier,C.P.;Wong,E.W.;Belohradsky,M.Science,1999,285: 3917Joachim,C.;Gimzewski,J.K.;Aviram,A.Nature,2000,408:541 8Reed,M.A.;Zhou,C.;Muller,C.J.;Burgin,T.P.;Tour,J.M.Science,1997,278:2529Li,Y.D.;Li,H.H.;Wang,C.K.Acta Phys.Sin.,2002,51(10):2349[李英德,李红海,王传奎.物理学报(Wuli Xuebao),2002, 51(10):2349]10Baer,R.;Seideman,T.;Neuhauser,D.Chem.Phys.,2003,120: L338711Seungwu,H.J.Korean Phys.Soc.,2001,39(3):56412Baer,R.;Neuhauser,D.Int.J.Quant.Chem.,2003,91:L52413Rueckes,T.;Kim,K.;Joselevich,E.Science,2000,289:9414Lang,N.D.;Avouris,P.Phys.Rev.Lett.,1998,81:351515Lang,N.D.;Avouris,P.Phys.Rev.Lett.,2000,84:35816Becke,A.D.Phys.Rev.A,1988,38:309817Becke,A.D.J.Chem.Phys.,1993,98:564818Weltner,J.W.;Van,Z.R.J.Chem.Rev.,1989,89:171319Cao,Z.X.;Liang,G.M.;Tian,A.M.Acta Phys.鄄Chim.Sin., 1993,9(6):770[曹泽星,梁国明,田安民.物理化学学报(Wuli Huaxue Xuebao),1993,9(6):770]20Meng,D.Q.;Zhu,Z.H.;Jiang,G.J.Molecular Structure,2002, 610:241705。
