含量均匀度
含量均匀度操作规程

含量均匀度操作规程1. 引言含量均匀度是评价药物制剂质量的重要指标之一。
合格的药物制剂应该在整个批次中保持均匀的含量,以确保每个剂量单元的有效成分符合规定的标准。
本操作规程旨在规范含量均匀度测试的操作流程,确保测试结果准确可靠。
2. 适用范围本操作规程适用于药物制剂的含量均匀度测试。
3. 仪器和试剂准备3.1. 含量均匀度测试所需仪器包括:分析天平、振荡器、试验管等。
3.2. 所需试剂包括:待测试的药物制剂样品、溶剂等。
4. 操作步骤4.1. 准备工作 4.1.1. 将分析天平校准至合适的灵敏度和准确度。
4.1.2. 准备适量的溶剂,满足测试样品的溶解需求。
4.2. 试样制备 4.2.1. 将药物制剂样品称取合适的质量,并记录质量值。
4.2.2. 将样品溶解于适量的溶剂中,并充分混合均匀,以得到均一的样品溶液。
4.3. 空白样品制备 4.3.1. 准备相同质量的溶剂,作为空白样品。
4.3.2. 将溶剂倒入试验管中,作为空白样品。
4.4. 振荡测试 4.4.1. 将试样管和空白样品管放入振荡器中。
4.4.2. 设置振荡器的参数,如振荡频率、振荡时间等。
4.4.3. 开始振荡测试,并确保试样管和空白样品管在相同条件下振荡。
4.5. 含量测定 4.5.1. 将振荡结束后的试样管和空白样品管取出。
4.5.2. 使用分析天平分别称取试样管和空白样品管中的溶液质量,并记录质量值。
4.5.3. 计算试样的含量,根据以下公式:含量 = (试样溶液质量 - 空白溶液质量) / 试样质量 x 100%5. 结果评定与记录5.1. 根据所制备的样品,计算每个样品的含量。
5.2. 通过对含量数据进行统计分析,计算均值和相对标准偏差。
5.3. 判断样品的含量均匀度是否符合规定的标准范围。
5.4. 将测试结果进行记录,并进行必要的数据分析和报告。
6. 风险与安全措施6.1. 在操作过程中要注意个人安全,并遵守实验室安全规定。
含量均匀度操作规程

含量均匀度操作规程含量均匀度操作规程一、目的和范围为了确保制药工艺中药品含量均匀度的一致性,保证药物的质量,制定本操作规程。
本操作规程适用于制药工艺中含量均匀度的检测和调整。
二、定义1. 含量均匀度:指药品中各组分在一定范围内的分布是否均匀。
2. 均匀度检测:通过一定方法和仪器检测药品中各组分的含量分布情况,以评估均匀度。
3. 均匀度调整:根据均匀度检测结果,针对不符合要求的药品进行调整。
三、原料准备1. 按照生产工艺要求准备所需的原料。
2. 对原料进行检测,确保原料的含量和质量符合要求。
四、装备准备1. 保证使用的仪器设备处于良好的工作状态。
2. 根据检测方法准备所需的仪器和试剂。
3. 对仪器和试剂进行校准和检验,确保准确性和精确度。
五、检测操作1. 按照检测方法,将待检药品取样。
2. 准确称取样品,并将样品置于检测仪器中进行测定。
3. 检测结束后,记录检测结果。
4. 根据检测结果,评估样品的含量均匀度,并判断是否符合要求。
六、调整操作1. 如果样品的含量均匀度符合要求,则不需要进行调整操作。
2. 如果样品的含量均匀度不符合要求,根据不同的情况,采取相应的调整措施。
3. 调整措施可以包括调整原料比例、改变加工工艺、调整设备参数等。
4. 调整完成后,重新取样并进行检测,直到样品的含量均匀度符合要求为止。
七、记录和报告1. 对每次含量均匀度检测和调整操作进行详细记录,包括检测方法、检测结果、调整措施等。
2. 汇总记录,形成相应的报告,并进行归档。
3. 定期进行含量均匀度的总结和分析,分析调整的效果,并根据需要对操作规程进行修订和完善。
八、操作注意事项1. 操作人员必须熟悉检测方法和仪器的操作要求,确保准确性和可靠性。
2. 操作过程中,保持操作环境的清洁与整洁,防止污染样品。
3. 操作中应注意安全,遵守相关的操作规范和安全规程。
4. 定期对仪器设备进行维护和保养,确保其正常运行。
5. 检测和调整过程应记录详细,以便追溯和分析。
含量均匀度检查法操作规程

含量均匀度检查法操作规程一、仪器和试剂准备1.高效液相色谱仪(HPLC)及其附件;2.所需的标准品和质量控制品;3.色谱柱:选择合适的色谱柱,确保其适应检测的活性成分;4.进样器:设定合适的进样体积,保证样品浓度适中;5.洗涤溶剂和流动相:按照方法要求配置好洗涤溶剂和流动相;6.离心机:用于制备样品溶液;7.干燥器:用于干燥样品或试剂;8.重量计:用于称取试剂和样品;9.pH计:用于测定溶液的pH值;10.紫外可见分光光度计:用于检测溶液的吸光度。
二、操作步骤1.样品的制备(1)将样品药品的数量根据检测要求称取到干燥器中;(2)打开干燥器,将药品在低温下进行干燥,直到其完全干燥;(3)关闭干燥器,等待样品冷却;(4)将干燥后的样品用适量的洗涤溶剂溶解,并进行适当的振荡和离心;(5)取出上清液,即为样品溶液。
2.仪器的配置(1)打开HPLC仪器的电源,并进行预热和平衡;(2)将色谱柱连接好,保证其正常的流动相;(3)调整进样器的体积,设定合适的样品进入量;(4)检查流速、温度和检测波长等参数的设置是否正确。
3.样品的进样(1)用吸管或进样器将样品溶液吸入色谱柱;(2)调整进样器的进样速度和体积,确保样品进入量合适。
4.HPLC方法运行(1)启动HPLC仪器,进入相应的方法运行界面;(2)设置合适的流动相速度,保证样品的快速流动;(3)检测样品的吸光度,记录峰高和峰面积等数据。
5.数据分析与结果记录(1)将样品的吸光度数据转化为样品中活性成分的含量;(2)对各个样品进行含量均匀度分析;(3)判断样品的含量均匀度是否合格;(4)记录各个样品的含量均匀度结果。
6.结果的解释与判断(1)根据含量均匀度检查结果,判断样品的质量是否合格;(2)当样品的含量均匀度达到要求时,判定为合格;(3)当样品的含量均匀度不达标时,判定为不合格;(4)根据不同样品的含量均匀度结果,进行相应的药品调整或重配。
三、操作注意事项1.严格按照方法要求进行操作;2.仔细准备和称取样品和试剂,避免误差;3.所有仪器和试剂都要按照要求进行校准和质量验证;4.样品制备时要避免污染和杂质的存在;5.检查样品进样的速度和体积,保证其准确性和一致性;6.在HPLC方法运行过程中,监测仪器和管路的状态,并及时处理异常情况;7.数据分析和结果判定要准确、客观、合理;8.结果的解释和判断要全面、客观,并根据相应的质量标准进行评价;9.操作结束后,及时清洗和维护仪器设备,确保其正常使用。
药物含量均匀度的作用

药物含量均匀度的作用
药物含量均匀度是指同一批次的药物制剂中药物成分的浓度分布是否均匀。
药物含量均匀度的作用有以下几个方面:
1. 药效可靠性:药物含量均匀度高可以确保药物在制剂中的浓度分布均匀,从而保证每一次使用时药物的剂量准确,药效可靠。
2. 治疗效果:药物含量均匀度高有助于确保患者每次使用的药物剂量相同,提高药物的治疗效果。
如果药物含量均匀度较低,可能导致剂量不一致,影响疗效。
3. 安全性:药物含量均匀度高可以避免药物剂量过高或过低的情况发生。
过高的药物剂量可能导致药物的毒副作用增加,过低的药物剂量则可能无法产生预期的治疗效果。
4. 产品质量控制:药物含量均匀度是药物品质的重要指标之一,监控药物含量均匀度可以有效控制产品的质量,确保制剂在不同批次之间的一致性。
药物含量不均匀可能导致产品质量不稳定,增加质量控制的困难。
因此,药物含量均匀度的高低对于药物的效果、安全性以及产品质量控制都具有重要的影响,是药物制剂过程中需要重视的方面。
含量均匀度 一组

吡罗昔康片、盐酸、甲醇
(二)操作方法
1.取本品1片,置100mL容量瓶中。
2.加0.1mol/L盐酸甲醇溶液适量,超声20 分钟,超声20min使吡罗昔
康溶解。
3. 0.1mol/L盐酸甲醇溶液稀释至刻度,摇匀,滤过。 4. 精密量取续滤液适量,用 0.1mol/L 盐酸甲醇溶液定量稀释制成每 1mL中吡罗昔康的溶液 5.照紫外-可见分光光度法(通则0401),在波长334nm处测定吸光度。 6.按C15H13N3O4S的吸收系数为856计算含量。
(3)粒子形态的影响粒子形态规则,表面平滑,易于混匀;但
各组分的密度差异如果较大,则易于因振动再分离,致均匀度不好。
吡罗昔康片含量均匀度测定
――紫外可见分光光度法
本品含吡罗昔康( C15H13N3O4S )应为标示量的90.0% 〜110.0%
(一)主要仪器与药品
1.仪器
紫外分光光度计
超声波清洗器
(三)记录与计算
记录: 应记录检测方法,所用仪器型号,以及每片测得的结果等。 计算: 1.共做10片,分别测定每片以标示量为100的相对含量X
2.求10片平均值x
3.标准差S
4.标示量与均值之差的绝对值A(A=∣100-x∣)
(四)结果判断
(2)当A > 0.25 L时,若A+1.7 S≤L ,符合规定 若A+1.7 S>L ,不符合规定 注意
检验原始记录填写要求
所用检测方法,仪器型号,测定条件,供试
溶液的制备方法,各测量值,计算结果与判断。
Thank Thank You You
(五)注意事项
1.供试品的主要必须溶解完全,必要时可用乳钵研磨或超声波处 理,促使溶解,并定量转移到容量瓶中。
15版药典含量均匀度检查法
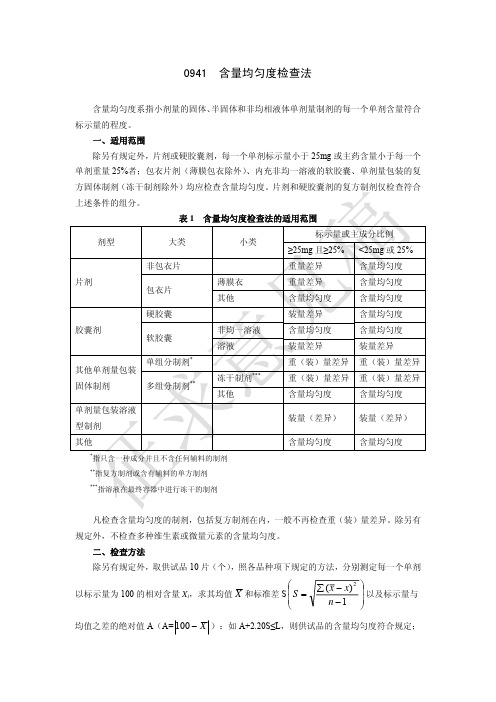
0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。
含量均匀度检查法

含量均匀度检查法含量均匀度检查法是一种用于检测药物活性成分在制剂中的均匀分布程度的方法。
其目的是确保制备的药物剂型无论在剂量单元还是整个剂型范围内,药物成分均匀分布,以保证治疗效果的一致性和可靠性。
本文将介绍含量均匀度检查法的原理、应用和操作步骤,旨在提供一种简明扼要的指导。
一、原理含量均匀度检查法基于样品的多次取样检测,通过检查不同位置或不同制剂单位中活性成分的含量来评估制剂的均匀度。
这种方法可以分析出制剂中成分分布的不一致性,从而评估药物品质和稳定性。
二、应用含量均匀度检查法广泛应用于药品生产和质量控制的各个环节。
尤其对于固体制剂如片剂、胶囊剂,以及液体制剂如溶液和悬浊液等,均匀度的检测是必要的。
这种方法能够帮助制药企业判断产品是否符合国家相关标准和规定要求,为产品的质量控制提供依据。
三、操作步骤1. 样品准备:按照相关规程,制备一定数量的样品。
2. 取样:在样品中分别取若干等份,要保证取样的均匀性。
3. 测试:对每个取样进行活性成分的含量测定。
4. 数据处理:将各个样品的含量数据进行统计分析,计算出平均值、标准偏差和相对标准偏差等指标。
5. 结果判定:根据国家标准或企业内部标准,判断样品的活性成分含量均匀度是否合格。
四、注意事项1. 取样时要注意样品的代表性和均匀性,以确保取样的准确性和可靠性。
2. 检测前要对仪器设备进行校准,以保证测试结果的准确性和可比性。
3. 检测过程中要按照规程和操作规范来进行,避免操作失误。
4. 数据处理时,要选择合适的统计方法和指标,以得出准确可靠的结果。
5. 结果判定时要参照相应的标准和规范,以确保判定的准确性和公正性。
五、总结含量均匀度检查法是一种重要的药品质量控制方法,在药品生产和质量保证中起着关键作用。
通过这种方法,制药企业可以检测药物制剂中活性成分的分布均匀性,确保产品质量的稳定和一致性。
因此,在药品生产和监管中,合理应用含量均匀度检查法是非常必要的。
药物分析之西药分析——含量均匀度检查法

量均匀度系指小剂量片剂、膜剂、胶囊剂或注射用无菌粉末等制剂中的每片(个)含量偏离标示量的程度。
凡检查含量均匀度的制剂,不再检查重(装)量差异。
除另有规定外,取供试品10片(个),照各药品项下规定的方法,分别测定每片以标示量为100的相对含量X,求其均值X和标准差S①以及标示量与均值之差的绝对值A(A=│100-X|);如A+1.80S≤15.0,即供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+ 1.80S >15.0,且A+S≤15.0,则应另取20片(个)复试。
根据初、复试结果,计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,即供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
如该药品项下规定含量均匀度的限度为±20%或其他百分数时,应将上述各判断式中的15.0改为20.0或其他相应的数值,但各判断式中的系数不变。
在含量测定与含量均匀度检查所用方法不同时,而且含量均匀度未能从响应值(如吸收度)求出每片含量情况下,可取供试品10片(个),照该药品含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰面积等),求其均值Y。
另由含量测定法测得以标示量为100的含量X<[A] >,由X<[A]>除以响应值的均值Y,得比例系数K(K=X<[A]>/Y)。
将上述诸响应值Y与K相乘,求得每片标示量为100的相对百分含量X(X=KY),同上法求其均值X和S以及A,计算,判定结果,即得。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
含量均匀度系指小剂量的固体、半固体 和非均相液体单剂量制剂的每一个单剂含量 符合标示量的程度。
除另有规定外,片剂或硬胶囊剂,每一个单 剂标示量小于25mg或主药含量小于每一个单剂 重量25%者;包衣片剂(薄膜包衣除外)、内充 非均一溶液的软胶囊、单剂量包装的复方固体制 剂(冻干制剂除外)均应检查含量均匀度。片剂 和硬胶囊剂的复方制剂仅检查符合上述条件的组 分。凡检查含量均匀度的制剂,包括复方制剂在 内,一般不再检查重(装)量差异。除另有规定 外,不检查多种维生素或微量元素的含量均匀度。
含量均匀度的限度应符合式中L=15.0;单剂量包装的 口服混悬剂、内充非均一溶液的软胶囊、胶囊型或泡囊型 粉雾剂、单剂量包装的眼用、耳用、鼻用混悬剂、固体或 半固体制剂,其限度均应为±20%,即L=20.0;透皮贴剂、 栓剂的限度应为±25%,即L=25.0。 如该品种项下规定 含量均匀度的限度为±20%或其他数值时,应将上述各判 断式中的15.0改为20.0或其他相应的数值,但各判断式中 的系数不变。 当含量限度上下限的平均值(T)大于 100.0(%)时,若X<100.0,则A=X−100;若 100.0≤X≤T,则A=0;若X>T,则A=X−T。同上法计算, 判定结果,即得。 若含量测定与含量均匀度检查所用检测方法相同,可将含 量均匀度中的均值X作为含量测定结果。试验过程应满足 含量测定的精密度要求
*指只含一种成分并且不含任何辅料的制剂 ** 指复方制剂或含有辅料的单方制剂 *** 指溶液在最终容器中进行冻干的制剂
检查方法
除另有规定外,取供试品10片(个),照各药品项
下规定的方法,分别测定每片以标示量为100的相 对含量X,求其均值X和标准差S以及标示量与均值 之差的绝对值A(A=∣100-X∣);如 A+1.80S≤15.0,即供试品的含量均匀度符合规定; 若A+S>15.0,则不符合规定;若A+1.80S>15.0, 且A+S≤15.0,则应另取20片(个)复试。根据初、 复试结果,计算30片(个)的均值X、标准差S和标 示量与均值之差的绝对值A;如A+1.45S≤15.0,即 供试品的含量均匀度符合规定;若A+1.45S>15.0, 则不符合规定。
当不能直接测定单剂含量时的处理方法
在含量测定与含量均匀度检查所用方法不同时,而且 含量均匀度未能从响应值求出每片含量情况下,可取供试 品10片(个),照该药品含量均匀度项下规定的方法,分 别测定,得仪器测定法的响应值Yi(可为吸收度、峰面积 等),求其均值Y.另由含量测定法测得以标示量为100的 含量XA,由XA除以响应值的均值Y,得比例系数K (K=XA/Y)。将上述诸响应值Y与K相乘,求得每片标示 量为100的相对含量(%)Xi(X=KYi),同上法求X和S 以及A,计算,判定结果,即得。如需复试,应另取20片 (个),按上述方法测定,计算30片(个)的均值、比例 系数K、相对含量(%)X、标准差S和A,判定结果,即 得。
