实验六苯甲酸(微波)与苯甲酸乙酯的制备
实验六苯甲酸(微波)与苯甲酸乙酯的制备

实验六苯甲酸(微波)与苯甲酸乙酯的制备一、实验目的1.学习苯甲酸的微波氧化合成方法。
2.掌握制备苯甲酸乙酯的原理和实验方法。
3.掌握分水器的使用,巩固萃取、回流等基本操作。
4.学习半微量有机合成实验操作。
二、基本原理微波辐射化学是研究在化学中应用微波的一门新兴的前沿交叉学科,它在国外的研究进展十分活跃。
自从1986年Gedye 等首次报道了微波作为有机反应的热源可以促进有机化学反应以来,微波技术已成为有机化学反应研究的热点之一。
与常规加热法相比,微波辐射促进合成方法具有显著的节能、提高反应速率、缩短反应时间、减少污染,且能实现一些常规方法难以实现的反应等优点。
本实验在微波辐射下合成苯甲酸,然后在浓硫酸催化下,苯甲酸和无水乙醇发生酯化反应得到苯甲酸乙酯。
主反应为:CH 2OH +34 KMnO 4COOK 3+ 4 MnO 2 + KOH + 4 H 2O COOK+ HClCOOH+ KClCOOH+ C 2H 5OH+COOC 2H 5+ H 2O副反应为:2 C 2H 5OHC 2H 5OC 2H 5 + H2O由于酯化反应是一个平衡常数较小的可逆反应,为了提高产率,在实验中采用过量的乙醇,同时利用苯-水共沸物尽可能除去产物中的小分子副产物-水。
合成苯甲酸乙酯的反应机理:三、主要试剂与仪器1.试剂苯甲醇2.1mL(20m mol),高锰酸钾4.2g(26.6m mol),无水乙醇2.0mL(34.3m mol),碳酸钠2.0g,苯2.8mL,乙醚10mL,浓硫酸,10%碳酸钠溶液,浓盐酸,无水氯化钙。
2.仪器250mL圆底烧瓶,球形冷凝管,布氏漏斗,吸滤瓶,烧杯,锥形瓶,微型仪器一套(包括15mL、10mL圆底烧瓶,球形冷凝管,分水器,分液漏斗,直形冷凝管,空气冷凝管,蒸馏头,克氏蒸馏头,支管接引管,锥形瓶,量筒,烧杯,毛细管等),微波反应器,红外灯。
四、实验步骤1.苯甲酸的制备在250mL圆底烧瓶中加入依次加入4.2g高锰酸钾、2.0g碳酸钠、20mL水,摇匀,再加入2.1mL 苯甲醇、30mL水和2粒沸石。
苯甲酸乙酯制备方案
酯类香料的合成设计——苯甲酸乙酯的合成方案苯甲酸乙酯(EBA)又名安息香乙酯⋯,为无色或淡黄色液体,略似依兰油香气,呈较强的冬青油和水果香,香调和顺带甜,天然品存在于桃子、菠萝、醋栗中。
它是一种典型常见的芳香酸酯,具有广泛的实际用途,如:作为高分子材料的聚合催化剂、染料分散剂等;广泛用于香料工业,也可用于纤维素酯、纤维索醚、树脂等的溶剂;由于它本身的荧光量子效率很低 J,所以也常作为一种荧光淬灭剂,随着人们对它的光物理性质研究的深入、,苯甲酸乙酯的合成正越来越受到人们的重视。
在工业上,苯甲酸乙酯是以浓硫酸做催化剂,由苯甲酸和乙醇直接酯化或者由苯甲酸甲酯与乙醇通过酯交换制备,但都摆脱不了操作麻烦或者腐蚀设备等缺点。
查文献知,一水硫酸氢钠能够提供氢离子【2】,可以作为催化剂,且不不是设备,操作也较简单。
在此,我们采用一水硫酸氢钠做催化剂,并探索其最佳用量及催化活性。
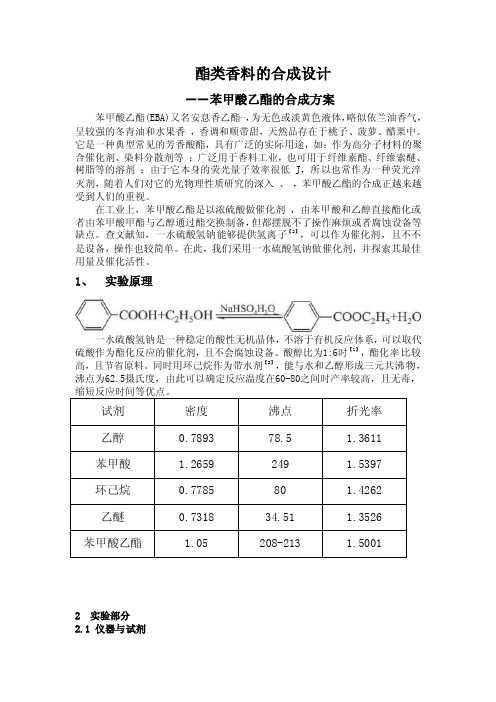
1、实验原理一水硫酸氢钠是一种稳定的酸性无机晶体,不溶于有机反应体系,可以取代硫酸作为酯化反应的催化剂,且不会腐蚀设备。
酸醇比为1:6时【1】,酯化率比较高,且节省原料。
同时用环己烷作为带水剂【2】,能与水和乙醇形成三元共沸物,沸点为62.5摄氏度,由此可以确定反应温度在60-80之间时产率较高,且无毒,2 实验部分2.1 仪器与试剂仪器:阿贝折射仪、电热套、回流冷凝管、直型冷凝管、50ml三颈烧瓶、分水器、电磁搅拌器试剂:苯甲酸(分析纯)、乙醇(分析纯)、BF3 、固体碳酸钠、环己烷、无水氯化钙、乙醚(分析纯)2.2 苯甲酸乙酯的合成①、在干燥洁净的100ml蒸馏烧瓶中依次加入8g(0.066mol)苯甲酸,19ml(0.396mol)无水乙醇,15ml环己烷,(4,5,6,7,8,9)g NaHSO4,磁子。
②、按实验装置图组装仪器,开启电磁搅拌器,加热回流,控制温度在60—80摄氏度之间,从有物质开始回流计时,回流90min【3】.③、当分水器中分出12ml水时,说明反应已经结束,继续加热,蒸出多余的乙醇和环己烷,从分水器中放出。
一种制备苯甲酸乙酯的方法

一种制备苯甲酸乙酯的方法制备苯甲酸乙酯有多种方法,以下是一种常用的实验室合成方法。
首先,准备以下实验材料和仪器:-苯甲酸-乙醇-硫酸催化剂(如无水硫酸)-回流装置-冷凝器-干燥管-分液漏斗-试剂瓶-量筒-烧杯-洗涤瓶-吸引装置-温浴设备操作步骤如下:1. 量取一定量的苯甲酸(摩尔质量为122.12 g/mol)和适量的乙醇(摩尔质量46.07 g/mol),分别称为物A和物B。
为了方便计算,可以选择20 mL苯甲酸和40 mL乙醇。
2.将物A倒入烧杯中,加入适量的硫酸催化剂(通常使用若干滴催化剂),并充分搅拌使其溶解。
3.将物B逐次加入物A中,同时用回流装置连接烧杯和冷凝器。
回流装置的作用是在反应过程中回收和循环使用乙醇。
4.加热烧杯使反应液回流,同时用冷凝器冷却气体,使它们变为液体并在冷凝器中收集回流的乙醇。
5.反应进行的同时,观察到反应溶液从无色逐渐变为黄色。
这是苯甲酸乙酯生成的表现。
6.接下来,需要加热溶液维持回流状态,直到反应进行到一定程度。
反应时间通常从2小时到4小时不等。
7.反应结束后,关闭加热源并冷却溶液。
冷却后,可以观察到在烧杯底部有沉淀产生。
8.将反应液转移到分液漏斗中,然后仔细加入适量的蒸馏水。
注意慢慢加入,以防止溶液溢出。
9.分液漏斗摇匀,使两种液体完全混合并产生两相。
然后,分离并丢弃底层的水层。
10.分液漏斗中,上层为苯甲酸乙酯,将其倒入干燥管中。
11.在干燥管中,使用无水氯化钙或其他干燥剂吸收残余的水分。
这一步可以帮助除去溶液中的任何水分,使苯甲酸乙酯更加纯净。
12.等待一段时间,直到干燥剂吸收了相当数量的水分。
13.将苯甲酸乙酯从干燥管中倒入试剂瓶中。
最后,你已经制备好苯甲酸乙酯。
注意,操作过程中需控制温度和催化剂用量以确保反应正常进行。
同时,实验室操作时需注意安全,避免接触到有害物质。
3.苯甲酸乙酯的制备

三 苯甲酸乙酯的制备一、 实验目的1.掌握苯甲酸乙酯制备原理及方法。
2.掌握可逆反应提高产率措施。
二、 实验原理苯甲酸乙酯(2109O H C )稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。
本实验利用酯化反应法制备,直接从苯甲酸→苯甲酸乙酯,再利用相应的物理、化学、光谱等方法鉴定它的存在!实验原理:直接酸催化酯化反应是经典的制备酯的方法,但反应是可逆反应,反应物间建立如下平衡:COOHC 2H 5OH COOC 2H 5H 2O因为这是反应可逆,为提高酯的转化率,使用过量乙醇(价格相对便宜)或将反应生成的水从反应混合物中除去,就可以使平衡向生成酯的方向移动。
另外,使用过量的强酸催化剂,水转化成它的共轭酸H 3O +, 没有亲核性,也可抑制逆反应的发生。
三、 药品及仪器苯甲酸、过量无水乙醇、 浓硫酸、Na 2CO 3 、无水CaCl 2 、苯、乙醚、 分水回流装置、烧杯、加热套、玻璃棒、分液漏斗等。
四、 实验装置图反应装置蒸馏装置回流装置减压抽滤五、实验步骤:1、制备样品:于50ml圆底烧瓶中加入:2.44g苯甲酸;10ml乙醇;7.5ml苯;3ml浓硫酸,摇匀,加沸石。
水浴上回流约2h,至分水器中层液体约3ml停止。
记录体积,继续蒸出多余的苯和乙醇(从分水器中放出)。
移去火源。
加水30ml,分批加入固体Na2CO3中和至中性。
除2种酸。
即硫酸、苯甲酸。
分液,水层用10ml乙醚萃取。
合并有机层,用无水氯化钙干燥。
回收乙醚,加热精馏,收集210-213 oC馏分。
2、鉴定:物理方法:取少量样品,用手扇动其,在闻其气味!应该稍有水果气味。
化学方法:酯与羟胺反应生成一种氧酸。
氧酸与铁离子形成牢固的品红色的络合物。
在试管中加入两滴新制备的酯,再加入5滴溴水。
有溴水的颜色不变或没有白色沉淀生成,将5滴新制备的酯滴入干燥的试管中,在加入7滴3%的盐酸羟胺的95%酒精溶液和3滴2%的NaOH溶液,摇匀后滴入7滴5%HCl溶液和1滴5% FeCl3溶液,试管内显示品红色,证明酯的存在。
实验苯甲酸乙酯的制备

实验苯甲酸乙酯的制备苯甲酸乙酯,又称苯乙酸乙酯,是一种常用的酯类有机化合物,具有香气和挥发性。
它广泛应用于香料、涂料、塑料制造等领域。
在实验室中,苯甲酸乙酯通常通过酯化反应制备得到,本文将介绍苯甲酸乙酯的制备过程。
一、实验原理苯甲酸乙酯是通过苯甲酸和乙醇之间的酯化反应制备得到的,反应方程式如下:C6H5CH2COOH + CH3CH2OH → C6H5CH2COOCH2CH3 + H2O该反应需要催化剂的存在,通常选用硫酸或盐酸作为催化剂,在适当的条件下反应可得苯甲酸乙酯。
苯甲酸乙酯的制备过程涉及到实验室中常用的反应技术和设备操作,包括重量法称取物质、等压漏斗滴加、加热反应、冷却、筛滤等步骤。
二、实验材料和设备1.苯甲酸:优级2.乙醇:优级3.盐酸:纯度为37%5.硅胶:砂纸用6.滤纸:普通过滤纸7.细口长颈漏斗:50毫升8.反应瓶:100毫升圆底瓶9.反应管:试管3个10.加热设备:油浴锅或电热板11.称量设备:称量纸、电子天平12.搅拌设备:磁力搅拌器、磁子三、实验过程①将乙醇、盐酸、苯甲酸、苯甲酸乙酯分别称量并准备好;②准备滤纸和硅胶装入漏斗中备用;③准备三个试管,其中一个加入几滴盐酸作为酯化反应结束后酸化的指示剂;①称取苯甲酸5克(计量误差不得超过0.01克)放入100毫升圆底瓶中;②加入乙醇8毫升,再加入3毫升浓度为37%的盐酸,用磁力搅拌器搅拌至混合均匀;③使用50毫升细口长颈漏斗,将苯甲酸和乙醇混合物滴入圆底瓶中;④同时以适当速率加热,使反应混合物沸腾,并搅拌20-30分钟;⑤反应结束后,将圆底瓶移至水冷却器中冷却,用水冲洗漏斗和瓶口;⑥将反应液倒入试管中,在试管中加入几滴酸性指示剂查看酯化反应是否结束,如反应完成,则指示剂从红色变成黄色。
⑦反应液中加入一小片硅胶,用滤纸过滤,将得到的苯甲酸乙酯过程中发生的不纯物质过滤,过滤后的苯甲酸乙酯置于容器中储存。
四、实验结果分析经过酯化反应合成得到的苯甲酸乙酯,可通过测量分析其理化性质验证合成品的质量和纯度。
13.苯甲酸乙酯的合成实验设计
实验设计:苯甲酸乙酯的制备一、实验目的:1、掌握酯化反应原理,学习苯甲酸乙酯的制备。
2、学习分水器的使用及液体有机化合物的精制方法。
3、进一步练习蒸馏、萃取等基本操作。
二、实验原理:苯甲酰氯和乙醇反应是一种羧酸衍生物的醇解反应。
与苯甲酸相比,苯甲酰氯中的羰基更容易受到亲核试剂乙醇的进攻,反应活性较高,因此,生成苯甲酸乙酯的产率较高。
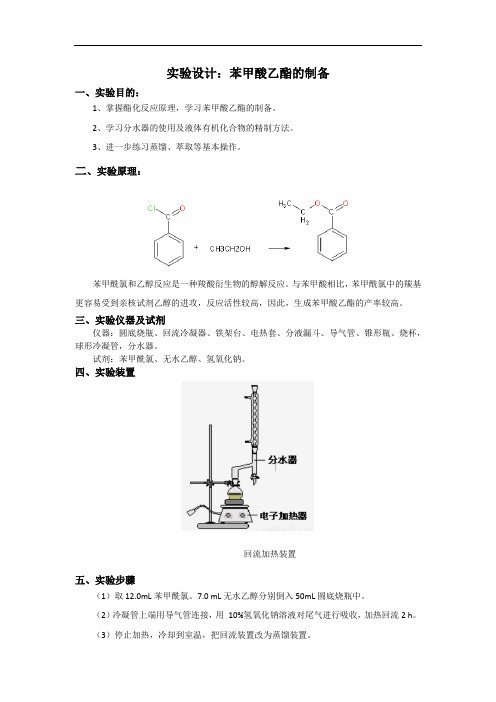
三、实验仪器及试剂仪器:圆底烧瓶、回流冷凝器、铁架台、电热套、分液漏斗、导气管、锥形瓶、烧杯,球形冷凝管,分水器。
试剂:苯甲酰氯、无水乙醇、氢氧化钠。
四、实验装置回流加热装置五、实验步骤(1)取12.0mL苯甲酰氯、7.0 mL无水乙醇分别倒入50mL圆底烧瓶中。
(2)冷凝管上端用导气管连接,用10%氢氧化钠溶液对尾气进行吸收,加热回流2 h。
(3)停止加热,冷却到室温,把回流装置改为蒸馏装置。
(4)用电热套加热蒸馏,收集馏分210~212 ℃。
六、注意事项1、制备苯甲酸乙酯时,随着反应的进行,一定要控制好液面位置,使得最上层液体始终为薄薄的一层,放水不要太多。
2、温度要控制好,不要太高,否则反应瓶中颜色很深,甚至炭化。
3、苯甲酰氯有一定的刺鼻气味,操作时注意要在通风的环境下进行。
七、思考题1、苯甲酸乙酯的制备中可能会有什么副产物生成?2、什么情况下,用过量醇,促进平衡向产物移动,没有实用性?3、酯的碱性水解为什么称为皂化反应?为什么优于硫酸催化水解?4、本实验采用了什么原理和措施来提高酯化反应的产率?资料扩展:苯甲酸乙酯又称安息香酸乙酯,具有较强的冬青油和水果香气,天然存在于桃子、菠萝、醋栗等中,常用作重要的有机溶剂。
由于毒性低,也常用于食用香料的调配和皂用香精及烟用香料中。
苯甲酸乙酯采用浓硫酸、无水氯化氢、对甲苯磺酸、氨基磺酸、无机氯化物、结晶硫酸氢钠、壳聚糖硫酸盐、固体超强酸、杂多酸(盐)催化或磺酸等催化下由苯甲酸和乙醇直接酯化法来合成。
目前,对苯甲酸乙酯的合成研究都是采用苯甲酸与乙醇进行酯化反应,所不同的只是选用不同的催化剂,改变反应物料配比和反应时间进行反应条件的优化;。
实验五、苯甲酸乙酯合成
实验五、苯甲酸乙酯制备一、实验目的1.掌握有机酸与醇在酸催化下的酯化反应。
2.掌握减压蒸馏的原理及操作。
3. 学习分液漏斗的使用原则及操作二、实验原理有机酸与醇在酸的催化下,进行酯化反应可生成酯。
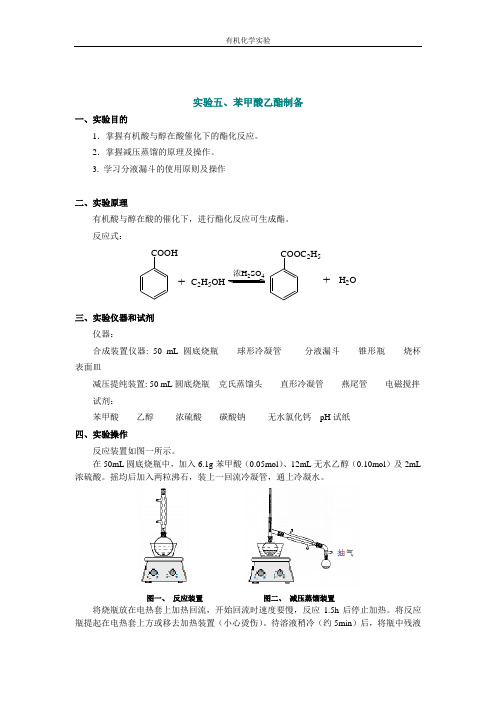
反应式: COOH +C 2H 5OH 24COOC 2H 5+H 2O三、实验仪器和试剂仪器: 合成装置仪器: 50 mL 圆底烧瓶 球形冷凝管 分液漏斗 锥形瓶 烧杯 表面皿减压提纯装置: 50 mL 圆底烧瓶 克氏蒸馏头 直形冷凝管 燕尾管 电磁搅拌 试剂:苯甲酸 乙醇 浓硫酸 碳酸钠 无水氯化钙 pH 试纸四、实验操作反应装置如图一所示。
在50mL 圆底烧瓶中,加入6.1g 苯甲酸(0.05mol )、12mL 无水乙醇(0.10mol )及2mL 浓硫酸。
摇均后加入两粒沸石,装上一回流冷凝管,通上冷凝水。
图一、 反应装置 图二、 减压蒸馏装置 将烧瓶放在电热套上加热回流,开始回流时速度要慢,反应1.5h 后停止加热。
将反应瓶提起在电热套上方或移去加热装置(小心烫伤)。
待溶液稍冷(约5min )后,将瓶中残液倒入50mL冷水的烧杯中,在搅拌下分批加入3.0-3.2g碳酸钠粉末中和到无二氧化碳气体产生(用pH试纸检验至呈中性)。
将反应混合物转移到125 mL分液漏斗中,用分液漏斗分出粗产物(上层),加入2-3g 无水氯化钙干燥4小时以上。
减压蒸馏,收集115~125℃馏分。
纯粹的苯甲酸乙酯的沸点为213℃。
安装减压蒸馏装置(图二)。
用少许棉花塞在漏斗口处,滤出干燥剂,将粗产品滤入25ml 干燥和称重过的圆底烧瓶中。
减压蒸馏,收集115~125℃/0.095Mpa馏分,对所得产品进行称重,测量体积,计算收率。
纯粹的苯甲酸乙酯的沸点为213℃。
附注: 减压蒸馏本次实验只是简单介绍,具体操作安排在实验六五、思考与讨论1.写出苯甲酸和乙醇的酸催化酯化反应的机理。
2.为使平衡趋向于生成更多的酯,有何方法?3.为什么在分液前加入碳酸钠?若采用NaOH结果会怎样?。
苯甲酸乙酯的制备实验报告

苯甲酸乙酯的制备高分子11-3 (09)苯甲酸乙酯(2109O H C )稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。
本实验利用酯化反应法制备,直接从苯甲酸→苯甲酸乙酯,再利用相应的物理、化学、光谱等方法鉴定它的存在!一、实验原理:直接酸催化酯化反应是经典的制备酯的方法,但反应是可逆反应,反应物间建立如下平衡:COOHC 2H 5OH COOC 2H 5H 2O因为这是反应可逆,为提高酯的转化率,使用过量乙醇(价格相对便宜)或将反应生成的水从反应混合物中除去,就可以使平衡向生成酯的方向移动。
另外,使用过量的强酸催化剂,水转化成它的共轭酸H 3O +, 没有亲核性,也可抑制逆反应的发生。
二、实验仪器及试剂:苯甲酸4.0g 过量无水乙醇10.0ml 浓硫酸 3.0ml Na 2CO 3 无水硫酸镁 8.0ml 环己烷 乙醚 分水回流装置、烧杯、加热套、玻璃棒、分液漏斗等装置图:分水回流装置 蒸馏装置三、实验步骤:1、制备样品:于50ml圆底烧瓶中加入:4.0g苯甲酸;10ml乙醇;8ml环己烷;3ml浓硫酸,摇匀,加沸石。
水浴上回流约2h,至分水器中层液体约5-6ml停止。
记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。
移去火源。
加水30ml,分批加入固体Na2CO3中和至中性。
除2种酸。
即硫酸、苯甲酸。
分液,水层用20ml石油醚分两次萃取。
合并有机层,用无水硫酸镁干燥。
回收石油醚,加热精馏,收集210-213摄氏度馏分。
2、鉴定:物理方法:取少量样品,用手扇动其,在闻其气味!应该稍有水果气味。
化学方法:酯与羟胺反应生成一种氧酸。
氧酸与铁离子形成牢固的品红色的络合物。
在试管中加入两滴新制备的酯,再加入5滴溴水。
有溴水的颜色不变或没有白色沉淀生成,将5滴新制备的酯滴入干燥的试管中,在加入7滴3%的盐酸羟胺的95%酒精溶液和3滴2%的NaOH溶液,摇匀后滴入7滴5%HCl溶液和1滴5% FeCl3溶液,试管内显示品红色,证明酯的存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
COOK + HCl
COOK 3 + 4 MnO2 + KOH + 4 H2O
COOH + KCl
COOH H + C2H5OH
+
COOC2H5 + H2O
副反应为:
2 C2H5OH H2SO4 C2H5OC2H5 + H2O
由于酯化反应是一个平衡常数较小的可逆反应,为了提高产率,在实验中采用过量的乙醇,同 时利用苯-水共沸物尽可能除去产物中的小分子副产物-水。 合成苯甲酸乙酯的反应机理:
结束后,蒸出苯及多余的乙醇,控制蒸出的总量 2.8mL 左右时,即可停止加热,不要蒸馏得太久, 否则反应瓶中很容易炭化。
六、思考题
1. 本实验采用了什么原理和措施来提高酯化反应的产率? 2. 为什么要用苯来除去反应体系中的水? 3. 比较微波促进反应与常规加热反应、微型实验与常量实验的优缺点。
七、附图表
五、注意事项
1、本实验选用的微波反应器及反应条件操作如下:
① 所设置的操作条件需要更改或正在运行的实验需要终止时,按 ② 反应过程中需要微波炉暂停,可按 先设定的工作程序。 ③ 反应过程中若需对反应体系进行调整,按开门键(勿按 键,当再次按
键。
键后,微波反应器将继续完成原
键) 。打开炉门时,微波炉自
动停止工作,处理完毕后,关上炉门,微波炉将继续完成原先设定的工作程序。
图 1 LWMC-201 型微波反应器控制面板图
2、制备苯甲酸时,反应结束抽滤后,如滤液呈紫红色,可将滤液放入微波反应器中继续反应 2min。 3、制备苯甲酸乙酯时,随着反应的进行,在分水器中会形成三层液体:下层为分水器中原有的 水;中层为共沸物的下层,占共沸物总量的 16%(含苯 4.8%,乙醇 52.1%,水 43.1%) ;上层为共 沸物的上层,占共沸物总量的 84%(含苯 86%,乙醇 12.7%,水 1.3%) 。应控制液面位置使得最上 层液体始终为薄薄的一层。 4、在制备苯甲酸乙酯回流时,温度不要太高,否则反应瓶中颜色很深,甚至炭化。同样,回流
p(mmHg )
b.p(℃)
图 2 苯甲酸乙酯的标准红外光谱
常量法制备苯甲酸乙酯: 在 50mL 干燥的圆底烧瓶中加入干燥的苯甲酸 5.0g、 无水乙醇 5.0mL、浓硫酸 1.0mL 和苯 7.0mL, 摇匀后加入 2 粒沸石。装上分水器(在分水器中预先加入适量的水并记下体积,液面离分水器支管 口约 0.5cm) ,分水器上端安装球形冷凝管。 开始小火加热,让其缓慢沸腾 30min,尽可能不要把乙醇蒸出。 然后,提高温度,加热回流。反应初期回流速度一定要适当慢一些。随着反应的进行,分水器 中逐渐出现上、中、下三层液体。在反应过程中应控制分水器中液面位置,上层液体始终是薄薄的 一层,中层液面不流回到反应瓶中即可。
实验六 苯甲酸(微波)与苯甲酸乙酯的制备
一、实验目的
1.学习苯甲酸的微波氧化合成方法。 2.掌握制备苯甲酸乙酯的原理和实验方法。 3.掌握分水器的使用,巩固萃取、回流等基本操作。 4.学习半微量有机合成实验操作。
二、基本原理
微波辐射化学是研究在化学中应用微波的一门新兴的前沿交叉学科,它在国外的研究进展十分 活跃。 自从 1986 年 Gedye 等首次报道了微波作为有机反应的热源可以促进有机化学反应以来, 微波 技术已成为有机化学反应研究的热点之一。与常规加热法相比,微波辐射促进合成方法具有显著的 节能、提高反应速率、缩短反应时间、减少污染,且能实现一些常规方法难以实现的反应等优点。 本实验在微波辐射下合成苯甲酸,然后在浓硫酸催化下,苯甲酸和无水乙醇发生酯化反应得到 苯甲酸乙酯。 主反应为:
回流 1.0h 后,停止加热,待烧瓶冷却后,将反应混合物倒入盛有 25mL 水的烧杯中,分为油层 和水层两相。在分液漏斗中分出油层后,水层用 12mL ×2 乙醚萃取。 合并油层和醚层,依次用 5mL10%碳酸钠溶液洗涤(洗涤后检验碱层 pH=8~9) 、 10mL 水洗涤, 用无水硫酸钠干燥。 将干燥后的苯甲酸乙酯的醚溶液转入 50mL 圆底烧瓶中,在常压下先小火蒸出乙醚(注意低沸 点液体的蒸馏装置) ,再蒸出苯和没有除尽的乙醇,然后改用减压蒸馏,根据表 1 数据收集产品。 纯苯甲酸乙酯为无色液体,沸点 212.4℃,折射率 1.5001,相对密度 1.0509,其红外光谱见图 2。
三、主要试剂与仪器
1. 试剂 苯甲醇 2.1mL (20 m mol ),高锰酸钾 4.2g (26.6 m mol ),无水乙醇 2.0mL (34.3 m mol ) , 碳酸钠 2.0g,苯 2.8mL,乙醚 10mL,浓硫酸,10%碳酸钠溶液,浓盐酸,无水氯化钙。 2. 仪器 250 mL 圆底烧瓶,球形冷凝管,布氏漏斗,吸滤瓶,烧杯,锥形瓶,微型仪器一套
表 1 苯甲酸乙酯的 b.p / p 数据
p(mmHg )
b.p(℃) 1 44.0 70 132.5 10 86.0 80 136.2 20 102.5 90 139.5 30 111.3 100 143.2 40 118.2 400 188.4 50 123.7 760 212.4 60 128.5
(包括 15mL、10mL 圆底烧瓶,球形冷凝管,分水器,分液漏斗,直形冷凝管,空气冷凝管,蒸馏 头,克氏蒸馏头,支管接引管,锥形瓶,量筒,烧杯,毛细管等) ,微波反应器,红外灯。
四、实验步骤
1. 苯甲酸的制备 在 250mL 圆底烧瓶中加入依次加入 4.2 g 高锰酸钾、 2.0 g 碳 酸钠 、 20mL 水, 摇匀, 再加入 2.1mL 苯甲醇、30mL 水和 2 粒沸石。将圆底烧瓶置于微波化学反应器内,装上回流装置,关闭微波炉门, 设定反应时间为 18 min,反应功率为 60%(满功率 650 W) ,开启微波反应器。 反应结束后,趁热将反应瓶从微波反应器中取出,迅速抽滤。滤液冷却后,用浓盐酸(约 6mL) 酸化到 pH=3~4,析出固体。抽滤,用少量冷水洗涤,得到苯甲酸粗品。产品用红外灯干燥,用于下 一步反应。 2. 苯甲酸乙酯的制备 在 15mL 干燥的圆底烧瓶中加入干燥的苯甲酸 2.0g (16.4mmol )、无水乙醇 2.0mL (34.3 m mol )、 浓硫酸 0.4mL 和苯 2.8mL,摇匀后加入 2 粒沸石。装上分水器(在分水器中预先加入适量的水并记 下体积) ,分水器上端安装球形冷凝管。 开始小火加热,让其缓慢回流。反应初期回流速度一定要适当慢一些,随着反应的进行,分水 器中逐渐出现上、中、下三层液体。在反应过程中应控制分水器中液面位置,以中层不流回到反应 瓶中为准。 回流 1.5h 后,停止加热,放出中、下层并记下体积。 继续加热以蒸出苯和多余的乙醇,当分水器中的总量达到 2.8mL 左右时,即可停止加热,并将 分水器中液体放出。 烧瓶冷却后,将反应混合物倒入盛有 10mL 水的烧杯中,分为油层和水层两相。在分液漏斗中 分出油层后,水层用 5mL ×2 乙醚萃取。 合并油层和醚层,依次用 2mL10%碳酸钠溶液洗涤(洗பைடு நூலகம்后检验碱层 pH=8~9) 、 5mL 水 洗 涤 , 用无水硫酸镁干燥。 将干燥后的苯甲酸乙酯的醚溶液转入 10mL 圆底烧瓶中,在常压下先小火蒸出乙醚(注意低沸 点液体的蒸馏装置) ,再蒸出没有除尽的苯和乙醇,然后改用减压蒸馏,根据表 1 数据收集产品。 纯苯甲酸乙酯为无色液体,沸点 212.4℃,折射率 1.5001,相对密度 1.0509,其红外光谱见图 2。
