高中化学三大平衡
三大平衡

化学平衡一、化学平衡的影响因素1.浓度:在其他条件不变时增大反应物浓度或减小生成物开始的对应浓度可使平衡向着正反应方向移动;反之亦然。
2.压强:在有气体参加的可逆反应里,在其他条件不变时,增大压强,平衡向气体总体积缩小的方向移动;反之亦然。
【注意】(1)改变压强的实质是改变参加反应气体物质的浓度,故压强与参加反应的固体或液体物质的反应速率无关。
(2)对于化学方程式中反应前后气体的系数和相等的反应以及平衡混合物都是固体或液体的反应,改变压强,平衡不移动。
3.温度:在其他条件不变的情况下,升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动。
4.催化剂:使用催化剂能同时同等程度地改变正、逆反应速率,即正、逆反应速率相对不变。
所以催化剂对平衡移动无影响。
【总结】勒夏特列原理(平衡移动原理):已达平衡的可逆反应,如果改变影响平衡的一个条件,平衡就向着减弱这种改变的方向移动。
注意:平衡移动只能减弱条件改变对平衡的影响,不能完全抵消这种改变,更不能扭转这种改变。
水解一、盐类水解的类型及规律1.盐类水解的定义及实质强酸弱碱盐和强碱弱酸盐溶于水时,电离产生的阳离子、阴离子可分别与水电离产生的OH-或H+生成弱电解质——弱酸或弱碱,使得溶液中c(H+)≠c(OH-),因而这两类盐溶液呈现酸性或碱性。
盐与水发生的这种作用叫做盐类的水解。
盐类的水解会促进水的电离。
2.水解反应离子方程式的书写(1)酸式盐的水解:溶液的酸碱性决定于阴离子是以水解为主要过程还是以电离为主要过程。
①阴离子是较强或中强的酸根,电离为主:NaH2PO4 =Na++H2PO4-H2PO4-H++ HPO42-(以电离为主)呈酸性H2PO4-+H2OH3PO4 + OH-(水解次之)以电离为主的盐有:NaH2PO4、NaHSO3等,这样的盐溶液呈酸性,考虑离子浓度大小比较时可忽略水解。
②阴离子是弱酸根,如NaHCO3以水解为主:HCO3-+H2OH2CO3-+ OH-(以水解为主)呈碱性HCO3-H+ +CO32-(次要)这类盐还有:KHCO3、K2HPO4、KHS等,这样的盐溶液呈碱性,考虑离子浓度大小比较时可忽略电离。
高中化学四大平衡知识点总结

高中化学四大平衡知识点总结一、化学平衡的基本概念化学平衡是指反应物和生成物之间的反应速率相等时达到的状态。
在平衡态下,反应物和生成物的浓度保持不变,但是反应仍然在进行,只是前后反应速率相等而已。
二、平衡常数及其计算平衡常数(K)是在特定条件下,在平衡态时各种物质的浓度的乘积的比值。
对于一般反应aA + bB ⇌ cC + dD,平衡常数(Kc)的表达式为:Kc = [C]^c [D]^d / [A]^a [B]^b其中,[A]、[B]、[C]和[D]分别代表反应物A、B和生成物C、D的浓度。
计算平衡常数的方法:1. 已知反应物和生成物的浓度,直接代入表达式计算;2. 已知平衡态下各种物质的浓度,可根据反应方程式得出表达式;3. 已知反应物和生成物的摩尔数,可以根据摩尔比关系计算。
三、平衡常数的意义和计算结果的判断平衡常数的大小反映了反应体系的平衡位置,当平衡常数(K)大于1时,说明生成物的浓度较大;当K小于1时,说明反应物浓度较大。
当K接近于1时,说明反应物与生成物的浓度相差不大。
根据平衡常数计算结果的判断:1. 如果K >> 1,则可以认为反应向右进行,生成物浓度较大;2. 如果K <<1,则可以认为反应向左进行,反应物浓度较大;3. 如果K ≈1,则可以认为反应体系处于动态平衡状态,反应物与生成物的浓度相差不大。
四、影响平衡的因素及其调节1.温度的影响温度变化会改变反应物和生成物的浓度,从而影响平衡常数。
根据Le Chatelier原理,当温度升高,平衡常数K变大;当温度降低,平衡常数K变小。
此外,温度对平衡态的影响还取决于反应是否吸热或放热。
2.浓度的影响改变反应物或生成物的浓度可以改变平衡常数K的大小。
增加任一物质的浓度将促使反应往反应物一侧移动,使K减小;反之,如果减小某物质的浓度,则使K增大。
根据这个原理,可以通过改变物质的浓度来促使反应朝着我们所需的方向进行。
化学四大平衡笔记

化学四大平衡笔记
1、能量守恒定律:能量守恒定律认为,一个系统内所有能量的总和
是不变的,即能量在系统内转移,但总量不变。
2、熵守恒定律:熵守恒定律认为,熵(混乱程度)在系统中总是增加,并且不可逆转。
3、平衡位移定律:平衡位移定律认为,当一个化学反应放置在适当
的环境中时,反应趋向于使系统进入势能最低的状态,从而达到平衡位移。
4、 Le Chatelier定律:Le Chatelier定律认为,当一个化学反应
受到外界影响时,它会作出变化,以抵消外力的影响,从而尽快重新达到
平衡。
三大平衡

三大平衡一、电离平衡理论和水解平衡理论1.电离理论:⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;⑵多元弱酸的电离是分步的,主要以第一步电离为主;2.水解理论:从盐类的水解的特征分析:水解程度是微弱的(一般不超过2‰)。
例如:NaHCO3溶液中,c(HCO3―)>>c(H2CO3)或c(OH― )理清溶液中的平衡关系并分清主次:⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。
利用三种守恒关系——电荷守恒(溶液电中性)、物料守恒(元素守恒)、质子守恒(水的电离守恒)。
除此之外还有如质量守恒、元素守恒、电子守恒、能量守恒等这里只讨论电解质溶液中的守恒问题。
二、电解质溶液中的守恒关系1、电荷守恒:电解质溶液中的阴离子的负电荷总数等于阳离子的正电荷总数,电荷守恒的重要应用是依据电荷守恒列出等式,比较或计算离子的物质的量或物质的量浓度。
如(1)在只含有A+、M-、H+、OH―四种离子的溶液中c(A+)+c(H+)==c(M-)+c(OH―),若c(H+)>c(OH―),则必然有c(A+)<c(M-)。
例如,在NaHCO3溶液中,有如下关系:C(Na+)+c(H+)==c(HCO3―)+c(OH―)+2c(CO32―)书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
化学中的四大平衡

A的初始浓度-A的平衡浓度 物 A 的 转 化 率 为 : α(A) = A的初始浓度 c0A-cA ×100%= ×100%。 c0A
助学园地
阅卷现场
注意 同一个反应中,反应物可以是多种,但不同反应物 的转化率可能不同;增大一种反应物的浓度,可以提高其 他反应物的转化率。工业生产中常常提高廉价原料的比 例,从而增大其他原料的利用率。 (3)电离平衡常数
章末整合
一、四大平衡不同点的比较 广义的化学平衡包括狭义的化学平衡、电离平衡、水 解平衡、沉淀溶解平衡。这四个方面的平衡被称为四大化 学平衡。四大平衡是中学化学知识结构的核心内容之一, 起到了支点的作用。
助学园地
阅卷现场
1.研究对象不同 平衡 化学平衡 类型 研究 可逆的化 对象 学反应 工业 合成氨 电离平衡 溶液中的 弱电解质 水解平衡 沉淀- - - 2. 酸式弱酸根离子如 HCO- 、 HS 、 HSO 既不能与 OH 3 3
大量共存,又不能与 H 大量共存。
3. 有沉淀生成包括有微溶物生成的离子不能大量共存, 如 Ba2+、
- 2- Ca2+、Mg2+、Ag+等不能与 SO2 、 CO 4 3 等大量共存。
能够水解 溶液中的难 的盐类 溶电解质
举例
溶液中的氯 碳酸钠、 醋酸溶液、 化银、硫酸 氯化铁、 氨水等 钡、氢氧化 醋酸铵等 铁等
助学园地
阅卷现场
2.描述方法不同
(1)化学平衡常数 对于一般可逆反应:mA(g)+nB(g) pC(g)+qD(g),在一温
[cC]p· [cD]q 度下达到平衡时,K= 。 [cA]m· [cB]n (2)平衡转化率 对于一般的化学反应:aA+bB cC+dD,达到平衡时反应
H++OH-。水的电离程度大小是用离子积(KW)来表示的,
【步步高】高考化学(通用版)二轮:专题9 电解质溶液考点2溶液中的“3大平衡”(含解析)
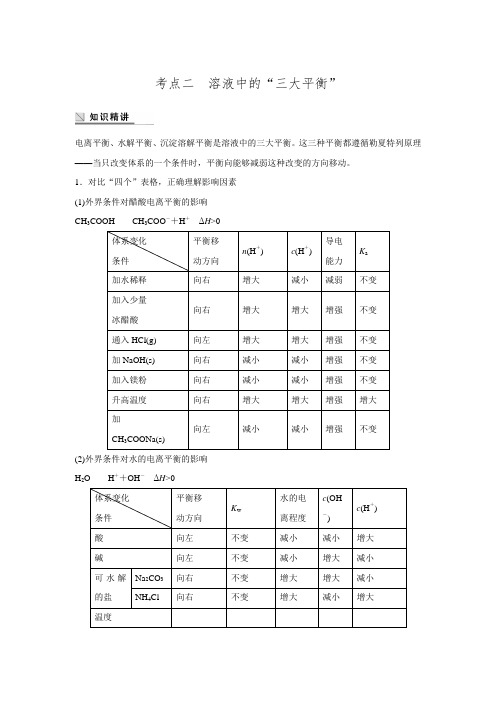
考点二 溶液中的“三大平衡”电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡。
这三种平衡都遵循勒夏特列原理——当只改变体系的一个条件时,平衡向能够减弱这种改变的方向移动。
1.对比“四个”表格,正确理解影响因素 (1)外界条件对醋酸电离平衡的影响 CH 33COO-+H +ΔH >0(2)外界条件对水的电离平衡的影响 H 2OH ++OH -ΔH >0(3)外界条件对FeCl 3溶液水解平衡的影响 Fe 3++3H 23+3H+ΔH >0(4)外界条件对AgCl 溶解平衡的影响+(aq)+Cl -(aq) ΔH >02.思考重点问题,辨析易错知识(1)加水稀释醋酸溶液,在稀释过程中,c (CH 3COO -)c (CH 3COOH)________(填“增大”、“减小”或“不变”,下同),c (H +)c (CH 3COO -)________,c (H +)·c (CH 3COO -)c (CH 3COOH)________,c (CH 3COO -)c (CH 3COOH)·c (OH -)________,c (CH 3COOH)+c (CH 3COO -)________,n (CH 3COOH)+n (CH 3COO -)________。
(2)在pH =5的酸性溶液中,c (H +)水=______ mol·L -1。
(3)常温下纯水的pH =7,升温到80 ℃,纯水的pH<7,其原因是______________________ ________________________________________________________________________。
(4)相同浓度的(NH 4)2Fe(SO 4)2溶液与(NH 4)2SO 4溶液相比,c (NH +4)________大(填“前者”或“后者”)。
高中化学平衡三大守恒定律
For personal use only in study and research; not for commercial useFor personal use only in study and research; not for commercial useNa2CO3溶液的电荷守恒、物料守恒、质子守恒碳酸钠:电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)上式中,阴阳离子总电荷量要相等,由于1mol碳酸根电荷量是2mol负电荷,所以碳酸根所带电荷量是其物质的量的2倍。
物料守恒c(Na+)是碳酸根离子物质的量的2倍,电离水解后,碳酸根以三种形式存在所以c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]质子守恒水电离出的c(H+)=c(OH-)在碳酸钠水溶液中水电离出的氢离子以(H+,HCO3-,H2CO3)三种形式存在,其中1mol 碳酸分子中有2mol水电离出的氢离子所以c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)此外质子守恒也可以用电荷守恒和物料守恒两个式子相减而得到(电荷守恒-物料守恒=质子守恒)。
For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文。
高中化学溶液中的三个平衡与三个守恒
高中化学溶液中的三个平衡与三个守恒一、溶液中的三个平衡在中学阶段溶液中的三个平衡包括:电离平衡、水解平衡以及沉淀溶解平衡,这三种平衡都遵循勒夏特列原理——当只改变体系的一个条件时,平衡向能减弱这种改变的方向移动。
1. 电离平衡常数、水的离子积常数、溶度积常数均只与温度有关。
电离平衡常数和水的离子积常数随着温度的升高而增大,因为弱电解质的电离和水的电离均为吸热过程。
2. 弱酸的酸式盐溶液的酸碱性取决于弱酸的酸式酸根离子的电离程度和水解程度的相对大小。
①若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4;②若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4等。
3. 沉淀溶解平衡的应用沉淀的生成、溶解和转化在生产、生活以及医疗中可用来进行污水的处理、物质的提纯、疾病的检查和治疗。
解决这类问题时应充分利用平衡移动原理加以分析。
当Q C>K SP时,生成沉淀;当Q C<K SP时,沉淀溶解;当Q C=K SP时,达到平衡状态。
4. 彻底的双水解常见的含有下列离子的两种盐混合时,阳离子的水解阴离子的水解相互促进,会发生较彻底的双水解。
需要特别注意的是在书写这些物质的水解方程式时,应用“===”,并将沉淀及气体分别用“↓”、“↑”符号标出。
如:当Al3+分别遇到AlO2-、CO32-、HCO3-、S2-时,[3AlO2-+ Al3+ + 6H2O === 4Al(OH)3↓];当Fe3+分别遇到CO32-、HCO3-、AlO2-时;还有NH4+与Al3+;SiO3与Fe3+、Al3+等离子的混合。
另外,还有些盐溶液在加热时,水解受到促进,而水解产物之一为可挥发性酸时,酸的挥发又促进水解,故加热蒸干这些盐溶液得不到对应的溶质,而是对应的碱(或对应的金属氧化物)。
如:①金属阳离子易水解的挥发性强酸盐溶液蒸干后得到氢氧化物,继续加热后得到金属氧化物,如FeCl3、AlCl3、Mg(NO3)2溶液蒸干灼烧得到的是Fe2O3、Al2O3、MgO而不是FeCl3、AlCl3、Mg(NO3)2固体;②金属阳离子易水解的难挥发性强酸盐溶液蒸干后得到原溶质,如Al2(SO4)3、Fe(SO4)3等。
高中化学“三大平衡常数” 3
三大平衡常数一、化学平衡常数典例1、(2008年宁夏卷)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( ) A.9 B.16 C.20 D.25解析:由平衡时氢气的浓度可求得反应②分解消耗HI的浓度,c(HI)= 0.5mol·L-1×2=1mol/L,故①式生成c(HI)= c(HI)平衡+ c(HI)分解= 4mol·L-1+1mol/L =5mol·L-1,c(NH3) c(HI)①= 5mol·L-1,根据化学平衡常数公式K= c(NH3)平衡×c(HI)平衡=5 mol/L×4mol·L-1,平衡=故答案选C。
点评:本题考查的是应用化学平衡常数公式求算化学平衡常数。
学生易错选D,原因是将①式生成的c(HI)= 5 mol/L代入了公式中进行了求算,而未带入平衡时HI的浓度(4mol·L-1)。
因此,在求算化学平衡常数时,一定要严格的按照化学平衡常数的含义进行。
方法规律:①对于一般的可逆反应:mA(g)+ nB(g)pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。
当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为:,各物质的浓度一定是平衡..时的浓度,而不是其他时刻的.②在进行K值的计算时,固体和纯液体的浓度可视为“1”。
例如:Fe3O4(s)+4H2(g)3Fe(s)+4H2O(g),在一定温度下,化学平衡常数。
③利用K值可判断某状态是否处于平衡状态。
例如,在某温度下,可逆反应mA(g)+nB(g)pC(g)+qD(g),平衡常数为K。
若某时刻时,反应物和生成物的浓度关系如下:,则有以下结论:K/=K ,V(正)=V(逆),可逆反应处于化学平衡状态;K/<K ,V(正)>V(逆),可逆反应向正反应方向进行;K/>K ,V(正)<V(逆),可逆反应向逆反应方向进行。
高中化学四大平衡知识点总结
高中化学四大平衡知识点总结1. 动态平衡在化学反应中,当反应物转化为生成物的速率与生成物转化为反应物的速率相等时,反应达到了动态平衡。
动态平衡是指反应物和生成物浓度在一定时间内保持不变的状态。
要点总结:•动态平衡的条件是反应物和生成物之间的相对浓度不变,不是绝对浓度。
•动态平衡的实现需要封闭系统、可逆反应和相对稳定的温度。
•动态平衡可以用平衡常数来描述,平衡常数 K 表示反应物和生成物浓度的比值。
示例:N₂(g) + 3H₂(g) ⇌ 2NH₃(g)在给定温度下,该反应物质的浓度达到一定的数值后,反应物和生成物之间的浓度保持不变,反应达到平衡。
2. 化学平衡常数化学平衡常数(K)是描述化学反应平衡的一个重要指标,它表示在给定温度下,反应物质的浓度达到稳定时,反应物与生成物之间浓度的比值。
要点总结:•平衡常数与方程式的摩尔系数有关,可由化学方程式中化学物质的浓度表示。
•平衡常数不随反应物质的初始浓度而改变。
•平衡常数与反应方向有关,对于可逆反应,正向和逆向反应的平衡常数互为倒数。
示例:对于可逆反应:aA + bB ⇌ cC + dD平衡常数 K 的表达式为:K = \(\frac{{[C]^c * [D]d}}{{[A]a * [B]^b}}\)3. 平衡位置和平衡移动平衡位置指的是在动态平衡下,反应物和生成物之间浓度的比值。
平衡位置的决定因素主要包括温度、压力和物质的浓度。
要点总结:•当反应物浓度增加时,平衡位置向生成物一侧移动,使反应更倾向于生成物。
•当生成物浓度增加时,平衡位置向反应物一侧移动,使反应更倾向于反应物。
•温度升高对平衡位置的影响因反应方向不同而不同。
示例:对于可逆反应:N₂(g) + 3H₂(g) ⇌ 2NH₃(g)当向反应器中加入氮气和氢气时,平衡位置向右移动,反应更倾向于产生氨气。
4. 平衡常数与反应条件平衡常数与反应条件之间存在一定的关系。
反应条件的改变可能导致平衡常数的变化,从而影响反应的平衡位置。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水溶液中的化学平衡
高中化学中,水溶液中的化学平衡包括了:电离平衡,水解平衡,沉淀溶解平衡等。
看是三大平衡,其实只有一大平衡,既化学反应平衡。
所有关于平衡的原理、规律、计算都是相通的,在学习过程中,不可将他们割裂开来。
化学平衡勒夏特列原理(又称平衡移动原理)是一个定性预测化学平衡点的原理,内容为:在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动,但不能完全消除这种改变。
比如一个可逆反应中,当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少;但这种减弱不可能消除增加反应物浓度对这种反应物本身的影响,与旧的平衡体系中这种反应物的浓度相比而言,还是增加了,转化率还是降低了。
1、不管是电离、水解还是沉淀溶解,一般情况下,正反应的程度都不高,即产物的浓度是较低的,或者说产物离子不能大量共存。
双水解除外。
2、弄清楚三类反应的区别和联系。
影响电离平衡的因素
1.温度:电离过程是吸热过程,温度升高,平衡向电离方向移动
2.浓度:弱电解质浓度越大,电离程度越小
3.同离子效应:在弱电解质溶液中加入含有与该弱电解质具有相同离子的强电解质,从而使弱电解质的电离平衡朝着生成弱电解质分子的方向移动,弱电解质的解离度降低的效应称为同离子效应
4.化学反应:某一物质将电离的离子反应掉,电离平衡向正方向移动
1、电离平衡
定义:在一定条件下,弱电解质的离子化速率(即电离速率)等于其分子化速率(即结合速率)
(如:水部分电离出氢离子和氢氧根离子,同时,氢离子和氢氧根离子结合成水分子的可逆过程)
范围:弱电解质(共价化合物)在水溶液中
外界影响因素:1)温度:加热促进电离,既平衡向正反向移动(电离是吸热的)
2)浓度:越稀越电离,加水是促进电离的,因为平衡向电离方向移动(向离子数目增多的方向移动)
3)外加酸碱:抑制电离,由于氢离子或氢氧根离子增多,使平衡向逆方向移动
2、水解平衡
定义:在水溶液中,盐溶液中电离出的弱酸根离子或弱碱根离子能和水电离出的氢离子或氢氧根离子结合成弱电解质的过程。
范围:含有弱酸根或弱碱根的盐溶液
外界影响因素:1)温度:加热促进水解,既平衡向正反向移动(水解是吸热的,是中和反应的逆反应)
2)浓度:越稀越水解,加水是促进水解的,因为平衡向水解方向移动
3)外加酸碱盐:同离子子效应。
3、沉淀溶解平衡
定义:在水溶液中,在一定温度下,难溶电解质晶体与溶解在溶液中的离子之间存在溶解和结晶的平衡,也称为多项离子平衡。
范围:难溶性的酸碱盐(水溶液中浓度低于1X10^-5)
外界影响因素:1)温度:与物质本身的溶解度与温度的关系有关。
溶解度随温度升高而增大,则加热使平衡向正方向移动,反之,亦然。
2)浓度:同离子效应。
