相容性试验记录方案
相容性试验-模板

目录1 相容性试验样品及对照品1.1 试验样品来源1.2 试验样品批号1.3 试验用对照品2 相容性试验用仪器、设备3 相容性试验条件3.1 加速试验3.2 长期试验3.3 特别要求3.4 模拟恶劣运输/贮存条件4 相容性试验考察项目及方法4.1 检测项目4.2 检测方法依据5 相容性试验结果5.1 考察袋5.2 特殊要求试验考察结果5.3 考察药物的稳定性试验(1)葡萄糖注射液稳定性考察(2)氯化钠注射液稳定性考察5.4 模拟恶劣运输/贮存条件试验考察结果6 相容性试验结论三层共挤输液用袋相容性研究资料本试验设计依据为国家食品药品监督管理局《药品包装材料与药物相容性试验指导原则(试行)》。
1 相容性试验样品及对照品1.1 试验样品来源本试验所用袋为采用朗活医药耗材(北京)有限公司的多层共挤膜制成的输液用袋。
朗活医药耗材(北京)有限公司的复合聚丙烯三层共挤输液用膜,由北京双鹤药业股份有限公司制袋并进行相容性试验样品制备。
1.1.1 试验用样品的组成材料膜材的配方:第一层(内层,封口层)聚丙烯第二层聚丙烃第三层聚丙烯该膜材已取得《药品包装用材料和容器注册证》,许可证号:国药包字20070795。
口管的来源:北京奥星恒迅包装科技有限公司1.1.2 袋的质量标准及质量控制采用上述膜材,按申报资料7所述工艺,进行输液用袋的生产,其袋的质量应符合国家药品监督管理局颁发的国家药品包装容器(材料)标准《多层共挤输液用膜、袋通则》的规定。
根据试验,本公司对上述标准略作修订,见申报资料8:《三层共挤输液用袋》修订标准。
本公司按上述修订标准对三批输液用袋进行检验,检验结果均符合要求,见申报资料9:三层共挤输液用袋检验报告。
1.2试验样品批号1.2.1考察包材相容性试验样品采用三批输液用袋,批号分别为080922、080827、081104,对北京双鹤药业股份有限公司生产的葡萄糖注射液、氯化钠注射液各一批进行灌装,采用外包膜进外包装,在121℃,灭菌15分钟,作为考察包材的相容性试验样品。
包材相容性试验方案

包材相容性试验方案一、引言随着科技的不断进步和包装行业的快速发展,包材的选择变得越来越重要。
包材相容性试验是一种评估包材与产品或其他包材之间相互作用的方法。
相容性试验的结果能够帮助生产商或供应商确定最佳的包材选择,以确保产品质量和包装的完整性。
本文将介绍包材相容性试验方案的制定,包括试验目的、试验方法、试验条件和结果解读等。
二、试验目的包材相容性试验的主要目的是评估包材与产品或其他包材之间的相互作用。
具体目的包括:1. 确定包材是否会对产品质量产生负面影响,例如导致化学反应、变色、变质等。
2. 评估包材与产品之间的物理相容性,以确保包装的完整性和稳定性。
3. 比较不同包材的性能,选择最适合的包材。
三、试验方法1. 确定试验样本和包材:根据试验要求和产品特性,选择适当的样本和包材。
确保样本和包材的数量足够进行试验,以获取可靠的结果。
2. 储存条件:确定试验样本和包材的储存条件,包括温度、湿度等。
3. 样本处理:根据试验要求,对样本进行必要的处理,例如清洁、消毒等。
4. 相容性测试方法:根据试验要求,选择相应的相容性测试方法。
常用的方法包括摩擦测试、抗拉强度测试、耐化学性测试等。
5. 试验数据记录:记录试验过程中的相关数据,包括样本信息、包材信息、试验条件、试验结果等。
四、试验条件1. 温度和湿度:根据产品特性和使用环境确定试验温度和湿度。
通常情况下,试验温度为常温(20-25°C)或产品使用温度。
2. 试验时间:根据试验目的和商品特性,确定试验时间。
通常情况下,试验时间为24小时或数天。
3. 试验样本数量:根据试验目的和样本特性,确定试验样本数量。
通常情况下,每组试验样本至少3个。
4. 试验设备:根据试验方法选择适当的试验设备,例如试验机、摩擦测试机等。
五、结果解读根据试验结果,对包材相容性进行解读。
根据试验目的,可能的解读结果包括:1. 包材与产品相容:包材与产品之间无明显的相互作用,可以安全使用。
医疗器械生物相容性试验方案

医疗器械生物学试验方案我公司委托贵检验中心对我公司的×××××××××××产品,按照下列方法进行生物相容性试验:1.细胞毒性(1)(显微镜观察法)取××产品/部件,按□0.1g/mL;□0.2g/mL;□1.25cm2/mL;□3cm2/mL;□6cm2/mL的比例(浸提比例见样品制备方法说明),浸提介质为含血清培养基, (37±1)℃, (24±2)h制备试验液,取试验液按照GB/T16886.5-2017中8.2规定的浸提法进行。
细胞毒性分级不大于□ 1;□ 2;□ 3;□4(分级大于2时被认为有细胞毒性)(2)浸提液试验(MTT法)取××产品/部件,按 0.2g/mL 的比例,浸提介质为含血清培养基, (37±1)℃, (24±2)h制备试验液,取试验液按照GB/T16886.5-2017中附录C规定的浸提法进行。
细胞存活率应不小于70%。
(3)直接接触试验取××产品/原液直接使用,按照GB/T16886.5-2017中8.3规定的直接接触法进行。
(适用于液体,凝胶,单一材质的片状产品)细胞毒性分级不大于□ 1;□ 2;□ 3;□4(分级大于2时被认为有细胞毒性)(4)间接接触试验——琼脂扩散法细胞毒性分级不大于□ 1;□ 2;□ 3;□4(分级大于2时被认为有细胞毒性)2. 致敏试验(1)取××产品/部件,按 0.2g/mL 的比例,浸提介质0.9%氯化钠注射液和植物油;(37±1)℃,(72±2) h制备试验液,按照GB/T16886.10-2017中7.5规定的最大剂量试验方法进行。
或者(2)××产品/部件,按照GB/T16886.10-2017中7.6规定的封闭贴敷试验方法进行。
医疗器械生物相容性试验方案(可编辑修改word版)

以 ,□52周,□其他周期:(植入观察点选择,可多选),按照GB/T16886.6-
, 2015中规定的试验方法进行。 (与阴性对照样品相比较,应为无刺激) 文 10. 亚急性全身毒性试验
本 (1)取××××产品/部件,按 0.2g/mL 的比例,浸提介质为0.9%氯化钠注射液,(37±1)℃,(72±2)
不规则形状多孔器械(低密度材料)
0.1g/mL
吸水材料
除吸收容量外0.1g/mL
表3 浸提条件
条件
备注
!
37±1℃,24±2h 37±1℃,72±2h 50±2℃,72±2h
该项条件仅推荐细胞毒使用
库
文 常用
三类及长期植入产品建议选择加严条
70±2℃,24±2h
件浸提。
度
121±2℃,1±0.1h
表2)、温度和时间(见表3)。或依据常用操作并在论证的基础上提供一个标准化的方法,在多
数情况下产品应使用适宜的加严条件。
随
便 若受试样品不适合用二甲基亚砜等有机溶剂做为浸提介质(如PVC、PC、PS、PES等),可采用
以 其他浸提介质,如遗传毒性可改用细胞培养基等。
性质
, 表1 浸提介质 浸提介质
文 极性介质
2017中7.6规定的封闭贴敷试验方法进行。(适合于与正常皮肤接触的胶带、敷贴类,材料单一
的产品)
文
本 或者(3)取××产品/部件,按 0.2g/mL
的比例,浸提介质为0.9%氯化钠注射液和植物油,(37±1)℃, (72±2)
载 h制备试验液,按照GB/T16886.10-
下 2017中7.6规定的的封闭贴敷试验方法进行。(适合于与正常皮肤接触的但不易进行直接贴敷的
锝药相容性试验方案解析
锝即时标记药物药品包装材料相容性试验方案目录:1、检查目的 (3)2、试验内容及依据标准 (3)2.1 试验内容 (3)2.2 依据标准 (3)3、样品批号 (3)4、检测项目 (4)4.1锝[99m Tc]亚甲基二膦酸盐注射液 (4)4.2锝[99m Tc] 喷替酸盐注射液 (4)4.3高锝[99m Tc]酸钠注射液 (4)4.4锝[99m Tc]司它比注射液 (5)5、检测仪器: (5)6、稳定性数据: (5)6.1性状 (5)6.2 pH (6)6.3 鉴别 (7)6.4 .放射性活度 (7)6.5 放射性化学纯度 (8)6.6 细菌内毒素 (9)6.7 无菌 (9)7 结论: (10)1、检查目的对于产品锝即时标记药物(锝[99m Tc]亚甲基二膦酸盐注射液、锝[99m Tc] 喷替酸盐注射液、高锝[99m Tc]酸钠注射液、锝[99m Tc] 司它比注射液),我们一直选择一次性使用无菌注射器作为其包装形式,根据我公司多年来的使用情况,1.一直使用同一家供应商的包材(一次性使用无菌注射器供应商:上海康德莱企业发展集团股份有限公司),2.培养基模拟分装验证结果合格,基于以上情况,进一步进行锝即时标记药物包材相容性试验,验证公司产品锝即时标记药物(锝[99m Tc]亚甲基二膦酸盐注射液、锝[99m Tc] 喷替酸盐注射液、高锝[99m Tc]酸钠注射液、锝[99m Tc] 司它比注射液)所使用包材是否影响药物质量。
2、试验内容及依据标准2.1 试验内容试验内容:定期对产品进行稳定性试验,试验选用药物用拟上市包装的一批材料或容器包装后进行相关试验,考察包材对于产品的质量是否有影响。
稳定性试验:将供试品保存在密封的一次性使用无菌注射器中,至于适宜的铅容器中,室温保存,于标定第0小时、第3小时、第6小时取样,进行检测,检测项目:性状、PH、鉴别、放射性活度、放射性核纯度、放射性化学纯度、细菌内毒素、无菌,详情请见QC.030.01稳定性试验规程。
水泥与混凝土外加剂相容性的试验研究
水泥与混凝土外加剂相容性的试验研究水泥与外加剂相容性是生产优质混凝土的重要影响因素,本文通过检测水泥净浆流动度,对比不同矿物组成的熟料及不同条件下的水泥与外加剂相容性的差异,为高性能水泥生产提供参考。
1 试验用材料1)水泥、熟料:选择江山南方水泥生产过程中有代表性的样品及小磨制备对比样品。
2)混凝土外加剂:不同时间用户提供的多种外加剂。
2 试验方法检测水泥、熟料掺入外加剂后的净浆流动度,外加剂掺量按用户提供的推荐掺量加入。
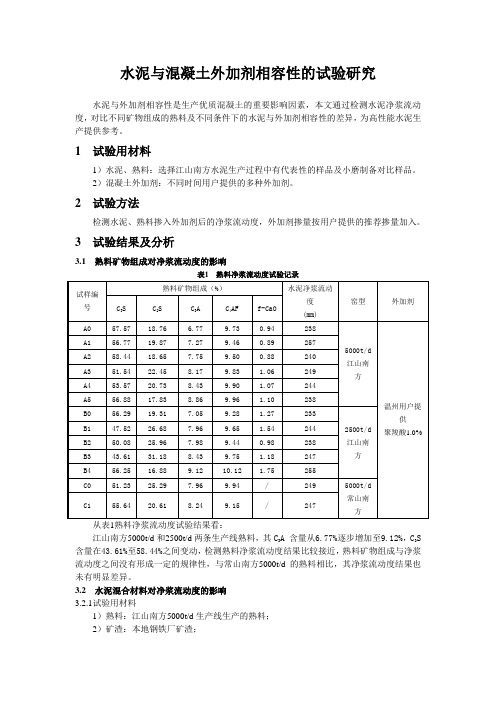
3 试验结果及分析3.1 熟料矿物组成对净浆流动度的影响表1 熟料净浆流动度试验记录试样编号 熟料矿物组成(%) 水泥净浆流动度 (mm) 窑型外加剂C 3S C 2S C 3A C 4AF f-CaO A0 57.57 18.76 6.77 9.73 0.94 238 5000t/d 江山南方 温州用户提供 聚羧酸1.0%A1 56.77 19.87 7.27 9.46 0.89 257 A2 58.44 18.65 7.75 9.50 0.88 240 A3 51.54 22.45 8.17 9.83 1.06 249 A4 53.57 20.73 8.43 9.90 1.07 244 A5 56.88 17.83 8.86 9.96 1.10 238 B0 56.29 19.31 7.05 9.28 1.27 233 2500t/d 江山南方 B1 47.52 26.68 7.96 9.65 1.54 244 B2 50.08 25.96 7.98 9.44 0.98 238 B3 43.61 31.18 8.43 9.75 1.18 247 B4 56.25 16.88 9.12 10.12 1.75 255 C0 51.23 25.29 7.96 9.94 / 249 5000t/d 常山南方 C155.6420.618.249.15/247从表1熟料净浆流动度试验结果看:江山南方5000t/d 和2500t/d 两条生产线熟料,其C 3A 含量从6.77%逐步增加至9.12%,C 3S 含量在43.61%至58.44%之间变动,检测熟料净浆流动度结果比较接近,熟料矿物组成与净浆流动度之间没有形成一定的规律性,与常山南方5000t/d 的熟料相比,其净浆流动度结果也未有明显差异。
密封胶相容性试验报告

密封胶相容性试验报告1. 引言密封胶在许多工业应用中起着至关重要的作用,如汽车制造、建筑施工和电子设备组装等。
为了确保密封胶的可靠性和性能,密封胶的相容性试验是必不可少的。
本报告旨在介绍密封胶相容性试验的一般步骤和结果分析。
2. 试验步骤2.1 准备工作在进行密封胶相容性试验之前,需要准备好以下材料和设备: - 不同类型的密封胶样品 - 不同类型的试验物质 - 实验室天平 - 试验容器 - 实验记录表格2.2 试验设计在试验设计阶段,需要选择合适的试验物质和密封胶样品。
试验物质应包括常见的溶剂、润滑剂和化学物质。
密封胶样品应选择代表常见应用领域的不同类型的密封胶。
2.3 试验操作试验操作包括以下步骤: 1. 将试验物质倒入试验容器中,确保足够的量以覆盖密封胶样品。
2. 将密封胶样品放置于试验容器中,确保完全浸泡在试验物质中。
3. 记录试验开始时间,并设置试验时间。
4. 在试验时间结束后,取出密封胶样品并进行观察。
2.4 观察和记录观察密封胶样品的外观和性质的变化,并将观察结果记录在实验记录表格中。
可能的观察指标包括密封胶的颜色变化、质地变化、弹性变化等。
2.5 结果分析将观察结果与试验前的密封胶样品进行对比分析。
根据观察结果,可以评估不同试验物质对密封胶的相容性影响。
例如,如果密封胶样品出现较大的变化,如变色或变硬,表示该密封胶与试验物质不相容。
3. 结论通过密封胶相容性试验,我们可以评估密封胶在特定环境下的适用性和耐久性。
试验结果可以帮助制造商选择合适的密封胶,并确保产品在使用过程中不会受到损坏或失效。
4. 建议措施根据试验结果,我们可以提出一些改进和建议措施,以提高密封胶的相容性和应用性能。
例如,可以尝试使用不同类型的密封胶或调整密封胶的配方,以提高其对特定试验物质的耐受性。
5. 参考文献在编写报告时,应引用使用的参考文献,以便读者进一步了解密封胶相容性试验和相关研究。
结束语密封胶相容性试验是确保密封胶性能和可靠性的关键步骤。
注射用头孢他啶(1.0g)与胶塞相容性考察方案

题目:注射用头孢他啶(1.0g)与胶塞相容性考察方案
注射用头孢他啶(1.0g)与胶塞
相容性考察方案
注射用头孢他啶(1.0g)与胶塞相容性考察方案
1. 目的
对新增加的供应商××生产的20-B2注射用无菌粉末用卤化丁基橡胶塞(溴化)(以下简称胶塞)与注射用头孢他啶进行相容性考察,以发现注射用头孢他啶与胶塞的稳定性问题。
2. 标准依据:国家药品监督管理局直接接触包装材料和容器标准(试行)
YBB00142002药品包装材料与药物相容性指导原则。
3. 考察内容
分别以3批胶塞对一批注射用头孢他啶,进行胶塞相容性试验。
1)品名:注射用头孢他啶
2
3)仪器:真空干燥箱、澄明度仪。
4)检验依据和方法:注射用头孢他啶内控质量标准(编号)和注射用头孢他啶检验操作规程()。
胶塞相容性试验:
按考察批次和数量取样品,倒置于60℃±2℃温度下放置5天,5天后取样进行胶塞相容性检测,试验结果与0天进行比较。
3、方案实施与结果分析:
本方案由质量控制部负责实施,记录上述所有数据并汇总。
并对试验过程中异常情况记录、调查。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5) 所选用防火涂料的粘结强度不小于相关规范要求;
(6) 防火涂料应通过国家认可的检测机构检测和认证并通过相关的耐老化检测报告;
(7)选用的涂装材料应互相匹配,避免发生化学反应。
5、施工环境条件
底材温度不低于5℃且至少高于空气露点温度3℃以上,不得高于50℃,相对湿度不得高于90%,风力≤5m/s。
相对湿度大于90%、大风、雨、雾环境条件以及可能受到尘埃、油污、盐分和腐蚀介质污染的环境下不能施工。
施工环境温度以15~30℃为好。
6、施工工艺及操作方法
6.1、钢结构表面处理
防火涂料刷涂前应检查钢结构表面是否干净,钢结构表面防锈涂层是否完整。
当钢结构表面上附有浮锈、油、灰尘等时,要进行清除,以不影响实施防火保护层部分的附着力。
首先,可用压缩空气吹除浮尘、浮锈,必要时用刮刀、钢丝刷等去除污染附着物。
对油类污染可用挥发油进行清洗,并用干净回丝擦拭干净。
6.2、除锈、防火涂料施工工艺
(1)检查构件表面的除锈等级和粗糙度是否满足要求,如表面有锈斑, 焊渣和残留物需要用钢丝刷, 铲刮、锤击等办法清除。
(2)底漆:富锌环氧底漆喷涂干膜厚度50-60um 涂刷遍数:2遍
选用环氧富锌底漆,一边加入一边搅拌,加入完毕后用搅拌器进行充分搅拌,在使用过程中应经常搅拌,以保证涂料的均匀性,如太稠须在供应商工程师指导下加入适量稀释剂,稀释剂为专用稀释剂,清洗器具也需用此稀释剂,混合后使用寿命为:4小时(3)室内薄型防火涂料:采用人工喷涂,把涂料桶开启后,将防火涂料倒入大桶内,用搅拌器进行充分搅拌,搅拌均匀即可直接施工。
涂装要求
防火涂料应分多次涂装(每层厚度不超过2.5mm,且必须在前一遍干燥后,才能进行下一遍施工):檩条及屋面支撑耐火极限 1.0h / 5.5mm厚(3 遍),钢梁耐火极限1.5h / 7.0mm厚(3遍),钢柱及柱间支撑耐火极限2.5h /7.0mm厚(3 遍)。
刷涂方法:压力约为0.4MPa喷枪喷涂,修补部分可采用抹涂施工。
严禁将刷涂不同涂料的刷子在同一个清洗容器中清洗,必须使用配套的稀释剂清洗。
混合搅拌方法如同上述底漆
7、结果判定
涂装过程中湿膜状态下观察有无咬底、邹皮现象。
涂装完成后干燥一定时间后,检查漆膜无起泡、渗色、咬边、起皱现象。
涂装完成后干燥60天后(每周一次记录),无起皱、脱落现象
经实验判定环氧富锌底漆与室内薄型防火涂料配套性良好。
相容性试验记录表
编号:20180927
记录人:检验:审核:
相容性试验记录表
编号:20180927。
