环己醇制备环己烯
环己烯的制备

加样品 摇匀
安装好 仪器
加热反应 分馏柱顶 <90
分去 水层
等体积 饱和食盐 水洗涤
无水 CaCl2 干燥
水浴 蒸馏
图3 分液漏斗
至出现 白雾停
粗产品
止蒸馏
收集80-85度馏分 产品称重,计算 产率。
步骤: 在 50 毫升干燥的圆底(或茄形)烧瓶中,放入 10ml 环己醇(9.6g,0.096mol)、5ml 85% 磷酸,充分振摇、混合均匀。投入几粒沸石,按图 1 安装反应装置,用锥形瓶作接受器。 将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上端的温度不要超过 90℃, 馏出液为带水的混合物。当烧瓶中只剩下很少量的残液并出现阵阵白雾时,即可停止蒸馏。 全部蒸馏时间约需 40min。 将蒸馏液分去水层,加入等体积的饱和食盐水,充分振摇后静止分层,分去水层(洗涤 微量的酸,产品在哪一层?)。将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的 上口倒入干燥的小锥形瓶中,加入1-2克无水氯化钙干燥。 将干燥后的产物滤入干燥的梨形蒸馏瓶中,加入几粒沸石,用水浴加热蒸馏。收集 80 -85℃的馏分于一已称重的干燥小锥形瓶中。产量 4-5g。 本实验约需 4h。 六、注意事项
反应采用 85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱 得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分 馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝 、 下降、流回加热容器中;结果将沸点不同的物质分离。
98
5ml(0.08mol) 42.35
1.834 易溶于水
其它药品
饱和食盐水、无水氯化钙
环己烯的制备实验现象

环己烯的制备实验现象环己烯是一种具有六个碳原子组成的环状烯烃化合物,其结构中含有一个碳碳双键。
环己烯的制备方法有多种,下面将介绍几种常见的制备实验现象。
一、制备环己烯的加热脱水反应实验中,可以通过将环己醇与浓硫酸反应来制备环己烯。
首先,将环己醇与浓硫酸混合,然后加热至适当的温度。
在加热的过程中,观察到反应体系从无色透明变为混浊的现象,同时伴随着产生大量的气体。
这是由于环己醇分子中的羟基与硫酸反应,生成了环己烯和水。
环己烯是一种气体,在加热的条件下会逸出反应体系,形成气泡。
二、制备环己烯的蒸馏分离法实验中,可以通过对环己烷进行蒸馏分离来制备环己烯。
首先,将环己烷装入蒸馏烧瓶中,然后进行加热。
当温度达到环己烷的沸点时,环己烷开始汽化,形成蒸汽。
蒸汽经过冷凝器后,转化为液体环己烯。
在冷凝器中,可以观察到由于环己烷蒸汽冷凝而产生的液滴滴入集液瓶中的现象。
最后,通过收集液滴,可以得到纯净的环己烯。
三、制备环己烯的催化裂解反应实验中,可以通过将环己烷与催化剂进行催化裂解来制备环己烯。
首先,在反应釜中加入适量的环己烷和催化剂,然后进行加热。
在催化剂的作用下,环己烷分子中的碳碳单键被打断,形成环己烯和其他碳氢化合物。
在加热的过程中,可以观察到反应体系中逸出的气体,其中包括环己烯。
同时,可以通过气相色谱仪等分析方法对反应产物进行检测和定量分析。
四、制备环己烯的氧化反应实验中,可以通过将环己烷与氧气进行氧化反应来制备环己烯。
首先,在反应釜中加入适量的环己烷和适量的氧气,然后进行加热。
在氧气的作用下,环己烷分子中的碳碳单键被氧化,形成环己烯和其他氧化产物。
在加热的过程中,可以观察到反应体系中的气体产生变化,同时可以通过红外光谱等分析方法对反应产物进行鉴定和定量分析。
环己烯可以通过加热脱水反应、蒸馏分离法、催化裂解反应和氧化反应等多种方法进行制备。
通过实验观察到的现象,我们可以了解到环己烯的制备过程,并通过适当的分析方法对反应产物进行鉴定和定量分析,从而得到纯净的环己烯。
环己烯的制备

• 答:采用硫酸作催化剂虽然反应速度较快,但由于硫酸的氧化性比磷酸强, 反应时部分原料会被氧化、甚至碳化,使溶液颜色加深,产率有所降低。此 外,反应时会有少量SO2气化放出。在纯化时,需要碱洗,增加了纯化步骤。
环己烯的制备
一、目的
1、学习、掌握由环己醇制备环己烯的原理及方法。 • 2、了解分馏的原理及实验操作。 • 3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、原理
ቤተ መጻሕፍቲ ባይዱ 实验药品及物理常数
药品名称
环己醇 环己烯 85%磷酸
分子量 (mol wt)
100.16
用
量
(ml、g、mol)
10ml(0.096mol)
• 反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸 氧化能力较硫酸弱得多,减少了氧化副反应。
• 分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热 交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上 升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中; 结果将沸点不同的物质分离。详细的原理参见P88-89。
• 2 环己醇与磷酸应充分混合,否则在加热过程中可能会局部碳化,使溶液变黑。
• 3 由于反应中环己烯与水形成共沸物(沸点70.8℃,含水l0%);环己醇也能与水形成共 沸物(沸点97.8℃,含水80%)。因比在加热时温度不可过高,蒸馏速度不宜太快,以减 少末作用的环己醇蒸出。文献要求柱顶控制在73℃左右,但反应速度太慢。本实验为 了加快蒸出的速度,可控制在90℃以下。
• 6 在蒸馏已干燥的产物时,蒸馏所用仪器都应充分干燥。接收产品的三角瓶应事先称 重。
• 7一般用块状的无水氯化钙进行干燥,便于后面的分离。用无水氯化钙干燥的时间一般 要在半个小时以上,并不时摇动。但实际实验中,由于时间关系,只能干燥5-10分钟 。因此,水是没有除净的,在最后蒸馏时,会有较多的前馏分(环己烯和水的共沸物 )蒸出。
实验7 环己烯的制备
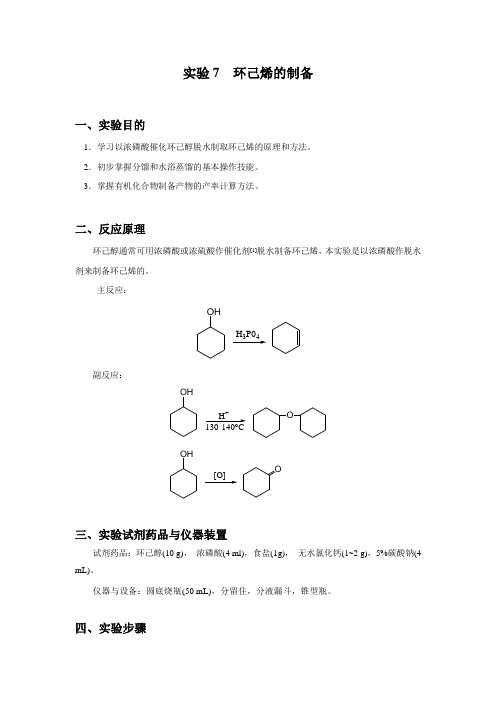
实验7 环己烯的制备一、实验目的1.学习以浓磷酸催化环己醇脱水制取环己烯的原理和方法。
2.初步掌握分馏和水浴蒸馏的基本操作技能。
3.掌握有机化合物制备产物的产率计算方法。
二、反应原理环己醇通常可用浓磷酸或浓硫酸作催化剂[1]脱水制备环己烯,本实验是以浓磷酸作脱水剂来制备环己烯的。
主反应:OH34副反应:OHOOHOH +o [O]三、实验试剂药品与仪器装置试剂药品:环己醇(10 g), 浓磷酸(4 ml),食盐(1g), 无水氯化钙(1~2 g),5%碳酸钠(4 mL)。
仪器与设备:圆底烧瓶(50 mL),分留住,分液漏斗,锥型瓶。
四、实验步骤1.粗环己烯的制备在50 mL干燥的圆底烧瓶中,放入10 g环己醇(10.4 mL,0.1 mol)、4 mL浓磷酸和几粒沸石,充分振摇使混合均匀。
烧瓶上装一短的分馏柱作分馏装置,接上冷凝管(见图2-21),用锥形瓶作接受器,外用冰水冷却。
将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上端的温度不要超过90℃[2],慢慢的蒸出生成的环己烯和水(混浊液体[3]。
当烧瓶中只剩下很少量的残渣并出现阵阵白雾时,即可停止蒸馏。
全部蒸馏时间约需l h。
2.环己烯的精制将蒸馏液用精盐饱和,然后加入3~4 mL 5%碳酸钠溶液中和微量的酸。
将此液体倒入小分液漏斗中,振摇后静置分层。
将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒入干燥的小锥形瓶中,加入1~2 g无水氯化钙干燥[4]。
将干燥后的产物滤入干燥的蒸馏瓶中,加入沸石后用水浴加热蒸馏。
收集80~85℃的馏分于一已称重的干燥小锥形瓶中。
= 1.4465。
产率3.8~4.6 g(产率46%~56%)。
纯粹环己烯的沸点为82.98℃,n20D图3-1 环己烯的红外光谱五、注意事项1.环己醇在常温下是粘碉状液体,因而若用量筒量取时应注意转移中的损失,可用称量法。
环己烯与硫酸应充分混合,否则在加热过程中可能会局部碳化。
环己烯的制备同名

环己烯的制备(同名15884) 环己烯的制备一、实验目的1.学习由环己醇制备环己烯的反应原理和方法。
2.掌握醇的消去反应实验技术和无水乙醇的蒸馏方法。
二、实验原理环己醇在酸性条件下加热发生消去反应生成环己烯,反应方程式如下:CH3CH(OH)CH2CH2CH2CH3 → CH2=CHCH2CH2CH2CH3 + H2O反应机理为E1消除反应,即醇首先解离出氢离子和烷氧基负离子,然后碳正离子与β-碳上的氢结合生成烯烃和水。
由于反应中生成了水,因此需要使用干燥剂无水硫酸钠吸收水分,防止水对产物的影响。
三、实验步骤1.在50mL圆底烧瓶中加入5.0g环己醇和5mL 10%磷酸,摇匀。
2.在水浴中加热至沸腾,保持回流0.5h。
3.取出烧瓶,迅速加入10mL冷水,摇匀后静置冷却。
4.分液,水层用10mL乙醚萃取一次,合并有机层。
5.用无水硫酸钠干燥有机层,过滤除去硫酸钠。
6.常压蒸馏,收集沸点为83-84℃的馏分,得到环己烯粗产品。
7.用少量无水乙醇洗涤环己烯粗产品,然后用无水硫酸钠干燥。
8.常压蒸馏,收集沸点为83-84℃的馏分,得到环己烯纯品。
四、实验结果与讨论1.实验结果(1)环己醇的质量为5.0g,理论上可以得到环己烯的质量为4.6g。
实际得到的环己烯质量为4.0g,产率为87%。
(2)通过常压蒸馏得到的环己烯纯品为无色透明液体,具有特殊的气味。
2.实验讨论(1)在本实验中,使用了磷酸作为催化剂。
磷酸的催化效果好,但由于其酸性较强,可能会对产物造成一定的影响。
可以考虑使用其他酸性较弱的催化剂,如硫酸或盐酸等。
(2)实验中需要控制加热温度和时间,以防止副反应的发生。
同时,在冷却过程中需要迅速加入冷水,以防止产物进一步反应。
(3)在蒸馏过程中,需要注意控制加热速度和温度,以防止产物分解或发生其他副反应。
同时,需要使用干燥的仪器和试剂,以保证产物的纯度。
五、实验结论通过本实验,我们成功地制备了环己烯,并对其进行了分离和提纯。
环己烯的合成一实验目的1.熟悉环己醇脱水制备环己烯的原理及反应

环己烯的合成
一、实验目的
1.熟悉环己醇脱水制备环己烯的原理及反应装置
2.掌握易挥发液体有机化合物的蒸馏,洗涤与分液等操作技能
二、实验原理
本实验由环己醇在浓磷酸的作用下脱水制得环己烯,醇的脱水可以使用氧化铝在350-500℃之间进行催化脱水,也可以使用硫酸、无水氯化锌等脱水剂脱水。
该反应可逆,为使这一反应有利于产物生成,可以使环己烯一生成即从反应混和物中连续蒸出。
由于环己烯易挥发,为了防止外逸,需要将接收瓶置于冰水中。
反应式:
H
O
可能的副产物是醚和烯烃的聚合物。
三、仪器与试剂
1.仪器圆底烧瓶(50mL),分馏柱,蒸馏头,直形冷凝管,真空接液管,梨形瓶,分液漏斗,锥形瓶,热源,温度计(100℃)。
2.试剂环己醇(C.P.),85﹪磷酸,5﹪碳酸钠溶液,氯化钠(C.P.),无水氯化钙(C.P.)。
四、实验步骤
50mL
5.2mL
环己烯
2.0mL85%
磷酸
沸石
慢慢升温至沸顶部温度小于90。
C
中和
过滤混合均匀搭装置, 见下图接受瓶置冰水中馏出液蒸馏产品五、注意事项
1.在收集和转移环己烯时,最好保持充分冷却,以避免因挥发而损失;
2.蒸馏已干燥的产品,所用仪器应充分干燥;
3.磷酸的腐蚀性非常大,不可触及皮肤;
4.环己烯是易燃物,而且颇具有挥发性,要注意勿让火焰靠近接收瓶。
有机化学实验二环己烯的制备

实验二:环己烯的制备一、实验目的1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、实验原理OH 85%H 3PO4+ H 2O OH85%H 3PO 42O+ H 2O主反应副反应主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。
但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。
为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离。
详细的原理参见P88-89。
三、实验药品及物理常数药品名称分子量 (mol wt) 用 量 (ml 、g 、mol) 熔点(℃) 沸点 (℃) 比重 (d 420) 水溶解度 (g/100ml) 环己醇 100.16 10ml (0.096mol )25.2 161 0.9624 稍溶于水 环己烯 82.1483.19 0.8098 不溶于水 85%磷酸98 5ml (0.08mol )42.35 1.834 易溶于水其它药品 饱和食盐水、无水氯化钙四、实验装置图圆底烧瓶刺形分馏柱温度计直形冷凝管接引管锥形瓶蒸馏头水浴温度计直形冷凝管接引管锥形瓶图1 反应装置图2 蒸馏装置图3 分液漏斗五、实验流程图10ml 环己醇5ml85%加样品摇匀安装好仪器加热反应分馏柱顶<90分去水层粗产品无水等体积饱和食盐水洗涤至出现白雾停止蒸馏干燥收集80-85度馏分产品称重,计算产率。
制备环己烯实验报告

一、实验目的1. 学习以浓磷酸催化环己醇脱水制备环己烯的原理和方法。
2. 掌握分馏、水浴蒸馏和液体干燥等基本操作技能。
3. 了解环己烯的物理和化学性质。
二、实验原理环己烯是一种重要的有机化工原料,广泛应用于医药、农药、合成橡胶等领域。
本实验采用浓磷酸作为催化剂,使环己醇在加热条件下发生脱水反应,生成环己烯。
主反应式:C6H12O → C6H10 + H2O该反应历程为E1历程,即醇首先在酸性条件下发生质子化,生成正碳离子,然后失去一个质子,形成烯烃。
三、实验材料与仪器1. 实验材料:- 环己醇:10.0g(10.4mL,0.1mol)- 浓磷酸:4mL- 氯化钠、无水氯化钙、5%碳酸钠水溶液2. 实验仪器:- 50mL圆底烧瓶- 分馏柱- 直型冷凝管- 100mL分液漏斗- 100mL锥形瓶- 蒸馏头- 接液管- 沸石- 温度计四、实验步骤1. 准备反应装置:将50mL圆底烧瓶放入分馏柱中,连接直型冷凝管、100mL分液漏斗、100mL锥形瓶和接液管。
2. 加入环己醇:将10.0g(10.4mL,0.1mol)环己醇倒入圆底烧瓶中。
3. 加入浓磷酸:将4mL浓磷酸缓慢倒入圆底烧瓶中,边倒边摇匀。
4. 加热反应:将圆底烧瓶放入水浴中,加热至70-80℃,保持一段时间。
5. 分馏:待反应液清亮透明后,小心滤入干燥的小烧瓶中,投入几粒沸石后用水浴蒸馏。
6. 收集馏分:收集80-85℃的馏分,倒入干燥的锥形瓶中。
7. 干燥:将收集到的环己烯用无水氯化钙干燥。
8. 纯化:将干燥后的环己烯进行重结晶,得到较纯净的环己烯产物。
五、实验结果与分析1. 环己烯的物理性质:- 外观:无色透明液体- 气味:具有特殊刺激性气味- 沸点:83.0℃- 溶解度:不溶于水,溶于乙醇、乙醚等有机溶剂2. 环己烯的化学性质:- 环己烯可以与溴水发生加成反应,生成1,2-二溴环己烷。
- 环己烯可以与酸性高锰酸钾溶液发生氧化反应,生成环己二醇。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环己烯
-104
83
325
中等毒 性
对甲苯磺 106~107 酸
116
中等毒 性
仪器与试剂
• 仪器:圆底烧瓶、分馏柱、冷凝 管、三角烧瓶、烧杯 • 试剂:环己醇、对甲苯磺酸(P-CH 3C6H4SO3H·H2O)、精盐等。
实验底烧瓶中,加入20 g (约0.2mol)环己醇、2.55-3.8 0 g (0.015-0.020 mol)对甲苯磺酸和几 粒沸石, 安装上带分馏柱的蒸馏装置 ,用50 m L三角烧瓶作接收器,并置于 冰水浴中。
实验结果及记录
环己醇 催化剂 产物质 性状 质量 质量 量
折光率 产率
注意事项
【1】环己醇在室温下为粘稠的液体,量筒内 的环己醇难以倒净,会影响产率。可 采 用称量法避免损失。 【2】当蒸气上升到分馏柱顶部,开始有液体 馏出时应密切注意调节温浴控制溜出 液的速度为2~3s一滴。 【3】蒸馏时速度不宜过快,以减少未作用的 环己醇的蒸出
实验步骤
2、用小火缓缓加热混合物至沸腾,控制 分馏柱顶部馏出温度不超过90℃,慢慢 蒸出生成的环己烯和水的混浊液体[约 1滴/(2~3)s],至烧瓶中只剩下少量残 液并开始变黑冒白烟,顶部温度下降, 则停止加热,全部过程约3 5-5 0 min 。
实验步骤
3、将馏出液用1g精盐饱和,再加入3~4mL 质量分数为5%的 Na2CO3溶液中和微量酸 ,并转入分液漏斗中,振摇后静置分层, 放出下面水层。上层粗产品用少量无水 氯化钙干燥至透明, 再转入50mL蒸馏瓶 中加入沸石在水浴上进行蒸馏,收集83~ 87℃的馏分,即为所得溶液。
实验原理
本实验是以对甲苯磺酸作催化剂,环己醇脱水 来备环己烯。主反应式如下:
OH
p-CH3C6H4SO3H·
H2 O
部分化合物物理性质
熔点/℃ 沸点/℃ 燃点/℃ 毒性
环己醇 25.1 161.1 300 低毒
性状 /25℃
无色透明 液体,有 樟脑气味 无色透明 液体,有 特殊刺激 性气味 无色单斜 片状或柱 状醋酸气 味晶体
环己烯制备环己醇
汇报人:*******
实验目的
1
学习在酸催化下醇脱水制取烯烃的原理和方法
2
了解简单蒸馏和分馏的原理,初步掌握简单蒸馏和分馏的装置及操作
3
掌握分液漏斗的使用方法及干燥剂干燥液体的方法
实验原理
• 环己烯是重要的有机化工原料,常用于医药、 农药中间体和高聚物的合成中,在石油工业 中 用作萃取剂、高辛烷值汽油的稳定剂、化工生 产 中的溶剂及制备催化剂等方面,是一种重要 的有机化合物。目前工业上均采用硫酸或磷酸 催化的液相脱水法或苯的部分氢化来制备。硫 酸催化法虽是经典方法,工艺成熟,但产品收率 不高,而且存在严重腐蚀性和副反应;磷酸虽较 硫酸好,但成本较高;苯的部分加氢法存在催化 剂制备成本高和苯污染问题,不适于实验室和 小型企业生产。对甲苯磺酸是一种固体有机酸 ,经济、易得,保管、运输、使用比硫酸方便、 安全,对设备的腐蚀和引起的副反应可能性比 硫酸小,活性高,是替代硫酸的良好催化剂。
