环己酮的制备
环己酮

环己酮生产工艺的发展及研究进展24号朱海鹏摘要:本文介绍了环己烷液相氧化法生产环己酮的工艺以及其改进情况。
同时, 还介绍了几种环己烷催化氧化制环己酮的新工艺研究进展。
关键词:环己酮, 工艺, 发展, 研究环己酮是一种重要的有机化工产品, 具有高溶解性和低挥发性, 可以作为特种溶剂, 对聚合物如硝化棉及纤维素等是一种理想的溶剂; 也是重要的有机化工原料, 是制备己内酰胺和己二酸的主要中间体。
1893 年A.Bayer 采用庚二酸和石灰(庚二酸钙) 干馏首先合成了环己酮。
1943 年德国I. G.Farben 公司建成了苯酚加氢法合成环己酮生产装置。
1960 年德国BASF 公司采用环己烷氧化法建成大型环己酮生产装置, 使环己烷氧化技术得以迅速发展, 并导致聚酰胺纤维的大规模发展。
世界上环己酮工业生产工艺主要有苯酚加氢法、环己烷液相氧化法、环己烯水合法。
目前90 %以上的环己酮是采用环己烷氧化法生产的。
1 苯酚加氢法苯酚合成环己酮工艺是最早应用于工业化生产环己酮的工艺, 该工艺早期分为两步: 第一步苯酚加氢为环己醇, 第二步环己醇脱氢生成环己酮。
20世纪70 年代开发成功了一步加氢法合成环己酮的新工艺。
苯酚一步加氢有气相和液相两种方式。
工业上主要是采用气相法, 该工艺采用3~5 个反应器串联, 温度为140~170 ℃、压力0.11 MPa , 反应完全, 收率可达95 %。
苯酚加氢法生产的环己酮质量较好, 安全性高, 但由于苯酚价格昂贵, 并使用了贵金属催化剂, 使环己酮的生产成本较高, 因此该工艺的应用受到了很大的限制。
2 环己烷液相氧化法目前工业生产中环己烷液相氧化法有两条氧化工艺路线, 一种为催化氧化工艺, 另一种为无催化氧化工艺。
催化氧化工艺主要是采用钴盐、硼酸或偏硼酸为催化剂。
2.1 钴盐催化氧化法该工艺一般采用环烷酸钴、硬脂酸钴、油酸钴、辛酸钴、环烷酸钴铬复合物等钴盐为催化剂,环己烷在钴盐催化作用下与空气发生氧化反应, 该过程首先是环己烷与氧气通过自由基反应形成环己基过氧化氢, 然后该过氧化物在催化剂作用下受热分解, 生成环己酮、环己醇。
环己酮的制备实验报告

环己酮的制备实验报告实验学专班姓指导日机化学实验报告名称:环己酮的制备院:化学工程学院业:化学工程与工艺级:化工10-6班名:严晓晓学号 10402021602 教师:邵琼芳陈斌期: 2021年11月27日有一、实验目的1、学习次氯酸氧化法制环己酮的原理和方法;2、进一步了解醇和酮这件的联系和区别。
二、实验原理用次氯酸钠作氧化剂,讲环己醇氧化成环己酮。
OH[O]O三、主要试剂及仪器试剂:环己醇(有樟脑气味的无色粘性液体,熔点:25.2℃,沸点:160.9 ℃ 相对密度:0.9624)、次氯酸钠、冰醋酸、无水碳酸钠、无水硫酸镁、氯化铝、沸石、氯化钠、碘化钾淀粉试纸。
仪器:搅拌器、滴液漏斗、温度计、250 ml三颈烧瓶、酒精灯、锥形瓶、冷凝管、蒸馏烧瓶、接液管、分液漏斗。
四、试剂用量规格药品环己醇冰乙酸次氯酸名称钠药品用量 5.2ml 25ml 38ml 亚硫酸氢钠适量氯化铝 3g 沸石碳酸钠氯化钠适量无水硫酸镁适量适量适量五、实验仪器装置反应装置蒸馏装置分液装置空气冷凝蒸馏装置六、实验步骤及现象时间 9:15 步骤投料,将环己醇5.2ml和冰乙酸25ml倒入三颈烧瓶中。
慢慢滴加次氯酸钠38ml 次氯酸钠滴加完毕T=18℃ 无色溶液变成乳白色,温度升高,T=32℃ 试纸显紫色溶液呈无色透明状液体,T=21℃ 试纸不显色液体暴沸T=90℃T=93℃ 温度下降溶液分层,上层是黄色液体有机层为6ml 蒸得馏分0.165ml 现象 9:25 9:45 9:52 用碘化钾试纸检验 10:25 搅拌完毕 10:27 加入适量硫酸氢钠,用碘化钾试纸检验 10:35 开始蒸馏 10:50 将液体过滤,除去沉积物 11:30 12:02 12:07 12:40 再次开始蒸馏馏分出现馏分稳定蒸馏完成 12:55 加碳酸钠中和至pH=7,再加入氯化钠 13:10 静置,分液 13:30 将上层分得的液体用无水硫酸镁干燥 13:55 过滤14:02 蒸馏(150℃-155℃)七、实验数据处理环己醇的物质的量计算:n=m/M=5g/100g?mol-1=0.05mol环己酮的物质的量计算:n′=m′/M′=ρV/M′=0.9624g?cm-3*0.165cm3/98 g?mol-1=0.0016mol 理论应该得出的环己酮的物质的量=实际环己醇的物质的量=0.05mol 环己酮产率=实际量/理论量=0.0016/0.05=3.2%八、实验讨论1、由于在第一次蒸馏时,溶液暴沸,所以将溶液过滤,除去沉积物,使得损失了大量产品;2、加热蒸馏不够充分,而且可能有部分蒸汽逸出,导致产品损失;3、分液静置的时候时间不够长,导致产品损失;4、最后蒸馏的时候时间太短,不够充分,使得环己酮没有完全分离出来。
环己酮制备

六、思考题
1. 反应温度为什么要控制在之间,温度过高或过低有什 么不好? 2. 能否用铬酸氧化把2-丁醇和2-甲基-2-丙醇区别开来?说 明原因,并写出有关的反应式。 3. 如何用IR鉴别环己醇和环己酮。
上页 返回 退出
3
+ + NaCr2O7 5 H2SO4
3
+ + + Cr2(SO4)3 2 NaHSO4 7 H2O
以铬酸为氧化剂氧化仲醇是制备脂肪酮常用的方法。铬 酸氧化是一个放热反应,必须严格控制反应温度以免反 应过于剧烈。
1:用铬酸氧化制备醛和酮有什么不同? 2:环己醇用铬酸氧化和用高锰酸钾氧化有什么不同? 提问
上页 下页 返回 退出
四、实验步骤
3. 反应完毕后在反应瓶中加入30mL水进行 蒸馏。
收集约30mL 馏出液
上页 下页 返回 退出
四、实验步骤
4. 将馏出液用食盐饱和后转入分液漏斗中,分出有机相。 水相用8mL乙醚提取一次,将乙醚提取液和有机相合并, 用无水硫酸镁干燥;
5. 在旋转蒸发仪上蒸除乙醚。
上页 下页 返回 退出
三、试剂及仪器
试剂:
重铬酸钠 5g 环己醇 5mL 浓硫酸 4.3mL 氯化钠 无水硫酸镁
仪器:
半微量有机合成玻璃仪器; 旋转蒸发仪;
上页 下页 返回 退出
四、实验步骤
1. 配制铬酸溶液:在100mL烧杯中加入30mL水和5g重铬酸钠, 搅拌使之全部溶解。然后在搅拌下慢慢加入4.3mL浓硫酸,将 所得橙红色溶液冷却到30℃以下备用; 2. 100mL圆底烧瓶中加入5mL环己醇,然后一次加入配制好的 铬酸溶液,并充分振摇使之混合均匀。用水浴冷却,控制反 应温度在55~60℃。当温度开始下降时移去冷水浴,室温下 放置1h,其间要间歇振摇反应瓶;
环己酮原材料

环己酮原材料
环己酮是一种重要的有机化工原料,广泛应用于制造尼龙6、环己酮树脂、溶剂等产品。
制备环己酮的主要原材料包括:
1. 环己烷
环己烷是环己酮生产的主要原料之一,通过环己烷的氧化反应可以制得环己酮。
环己烷可以从石油或天然气中分离提纯而来。
2. 苯
苯也是合成环己酮的常用原料,通过苯的加氢和环合反应可以制备环己烷,再经过氧化反应生成环已酮。
苯主要来源于石油化工行业的重组分。
3. 丁二烯
丁二烯是另一种制备环己酮的原料,通过丁二烯的二聚环合反应可以得到环已烷,再经过氧化反应生成环已酮。
丁二烯可以从石油裂解气中分离。
4. 空气/氧气
制备环己酮需要氧化剂,通常使用空气或者纯氧气作为氧化剂。
5. 催化剂
环己烷或苯等原料的氧化反应需要添加催化剂,常用的催化剂有钴、铬、锰等金属氧化物。
通过对上述原材料进行适当反应,可以高效合成环己酮,满足工业生产的需求。
原材料的选择和反应工艺路线将直接影响环己酮的生产成本和效率。
环己酮的制备-PPT精选文档10页

有机化学实验
二、实 验 原 理:
Chem is try !
用次氯酸钠作氧化剂,将环己醇氧化成环己酮。
有机化学实验
三、药品和仪器:
Chem is try !
环 己 醇 5g ( 5.2ml ) , 乙 酸 , 次 氯 酸 钠 溶 液 ( 约 1.8mol/L),饱和亚硫酸氢钠溶液,KI淀粉试纸,无水 碳酸钠,无水硫酸镁,氯化钠,碳酸氢钠。
3. 加入氯化钠形成饱和溶液是为了降低环己酮在水 中的溶解度,并有利于分层。但蒸出的水不宜加 过多,既形成的饱和溶液不能过多,否则还是会 降低环己酮的产率。
有机化学实验
六、思考题:
Chem is try !
1. 环己酮还能通过什么方法制备? 2. 具体说明加饱和氯化钠的作用原理?
实验装置
有机化学实验
三、组要试剂及物理性质:
Chem is try !
有机化学实验
四、实验步骤:
Chem is try !
有机化学实验
Chem is try !
有机化学实验
五、注意事项:
Chem is try !
1. 转移次氯酸钠溶液应该在通风橱内进行。
2. 加入水蒸馏,实际是简化了的水蒸气蒸馏,环己 酮与水形成恒沸混合物,沸点95℃,含环己酮 38.4%。
化学化工学院
Chem is try !
实验五十五 环己酮的制备 (4学时) 主讲教师:
有机化学实验
2019/9/23
有机化学实验
一、实 验 目 的:
Chem is try !
学习次氯酸氧化法制环己酮的原理及方法
进握 回流操作。
环己酮的制备实验报告

环己酮的制备实验报告实验学专班姓指导日机化学实验报告名称:环己酮的制备院:化学工程学院业:化学工程与工艺级:化工12-4班名:王伟杰学号 12402010414 教师:张宗勇杨春风期:有一、实验目的1、学习次氯酸氧化法制环己酮的原理和方法;2、进一步了解醇和酮这件的联系和区别。
二、实验原理用次氯酸钠作氧化剂,讲环己醇氧化成环己酮。
OH[O]O三、主要试剂及仪器试剂:环己醇(有樟脑气味的无色粘性液体,熔点:25.2℃,沸点:160.9 ℃ 相对密度:0.9624)、次氯酸钠、冰醋酸、无水碳酸钠、无水硫酸镁、氯化铝、沸石、氯化钠、碘化钾淀粉试纸。
仪器:搅拌器、滴液漏斗、温度计、250 ml三颈烧瓶、酒精灯、锥形瓶、冷凝管、蒸馏烧瓶、接液管、分液漏斗。
四、试剂用量规格五、实验仪器装置反应装置蒸馏装置分液装置空气冷凝蒸馏装置六、实验步骤及现象七、实验数据处理环己醇的物质的量计算:n=m/M=5g/100g?mol-1=0.05mol 环己酮的物质的量计算:n′=m′/M′理论应该得出的环己酮的物质的量=实际环己醇的物质的量=0.05mol 环己酮产率=实际量/理论量八、实验讨论1、由于在第一次蒸馏时,溶液暴沸,所以将溶液过滤,除去沉积物,使得损失了大量产品;2、加热蒸馏不够充分,而且可能有部分蒸汽逸出,导致产品损失;3、分液静置的时候时间不够长,导致产品损失;4、最后蒸馏的时候时间太短,不够充分,使得环己酮没有完全分离出来。
九、注意事项1、蒸馏时温度不宜升的过快,将导致溶液暴沸;2、加入次氯酸不宜过多,否则中和时加入较多的亚硫酸氢钠,从而造成蒸馏时间过长;3、盐析时,NaCl不宜加入太多,应该慢慢加入。
相关文档:更多相关文档请访问:。
环己酮的制备实验讨论及总结

环己酮的制备实验讨论及总结[实验目的]1、了解用环己醇制备环己酮的原理和方法;2、掌握和熟练反应装置、分液装置的安装和使用方法。
3、进一步了解醇和酮之间的联系和区别[实验原理]环己醇可被氧化生成环已酮:[主要试剂及性质]1、环己醇:无色透明油状液体或白色针状结晶,有似樟脑气味。
可被强氧化剂养化成酮;2、乙酸: 无色液体;3、次氯酸钠溶液:无色溶液,强氧化剂,可氧化醇;4、饱和亚硫酸氢钠溶液:无色溶液,可与次氯酸钠反应;5、氯化铝:白色固体,消去气泡;6、沸石:白色固体,可防止暴沸;7、碳酸钠溶液:无色液体,碱性,可除去反应中的乙酸:8、硫酸镁:白色晶体,具有吸收性:9、氯化钠:白色晶体,盐析,降低环已酮的溶解度。
[试剂用量规格]5.12g环已醇、25mL 乙酸、38mL, 1.8mol/L 次氯酸钠、饱和亚硫酸氢钠、30mL水、3g氯化铝、少量沸石、适量碳酸钠、过量氯化钠、足量硫酸镁。
[仪器装置]1、仪器:烧杯、搅拌器、三口圆底烧瓶、滴液漏斗、温度计、直行冷凝管、接液管、蒸馏头、蒸馏烧瓶、空气冷凝管、锥形瓶、玻璃棒;2、仪器装置图:[实验结果]1、M (环己称) =5.12g,计算出环己酮理论值M (环己酮) = ( 5.12*98) /100=5.02g2、M (饶杯) =42.27g, M (g) =45.76g; 粗产量m=3.49g,粗产率=69.5%3、M (维形瓶) =78.79g,M (g) =94.30g, 九组纯产量总和M=15.51g4、平分后纯产量m=2.45g,产率=48.8%[注意事项]1、次氯酸钠滴加时你能过快,否则会使反应不够充分;2、搅拌器转速不能太快,V<300r/min;3、第二次蒸馏时要先干燥仪器;4、实验结束后要及时清洗仪器。
[实验讨论与分析]1、实验所得的产量较低,分析了几种可能引起误差因素:读数引起的误差,连接处出现漏气引起误差,分液漏斗分层和用普通漏斗过滤时产品的流失,转移过程中液体的损失,蒸馏没有进行彻底。
有机化学环己酮的制备实验报告
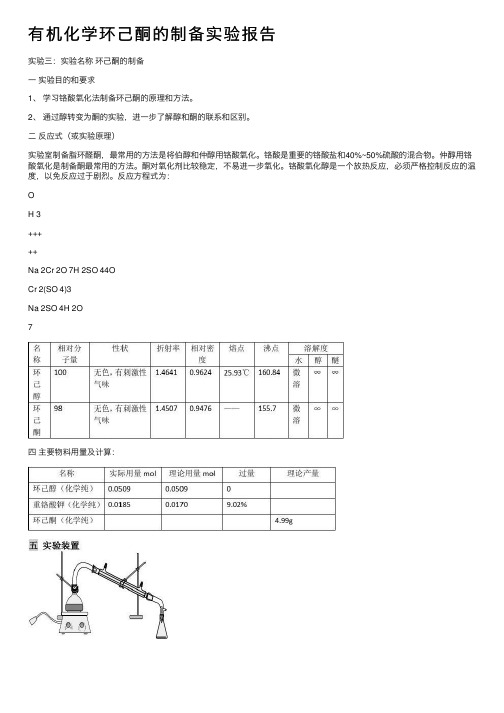
有机化学环⼰酮的制备实验报告实验三:实验名称环⼰酮的制备⼀实验⽬的和要求1、学习铬酸氧化法制备环⼰酮的原理和⽅法。
2、通过醇转变为酮的实验,进⼀步了解醇和酮的联系和区别。
⼆反应式(或实验原理)实验室制备脂环醛酮,最常⽤的⽅法是将伯醇和仲醇⽤铬酸氧化。
铬酸是重要的铬酸盐和40%~50%硫酸的混合物。
仲醇⽤铬酸氧化是制备酮最常⽤的⽅法。
酮对氧化剂⽐较稳定,不易进⼀步氧化。
铬酸氧化醇是⼀个放热反应,必须严格控制反应的温度,以免反应过于剧烈。
反应⽅程式为:OH 3+++++Na 2Cr 2O 7H 2SO 44OCr 2(SO 4)3Na 2SO 4H 2O7四主要物料⽤量及计算:分液装置制备蒸馏装置精馏蒸馏装置六实验步骤流程1、配制铬酸溶液:在200mL烧杯中加⼊30mL⽔和5.5g重铬酸钠,搅拌使之全部溶解。
然后在搅拌下慢慢加⼊4.5mL浓硫酸,将所得橙红⾊溶液冷却到30℃以下备⽤;2、250mL圆底烧瓶中加⼊5.3mL环⼰醇,然后⼀次加⼊配制好的铬酸溶液,并充分振摇使之混合均匀。
⽤⽔浴冷却,控制反应温度在55~60℃。
当温度开始下降时移去冷⽔浴,室温下放置0.5h,其间要间歇振摇反应瓶;3、反应完毕后在反应瓶中加⼊30.0mL⽔和⼏粒沸⽯,改成蒸馏装置进⾏蒸馏。
将环⼰酮和⽔⼀起蒸出来,直⾄馏出液不再浑浊再多蒸8~10mL,约收集馏出液25mL。
4、将馏出液⽤⾷盐饱和后转⼊分液漏⽃中,分出有机相。
⽔相⽤7.5mL⼄醚提取⼀次,将⼄醚提取液和有机相合并,⽤1~2g ⽆⽔碳酸钾⼲燥;在⽔浴上蒸除⼄醚,换空⽓冷凝管,蒸馏收集151~155℃馏分。
5、称量产品。
纯粹环⼰酮沸点155.7℃,d420为0.9476,折射率n420为1.4507.七实验记录⼋、产率计算实际产品质量:2.5g理论产品质量:4.99g产率=(实际产品质量/理论产品质量)*100%=(2.5/4.99)*100%=50.1%九、讨论本实验中,铬酸氧化醇是⼀个放热反应,需要严格控制温度以防反应过于剧烈,⽤冷⽔和热⽔来维持;温度过⾼副反应增多,温度过低反应困难。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、实验目的
1.学习次氯酸氧化法制环己酮的原理和方法。
2.进一步了解醇和酮之间的联系和区别。
二、实验原理
用次氯酸钠作氧化剂,将环己醇氧化成环己酮。
三、主要试剂及物理性质
1.试剂:环己醇5g(5.2ml),冰醋酸,次氯酸钠溶液(约1.8mol/L),饱和亚硫酸钠溶液,氯化铝,KI淀粉试纸,无水碳酸钠,无水硫酸镁,氯化钠。
2.物理性质:
环己醇:无色透明油状液体或白色针状结晶,有似樟脑气味。
熔点25.93℃。
沸点160.84℃,微溶于水,可混溶于乙醇、乙醚、苯、乙酸乙酯、二硫化碳、
油类等。
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味。
熔点-45℃,沸点155.6℃
四、仪器装置
1250ml三颈烧瓶,搅拌器,125ml滴液漏斗,温度计,直型冷凝管,接受器,125ml 分液漏斗,蒸馏头,玻璃塞,空气冷凝管,三角漏斗。
五、 实验步骤及现象
六、 实验结果
M =5.0环己醇g ,则环己酮的理论产量为 5.098
M ==4.9g 100
环己酮 蒸馏得到环己酮体积V 环己酮=1.4ml 所以M 环己酮=1×0.9478g/ml=1.33g
产率=1.33g
×100%=27.1% 4.9g
七、实验讨论
1.蒸馏过程中装置没有紧密导致产率降低。
2.蒸馏时还有油状液体蒸出时就停止蒸馏导致产率降低。
3.分液静止时间不够长,导致环己酮的损失。
