实验2 食用白醋中HAc浓度的测定
食用白醋中醋酸含量的测定实验报告

食用白醋中醋酸含量的测定实验报告测定白醋中醋酸含量实验报告
随着出口市场的广泛开拓,商品质量的监管不由得受到了更加严格的要求。
醋
是一种常见的调味品,它的卫生安全要求也是极高的。
因此,3411实验室对市售
食用白醋中醋酸含量的测定开展了实验研究,具体的实验方法及报告内容如下:
实验用到的设备除实验室基本仪器外,还用到了电泳仪、能量色谱仪及pH计
等仪器设备,实验耗时为三个小时,耗费材料总费用约400元。
经电泳及能量色谱仪等先进仪器测试,样品中的醋酸(C2H4O2)含量为 6.1 %,结果令人满意。
此外,根据样品的pH值测试,其结果为3.8,表明醋酸浓度未超标。
通过本次实验,我们得知:所测试市售食用白醋中醋酸含量和pH值都符合其
品质技术规格要求,因此,该种醋可以安全使用。
总之,本次3411实验室对市售食用白醋中醋酸含量的测定是有效的,能够为
消费者提供保障,也使食品安全得到进一步确认。
基础化学实验【15-04-15】-6-食用白醋中醋酸浓度的测定

食用白醋的主要成份是醋酸(3~5%)和水,不含或极少含其
他成分,可视为一种醋酸水溶液。醋酸是一种有机弱酸
(Ka = 1.8 X 10-5),可利用NaOH标准溶液滴定,反应方程式为:
HAc NaOH NaAc H2O
10VNaOH cNaOH M HAc V白醋
1. 测定食用白醋含量时,为什么选用酚酞指示剂,能否 选用甲基橙或甲基红?
下周实验预习
实验五 混合碱的含量测定
13
1. 试剂
食用白醋(市售) 0.1000 mol/L NaOH标准溶液 0.1%酚酞指示剂
2. 仪器
碱式滴定管(50 mL) 锥形瓶(250 mL) 容量瓶(250 mL) 移液管(25 mL) 烧杯、吸耳球、玻璃棒
精密量取食用白醋样品25 mL,置于250 mL容量瓶中, 定容摇匀。
准确移取25 mL白醋稀释溶液于250 mL锥形瓶中。 滴加2滴酚酞指示剂。 用0.1000 mol/L NaOH标准溶液滴定。 溶液显示淡红色,30s不褪色为终点。 平行测定三次。 计算食用白醋中醋酸含量和测定结果的相对平均偏差。
测量次数
项目
V白醋(mL) cNaOH(mol・L-1) VNaOH-初(mL) VNaOH-终(mL)
VNaOH(mL) bHAc(g・mL-1) bHAc(g・mL-1)平均值
偏差
di xi - x
平均偏差
d d1 d2 dn n
相对平均偏差
dr
d x
100%
12ຫໍສະໝຸດ 3bHAc反应产物为弱酸强碱盐,滴定突跃在碱性范围内,可用酚酞作
测定食用醋中醋酸浓度

• 3.醋酸是一弱酸,但能與鹼類起 中和作用,生成醋酸鹽。例如醋 酸與燒鹼或純鹼起中和作用生成 醋酸鈉。反應式如下:
CHN3aCOOHO→HC+H3COONa+ H2O 2N+aCC2HCO3O2C3O→O2HC+H3COONa+ H2O
• 4.醋酸也能和醇類起酯化作用, 生成各種酯類。例如醋酸和乙醇 起化學反應,生成醋酸乙酯:
*實驗注意事項: 1.稀釋:稀釋標準液或未知樣品時,需盡量 減少稀釋次數,當需要1、10、100、1000、 10000倍的的濃度,盡量以母液來稀釋,而不 是階段性稀釋(拿10倍稀釋成100倍,再拿
100倍稀釋成1000倍就是錯誤的)。 2. 滴定管:滴定管需先以標準液潤洗,再盛 裝一半標準液,以標準液小心排除滴定管前 端的氣體後,添加適量標準液至管中,仔細
滴管 滴定管刷 肥皂粉 標籤
實驗步驟
一、食用醋稀釋方式說明(稀釋比例列入評 分)
1.取2mL醋於錐形瓶中→加三滴酚酞→以 滴定0.0933N的NaOH來標定。用去約 14mL,得知醋之濃度大約為0.07N左右。
2.取10mL醋酸稀釋成100mL,得濃度約 為0.07N,如此每20mL稀釋醋約需 15mL,0.0933N的NaOH來標定。
• d.若滴定過程中會產生危險氣體,請在抽氣 櫃中操作。
e.標準液若不足需再添加時,先讀取讀數, 加入標準液後再讀取讀數,計算其差值。
f.操作完畢廢液請依實驗室守則小心處理。
讀取並記錄刻度,即可開始滴定。
• 3.預備實驗:針對未知樣品,若樣品量夠的話先 進行預備實驗,以決定標準液濃度,避免過量或 標準液添加過多導致終點判定有誤。
• 4.滴定:
a.指示劑需謹慎選擇並適量使用,勿過度添加。
b.有需要用目測判讀刻度者需平視讀取液面下方 或上方(凹讀下、凸讀上)。
实验五食用白醋中醋酸浓度的测定

实验五食用白醋中醋酸浓度的测定实验五:食用白醋中醋酸浓度的测定一、实验目的通过滴定法测定食用白醋中醋酸的浓度,了解醋酸的性质及浓度对生活和健康的影响。
二、实验原理醋酸是一种有机酸,具有酸的性质。
滴定法是一种常用的测定酸浓度的化学方法。
在滴定实验中,将已知浓度的碱溶液滴加入未知浓度的酸溶液中,当酸碱中和反应完成时,根据滴定的体积和反应方程式计算酸的浓度。
三、实验步骤1.准备实验用品:食用白醋、酚酞指示剂、滴定管、三角瓶、电子天平、容量瓶(100mL)、称量纸、吸水管等。
2.称量5.0g酚酞指示剂放入容量瓶中,加入适量食用白醋,摇匀后备用。
3.将食用白醋摇匀并用量筒取样10.0mL置于三角瓶中。
4.用滴定管吸取一定量的氢氧化钠溶液,缓慢滴加入三角瓶中,同时搅拌,并记录滴定量(V1)。
5.当溶液颜色变化时(由粉红色变为无色),停止滴定,记录滴定量(V2)。
6.计算:根据反应方程式和滴定的体积,计算出食用白醋中醋酸的浓度。
四、实验结果与数据分析1.数据记录:实验过程中记录了滴定的体积(V1和V2),以及食用白醋的体积(10.0mL)。
这些数据用于后续的计算和分析。
2.数据处理:根据滴定的反应方程式和滴定的体积,计算出食用白醋中醋酸的浓度。
具体公式如下:醋酸浓度(mol/L)= (C×V×K)/V样品其中,C为氢氧化钠溶液的浓度(0.1000mol/L),V为氢氧化钠溶液的体积(mL),K为转换系数(K=6.02×10^7),V样品为食用白醋的体积(10.0mL)。
3.结果分析:通过计算和分析,得到了食用白醋中醋酸的浓度。
这个结果可以用于了解日常生活中的食品成分,以及醋酸浓度对健康的影响。
五、结论通过滴定法测定食用白醋中醋酸的浓度,我们得到了一个具体的数值。
这个数值反映了食用白醋中醋酸的含量。
醋酸是一种常见的有机酸,在食品和饮料中广泛存在。
适量的醋酸对人体有益,可以促进消化、增强免疫力等。
项目一 食醋中醋酸含量的测定

化工基本技能实训项目一食醋中醋酸含量的测定(实验方案)一测定原理:食用醋中含醋酸HAc,CH3COOH,是一种弱酸,味道呈酸性,通常用作调味品。
食用醋生产:粮食淀粉->发酵->葡萄糖->乙醇->乙酸,含量通常为5%,国家标准规定:不低于3.5%(3.5/100g)贵阳生产:味纯园防腐剂:苯甲酸钠、山梨酸钠可用NaOH标准溶液滴定HAc:NaOH + CH3COOH = CH3COONa + H2O标准溶液未知的0.1 mol/L 5%(5g/100g)根据消耗的NaOH体积和浓度,计算出HAc的含量。
该测定属于酸碱滴定分析。
酸碱滴定分析——用已知浓度的酸或碱的标准溶液,滴定未知浓度的碱或酸,根据消耗的标准溶液的体积和浓度,计算出未知浓度(待测)旳酸或碱的含量。
这样的分析方法,叫做酸碱滴定分析。
所发生的反应:酸碱中和反应。
NaOH标准溶液装在滴定管(碱式滴定管)中,HAc装在锥形瓶中。
指示剂:0.5%酚酞终点颜色:浅红色标准溶液——已知准确浓度的溶液:0.1002 mol/L溶液的标定——求准确浓度的操作,如NaOH溶液的标定二仪器试剂:1仪器:50mL滴定管、250mL锥形瓶、25.00mL移液管、500mL试剂瓶2试剂:0.1mol/LNaOH标准溶液,0.5%酚酞指示剂试样:5%食用醋——样品三 测定步骤:1 配制与标定0.1mol/L NaOH 溶液 (1) 配制0.1mol/L NaOH 溶液500mL在托盘天平上称取NaOH 固体2g 于50mL 小烧杯中,加入30mL 蒸馏水,用玻璃棒搅拌,直到完全溶解,转移到500mL 试剂瓶中,加水稀释到500mL ,摇匀,贴上标签,写上溶液的名称和浓度及配制日期。
NaOH 的大致浓度:C NaOH =NaOHNaOHV m ⨯40=1.05.0402≈⨯ mol/L (2) 标定NaOH 溶液浓度(求准确浓度)NaOH + 邻苯二甲酸氢钾 = 邻苯二甲酸钾钠 + H 2O(99.99%以上纯物质)100% 1mol 204.2g/mol V NaOH C NaOH/1000 m邻苯二甲酸氢钾2.20410001m C V NaOHNaOH =⨯ OHN NaOHV m C a 邻苯二甲酸氢钾2.2041000⨯∙=(mol/L)在电子天平上准确称取0.5000g 邻苯二甲酸氢钾于250锥形瓶中,加入30~50mL 蒸馏水溶解,加入1~2滴0.5%酚酞试剂,用所配制的NaOH 溶液滴定到溶液呈浅红色,并能维持30秒不褪色。
食醋中HAc浓度的测定

食醋中HAc浓度的测定食醋是一种复杂的液体,其中含有多种有机成分,如醋酸(HAc)、酒精、糖等。
HAc是食醋中的主要成分之一,其浓度的高低直接影响食醋的口感和品质。
因此,对食醋中HAc浓度的测定具有重要意义。
目前,测定食醋中HAc浓度的方法主要有滴定法、气相色谱法、高效液相色谱法、电位滴定法等。
其中,滴定法是最常用的方法之一,其原理是利用酸碱中和反应进行滴定,通过滴定终点时溶液的pH值来计算HAc的浓度。
下面将详细介绍滴定法测定食醋中HAc浓度的实验过程及注意事项。
一、实验准备1.实验仪器:滴定管、容量瓶、三角瓶、电子天平、pH计。
2.实验试剂:NaOH、酚酞指示剂、食醋样品。
二、实验步骤1.样品处理:将食醋样品摇匀,用滤纸过滤,去除其中的悬浮物和杂质。
2.标定NaOH:使用电子天平称取一定量的NaOH,加入酚酞指示剂,摇匀后滴入滤液中,直到颜色变化且半分钟内不恢复原色,记录所消耗的NaOH体积。
3.样品滴定:将处理后的食醋样品放入容量瓶中,加入酚酞指示剂,摇匀后将滴定管插入瓶口,缓慢滴加NaOH溶液,同时搅拌,直到颜色变化且半分钟内不恢复原色,记录所消耗的NaOH体积。
4.计算浓度:根据所消耗的NaOH体积和浓度,计算出食醋中HAc的浓度。
三、注意事项1.在使用滴定法时,需要保证滴定管的清洁和干燥,避免对实验结果产生影响。
2.在滴定过程中,要控制好滴加速度,避免因速度过快导致实验误差。
3.在使用酚酞指示剂时,需要注意其颜色变化情况,避免因指示剂误差导致实验结果不准确。
4.在实验过程中,需要注意温度、湿度等环境因素对实验结果的影响。
5.在数据处理时,需要注意单位的统一和数据的修约,以保证实验结果的准确性。
四、结果分析通过滴定法测定食醋中HAc浓度的实验,我们可以得到一系列的实验数据。
通过对数据的分析,我们可以得出以下结论:1.实验方法可行:通过对比已知浓度的标准溶液和食醋样品的滴定结果,可以验证该方法的准确性和可靠性。
化学工程与工艺专业分析化学实验讲义
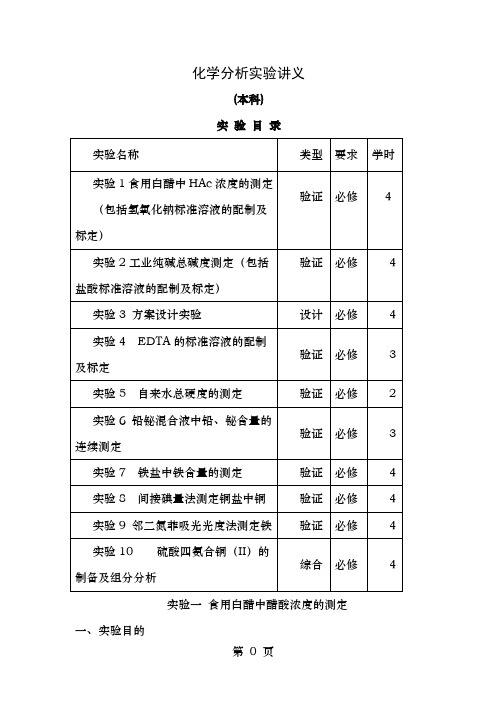
化学分析实验讲义(本科)实验目录实验一食用白醋中醋酸浓度的测定一、实验目的1.了解基准物质邻苯二甲酸氢钾的性质及其应用。
2.掌握NaOH 标准溶液的配制、标定的操作。
3.掌握强碱滴定弱酸的反应原理及指示剂的选择。
4.巩固分析天平操作,熟悉滴定操作方法,学习移液管与容量瓶等量器的正确使用。
二、实验原理1.食用白醋中的主要成份为醋酸,醋酸的Ka=1.8×10-5,可用标准NaOH 溶液直接滴定,滴定终点产物是醋酸钠,滴定突跃在碱性范围内,pHsp≈ 8.7,选用酚酞作指示剂。
从而测得其中醋酸的含量。
HAc+NaOH=NaAc+H 2O2. NaOH 标准溶液采用标定法,这是因为NaOH 固体易吸收空气中的CO 2与水蒸汽,故只能选用标定法来配制。
常用来标定碱标准溶液的基准物质有邻苯二甲酸氢钾、草酸等。
本实验用基准物质邻苯二甲酸氢钾标定,滴定产物为邻苯二甲酸钠钾,滴定突跃在碱性范围内,pHsp≈9,用酚酞作指示剂。
反应式如下:三、仪器台秤、半(全)自动电光分析天平、称量瓶、量筒(10mL)、烧杯、试剂瓶、碱式滴定管(50 mL)、锥形瓶(250mL)、移液管(25 mL )、容量瓶(250 mL )、电炉。
四、试剂NaOH(s)(A.R.)、酚酞指示剂(0.2%乙醇溶液)、食用白醋(市售)。
CO CO+ N a CO + H 2 O CO邻苯二甲酸氢钾(KHC8H4O4)基准物质(烘干温度100-1250C)。
五、实验步骤1.0.1mol/LNaOH标准溶液的配制用台秤称取4.0g NaOH固体于1000mL烧杯中,加去离子水溶解,然后转移至试剂瓶(聚乙烯)中,用去离子水稀释至1000mL,充分摇匀,贴上标签(溶液名称,姓名,配制日期),备用。
2.0.1mol/L NaOH溶液的标定准确称取邻苯二甲酸氢钾0.4~0.8g三份,分别置于250mL锥形瓶中,各加入约40mL热水溶解,冷却后,加入3滴酚酞指示剂,用NaOH溶液滴定至溶液刚好由无色变为微红色且30s内不褪,停止滴定。
实验题目食用白醋中hac含量的测定

实验题目食用白醋中H A c含量的测定-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN实验题目食用白醋中HAc含量的测定一、实验目的:1、了解基准物质邻苯二甲酸氢钾的性质及其应用。
2、掌握滴定管、容量瓶、移液管的使用方法和滴定操作技术。
3、掌握NaOH标准溶液的配制、标定及保存要点。
4、掌握强碱滴定弱酸的过程、突跃范围及指示剂的选择原则。
二、实验原理食用白醋中醋酸含量大约在30~50mg.mL-1。
醋酸为有机弱酸(Ka=1.8×10-5),为了测定白醋中醋酸含量,通常标定好的标准NaOH与白醋直接反应,实际反应式为: HAc+NaOH=NaAc+H2O 反应产物NaAc为一元弱碱,滴定突跃在碱性范围内,可选用酚酞指示剂来指示滴定终点。
终点为NaOH滴定至溶液呈浅红色30秒钟不消失即为终点。
根据消耗NaOH溶液的体积即可求得醋酸的含量。
三、仪器及试剂:食用白醋,0.1 mol·dm-3NaOH标准溶液,邻苯二甲酸氢钾(KHC8H4O4),酚酞,碱式滴定管,烧杯,锥形瓶,电子天平,量筒,干燥器,铁架台。
四、实验步骤:(一)标定NaOH1、计算邻苯二甲酸氢钾(KHC8H4O4)的称量范围;(0.4~0.6g)2、用“差重法”准确称取称量范围的邻苯二甲酸氢钾(KHC8H4O4)于洁净的锥形瓶中;3、在锥形瓶中加入约30ml纯水,在温水浴中加热,摇动使之完全溶解,并滴加2~3滴酚酞;4、用50 cm3的碱式滴定管装入标准氢氧化钠,调节好刻度,记下初读数后,左手控制玻璃珠子,右手摇动锥形瓶使锥形瓶中液体作圆周运动,控制好滴速,当无色—变为浅红色(30秒不褪)(即为滴定终点),停止滴定,取下滴定管,正确读数(终读数)并记下读数,读数结果小数点后保留两位。
5、再分别称取称量范围的邻苯二甲酸氢钾(KHC8H4O4)于洁净的锥形瓶中,按上述方法重复两次。
(二)食用白醋中HAc含量的测定1、用25mL移液管准确移取食用白醋25.00mL置于250mL容量瓶中,用蒸馏水稀释,并配制成250mL溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验3 食用白醋中HAc浓度的测定一、实验目的
1.了解基准物质邻苯二甲酸氢钾(KHC
8H
4
O
4
)的性质及其应用。
2.掌握NaOH标准溶液的配制,标定及保存要点。
3. 掌握强碱滴定弱酸的滴定过程,突跃范围及指示剂的选择原理。
二、实验原理
醋酸为有机弱酸(Ka=1.8×10—5),与NaOH反应式为
HAc + NaOH NaAc + H
2
反应产物为弱酸强碱盐,滴定突跃在碱性范围内,可选用酚酞等碱性范围变色的指示剂。
食用白醋中醋酸含量大约在30~50 mg·mL-1。
三、主要试剂和仪器
1. NaOH溶液 0.1mol·L—1
用烧杯在粗天平上称取4g固体NaOH,加人新鲜的或煮沸除去CO
2
的蒸馏水,溶解完全后,转入带橡皮塞的试剂瓶中,加水稀释至1 L,充分摇匀。
2.酚酞指示剂 2g·L—1乙醇溶液。
3.邻苯二甲酸氢钾(KHC
8H
4
O
4
)基准物质在100~125℃干燥1 h后,置于干
燥器中备用。
四、实验步骤
1.0.1 m01·L—1 NaOH标准溶液浓度的标定
在称量瓶中以差减法称量KHC
8H
4
O
4
3份,每份0.4~0. 6g,分别倒入250 mL
锥形瓶中,加入40~50mL蒸馏水,待试剂完全溶解后,加入2~3滴酚酞指示剂,用待标定的NaOH溶液滴定至呈微红色并保持半分钟即为终点,计算NaOH溶液的浓度和各次标定结果的相对偏差。
2.食用白醋含量的测定
准确移取食用白醋25.00mL置于250 mL容量瓶中,用蒸馏水稀释至刻度、摇匀。
用50 mL移液管分取3份上述溶液,分别置于250mL锥形瓶中,加入酚酞指示剂2~3滴,用NaOH标准溶液滴定至微红色在30s内不褪即为终点。
计算每100mL食用白醋中含醋酸的质量。
五、数据记录与处理
六、思考题
1.标定NaOH标准溶液的基准物质常用的有哪几种,本实验选用的基准物质是什么?与其它基准物质比较,它有什么显著的特点?
2.称取NaOH及KHC
8H
4
O
4
各用什么天平,为什么?
3.已标定的NaOH标准溶液在保存时吸收了空气中的CO
2
,以它测定HCl溶液的浓度,若用酚酞为指示剂,对测定结果产生何种影响?改用甲基橙为指示剂,结果如何?
4.测定食用白醋含量时,为什么选用酚酞为指示剂?能否选用甲基橙或甲基红为指示剂?
5.酚酞指示剂由无色变为微红时,溶液的pH为多少?变红的溶液在空气中放置后又会变为无色的原因是什么?。
