江西省新建二中高二化学上学期周练(13)(实验班)
江西省南昌市新建二中高三化学上学期周练16(实验班)新

新建二中2013-2014学年上学期高三化学实验班周练(16)一、选择题(每题只有1个正确答案,每小题3分,共48分) 1. 下列说法中正确的是( )① Fe(OH)3胶体和CuSO 4溶液都是混合物;② BaSO 4是一种难溶于水的强电解质;③ 冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④ 煤的干馏、煤的汽化和液化都属于化学变化; ⑤ 置换反应都属于离子反应;⑥ 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体; ⑦ C 60、C 70、C 540互称为同素异形体,微粒中的化学键只有非极性共价键。
A .①②④⑦B .①②⑤⑥C .②③④⑥D .③④⑤⑦2.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如下图所示,则原溶液可能是( )A .Na 2SiO 3与Na 2CO 3的混合溶液B .Na 2S 和Na 2SO 3的混合溶液C .NaAlO 2与Na 2SiO 3的混合溶液D .Na 2SO 3与Na 2SiO 3的混合溶液 3.下列各组离子在指定的溶液中不能大量共存的是( )A .滴入KSCN 溶液显红色的溶液中:K +、Fe 2+、SO 42-、Cl -B .1 mol·L -1的烧碱溶液中:S 2-、SO 32-、SO 42-、K+C .使淀粉碘化钾试纸变蓝的溶液:Cs +、Ba 2+、S 2-、Cl -D .含有大量H C的澄清透明溶液中:K +、N 2-- 4. 2012年6 月24日午间,神九与天宫一号顺利完成了我国首次手控交会对接, 神九火箭中使用的燃料是偏二甲肼(CH 3-NH -NH -CH 3)和四氧化二氮(N 2O 4)。
在火箭升空过程中,燃料发生反应:CH 3-NH -NH -CH 3+2N 2O 4→2CO 2+3N 2+ 4H 2O 提供能量。
下列有关叙述正确的是( ) A .该燃料绿色环保,在燃烧过程中不会造成任何环境污染 B .该反应中N 2O 4是氧化剂,偏二甲肼是还原剂 C .CO 2是氧化产物,N 2是还原产物 D .每有0.6 mol N 2生成,转移电子数目为2.4NA5.下面是4种有机弱酸,强弱顺序为:下列说法中不正确的是( ) A .等浓度等体积的4种酸中和碱的能力: B .等浓度的4种酸溶液中水电离出的c 水(H +):>CH 2ClCOOH > >CHCl 2COOHC .反应+ 2CH 2ClCOO-+2CH 2ClCOOH 一定能够发生 D .由题中信息可推知酸性:CH 2FCOOH >CH 2ClCOOH 6.根据表中信息判断,下列选项不正确的是( )A .第①组反应的其余产物为 H 2O 和O 2B .第②组反应中Cl 2与FeBr 2的物质的量之比为1:2C .第③组反应中生成1molCl 2 转移电子2molD .氧化性由强到弱的顺序为MnO 4->Cl 2>Fe 3+>Br 2 7.下列溶液中微粒的物质的量浓度关系正确的是( )① pH 相同的CH 3COONa 溶液、C 6H 5ONa 溶液、Na 2CO 3溶液的浓度关系: c (CH 3COONa)<c (Na 2CO 3)< c (C 6H 5ONa)②0.2mol·L -1CH 3COONa 溶液和0.1mol·L -1HCl 溶液等体积混合后的溶液中:c (Na +)>c (Cl -)>c (CH 3COO -)>c (H +)>c (OH -)③0.1 mol·L -1某一元弱酸溶液中:c (H +)2=c (H +)·c (A 一)+K W④0.1 mol·L -1Na 2CO 3溶液与0.1 mol·L -1NaHCO 3溶液等体积混合c(C O 32-)+2c (O H -)=c(H C )+3c (H 2CO 3)+2c (H +)⑤等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N 前>N 后 ⑥0.1 mol·L -1Na 2S 溶液中:2c (Na +)=c (S 2-)+c (HS -)+c (H 2S) ⑦用某浓度的NaOH 标准溶液滴定未知浓度的HA 溶液滴定过程中,溶液中的离子浓度可能满足下列关系:c(A -)>c(Na +)>c(H +)>c(OH -) A .3个 B.4个 C.5个 D.6个 8.在体积为V L 的恒容密闭容器中盛有一定量H 2,通入Br 2(g)发生反应:H 2(g)+Br 2(g) 2HBr(g)△H<0。
江西省南昌市新建二中2024学年化学高二上期末达标检测模拟试题含解析

江西省南昌市新建二中2024学年化学高二上期末达标检测模拟试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)1、下列微粒间的关系正确的是A.相同物质的量浓度的①NH4Cl 溶液、②(NH4)2SO4溶液、③NH4HSO4溶液、④(NH4)2SO3溶液,c(NH+):④>②>③>①4B.盐酸和稀NH4Cl溶液pH 都等于4,则c水(H+)前者与后者之比为1∶106C.向1 L 1 mol/L CH3COONa 中加入等体积等浓度的醋酸,溶液中c(CH3COO-)+c(CH3COOH)=2 mol/L D.0.01 mol/L Na2CO3溶液中,c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)2、用N A表示阿佛加德罗常数,下列说法正确的是A.22.4L H2的物质的量约为1molB.标准状况下,11.2L H2O的物质的量约为0.5 molC.1 L 1mol/L的MgCl2溶液中Cl-的物质的量浓度为 2mol/LD.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3N A3、已知:H2(g)+F2(g)=2HF(g) ΔH=-270kJ·mol-1,下列说法正确的是:A.氟化氢气体分解生成氢气和氟气的反应是放热反应B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJC.在相同条件下,1mol H2与1mol F2的能量总和小于2mol HF气体的能量D.该反应中的能量变化可用如图来表示4、下列关于化学反应速率的说法正确的是①有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。
江西省新建二中2014-2015学年高二上学期周练(13)化学实验班试题 Word版含答案

新建二中2014-2015学年度高二实验班化学周练13内容:化学平衡及其影响因素供题:徐福明时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。
江西省南昌市新建二中高三化学上学期周练10(实验班)

新建二中2013-2014学年度高三化学实验班周练(10)一、选择题1.下列有关化学用语表示正确的是()A.四氯化碳分子比例模型: B.次氯酸的结构式为 H-Cl-OC.COS的电子式是S C OD. 18 8O2-离子结构示意图:2.下列说法正确的是( )①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同A.③④⑦⑧B.①③④⑦⑧C.②⑤⑥⑧⑨ D.①④⑦⑨3.下列图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。
下列各图4.下列表示对应化学反应的离子方程式错误的是()A.NaOH溶液与SO2反应,当n(NaOH):n(SO2) = 4:3时,4OH-+3SO2 =SO32-+2HSO3-+H2OB.在溴化亚铁溶液中通入过量的氯气:2Cl2+2Fe2++2Br-=2Fe3++4Cl-+Br2C.将SO2通入酸性KMnO4溶液中:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+D.向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O=C6H5OH+HCO3-5.短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。
原子半径X<Y< W< R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。
下列说法不正确的是()A.Y、Z、R的简单离子具有相同的电子层结构B.X2Y分子间存在氢键,故X2Y比X2W稳定C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生反应6.现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。
2021年高二化学上学期周练(13)(实验班)
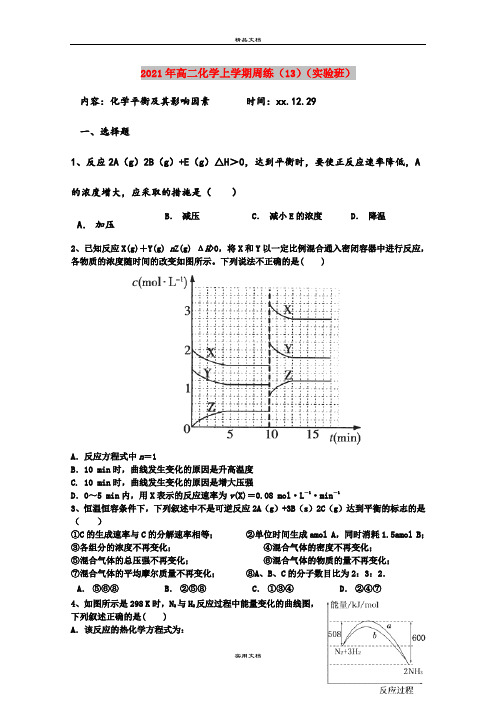
2021年高二化学上学期周练(13)(实验班)内容:化学平衡及其影响因素时间:xx.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A 的浓度增大,应采取的措施是()B.减压C.减小E的浓度D.降温A.加压2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.A.⑤⑥⑧B.②⑤⑧C.①③④D.②④⑦4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?)B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g) C(g)+D(s)。
江西省南昌市新建二中高三化学上学期周练5(实验班)新

新建二中2013-2014届高三实验班化学周练五一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1.SO2是常见的大气污染物之一,下列措施中能够减少SO2排放量的是( )①用天然气代替煤炭作民用燃料②使用水煤气或干馏煤气作燃料③硫酸厂使用V2O5作催化剂,加快SO2的转化速率④将块状煤粉碎,提高其燃烧效率⑤在煤中加入生石灰后燃用⑥循环处理吸收塔放出的尾气A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥2.化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是()①淀粉溶液遇碘化钾——蓝色②FeSO4溶液中加入KSCN——红色③溴化银见光分解——白色④FeCl3溶液中加入铁粉——无色⑤新制氯水久置后——无色⑥过氧化钠在空气中久置——淡黄色⑦Fe(OH)2遇空气——红褐色⑧石蕊试液中通二氧化硫气体——无色⑨无水硫酸铜吸收水蒸气——浅绿色⑩含有酚酞的NaOH溶液中通入Cl2—红色A.2个B.3个C.4个D.5个3.下列说法中不正确的有()①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;②光照氯水有气泡逸出,该气体是Cl2;③燃煤时加入适量石灰石,可减少废气中SO2的量;④pH在5.6~7.0之间的降水通常称为酸雨;⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。
⑥氯气易液化,液氯可以保存在钢瓶中;⑦常温下浓硫酸可以用铝制容器盛放;⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤A.2个B.3个C.4个D.5个4.按如图实验,反应后可能出现的现象是()A.a装置中有白色固体B.b装置中产生白色沉淀C.c装置中溶液先变红后褪色D.d装置中溶液变蓝色5.下列实验能证明某无色气体一定为SO2的是()①能使澄清石灰水变浑浊②能使湿润的蓝色石蕊试纸变红③能使品红试液褪色,加热后又显红色④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀产生,该沉淀溶于稀盐酸⑤能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生A.都能证明B.都不能证明C.③⑤D.③④⑤6.标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中正确的是( )A.ab段反应是:SO2+2H2S===3S↓+2H2OB.亚硫酸是比氢硫酸更弱的酸C.原H2S溶液的物质的量浓度为0.05 mol/LD.b点对应的溶液导电性最强7.下列除杂方法正确的是( )①Cl2(HCl):将混合气体通过碱石灰中;②HCl(C l2)将混合气体通入四氯化碳中;③H2S(HCl):将混合气体通入饱和硫化钠溶液中;④SO2(SO3):将混合气体通入98.3%的浓硫酸中;⑤CO2(SO2): 将混合气体通入硝酸钡溶液中;⑥CO2(CO):混合气体点燃即可;⑦SO2(SO3):将混合气体通入饱和亚硫酸氢钠溶液中。
江西省新建二中高二上学期周练(13)化学实验班试题 Wor

新建二中2014-2015学年度高二实验班化学周练13内容:化学平衡及其影响因素供题:徐福明时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。
江西省新建二中2023-2024学年第二学期高二化学期末考试题答案
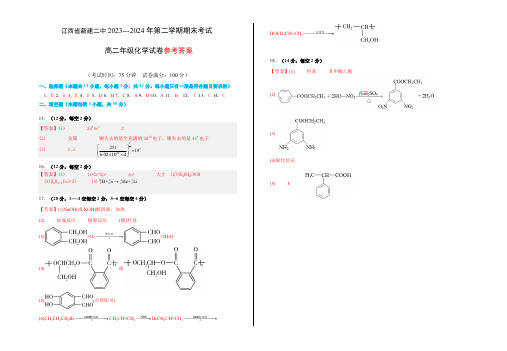
(4)
或
(5)
(合理即可)
(6)CH3CH2CH2Br
NaOH醇溶液 Δ
CH3CH=CH2
NBS
BrCH2CH=CH2
NaOH水溶液 Δ
HOCH2CH=CH2 一定条件 18.(14 分,每空 2 分) 【答案】(1) 羟基 苯甲酸乙酯 (2)
(3) (4)取代反应 (5) 8
江西省新建二中 2023---2024 年第二学期期末考试 高二年级化学试卷参考答案
(考试时间:75 分钟 试卷满分:100 分)
一、选择题(本题共 14 小题,每小题 3 分,共 42 分。每小题只有一项是符合题目要求的) 1.D 2.B 3.B 4.D 5.D 6.B 7.C 8.A 9.D 10.A 11.B 12. C 13.C 14.C
二、填空题(本题包括 4 小题,共 58 分)
15.(12 分,每空 2 分)
【答案】(1)
3d84s2
2
(2)
金属
铜失去的是全充满的 3d10 电子,镍失去的是 4s1 电子 Nhomakorabea1
(3)
1:3
6.02
251 1023
d
3
107
16.(12 分,每空 2 分)
【答案】(1) (3)BnHn+4(n≥2)
1s22s22p3
sp3
(4)
10 5
B+
1 0
n
4 2
He+
7 3
Li
大于 (2)NH3BH2COOH
17.(20 分,1----4 空每空 2 分,5--6 空每空 4 分) 【答案】(1)NaOH(或 KOH)醇溶液、加热 (2) 加成反应 缩聚反应 (醇)羟基
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
江西省新建二中2014-2015学年高二化学上学期周练(13)(实验班)内容:化学平衡及其影响因素时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()A.加压B.减压C.减小E的浓度D.降温2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.A.⑤⑥⑧B.②⑤⑧C.①③④D.②④⑦4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。
达到平衡时,测得压强为原压强的。
则A的转化率为A.25% B.40% C.50% D .75%9、(实)已知工业上真空炼铷的原理如下:2RbCl+Mg MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是 ( )A.铷的金属活动性不如镁强,故镁可置换铷B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移C.MgCl2的热稳定性不如Rb强D.铷的单质状态较化合态更稳定10、(实)一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣905.9kJ•mol﹣1,下列叙述正确的是()A.4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJB.平衡时5v正(O2)=4 v逆(NO)C.平衡后减小压强,混合气体平均摩尔质量增小D.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大11、(实)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。
在一定条件下,Ni可以与 CO(g)发生如下反应:但Ni粉中的杂质不与CO(g)发生反应。
玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是A.纯Ni(s)和Ni(CO)4(g) B.纯Ni(s)和CO(g)C.不纯Ni(s)和CO(g) D.不纯Ni(s)和Ni(CO)4(g)二、填空题12、在一密闭容器中发生反应N 2+3H22NH3,ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:(1)处于平衡状态的时间段是__________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3D.t3~t4 E.t4~t5 F.t5~t6(2)t1、t3、t4时刻分别改变的一个条件是(填选项),t1时刻________; t4时刻________。
A.增大压强 B.减小压强 C.升高温度D.降低温度 E.加催化剂 F.充入氮气(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C. t3~t4 D.t5~t6 (4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
13、800℃时,在2L密闭容器中发生2NO(g)+O 2(g)2NO2(g),测得n(NO)随时间的变化如下表:时间(s) 0 1 2 3 4 5n(NO)(mol) 0.20 0.10 0.08 0.07 0.07 0.07(1)用O2表示2s时该反应的平均速率v =__________________。
(3)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变C.v逆(NO)=2v正(O2) D.容器内气体的密度保持不变(3)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
A.及时分离出NO2气体 B.适当升高温度C.增大O2的浓度 D.选择高效的催化剂(4)下图中的曲线表示的是其他条件一定时,反应:2NO(g)+O2(g)2NO2(g)中NO的平衡转化率与温度的关系。
图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是() 。
A.a点B.b点C.c点D.d点14、容积的相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)2SO3(g),并达到平衡状态。
在这个过程中,甲容器保持压强不变,乙容器保持容积不变。
(1)起始时:甲容器中SO2的速率___________乙容器中SO2的速率(填:“>”“<”或“=”) 反应开始后:甲容器中SO2的速率___________乙容器中SO2的速率(填:“>”“<”或“=”) (2)达到平衡所需的时间:甲容器___________乙容器(填:“>”“<”或“=”)(3)若甲容器中SO2的平衡转化率为P%,则乙容器中SO2的平衡转化率 _______P%(填:“>”“<”或“=”)15.在100 ℃和200 kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物压强(kPa) 200 500 1 000B的浓度(mol·L-1) 0.04 0.1 0.27(1)压强从200 kPa增加到500 kPa时,平衡移动(填“正向”“逆向”或“不”),理由是。
(2)压强从500 kPa增加到1 000 kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是。
新建二中2014-2015学年度高二实验班化学周练13 班级:姓名:学号:得分:题号 1 2 3 4 5 6 7 8 9 10 11选项12、(1)___________(2)______________ ________________(3)________________(4)________________13、(1)_________________________(2)_____________________________(3)__________________________(4)____________________________14(1)____________ _____________(2)__________________________(3)___________________________15.(1)_____________ ___________________________________________(2)___________ _____________________________________实验班周练13参考答案题号 1 2 3 4 5 6 7 8 9 10 11 选项 D B A B D B C A B C B12、13、(9分,每个答案2分)(1)1.5×10-2mol·L-1·s-1 或0.015 mol·L-1·s-1 ;(1分)14.= > < <15. (1)不浓度增加的倍数等于体积减小的倍数(2)正向c液化了实验班周练13参考答案题号 1 2 3 4 5 6 7 8 9 10 11 选项 D B A B D B C A B C B12、13、(9分,每个答案2分)(1)1.5×10-2mol·L-1·s-1 或0.015 mol·L-1·s-1 ;(1分)14.= > < <15. (1)不浓度增加的倍数等于体积减小的倍数(2)正向c液化了。
