饱和溶液和不饱和溶液
饱和溶液与不饱和溶液的互相转化

饱和溶液与不饱和溶液的互相转化
溶解的过程是物质在溶剂中的分子间的相互作用,也是溶液的形成过程。
饱和溶液和不饱和溶液是溶解过程的两个重要状态,饱和溶液是
溶质达到它的最大溶解量时的状态,而不饱和溶液含有的溶质量少于
最大溶解量。
二者之间可以相互转化。
具体操作可以通过加热升温或冷却降温来实现。
如果从不饱和溶液中
转化到饱和溶液,则可以通常通过加热方式。
提高温度可以使溶质的
溶解能力增强,从而将不饱和溶液向饱和溶液转化。
例如,可以用热
水来溶解盐,以便使其从不饱和溶液转变为饱和溶液。
反之,从饱和溶液到不饱和溶液的转变,可以通过降温方式予以实现。
降低温度可以使溶质的溶解能力减弱,从而将饱和溶液转变为不饱和
溶液。
例如,可以加入冷冻水,然后用刮刀将溶解好的盐晶体刮开,
从而使其从饱和溶液转变为不饱和溶液。
总之,饱和溶液与不饱和溶液的相互转化可以通过升温或降温的方式
进行。
溶质的溶解能力随温度的升降而变化,从而使不饱和溶液形成
饱和溶液,将饱和溶液转变为不饱和溶液。
通过改变温度,可以实现
二者之间的转变,从而完成溶液的制备和采集工作。
饱和溶液和不饱和溶液的定义

饱和溶液和不饱和溶液的定义
饱和溶液与不饱和溶液的相互转换的方法有:升高温度、增加溶剂。
大多数物质的溶解度随着温度的升高而增加。
通常,饱和溶液可以转化为不饱和溶液。
提高温度的方法可用于增加溶解度,并将饱和溶液转化为不饱和溶液。
加入溶剂可以将饱和溶液转化为不饱和溶液。
一般将不饱和溶液转化为饱和溶液。
常用的方法有:增加溶质、蒸发溶剂、降低温度。
饱和溶液就是所指在一定温度和压力下,溶剂中所熔化的溶质已超过最大量的溶液。
即为溶质与溶剂碰触时,熔化速度与划出速度成正比的溶液。
溶解度就是所指在一定的温度下,某物质在克溶剂里达至饱和状态时所熔化的克数溶质的量未达至对应的饱和状态的溶液,称为不饱和溶液。
溶质的量少于对应的饱和状态的溶液,称为过饱和溶液。
溶液就是饱和状态还是不饱和,最为关键的就是看看它能够不能溶解更多的溶质,也不是看看溶液的淡或淡,每种物质的溶解度就是不一样的,同一种物质在相同的温度下的溶解度也就是不一样的,有些物质,比如说碳酸钙的溶解度就不大,即使就是碳酸钙的饱和溶液,看上去仍然就是诺伍德的,碳酸钙在8摄氏度时,克水至多就可以熔化0.克。
与碳酸钙恰好相反的就是,有些物质比如说蔗糖的溶解能力就非常大,即使蔗糖的溶液已经很浓了,但是也还不是蔗糖的饱和溶液,蔗糖在20摄氏度时,克水即使就是熔化了克的蔗糖,但是此时的蔗糖溶液仍然不是饱和溶液,因为它还可以熔化更多的蔗糖。
饱和溶液和不饱和溶液

三、设计实验进行检验:(控制变量法)
温度不同,溶质、溶剂一样
(1)在室温下用一定量100克的水配制硝酸 钾的饱和溶液。 (2) 升高温度,饱和溶液变成不饱和溶液,
可以继续溶解硝酸钾。 (3)降低温度,饱和溶液中有固体析出.
对于同一种溶质,温度改变, 溶解度改变
结论
影响固体溶解度的因素有: 温度 (外因) 溶质和溶剂的性质(内因)
CYL
度 溶 200
3、溶解度与温度关系
/
解 190
g 180
的表示方法:
170
.
160
(1)列表法:
150
硝酸钾在不同温度时的溶解度: 140
.
130
120 110
.
13.3 20.9 31.6 45.8 63.9 85.5 110 138 168 202 246 100
90
.
(2)溶解度曲线
80 70
稀溶液
在一定量的溶剂中,溶有较少溶质的溶液
CYL
三、溶液“浓”“稀”与 饱和和不饱和之间的关系
不同溶质
浓溶液不一定是饱和溶液 稀溶液不一定是不饱和溶液
同种溶质
饱和溶液一定比不饱和溶液要浓
怎样判断溶液是否饱和?
1、如果溶液中有少量未溶的溶质, 则是饱和溶液;
2、 加少量的溶质,溶质能继续溶解的是 不饱和溶液,不能溶解的是饱和溶液。
溶解度/g
>10g 1--10g 0.01--1g <0.01g
溶解性
易溶 可溶 微溶 难溶
典型例子 氯化钠、蔗糖、氯化铵、硝酸钾
氯酸钾
氢氧化钙 碳酸钙
CYL
影响固体溶解度大小的因素
CYL
饱和溶液和不饱和溶液的概念

饱和溶液和不饱和溶液的概念1. 饱和溶液的概念饱和溶液是指在特定温度和压力下,溶质的浓度达到最大值,不能再溶解更多溶质的溶液。
当溶质的浓度达到最大值时,溶液中的溶质和溶剂的比例也达到最大,溶质和溶剂的比例称为溶质的摩尔比例,也称为溶质的摩尔浓度。
当溶质的摩尔浓度达到最大值时,溶液就是饱和溶液。
:2. 不饱和溶液的概念不饱和溶液是指溶液中的溶质没有完全溶解,溶液中的溶质仍有一部分沉淀在底部,因此溶液中的溶质浓度小于其平衡浓度,即溶液不能再溶解更多的溶质,这种溶液就是不饱和溶液。
3. 饱和溶液的特征:饱和溶液是指溶质的溶解度达到最大,不能再溶解更多溶质的溶液。
它的溶质浓度是固定的,不会随温度的变化而变化,温度越高,溶质的溶解度越大。
饱和溶液的溶质浓度是与温度有关的,温度越高,溶质的溶解度越大,溶质浓度也越大。
饱和溶液中的溶质极不容易再溶解出更多溶质,即使加入更多的溶质,溶质也不会溶解出更多的溶质。
4. 不饱和溶液的特征:不饱和溶液中,溶质的浓度低于其平衡浓度,溶质会继续溶解,直到溶质的浓度达到平衡浓度。
不饱和溶液的沸点比纯液体低,比饱和溶液的沸点高,溶液的密度也比纯液体低,比饱和溶液的密度高。
不饱和溶液可以通过蒸馏或滤过等方法分离出溶质。
饱和溶液和不饱和溶液是溶解度的两种概念,它们之间有着明显的区别。
饱和溶液是指溶质在溶剂中达到平衡状态时所形成的溶液,其中溶质的浓度不再发生变化。
而不饱和溶液则是指溶质在溶剂中未达到平衡状态时所形成的溶液,其中溶质的浓度还可以继续发生变化。
另外,饱和溶液的溶质浓度是固定的,而不饱和溶液的溶质浓度则是可变的。
此外,饱和溶液的溶质分子不会再溶解,而不饱和溶液的溶质分子还可以继续溶解。
最后,饱和溶液的溶质溶解度是固定的,而不饱和溶液的溶质溶解度则是可变的。
饱和溶液和不饱和溶液
设问
生活中我们会碰到很甜的 糖水,说明浓度很大,那这种 浓度很大的糖水是否一定 是 饱 和 溶 液 呢 ?
10克蔗糖 溶液
10毫升水
0.2克熟石灰 溶液 10毫升水 固体
蔗糖.熟石灰在水中溶解的实验
概
念
概
念
升温或增加溶剂 饱和溶液
降温.减少溶剂 加溶质 降温 减少溶剂.加溶质 减少溶剂
不饱和溶液
浓溶液
稀溶液
巩固练习: 温度 溶剂 不能 1.在一定 _________下,一定量的_________ 里 ________ 再继续溶解某种溶质的 溶液叫饱和溶液. 2.要使饱和硝酸钾溶液变成不饱和溶液,可采取的措施有 升 温 加 水 (1)________________________ (2)________________________ 无 3.30 C饱和硝酸钾溶液升高温度至100oc,则杯底_______(有或无)晶体,则该 不饱和 100oc的硝酸钾溶液是________溶液(填饱和.不饱和) 4.下列说法是否正确?不正确的请给予改正. (1)饱和溶液是指不能再继续溶解原溶质的溶液,不饱和溶液是还能继续溶解原 溶质的溶液………………………………………………………………………( 错 ). (2)浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液…………………..( 错 ).
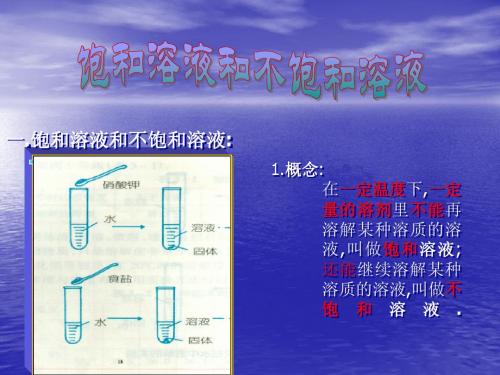
饱和溶液和不饱和溶液: 一.饱和溶液和不饱和溶液 饱和溶液和不饱和溶液
1.概念 概念: 概念 在一定温度 一定 一定温度下,一定 一定温度 量的溶剂里不能 不能再 量的溶剂 不能 溶解某种溶质的溶 液,叫做 饱和 溶液 溶液; 还能继续溶解某种 溶质的溶液,叫做不 不 饱 和 溶 液 .
2.饱和溶液和不饱和溶液的相互转化 饱和溶液和不饱和溶液的相互转化: 饱和溶液和不饱和溶液的相互转化
知识总结:饱和溶液和不饱和溶液

1∕1 饱和溶液与不饱和溶液
(1)饱和溶液与不饱和溶液是相对而言的,在一定的条件下是可以相互转化的。
(2) 饱和溶液与不饱和溶液必须指明是溶质是什么。
例如:食盐的饱和溶液还能继续溶解蔗糖,对食盐来说溶液是饱和的,但对蔗糖溶液来说未必就是饱和的。
(3)在温度相同的条件下,两种不同物质的饱和溶液相混合,会因为水(溶剂)的总量增多而使溶液均变为不饱和溶液。
(4)多数溶质(固体)升高温度可使饱和溶液转化为不饱和溶液,但如氢氧化钙、硫酸钙的饱和溶液升高温度,溶解度减小,仍为饱和溶液。
(5)有些物质在一定的温度、压力下,当溶液中溶质浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的溶液叫过饱和溶液,这种现象叫过饱和现象。
制取过饱和溶液通常是使较高温度下的饱和溶液缓慢降温形成的。
过饱和溶液不够稳定,多数可自动析出晶体,少数不能自动析出晶体的,经搅拌或摩擦容器壁或投入小颗粒晶体使之析出晶体。
注意不是每一种物质都可以制成过饱和溶液的,一般来说溶解度随温度增大的物质容易形成过饱和溶液。
例如:硫代硫酸钠(Na 2S 2O 3)就是一个能形成相当稳定的过饱和溶液的例子。
饱和溶液 改变温度或减少溶剂或增加溶质
改变温度或增加溶剂 不饱和溶液。
九年级化学饱和溶液与不饱和溶液的相互转换

饱和溶液和不饱和溶液的概念①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液判断一种溶液是否是饱和溶液要注意:①在一定温度下。
②在一定量的溶剂里。
因为温度改变或溶剂量改变都会把饱和溶液变成不饱和溶液,也就是说饱和溶液与不饱和溶液在一定条件下可以互相转化,③被溶解的物质,即溶质能否继续溶解,若能继续溶解则为不饱和溶液,若不能继续溶解则为饱和溶液。
④某一种物质的饱和溶液是对该物质而言,但对其他物质则不是饱和溶液。
如20℃时,NaCl的饱和溶液不能再溶解NaCl了,但还能继续溶解KNO3,即此溶液对于NaCl来说是饱和溶液,但对KNO3来说则是不饱和溶液。
饱和溶液与不饱和溶液的相互转化方法:(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大饱和溶液不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少饱和石灰水不饱和石灰水概念的理解:(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。
因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。
如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:①饱和溶液不饱和溶液(或不饱和溶液饱和溶液。
不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小判断溶液是否饱和的方法:①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
初中化学课件 饱和溶液与不饱和溶液

讲授新课
操作 5g硝酸钾,搅拌 再加5g硝酸钾,搅拌
加热 再加5g硝酸钾,搅拌
冷却
现象 固体溶解 固体部分溶解 固体全部溶解 固体全部溶解 晶体析出
结论
一定量的溶剂 中,硝酸钾的 溶解的量随着 温度的升高而 增大。
讲授新课
讲授新课
4.饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系食盐的不饱和溶液
熟石灰不完全溶解 熟石灰的饱和溶液
浓度大
浓度小
10毫升水
10毫升水
①对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液
也不一定是不饱和溶液。
②对于同种溶质来说:在一定温度时饱和溶液比不饱和溶 液要浓。
讲授新课
思考1:20℃时,往盛有饱和食盐水的烧杯中加入5g食 盐,加入食盐后的溶液中,质量不变的是( D ) A.溶剂的质量 B.溶质的质量 C.溶液的质量 D.溶剂、溶质、溶液的质量
饱和溶液 不包括未溶解
的固体!
讲授新课
思考2:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱 和溶液,可采用的方法有哪些? 加入硝酸钾、蒸发掉一些水、降低温度 加入溶质、蒸发溶剂、改变温度
一 饱和溶液
1.饱和溶液与不饱和溶液 (1)饱和溶液: 在一定的温度下,在一定量的溶剂里, 不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。 (2)不饱和溶液: 在一定的温度下,在一定量的溶剂 里,还能继续溶解某种物质的溶液叫做这种溶质的不饱 和溶液。
只有指明“一定温度”和“一定量溶剂”,“饱和” 和“不饱和”才有意义。
随堂训练
6.在一定条件下,一容器内含有三种微观粒子,一种是 阳离子,一种是阴离子,还有一种是分子,且三种微观 粒子处于自由移动的状态.当改变条件后,容器内的部 分阳离子和部分阴离子便处于不能自由运动的状态,这 个过程属于( B ) A.结晶 B.蒸馏 C.溶解 D.过滤
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.溶质性质 1.溶质性质 2.溶剂性质 2.溶剂性质 3.温度 3.温度
不同溶质在水中溶解能力不同 溶剂的种类不同和溶剂的量也影响溶解。 溶剂的种类不同和溶剂的量也影响溶解。
多数物质随温度升高溶解性增强
熟石灰Ca(OH)2和气体随温度升高溶解性减弱 熟石灰Ca(OH)
二、饱和溶液和不饱和溶液
1、概念: 一定温度下 一定量的溶剂里不能再溶解某 在一定温度下,在一定量的溶剂里不能再溶解某 饱和溶液; 种物质的溶液,叫做该物质的饱和溶液 种物质的溶液,叫做该物质的饱和溶液; 还能继续溶解某种物质的溶液 叫做该物质的不 某种物质的溶液, 还能继续溶解某种物质的溶液,叫做该物质的不 饱和溶液 饱和溶液的前提条件是什么? (1)饱和溶液的前提条件是什么? 一定温度、一定量的溶剂 一定温度、 (2)饱和溶液与不饱和溶液的根本区别是什么? 饱和溶液与不饱和溶液的根本区别是什么? 一定温度下, 一定温度下,溶质是否能继续溶解
1、把少量的下列各物质分别放入水里, 把少量的下列各物质分别放入水里, 充分振荡后可形成溶液的是( 充分振荡后可形成溶液的是( A ) A、葡萄糖 B、面粉 C、花生油 D、冰块
2、下列物质溶于水时, 下列物质溶于水时, D 使溶液的温度明显升高的是 ( C 溶液的温度明显降低的是 ( )。 A、蔗糖 B、食盐 C、硝酸铵 D、氢氧化钠
升温、减少溶剂.加溶质 升温、减少溶剂.
不饱和石灰水
Ca(OH)2溶液
饱和石灰水 降温、 降温、加溶剂
1、室温下有一杯接近饱和的硝酸钾溶液, 室温下有一杯接近饱和的硝酸钾溶液, 怎样把它变为饱和溶液? 怎样把它变为饱和溶液? 方法: 方法: 加入一定量的硝酸钾至不再溶解 1、加入一定量的硝酸钾至不再溶解 蒸发一定量的水至刚好有晶体析出 2、蒸发一定量的水至刚好有晶体析出 降低一定温度至刚好有晶体析出 3、降低一定温度至刚好有晶体析出 如何判断某一杯蔗糖溶液是否饱和? 2、如何判断某一杯蔗糖溶液是否饱和? b
9.在一定温度下,某物质的饱和溶液一定是 ( 在一定温度下, 在一定温度下 ) D (A)非常浓的溶液 (B)很稀的溶液 增加该溶液的溶质, (C)增加该溶液的溶质,溶质还能继续溶解的溶液 增加该溶液的溶质, (D)增加该溶液的溶质,溶质不能继续溶解的溶液 10.下列说法正确的有 ( D ) 下列说法正确的有 A.在一定量的溶剂里 在一定量的溶剂里, A.在一定量的溶剂里,硝酸钾的饱和溶液比它的不饱 和溶液要浓 B.浓溶液一定是饱和溶液 浓溶液一定是饱和溶液, B.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液 C.20℃时的硝酸钾饱和溶液 当温度升高到60℃ 时的硝酸钾饱和溶液, 60℃时 C.20℃时的硝酸钾饱和溶液,当温度升高到60℃时, 其它条件不变, 其它条件不变,该溶液还是饱和溶液 D.对同一溶质的溶液而言 在一定温度下, 对同一溶质的溶液而言, D.对同一溶质的溶液而言,在一定温度下,饱和溶液 比不饱和溶液要浓
(3)如何判断某一溶液是否是饱和溶液
温度不变,向溶液中加入少量原溶质,如果不再溶解, 温度不变,向溶液中加入少量原溶质,如果不再溶解, 证明原溶液是饱和溶液,如果继续溶解, 证明原溶液是饱和溶液,如果继续溶解,原溶液是不饱 和溶液。 和溶液。
(4)为什么必须说明是“这种溶质”的饱和溶液? 为什么必须说明是“这种溶质”的饱和溶液? 说明: 说明:
概
念
概
念
升温或增加溶剂 饱和溶液 降温.减少溶剂. 降温.减少溶剂.加溶质 不饱和溶液
浓溶液
稀溶液
4、在一定温度下,将一瓶接近饱和 在一定温度下, 的硝酸钾溶液转化成饱和溶液的方法 ( B ) 升高温度②降低温度③增加溶质④ ①升高温度②降低温度③增加溶质④增 加溶剂⑤ 加溶剂⑤蒸发溶剂
A、①②③ B、②③⑤ C、②③④ D、③④⑤
),
物质的溶解性
第一课时
1、了解溶解性的概念, 了解溶解性的概念, 并知道影响物质溶解性的因素 2、了解饱和溶液和不饱和溶液的概念, 了解饱和溶液和不饱和溶液的概念, 并知道溶液的饱和与溶液的浓稀之间的区别。 并知道溶液的饱和与溶液的浓稀之间的区别。 溶液的饱和 之间的区别 3、知道饱和溶液与不饱和溶液相互转化的方法。 知道饱和溶液与不饱和溶液相互转化的方法。
a.将大块蔗糖投入杯中, a.将大块蔗糖投入杯中,观察蔗糖是否溶解 投入杯中 b.加入粉碎的蔗糖少量,不断搅拌, 加入粉碎的蔗糖少量 b.加入粉碎的蔗糖少量,不断搅拌, 观察蔗糖是否溶解 c.加入粉碎的蔗糖 加热并搅拌, 加入粉碎的蔗糖, c.加入粉碎的蔗糖,加热并搅拌, 观察蔗糖是否溶解
疑
问
生活中我们会碰到很甜的糖水,说明浓度很大, 生活中我们会碰到很甜的糖水,说明浓度很大, 那么这种浓度很大的糖水是否一定是饱和溶液呢? 那么这种浓度很大的糖水是否一定是饱和溶液呢? [总结一] 浓溶液不一定是饱和溶液, 总结一] 浓溶液不一定是饱和溶液, 稀溶液不一定是不饱和溶液。 稀溶液不一定是不饱和溶液。 [总结二] 同一物质,相同温度, 总结二] 同一物质,相同温度, 饱和溶液比不饱和溶液要浓。 饱和溶液比不饱和溶液要浓。 20℃,NaCl的饱和溶液和不饱和溶液, 20℃,NaCl的饱和溶液和不饱和溶液, 的饱和溶液和不饱和溶液 饱和溶液的质量分数大。 饱和溶液的质量分数大。
溶剂 _____下 一定量的____ 不能 1. 在一定 温度 下,一定量的____ 里 ___ 再 _____ 继续溶解某种溶质的溶液叫饱和溶液. 继续溶解某种溶质的溶液叫饱和溶液.
C饱和硝酸钾溶液升高温度至 饱和硝酸钾溶液升高温度至100 2.30 C饱和硝酸钾溶液升高温度至100oc,则 无 杯底_______(有或无)晶体,则该100 _______(有或无 杯底_______(有或无)晶体,则该100oc的硝酸 不饱和 钾溶液是________溶液(填饱和.不饱和) ________溶液 钾溶液是________溶液(填饱和.不饱和) 3、可以证明烧杯中的溶液是硝酸钾饱和溶液 的方法是( 的方法是( C ) 蒸发掉1g 1g水 A、蒸发掉1g水,有少量固体析出 降低温度, B、降低温度,有少量固体析出 加入少量硝酸钾固体, C、加入少量硝酸钾固体,固体不再溶解 加入少量水, D、加入少量水,没有固体析出
指出下列各题的错误之处,并加以改正:溶液叫饱和溶液; 不能再溶解某种溶质的溶液叫饱和溶液; 在一定温度.一定量的溶剂中,不能……. 在一定温度.一定量的溶剂中,不能……. 2、装有饱和溶液的瓶的瓶底,一定有这种溶质的固体; 装有饱和溶液的瓶的瓶底,一定有这种溶质的固体; 不一定,有可能刚好达到饱和。 不一定,有可能刚好达到饱和。 3 、在同一温度下,同体积的一种物质的饱和溶液, 在同一温度下,同体积的一种物质的饱和溶液, 一定会比另一物质的不饱和溶液含有的溶质多; 一定会比另一物质的不饱和溶液含有的溶质多; 不一定,这两种物质的溶解能力有可能不同。 不一定,这两种物质的溶解能力有可能不同。 4、不饱和溶液转化成饱和溶液,溶质质量分数一定增大 不饱和溶液转化成饱和溶液, 增加溶质或蒸发溶剂,溶质质量分数变大。 增加溶质或蒸发溶剂,溶质质量分数变大。 降低温度,溶质质量分数不变或减小。 降低温度,溶质质量分数不变或减小。
4、饱和溶液是指( D 饱和溶液是指( A、含溶质较多的溶液
)
B、还能继续溶解某种溶质的溶液 C、不能继续溶解某种溶质的溶液 D、在一定温度下,在一定量的溶剂里, 在一定温度下,在一定量的溶剂里, 不能继续溶解某种溶质的溶液。 不能继续溶解某种溶质的溶液。
6、室温下,向一定质量的氯化钠溶液中加入10 室温下,向一定质量的氯化钠溶液中加入10 克氯化钠固体,充分搅拌后,尚有部分未溶解, 克氯化钠固体,充分搅拌后,尚有部分未溶解, 加入10克水后,固体全部溶解。 10克水后 加入10克水后,固体全部溶解。下列判断正确的 是( A ) A、加水前一定是饱和溶液 B、加水前可能是饱和溶液 C、加水后一定是饱和溶液 D、加水后一定是不饱和溶液
加入少量 高锰酸钾 1.硝酸钾的饱和溶液 1.硝酸钾的饱和溶液 能继续溶解高锰酸钾 2.此为硝酸钾饱和溶液 2.此为硝酸钾饱和溶液 高锰酸钾不饱和溶液 硝酸钾饱和溶液
20℃时 20℃时,将33克食盐放入64克水中,食盐全部溶解, 33克食盐放入64克水中,食盐全部溶解, 克食盐放入64克水中 再向此溶液加入3 此时溶液质量为 97 克,再向此溶液加入3克食盐又 36 恰好全部溶解, 现在溶液恰好饱和, 恰好全部溶解,则溶质为 克,现在溶液恰好饱和, 36% 36 此时溶液的质量为 100 克,质量分数为 % 再向此溶液加入3克食盐, 再向此溶液加入3克食盐,溶液的质量是 100 克, 36% 质量分数为 36%
8、在一定温度下,一定量的水中,不 在一定温度下,一定量的水中, 断加入食盐晶体, 断加入食盐晶体,能正确表示溶解的 食盐质量m与时间t 食盐质量m与时间t的关系的图象的是 (D )
下列说法正确的是( 7. 下列说法正确的是( C )
A、凡是均一、稳定的液体都是溶液 凡是均一、 B、饱和溶液所含的溶质一定比不饱和溶 液的多 C、析出晶体后的溶液一定是饱和溶液 D、某物质的溶液达到饱和后应不能再溶 解任何物质
一、溶解性
1、定义: 定义: 一种物质(溶质)溶解在另一种物质(溶剂)中的能力。 一种物质(溶质)溶解在另一种物质(溶剂)中的能力。 不同的溶质,在相同的溶剂中,溶解情况是否相同? ①不同的溶质,在相同的溶剂中,溶解情况是否相同? ②向溶液中能否无限制的加入溶质? 向溶液中能否无限制的加入溶质? 影响溶解性的因素有哪些? ③影响溶解性的因素有哪些?
3、下列关于饱和溶液的说法中,错误的是 下列关于饱和溶液的说法中, ( B 、C ) A、在温度不变时,KNO3的饱和溶液不能再 在温度不变时, 溶解KNO 溶解KNO3 B、当温度升高时,饱和溶液一定能继续溶 当温度升高时, 解溶质 C、稀溶液一定是不饱和溶液,浓溶液一定 稀溶液一定是不饱和溶液, 是饱和溶液 D、改变温度可以使不饱和溶液变成饱和溶 液
