铜及其化合物性质归纳精编版
铜的化合物,物质颜色

下列反应,其产物的颜色按红色、红褐色、淡黄色、
蓝色顺序排列的是 (
)
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液, 并在空气中放置一段时间;③FeCl3溶液中滴入KSCN溶液; ④无水硫酸铜放入医用酒精中. A.②③①④ B.③②①④
C.③①②④
D.①②③④
【解析】
产物及颜色分别为:①Na2O2——淡黄色;
(5)如表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判
断都正确的是____________(填字母).
选项 A
陈述Ⅰ
陈述Ⅱ
判断
铜绿的主要成分
是碱式碳酸铜 铜表面易形成致 密的氧化膜
可用稀盐酸除铜
器表面的铜绿 铜容器可以盛放 浓硫酸
Ⅰ对;Ⅱ
对;有 Ⅰ对;Ⅱ 对;有
B
选
项
陈述Ⅰ
陈述Ⅱ
判断
铆在铜板上的铁钉
工艺的中间过程会发生反应:2Cu2O+Cu2S 反应的氧化剂是____________________. 6Cu+SO2↑,
(3)SO2尾气直接排放到大气中造成环境污染的
后果是_______________________;处理该尾气可得到有
价值的化学品,写出其中1种酸和1种盐的名称_____ . (4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质, 需进一步采用电解法精制.请简述粗铜电解得到精铜的原 理:___________________________________.
【答案】
(1)Cu2S
(2)Cu2O、Cu2S
(3)形成酸雨
硫酸、硫酸铵
(4)电解时,粗铜作阳极,精铜作阴极,电解质溶液为 硫酸铜溶液.阳极上发生氧化反应,Cu失去电子, 使Cu单质变为Cu2+进入溶液中,Cu-2e-=== Cu2+; 阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu质, Cu2++2e- === Cu,从而达到精制Cu的目的
铜的性质知识点总结

铜的性质知识点总结
1. 物理性质
铜是一种金属元素,是周期表中的第29号元素,原子序数为29。
其原子量约为63.55。
在常温下,铜是一种固态金属,具有金属光泽,呈红色。
铜具有良好的导电性和导热性,是制造电线、电路板和散热器等电子元器件的重要材料。
2. 化学性质
铜是一种活泼的金属,在空气中会逐渐氧化形成氧化铜,并最终生成铜绿。
铜的化合价一般为+1和+2,它可以形成多种不同价态的化合物,如Cu2O和CuO等。
铜还可以形成多种配合物,它们具有丰富的颜色和化学反应活性。
3. 热性质
铜具有良好的导热性,是热传导的良好材料,因此常用于制造散热器和热交换器。
此外,铜可以在高温下与氧反应生成氧化铜,因此在高温下需避免使用铜制品。
4. 机械性质
铜是一种软金属,可以很容易地用冷或热加工方式制造成形,因此常用于制造金属制品和精密零件。
此外,铜具有高弹性,能够在一定程度上承受变形而不破裂。
5. 光电性质
铜具有较高的反射率和导电率,因此可以用来制造反射镜和电子元件。
此外,铜的表面可以很容易地氧化形成氧化铜保护膜,使其具有良好的耐蚀性。
6. 其他性质
铜是一种具有良好韧性和可塑性的金属,因此常用于制造铜制品、合金等材料。
此外,铜还具有较高的抗菌性能,可以抑制细菌的生长,因此常用于制造医疗器械和食品器具。
总之,铜是一种多功能的金属,具有良好的导电性、导热性、化学活性和机械性能,因此在工业生产和日常生活中得到广泛应用。
对于铜的性质,我们应该充分了解并加以利用,以推动现代化工业和科技的发展。
高中化学:铜元素知识点总结

高中化学:铜元素知识点总结
一. 单质和化合物的性质:
1. Cu不能置换酸中氢,但可以和浓H2SO4、浓HNO3、稀HNO3反应。
2. Cl2能将Cu氧化成+2价,而单质S、I2等弱氧化剂只能将其氧化成+1价。
3. Cu能被、等离子氧化成。
4. Cu在乙醇的催化氧化反应中作为催化剂,其催化过程为:
5. Cu在潮湿的空气中能发生吸氧腐蚀表面生成一层绿色铜锈。
6. CuO能被H2还原为红色Cu单质。
其方程式为:
7. 新制的浊液作弱氧化剂可氧化醛及含醛基的其他烃的衍生物。
例:
8. 新制的浊液遇多羟基化合物(甘油、葡萄糖等)生成绛蓝色物质。
9. 受热分解:
10. CuSO4溶液中通入H2S气体,生成不溶于H2SO4的黑色沉淀。
方程式为:
二. 单质及化合物的用途
1. 铜单质导电性良好可用来做导线。
2. 利用为重金属离子能使蛋白质变性的特点,用胆矾、生石灰、水可制农药波尔多液。
3. 可用CuSO4固体检验乙醇中是否含水。
4. 还可用新制的Cu(OH)2浊液来检验病人是否患有糖尿病。
高中化学微专题15 铜及其化合物的性质、制备与实验探究-备战2022年高考化学考点微专题(解析版)
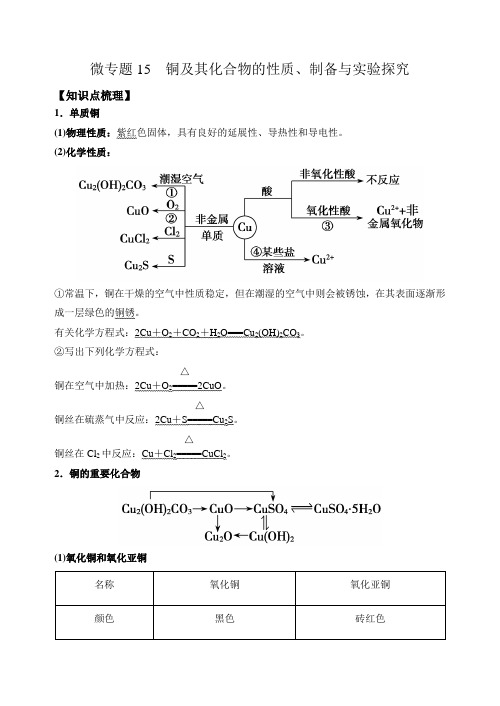
微专题15 铜及其化合物的性质、制备与实验探究【知识点梳理】1.单质铜(1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。
(2)化学性质:①常温下,铜在干燥的空气中性质稳定,但在潮湿的空气中则会被锈蚀,在其表面逐渐形成一层绿色的铜锈。
有关化学方程式:2Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3。
②写出下列化学方程式:铜在空气中加热:2Cu +O 2=====△2CuO 。
铜丝在硫蒸气中反应:2Cu +S=====△Cu 2S 。
铜丝在Cl 2中反应:Cu +Cl 2=====△CuCl 2。
2.铜的重要化合物(1)氧化铜和氧化亚铜名称 氧化铜 氧化亚铜 颜色黑色砖红色与酸反应(H+) CuO+2H+===Cu2++H2OCu2O+2H+===Cu2++Cu+H2O(2)氢氧化铜①物理性质:蓝色不溶于水的固体。
②化学性质及应用:(3)铜盐①Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的氧化铜,化学方程式:Cu2(OH)2CO32CuO+CO2↑+H2O。
②CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾,其受热分解的化学方程式为CuSO4·5H2O CuSO4+5H2O,蓝色晶体受热转化为白色粉末。
无水CuSO4遇水变蓝色(生成CuSO4·5H2O),据此可用来检验水的存在。
(3)铜盐的毒性。
铜盐溶液有毒,主要是因为铜离子能与蛋白质作用,使蛋白质变性失去生理活性,因此人们利用这一性质用胆矾、熟石灰、水配成了波尔多液,用来杀灭植物的病毒。
3.铜及其化合物的制备(1)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:(2)Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:Cu 2S ――→O 2△Cu ――→焙烧 Cu 2O 、CuO ―――――→足量稀硫酸A ――→操作Ⅰ B ――――――――→蒸发、结晶、过滤胆矾4.废铜综合利用的常见流程框图模式【专题精练】1.将3.84g 铜粉与一定质量浓硝酸反应,当铜完全溶解时,收集到NO 、NO 2混合气体2.24L(标准状况下),则所消耗酸的物质的量是 A .0.1mol B .0.11molC .0.16molD .0.22mol【答案】D 【分析】根据铜和硝酸的反应,可知消耗的硝酸有两个去处,一个是被还原生成氮的氧化物,一个是生成硝酸铜,根据元素守恒可得答案。
铜知识点总结大全

铜知识点总结大全铜是一种常见的金属,具有良好的导电性和导热性,因此在工业和日常生活中广泛应用。
本文将从铜的化学性质、物理性质、应用领域和环境影响等方面进行详细总结。
一、化学性质1. 原子结构:铜的原子序数为29,原子核内有29个质子和中子,电子排布为2, 8, 18, 1。
2. 化学性质:铜是一种活泼的金属,可以与氧气、水蒸气和酸等发生化学反应。
在空气中,铜会氧化生成黑色的氧化铜,这是铜制品表面产生的一种自然保护膜。
3. 溶解性:铜在一些强氧化剂的作用下可以溶解,如浓硫酸、硝酸等,生成对应的盐。
二、物理性质1. 密度:铜的密度为8.96克/立方厘米,比较高,可以用来制作重物体。
2. 导电性:铜是一种极好的导电材料,电阻率为1.724×10^-8Ω•m,在电工和电子行业得到广泛应用。
3. 导热性:铜也具有良好的导热性,热导率为401W/(m•K),因此常被用来制作散热器、导热管等散热部件。
4. 融点:铜的融点为1083°C,属于高熔点金属,可以用于高温工艺中。
5. 耐腐蚀性:铜具有一定的耐腐蚀性,但在特定条件下会发生腐蚀,如在含有盐和酸的环境中容易受到侵蚀。
三、应用领域1. 电工电子:铜是电线、电缆的主要原材料,其优良的导电性使得电力传输更为高效稳定。
2. 工业制造:铜可以制作各类机械零部件、轴承、齿轮等,在机械制造领域应用广泛。
3. 建筑装饰:铜具有良好的韧性和可塑性,可以用于制作建筑装饰品、古董、雕塑等艺术品。
4. 医疗卫生:铜具有抗菌作用,可以用于医疗器械的制作,也可以制作铜制品来做抗菌表面处理。
5. 环保节能:铜是可回收再利用的金属材料,对环境的影响较小,也被广泛应用于节能设备和新能源领域。
四、环境影响1. 生产污染:铜的提炼和生产会产生气体、废水和固体废物,对环境造成一定污染。
2. 电磁辐射:电子产品中大量使用的铜线圈和导线会产生电磁辐射,对人体健康造成一定影响。
3. 废旧处理:大量废旧的铜制品需要进行回收处理,对环境和资源有一定影响。
铜及其化合物知识点

铜及其化合物知识点铜是一种常见的金属元素,化学符号为Cu。
它具有良好的导电性和导热性,因此被广泛应用于电子、建筑和工业领域。
以下是一些关于铜及其化合物的知识点:- 物理性质:铜具有金属光泽,呈红褐色。
它的熔点为1083摄氏度,沸点为2567摄氏度。
铜是柔软的,并且具有良好的延展性和可塑性。
物理性质:铜具有金属光泽,呈红褐色。
它的熔点为1083摄氏度,沸点为2567摄氏度。
铜是柔软的,并且具有良好的延展性和可塑性。
- 化学性质:铜在常温下相对稳定,不容易被空气和水腐蚀。
然而,它会与一些酸和氧化剂发生反应,生成相应的化合物。
化学性质:铜在常温下相对稳定,不容易被空气和水腐蚀。
然而,它会与一些酸和氧化剂发生反应,生成相应的化合物。
- 铜离子:在化学反应中,铜原子往往失去2个电子,形成Cu2+离子。
这种离子具有蓝色,并且在化合物中起着重要的作用。
铜离子:在化学反应中,铜原子往往失去2个电子,形成Cu2+离子。
这种离子具有蓝色,并且在化合物中起着重要的作用。
- 铜的化合物:铜可以形成多种化合物,包括氧化物、硫化物、氯化物和硝酸铜等。
这些化合物在工业上有广泛的应用,如颜料、杀菌剂和催化剂等。
铜的化合物:铜可以形成多种化合物,包括氧化物、硫化物、氯化物和硝酸铜等。
这些化合物在工业上有广泛的应用,如颜料、杀菌剂和催化剂等。
- 应用领域:铜广泛应用于电子行业,如电线、导线和电路板等。
此外,它还用于建筑和装饰,如屋顶、管道和雕塑等。
应用领域:铜广泛应用于电子行业,如电线、导线和电路板等。
此外,它还用于建筑和装饰,如屋顶、管道和雕塑等。
以上是关于铜及其化合物的一些基本知识点。
了解铜的性质和应用领域,有助于我们更好地理解和应用这种重要的金属元素。
铜及其化合物知识点铜是一种常见的金属元素,化学符号为Cu。
它具有良好的导电性和导热性,因此被广泛应用于电子、建筑和工业领域。
以下是一些关于铜及其化合物的知识点:- 物理性质:铜具有金属光泽,呈红褐色。
2024年高考化学:铜及其化合物知识点汇总

2024年高考化学:铜及其化合物知识点汇总
01
铜及其化合物
一、铜
1. 物理性质:颜色:红色(紫红色)金属
2. 化学性质:价态:+1(不稳定) +2(稳定)
3. 与某些非金属单质反应:
(1)与氧气反应:
(2)与硫反应:
(3)与氯气反应:
4. 与酸反应:(非氧化性酸不反应)
5. 与某些盐反应:
二、铜的氧化物
1. CuO(黑色),(红色)
2. 与酸反应:
3. 与还原性物质(如、CO、C等)反应:
三、铜的氢氧化物及其反应
:蓝色物质,不溶性弱碱
1. 受热分解(是难溶碱的共性)
2. 弱氧化性:与新制氢氧化铜悬浊液反应
配制新制的悬浊液:
四、铜盐及其反应
碱式碳酸铜(铜绿)受热分解:。
铜及其化合物方程式

铜及其化合物方程式一、铜的基本性质铜是一种优良的金属,具有良好的导电性和导热性,而且外观美观,因此在建筑、电器、通信等领域得到广泛应用。
下面是铜的一些基本性质:1.化学符号:Cu(铜)2.原子序数:293.相对原子质量:63.554.密度:8.96g/cm³5.熔点:1083℃6.沸点:2595℃7.电阻率:1.678μΩ·cm(20℃)8.自身电极势:+0.34V二、铜的化学性质铜是一种化学性质较为稳定的金属,不易被氧化,但在一些强氧化剂的作用下仍然会发生反应,下面介绍一些常见的铜的化学反应:1.铜与空气反应铜受空气的影响,会在表面形成一层氧化膜,通常为黑色或者绿色的铜绿。
这一氧化膜能够保护铜的表面,避免其继续被氧化。
有时,如果环境中的氧气和水汽充足,铜也会发生氧化反应,形成黑色的氧化层。
Cu + O2 → CuO2Cu + O2 → 2CuO2.铜与酸反应铜可以与稀酸反应(如稀硫酸),放出氢气并生成相应的铜盐。
但是铜不能与浓酸反应,因为浓酸的氧化性太强,会氧化铜。
Cu + 2H2SO4 + O2 → CuSO4 + SO2 + 2H2O3.铜与碱反应铜与碱类反应,生成相应的铜盐和水。
例如:Cu + 2NaOH → Cu(OH)2 + 2Na+4.铜与氯化氢反应铜在氯化氢的存在下,可以发生还原反应,放出氢气并生成二价的铜盐(CuCl2)。
例如:Cu + 2HCl → CuCl2 + H2三、铜的化合物铜的化合物广泛存在于自然界中,下面介绍一些常见的铜的化合物及其反应:1.氢氧化铜(Cu(OH)2)铜的氢氧化物在水中难溶,但在强碱性环境中溶解度却很大。
当铜离子与氢氧根离子作用,可以生成氢氧化铜:Cu2+ + 2OH- → Cu(OH)22.氧化铜(CuO)氧化铜是一种黑色或棕色的固体,常用于制备其他铜化合物。
氧化铜可以通过热分解碳酸铜而得到:CuCO3 → CuO + CO23.硝酸铜(Cu(NO3)2)硝酸铜是一种蓝色的晶体,能够溶于水,并在空气中逐渐失去其中的水分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铜及其化合物性质归纳
精编版
MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】
铜及其化合物性质归纳
铜及其化合物的性质虽然在中学化学中没有专门介绍,但它们分散在中学教材的各个章节中。
在近几年高考题中经常出现铜及其化合物的影子,为便于同学们掌握它们的性质,现归纳如下:
一、铜
1、原子结构:原子序数为29,位于元素周期表中第4周期、第IB族,最外层有1个电子,常见化合价有+1、+2价。
2、物理性质:纯铜呈暗红色,属有色金属,导电导热性、延展性良好,焰色反应呈绿色。
3、化学性质:铜是一种较不活泼的金属,位于金属活动性顺序表中氢原子之后。
(1)与O
2的反应在空气中或O
2
中加热表面变黑:,利用此反应可除
去混在H
2、CO中的少量O
2。
(2)与O
2、CO
2
、H
2
O的作用
在潮湿的空气中铜可生成铜绿,。
(3)与其他非金属的反应
Cu在中燃烧生成棕黄色烟:;
在硫蒸气里燃烧生成黑色固体:
(4)与酸的反应
①与稀盐酸、稀不反应;
②与浓反应:
③与硝酸反应:
(浓)
(稀)
(5)与盐溶液反应:
二、铜的化合物
1、氧化物
CuO是不溶于水的碱性氧化物,具有较强的氧化性,在加热时能被CO、H
、C等还原:
2
,;可与酸反应:。
呈砖红色,可用于制红色玻璃,本身较稳定,但在酸液中易发生歧化反应生成Cu和。
2、
(1)难溶性碱,可与酸反应:。
(2)受热易分解:
(3)有弱氧化性,新制的悬浊液能氧化醛基化合物,本身被还原为,常用于醛基化合物的检验:。
(4)制备:可溶性铜盐与强碱反应:(蓝色絮状沉淀)。
3、铜盐
常见的铜盐有等。
(1)颜色:无水呈棕黄色,硫酸铜晶体(,又称胆矾或蓝矾)呈蓝色,其浓溶液呈绿色,无水硫酸铜呈白色,及其溶液呈蓝色。
常用无水硫酸铜白色粉末检验水蒸气或水的存在。
(2)化学性质
①水解性,其水溶液显弱酸性:。
②氧化性,与金属单质反应:。
③与强碱反应:。
④胆矾受热可失去结晶水变成白色粉末,过热时,会进一步分解出。
⑤可溶性铜盐能与H
S或反应生成黑色的沉淀,它难溶于强酸,常用于的
2
检验。
⑥易与形成络离子。
