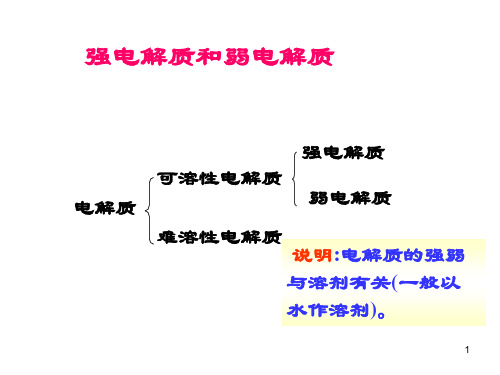
强电解质与弱电解质
高考化学复习经典讲解强电解质和弱电解质的同与不同

4.pH相同的两份酸溶液(甲:盐酸,乙:醋酸)分别与锌反应,若最后锌都已完全溶解,且放出的气体一样多,则下列判断不正确的是B
A.反应开始时,其速率:甲=乙B.反应所需时间:乙>甲
C.参加反应的锌的质量:甲=乙D.两份酸溶液的物质的量浓度:乙>甲
4.pH相同时:αH+=
1H+、OH-的离子浓度相同;
2溶液浓度:一元弱酸>>一元强酸>二元强酸;一元弱碱>>一元强碱>二元强碱。
3强、弱酸与同一金属反应时,初速相同。
4同等程度稀释时,弱酸的pH值比强酸的pH值增加得少些;弱碱的pH值比强碱的pH值下降得少些。
5.pH相同、溶液体积相同时:
1溶质的物质的量:弱酸>>一元强酸>二元强酸;弱碱>>一元强碱>二元强碱。
高考化学复习经典讲解强电解质和弱电解质的同与不同
一、强、弱电解质概念上的四大区别
强电解质在水溶液中全部电离,电离不可逆,不存在电离平衡,溶液中不存在电解质的分子,只有电解质的离子;其电离方程式写等号,在离子方程式中可溶的强电解质写离子符号。弱电解质在水溶液中只有很少部分电离,电离可逆,存在电离平衡,溶液中存在大量的电解质分子,少量的电解质离子;其电离方程式写可逆符号,在离子方程式中写分子式。
A1∶1B1∶10C100∶1D1∶100
7.某氨水的pH=x,某盐酸的pH=y,已知x+y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是AD
A.c >cCl->cOH->cH+B.c >cCl->cOH->cH+
l->c >cH+>cOH-D.c +cH+=cCl-+cOH-
强弱电解质的判断方法

强弱电解质的判断方法电解质是指在溶液中能够电离成离子的化合物,它们在维持人体正常生理功能中起着重要作用。
根据电解质在水中的电离程度的不同,可以将电解质分为强电解质和弱电解质两种。
强电解质在水中能够完全电离,生成大量离子,而弱电解质在水中只能部分电离,生成少量离子。
正确判断电解质的强弱对于临床诊断和治疗具有重要意义。
下面将介绍几种判断电解质强弱的方法。
首先,可以通过观察电解质的化学性质来判断其强弱。
强电解质通常是酸、碱或盐,具有较高的电离度,如盐酸、氢氧化钠等。
而弱电解质则通常是酸、碱的部分酸或部分碱,电离度较低,如乙酸、碳酸氢钠等。
因此,通过化学性质的观察,可以初步判断出电解质的强弱。
其次,可以通过电导率来判断电解质的强弱。
强电解质在水中能够迅速电离,生成大量离子,因此具有较高的电导率。
而弱电解质在水中只能部分电离,生成少量离子,因此具有较低的电导率。
通过测定溶液的电导率,可以间接判断电解质的强弱。
另外,可以通过观察电解质在水中的溶解度来判断其强弱。
强电解质通常具有较高的溶解度,能够在水中溶解并完全电离,生成大量离子。
而弱电解质的溶解度较低,只能部分电离,生成少量离子。
因此,通过观察电解质在水中的溶解度,也可以初步判断出其强弱。
此外,可以通过测定电解质溶液的pH值来判断其强弱。
强电解质在水中完全电离,生成大量离子,会显著改变溶液的pH值。
而弱电解质在水中只能部分电离,生成的离子较少,对溶液的pH值影响较小。
通过测定电解质溶液的pH值,也可以初步判断出电解质的强弱。
综上所述,通过观察电解质的化学性质、测定电导率、观察溶解度和测定pH值等方法,可以初步判断电解质的强弱。
在临床实践中,正确判断电解质的强弱对于指导治疗和预防并发症具有重要意义。
因此,医护人员需要熟练掌握这些判断方法,以确保临床工作的准确性和科学性。
弱电解质的电离

M++OH-,平衡时
c ( M+).c( OH- )
c(MOH)
意义:K值越大,电离程度越大,相应酸 (或
碱)的酸(或碱)性越强。K值只随温度变化。
对于多元酸:
多元弱酸是分步电离的,K1 >> K2(一般要相差
105)。多元弱酸的酸性由第一步电离决定。
试根据课本中“一些弱酸和弱碱的电离平衡常数”
向电离方向移动。
(2)浓度
浓度越大,电离程度越小。
(3)其他因素
(酸、碱度、盐离子的浓度等)
问题:怎样定量的比较弱电解质的相对强弱?
电离程度相对大小怎么比较?
弱电解质电离程度相对大小的参数一
电离平衡常数(K)
对于一元弱酸 HA
Ka=
H++A-,平衡时
c ( H+) .c( A-)
c(HA)
对于一元弱碱 MOH
1、适用范围: 电解质的电离。
2、用的是可逆号或等号。
3、多元弱酸分步电离,分步写。
H2S
H++HS-
HS-
H++S2-
4、多元弱碱分步电离一步写。
Al(OH)3
Al3++3OH-
5、其余同化学方程式。
1、稀硫酸
2、硫化钾溶液
3、硫酸氢钠溶液
4、硫酸铁溶液
5、磷酸钠溶液
6、硫化氢水溶液
7、磷酸溶液
OH-+NH4+
CH3COOH
H++PO43-
CH3COO-+H+
弱电解质的电离
电离
CH3COOH
CH3COO - + H+
强弱电解质的判断方法

强弱电解质的判断方法
电解质是指在水溶液中能够电离成离子的化合物,具有导电性质。
根据电解质的电离程度不同,可以分为强电解质和弱电解质。
强电解质在水溶液中能够完全电离,生成大量离子,而弱电解质只能部分电离,生成少量离子。
判断一个物质是强电解质还是弱电解质,可以通过一些简单的方法进行实验和观察。
首先,可以通过观察物质的溶解度来初步判断其为强电解质还是弱电解质。
一般来说,强电解质在水中的溶解度很高,可以溶解成透明的溶液,并且能够导电。
而弱电解质的溶解度相对较低,溶解后的溶液可能呈现浑浊或者微弱的导电性。
因此,通过观察溶解度可以初步判断物质的电解质性质。
其次,可以利用电导率仪进行实验,测量物质溶液的电导率。
强电解质的溶液能够导电,其电导率较高;而弱电解质的溶液导电能力较弱,电导率相对较低。
通过测量电导率,可以更加准确地判断物质的电解质性质。
另外,可以利用酸碱指示剂进行观察。
强酸和强碱是强电解质,它们在水中完全电离生成大量离子,因此可以通过酸碱指示剂的颜色变化来判断物质的电解质性质。
而弱酸和弱碱是弱电解质,它们只能部分电离,无法引起明显的酸碱指示剂颜色变化。
最后,可以通过测定物质的酸碱性来判断其为强电解质还是弱电解质。
强酸和强碱在水溶液中呈强酸性和强碱性,而弱酸和弱碱的酸碱性相对较弱。
通过测定物质的酸碱性,可以帮助判断其电解质性质。
总之,通过观察溶解度、测量电导率、利用酸碱指示剂和测定酸碱性等方法,可以较为准确地判断一个物质是强电解质还是弱电解质。
这些方法可以在化学实验中广泛应用,帮助我们更好地理解和认识电解质的性质。
强电解质和弱电解质
(4)液态或固态的纯物质,以及稀溶液中的 溶剂(如水),其活度均规定为aBonic strength)
(3.3)
式中, bi和 zi分别为溶液中第i 种离子的质 量摩尔浓度和该离子的电荷数,近似计算时, 也可以用ci代替bi 。
已解离的分子数 原有分子总数
(3.1)
在相同浓度下,不同电解质的电离度大小 反映了电解质的相对强弱,解离度就愈小,电 解质愈弱
4
表3-1 强电解质的表观电离度 (298K,0.10mol·L-1)
通常按解离度的大小,把浓度为 0.1mol·kg-1的电解质溶液中解离度大于30%的 称为强电解质,解离度小于5%的称为弱电解 质,而解离度介于5%~30%的称为中强度电解 质。
例如:醋酸的解离平衡如下式所示:
HAc + H2O
H3O + + Ac-
在平衡状态下,弱电解质在水溶液中的解离
程度的大小可以定量地用解离度ɑ来表示:
3
解离度(degree of ionization):符号为α 是指在一定温度下当解离达到平衡时,已解 离的弱电解质分子数与解离前分子总数的比率。
α=
离子氛是一个平均统计模型,虽然一个离 子周围的电荷相反的离子并不均匀,但统计结 果作为球形对称分布处理。
6
三、离子的活度和活度系数
离子的活度aB(activity):它是电解质溶液 中实际上能起作用的离子浓度。
aB = γ·cB/ cθ (3.2)
式中 γ称为溶质B的活度系数(activity coefficient)
例如:
NaCl HCl
Na+ + Cl- (离子型化合物) H+ + Cl- (强极性分子)
《强电解质和弱电解质》 知识清单

《强电解质和弱电解质》知识清单一、电解质的概念在水溶液里或熔融状态下能够导电的化合物叫做电解质。
电解质能够导电是因为在这些状态下,它们能够解离出自由移动的离子。
需要注意的是,单质和混合物既不是电解质也不是非电解质。
二、强电解质1、定义在水溶液中能完全电离的电解质称为强电解质。
2、常见的强电解质强酸:如盐酸(HCl)、硫酸(H₂SO₄)、硝酸(HNO₃)等。
强碱:如氢氧化钠(NaOH)、氢氧化钾(KOH)、氢氧化钡(Ba(OH)₂)等。
大多数盐:如氯化钠(NaCl)、硫酸铜(CuSO₄)、硝酸钾(KNO₃)等。
3、强电解质的电离特点强电解质在水溶液中完全电离,不存在电离平衡。
以氯化钠为例,NaCl = Na⁺+ Cl⁻,一旦溶解于水,就会迅速解离成钠离子(Na⁺)和氯离子(Cl⁻),且这个过程是不可逆的。
4、强电解质溶液的导电能力强电解质溶液的导电能力通常较强,但导电能力的强弱不仅仅取决于电解质的强弱,还与溶液中离子的浓度和离子所带电荷数有关。
离子浓度越大、离子所带电荷数越多,溶液的导电能力就越强。
三、弱电解质1、定义在水溶液中只有部分电离的电解质称为弱电解质。
2、常见的弱电解质弱酸:如醋酸(CH₃COOH)、碳酸(H₂CO₃)、氢氟酸(HF)等。
弱碱:如一水合氨(NH₃·H₂O)等。
少数盐:如醋酸铅((CH₃COO)₂Pb)等。
3、弱电解质的电离特点弱电解质在水溶液中部分电离,存在电离平衡。
以醋酸为例,CH₃COOH ⇌CH₃COO⁻+H⁺,在一定条件下,电离达到平衡状态,此时溶液中未电离的醋酸分子、醋酸根离子(CH₃COO⁻)和氢离子(H⁺)共存。
4、影响弱电解质电离平衡的因素(1)温度:一般来说,升高温度,电离平衡向右移动,电离程度增大。
(2)浓度:稀释溶液,电离平衡向右移动,电离程度增大。
(3)同离子效应:在弱电解质溶液中加入与弱电解质具有相同离子的强电解质,电离平衡向左移动,电离程度减小。
强弱电解质的判断方法

强弱电解质的判断方法
强弱电解质是指在溶液中能完全或部分电离成离子的物质。
判断一个物质是强电解质还是弱电解质可以通过以下方法:
1. 寻找物质的化学式:强酸、强碱和某些无机盐通常是强电解质,而大多数有机物和一些较弱的无机盐通常是弱电解质。
2. 观察物质的电离程度:强电解质在溶液中会完全电离,而弱电解质只会部分电离。
可以通过电离度来判断,电离度越高的物质越可能是强电解质。
3. 测定电导率:强电解质具有高电导率,而弱电解质具有较低的电导率。
可以通过测量溶液的电导率来判断物质的电离程度。
4. 酸碱指示剂:酸碱指示剂可以用来判断物质是否是强酸或强碱。
对于强酸,指示剂会发生明显的酸碱指示颜色变化;而对于弱酸或弱碱,则指示剂的颜色变化较弱或不明显。
需要注意的是,以上方法只能作为初步判断的依据,具体的判断还需结合其他实验数据和化学性质综合考虑。
强电解质与弱电解质课件

盐类强电解质
氯化钠
由强酸和强碱组成,在水中完全 电离,生成钠离子和氯离子,具
有良好的导电性。
硫酸钠
由强酸和强碱组成,在水中迅速 电离,生成硫酸根离子和钠离子 ,具有较高的溶解度和导电性。
碳酸钙
由强碱和弱酸组成,在水中部分 电离,生成钙离子和碳酸根离子 ,溶解度较低,但在强酸性环境 中可溶解并产生二氧化碳气体。
3. 进行实验:将强电解 质和弱电解质的溶液分 别置于试管中,观察其 颜色、导电性等性质, 并记录实验结果。
实验现象展示和结果分析
强电解质实验现象
NaOH溶液呈无色,加入酚酞指示剂后呈红色,说明 NaOH在水溶液中完全电离,产生OH-离子,使溶液呈 碱性。
CH3COOH溶液呈无色,加入甲基橙指示剂后呈橙色, 说明CH3COOH在水溶液中部分电离,产生的H+离子 浓度较低,使溶液呈弱酸性。
硝酸
在水中完全电离,生成氢离子和硝 酸根离子,具有强酸性和氧化性。
强碱类强电解质
01
02
03
氢氧化钠
在水中完全电离,生成氢 氧根离子和钠离子,具有 强碱性。
氢氧化钾
在水中迅速电离,生成氢 氧根离子和钾离子,具有 极强的碱性和腐蚀性。
氢氧化钙
在水中部分电离,生成氢 氧根离子和钙离子,具有 中强碱性。
HCl溶液呈无色,加入甲基橙指示剂后呈红色,说明 HCl在水溶液中完全电离,产生H+离子,使溶液呈酸 性。
弱电解质实验现象
NH3·H2O溶液呈无色,加入酚酞指示剂后呈粉红色, 说明NH3·H2O在水溶液中部分电离,产生的OH-离子 浓度较低,使溶液呈弱碱性。
06
思考题与课堂互动环节
思考题设计
题目1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解质溶液 溶液
液
电解质
通电后 灯泡 亮度
离子浓度
NaCl
亮 大
NaOH HCl CH3COOH NH3•H2O
亮亮 暗
暗
大
大小 小
只有离子
液面
H+ Cl-
H+
H+
H+
H+ Cl-
H+
Cl-
H+
H+
Cl-
H+
H+
Cl-
HCl电离的结果
既有离子,又有分子
液面
CH3COOH CH3COOH
CH3COOH H+
碳酸是一种弱酸。
酸式盐在水溶液中
NaHSO4 = Na + + H + + SO42-
NaHCO3 = Na + + HCO3 强酸酸式根( HSO4- )在水溶液中拆开写; 弱酸酸式根( HCO3- )不能拆;
电离方程式书写要求
①强电解质用“ ”连接 ②弱电解质用“ ”连接 ③多元弱酸分步电离 ④多元弱碱一步写完
常见的弱电解质: 弱酸:H2CO3 、CH3COOH、H2S、HF等 弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等
少数盐和水
BaSO4、CaCO3、AgCl 等 难 溶 于 水 的盐是否属弱电解质?
CH3COOH易溶,是否属强电解质? 强电解质的溶液导电能力一定强吗?
影响电解质溶液导电能力的主要因素 : 单位体积溶液中离子数目的多少和离子所带电 荷数的多少。
单质和混合物既不是电解质也不是非电解质
电解质的判断
判断物质是否属于电解质: 一看:是不是化合物; 二看:是不是导电;(熔融或水溶液中) 三看:是不是自身电离。
HCl 、 CH3COOH 、 NaOH 、 NaCl 、 NH3·H2O都是电解质,它们的导电能 力相同吗?
浓度相等电 NaCl NaOH溶 盐酸 醋酸溶液 氨水
H2CO3
HCO3-+H+
HCO3-
CO32-+H+
Cu(OH)2的电离方程式如何表示?
Cu(OH)2
Cu2++2OH-
请写出NaHSO4的电离方程式
水溶液
NaHSO4 = Na + + H + + SO42-
NaHSO4是一种酸式盐
请写出NaHCO3的电离方程式 ×NaHCO3 = Na + + H + + CO32√ NaHCO3 = Na + + HCO3-
H+
CH3COOH
CH3COOH
CH3COOH CH3COO-
CH3COOH
CH3COOH电离的结果
强电解质和弱电解质
1、强电解质: 在水溶液中或熔融状态下全部电离成离子 的电解质。
2、弱电解质
在水溶液中或熔融状态下部分电离成离子 的电解质。
常见的强电解质: 强酸: HCl、HNO3、H2SO4等 强碱: NaOH、KOH、Ba(OH)2等 大多数盐: NaCl、 AgNO3、BaSO4等
练习: 下列电离方程式正确的是( D )
A、MgCl2
Mg2+ + Cl2—
B、 CH3COOH
H + + CH3COO—
C、 H2CO3
2H + + CO32—
D、 Ba(OH)2 Ba2+ +2OH—
谢谢大家!
Al2(SO4 )3 = 2Al3+ + 3SO42-
请写出以下几种物质的电离方程式:K2CO3; Mg(NO3)2;FeCl3; NH4Cl 。
盐:凡电离时生成金属阳离子(或 NH4+)和酸根阴离子的化合物
弱电解质电离方程式:
NH3·H2O的电离方程式如何表示?
NH3·H2O
NH4++OH-
H2CO3的电离方程式如何表示?
练习: 下列物质中属于强电解质的是_①__④___⑤___⑧__⒂__
属于弱电解质的是_⑥___⑦___⑨__⑾____
①NaCl ②NH3 ③Cl2 ④BaSO4
⑤HCl
⑥CH3COOH ⑦ H2S
⑧NaHCO3 ⑨Cu(OH)2 ⑩Cu ⑾HF
⑿蔗糖 ⒀乙醇溶液 ⒁SO2 ⒂Na2O
电离方程式
HNO3 = H+
ቤተ መጻሕፍቲ ባይዱ+ SO42+ Cl-
+ NO3-
酸:凡电离时生成的阳离子全部是H+ 的化合物。
Ba(OH)2= Ba2+ + 2OH -
NaOH = Na+ + OH KOH = K+ + OH -
碱:凡电离时生成的阴离子全部是OH -离子的化合物
NaCl
= Na+ + Cl-
Na2SO4
= 2Na+ + SO42-
NaCl晶体不能导电,是因为其中不含 离子。这句话对吗,为什么?
不对。晶体中含有Na+和Cl-,但是不能 自由移动,所以NaCl晶体不能导电。
电解质在水溶液里或熔融状态下产生自由移 动离子的过程叫什么?
电离方程式: 用化学符号表示电解质电离过程的式子
NaCl Na+ + Cl -
H2SO4 = 2H+ HCl = H+
强电解质与弱电解质
常见的电解质: 酸: HCl、HNO3、H2SO4 、H2CO3 等
碱: NaOH、KOH、NH3·H2O等 盐: NaCl、 AgNO3、BaSO4等
活泼金属氧化物:Na2O、MgO、CaO等 水
常见的非电解质: 非金属氧化物:CO、 CO2、SO3 等 非酸性气态氢化物: NH3等 绝大部分有机化合物: CH4、蔗糖、酒精等
