胶团萃取
胶团和反胶团萃取要点

由于周围水层和极性基团的保护,保持了蛋白 质的天然构型,不会造成失活。
◘ 蛋白质进入反胶团溶液是一协同过程。在有机溶 剂相和水相两宏观相界面间的表面活性剂层 ,同 邻近的蛋白质分子发生静电吸引而变形 ,接着两 界面形成含有蛋白质的反胶团 ,然后扩散到有机 相中 ,从而实现了蛋白质的萃取。(可能机理) ◘ 改变水相条件 (如pH值、离子种类或离子强度 ) ,又可使蛋白质从有机相中返回到水相中 ,实OT需要6~8个水分
子,而其它水分子则不受束缚,可与普通水一样自由流动 。
故当W > 16时,“水池”中的水逐渐接近主体水相粘 度,胶团内也形成二重电荷层。
见下图。
假定反胶团为球形(除了W或表面活性剂浓度很 大外),反胶团平均直径dm的增加和W的增加基本成 正比,W=0~50之间,dm=2~30nm。
向)胶团。
水
极性头
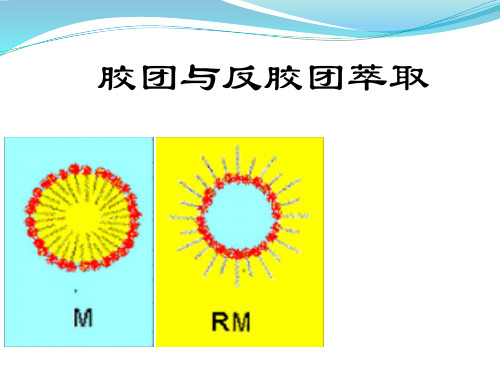
正胶团是在极性溶液中形成的,
其亲水性的极性端向外指向极 性(如水)溶液,疏水性的非 极性“尾”向内相互聚集在一
非极性的核 非极性尾
起。
反胶团是两性表面活性 剂在非极性有机溶剂中 亲水性基团自发的向内 聚集而成,内含微小水 滴,其疏水性的非极性 尾部向外,指向非极性 溶剂,而极性头向内, 与在水相中形成的微胶 团方向相反。
反胶团的分类
1、单一表面活性剂反胶团体系: 是指在使用时无须加入助剂的表面活性剂,具有多条中等长度的烷 基尾和一个较小的极性头。
A、 阴离子型,如AOT。该体系结构简单和稳定,反胶团体积较大 ,适用于等电点较高的、相对分子量较小的蛋白质的分离;
B、阳离子型,如CTAB,DAP等。该体系适用于等电点较低的、相对 分子量较大的蛋白质的分离; 分子量更大的蛋白质,但这类体系容易乳化。 C、非离子型表面活性剂,能形成更大的反胶团体系,能分离相对
胶团与反胶团萃取技术
极性基团两部分组成的两性分子。
表面活性剂的分类: 阴离子表面活性剂; 阳离子表面活性剂; 非离子型表面活性剂。
表面活性剂在溶液中开始形成胶团时的浓度称为临界胶束
浓度,简称CMC。当溶液中表面活性剂浓度低于CMC时,它 主要以单体形式,即分子或离子形式存在。表面活性剂形 成胶团后,溶液的许多物理化学质,如表面张力、摩尔电 导率、渗透压、密度、增溶性能等,在一个很窄的浓度范 围内呈现不连续变化。
从原理上,可当 做“液膜”分离操作 的一种。 如右图所示 :
(3)溶解法 将含有反胶团(W=3~30)的有机溶液与蛋白质固体粉末一齐搅 拌,使蛋白质进入反胶团中 。 用于非水溶性蛋白质。 该法所需时间较长,含蛋白质的反胶团体系稳定。 说明反胶团“水池”中的水与普通水的性质有区别。
二、反胶团萃取原理
从宏观上看反胶团萃取,是有机相-水相间的分配萃 取,和普通的液液萃取在操作上具有相同特征。 微观上,是从主体水相向溶解于有机溶剂相中的反胶 团微水相中的分配萃取。
表面活性剂 AOT CTAB TOMAC
有机溶剂 表面活性剂 有机溶剂 n-烃类(C6~C10)、异辛烷、 Brij60 辛烷 环己烷、四氯化碳、苯 己醇/异辛烷,己醇/辛烷
TritonX 己醇/环己烷 三氯甲烷/辛烷
磷脂酰胆碱 苯、庚烷 环己烷 磷脂酰乙醇胺 苯、庚烷
胶团分为正(向)胶团和反(向)胶团。
胶团与反胶团萃取
一、基本概念
二、萃取原理 三、影响因素 四、应用领域 五、胶团与反胶团萃取设备
一.基本概念
胶团萃取——是被萃取物以胶团或者胶体形式从水相 被萃取到有机相的溶剂萃取方法。它既可用于无机物的萃 取,也可用于有机物的萃取。
在无机物的方面:金属或其无机盐可以形成疏水胶体粒子粒子进入有
反相微胶团萃取技术培训课件

反相微胶团萃取技术培训 课件
欢迎参加反相微胶团萃取技术的培训课程。在本课程中,我们将深入探讨该 技术的背景、原理、应用领域、实验操作、案例研究、技术进展和应用前景, 并总结重要观点。
技术背景
掌握反相微胶团萃取技术,从理解其技术背景开始。该技术的原理基于微胶团的形成和提取过程。了解这些背 景知识是成功应用该技术的关键。
反相微胶团萃取技术的定义和 原理
反相微胶团萃取技术利用胶团结构的形成,将反相溶剂与目标组分结合。掌 握该技术的定义和原理,可以准确理解反相微胶团萃取的工作机制。
反相微胶团萃取技术的应用领 域
了解反相微胶团萃取技术的应用领域,包括环境监测、食品安全、药物分析 等。探索这些应用领域的案例,以及该技术在解决实际问题中的作用。
调整反相胶团体系
根据目标组分的特性,调整物质的浓度和 pH 值,以实现最佳萃取效果。
掌握操作步骤
详细了解每个步骤的操作要点,确保实验的可重复性和准确性。
案例研究
环境监测
食品安全
如何利用反相微胶团萃取技术进 行环境污染物的快速分析和监测。
探索反相微胶团萃取技术在食品 中农药和重金属残留检测中的应 用。
实验操作
1
准备实验样品
选择目标组分和适合的反相溶剂,以确保实验的成功。
2
构建微胶团体系ຫໍສະໝຸດ 通过调整物质的配比和 pH 值,形成稳定的反相微胶团体系。
3
胶团萃取过程
将待萃取的样品与反相溶剂的胶团混合,实现目标组分的高效提取。
反相微胶团萃取技术的步骤和操作注 意事项
准备实验条件
保持实验环境的洁净和适宜的温度,以确保实验结果的可靠性。
药物分析
了解反相微胶团萃取技术在药物 分析中的作用,提高药物检测的 准确性和灵敏度。
反胶团萃取技术

反胶团萃取法,亦称“逆胶束萃取法”。
利用反相微胶团在油相中形成的亲水空穴能选择性地溶解某些蛋白质分子的特性,来分离萃取蛋白质分子的一种方法。
反相微胶团是指油相中表面活性剂浓度超过临界胶团浓度后,在非极性油溶液中形成的聚集体,其内腔由表面活性剂分子的亲水头构成,外面被伸向连续油相的憎水尾部所包围,这种结构使其在连续油相中形成了许多亲水空穴,水相中的极性分子有可能溶解在油相中。
如水相中含有几种蛋白质,可调节系统的条件,使某些蛋白质溶于胶团中,而其他蛋白质则不能,以此达到分离的目的。
该法已成功地通过控制pH和氯化钾浓度,实现了α-核糖核酸酶、细胞色素C和溶菌酶的分离以及α-淀粉酶的连续萃取和反萃取操作。
反胶团萃取的原理

反胶团萃取的原理胶团是一种由胶原蛋白和其他蛋白质组成的胶体颗粒,它在食品加工和制备中具有重要的作用。
然而,在某些情况下,我们需要将胶团从食品中去除,这就需要用到反胶团萃取技术。
反胶团萃取的原理主要是利用一定的物理或化学手段,将胶团从食品中分离出来。
本文将介绍反胶团萃取的原理及其应用。
首先,反胶团萃取的原理涉及到胶团的特性。
胶团在溶液中通常呈现为胶态,其粒径较大,表面带有电荷,因此在溶液中具有一定的稳定性。
为了实现反胶团的萃取,我们需要破坏胶团的稳定性,使其聚集成团,从而可以被分离出来。
其次,反胶团萃取的原理可以通过改变溶液的物理条件来实现。
例如,可以通过调节溶液的pH值,改变离子强度,或者调节温度来破坏胶团的稳定性。
在酸性条件下,胶原蛋白的电荷状态会发生改变,从而导致胶团的聚集。
另外,通过加热或者冷却溶液,也可以改变溶液中胶团的稳定性,使其聚集成团。
此外,反胶团萃取的原理还可以通过添加特定的化学物质来实现。
例如,可以添加盐类、有机溶剂、蛋白酶等物质来改变溶液中胶团的性质,从而实现胶团的聚集和分离。
这些化学物质可以改变胶团表面的电荷状态,破坏其稳定性,使其聚集成团,便于分离。
最后,反胶团萃取的原理还可以通过物理手段来实现。
例如,可以利用超声波、高压处理、离心等方法来破坏胶团的稳定性,使其聚集成团,便于分离。
这些物理手段可以有效地改变胶团的结构和性质,从而实现胶团的萃取。
综上所述,反胶团萃取的原理主要是通过改变溶液的物理和化学条件,破坏胶团的稳定性,使其聚集成团,从而实现胶团的分离。
这种技术在食品加工和制备中具有重要的应用,可以有效地改善食品的质量和口感。
希望本文对反胶团萃取的原理有所帮助,谢谢阅读!。
第六章反向微胶团萃取与双水相萃取技术

• 6.4.2:相图 • 不同的双水相体系,其成相条件是不同的,相图常被用于 研究不同双水相体系中的成相现象。把双水相体系中 的组成成分,分别以不同的浓度相混,然后观察其成相过 程,把此过程以图的形式描绘下来,即称为此种双水相体 系的相图。
• 图中当体系的组成及浓度处于 TCB曲线的上方时,如M点,体系 分为两相。上相(轻相)的组成用 T表示,下相(重相)的组成用B点 表示。直线TMB曲线称为结线 (系线)。当体系的总组成由M变 到M‘,则体系组成为T‘和B’两相。 T‘、B’相间的差别比T、B相间的 差别要小。进一步改变体系的组 成,分相时形成的相间差别进一 步变小,达到C点时,则无成相现 象。C点可称为分相临界点,曲线 TCB称为双结点曲线。体系中的 组成处于TCB下方,体系中由于 不满足成相条件而呈现单相。
• 3、水相中的离子强度 • 微胶团 中水相的 离子强度 对反相微胶团萃取的影响,可 以用前面第二章中的盐溶和 盐析现象来解释 。在低离子 强度下,酶和蛋白质等生物大 分子表面上的荷电性和亲水 性得到了改善,溶解度上升,与 微胶团内表面的结合力增强。 当水相中的离子强度增加到 一定的程度时,由于抵消了生 物大分子表面上的电荷,并且 由于离子的水化作用而使蛋 白质分子表面上的水膜消失, 减少了与微胶团内表面的结 合作用,从而降低了溶解度。 使分离效率降低 •
• 关于蛋白质及酶等生物大分子是以何种形式被反相胶 团萃取的机理,有三种不同的见解。 – 一种认为是在反相胶团中,由表面活性剂的极性部分 围成一个中心,中心为水等极性溶剂占有,生物大分 子就溶解于其中,并且在生物大分子周围包膜着一层 水壳,对生物大分子起保护作用。此种见解即是所 谓的水壳模型。见4-2(a,b); – 第二种见解认为是生物大分子虽然溶解于由表面活 性剂极性部分围成的中心部分,但在中心部分生物大 分子是以被吸附的状态附着于胶团的极性壁上。见 图4-2(c); – 第三种见解则认为生物大分子的非极性部分与多个 微胶团的非极性部分连接,由此形成生物大分子溶解 于多个微胶团之间的一种状态。见图4-2(d)。上述 几种见解中,以所谓的“水壳模型”解释具有较多 的说服力。
反胶团萃取的原理

反胶团萃取的原理
胶团是一种由胶原蛋白和其他蛋白质组成的三维网络结构,广泛存在于动物组
织中,如皮肤、骨骼、软骨等。
在医学和生物工程领域,胶团的提取和分离是一项重要的技术,而反胶团萃取则是其中的一种关键方法。
反胶团萃取的原理基于胶团的特性,利用化学或物理手段将胶团从生物组织中
提取出来。
其过程主要包括预处理、溶解、分离和纯化等步骤。
首先,预处理阶段是为了改变胶团所处的环境,使得其易于被溶解和分离。
这
一步通常包括清洗、去除杂质和改变PH值等操作,以提高后续步骤的效率。
接下来是溶解步骤,通过加入适当的溶剂或改变温度、压力等条件,使得胶团
分子间的相互作用减弱,从而使胶团逐渐溶解于溶液中。
这一步需要根据胶团的特性和所处的生物组织来选择合适的溶解条件,以避免对胶团结构和性质的破坏。
随后是分离步骤,将溶解的胶团与其他生物组织成分分离开来。
这一步通常采
用离心、过滤、沉淀等方法,将胶团从溶液中分离出来,并去除残余的杂质和溶剂。
最后是纯化步骤,通过进一步的化学或物理处理,去除残余的杂质和溶剂,使
得提取的胶团达到所需的纯度和活性。
这一步通常包括柱层析、凝胶过滤、超滤等技术,以获得高纯度的胶团制品。
总的来说,反胶团萃取的原理是通过一系列的预处理、溶解、分离和纯化步骤,将胶团从生物组织中提取出来,并获得所需的纯度和活性。
这项技术在医学、生物工程和食品工业等领域具有重要的应用前景,为胶团的利用和开发提供了重要的技术支持。
反胶团萃取的原理

反胶团萃取的原理
反胶团萃取是一种从溶液中去除胶体颗粒的方法。
它利用与胶体颗粒相反的电荷特性,通过添加电荷相反的染料或胶体颗粒,使胶体颗粒与添加剂发生吸附作用,形成重叠反胶团结构。
这些重叠的反胶团结构会相互吸引,从而形成更大的聚集体,使胶体颗粒变得更易沉淀。
该方法的原理是通过添加电荷相反的剂量,改变胶体颗粒表面的电荷性质。
胶体颗粒通常具有带负电或带正电的表面电荷分布,造成它们在溶液中的稳定分散。
当添加具有相反电荷的反胶团剂,如阳离子染料或阳离子胶体颗粒时,这些反胶团剂会吸附到胶体颗粒表面,改变胶体颗粒电荷的分布。
反胶团剂与胶体颗粒的吸附作用导致胶体颗粒之间的吸引力增强,形成更大的组块。
这些组块比起单个胶体颗粒更重,因此在重力或离心力的作用下更容易沉淀。
此外,重叠的反胶团结构还可以通过减少胶体颗粒与溶剂之间的接触面积,进一步促进沉淀。
反胶团萃取方法简单易行,并且可以有效地去除溶液中的胶体颗粒。
通过调整反胶团剂的剂量和溶液的pH值等条件,可以
控制胶体颗粒的去除效果。
然而,需要注意的是,该方法可能对一些溶液中的其他成分产生影响,因此在具体操作中需要仔细考虑和控制实验条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B、高聚合物的浓度
❖ 聚合物分相的最低浓度为临界点,系线的长度为零, 此时分配系数为1,即组分均匀的分配于上下相.
❖ 随着成相聚合物的总浓度或聚合物/盐混合物的总浓 度增大,系统远离临界点,系线长度增加,两相性 质的差别(疏水性等)增大,蛋白质分子的分配系数 将偏离临界点处的值(m=1),即大于1或小于1。因 此,成相物质的总浓度越高,系线越长,蛋白质越容 易分配于其中的某一相。
双水相系统(aqueous two-phase system, ATPS)
PEG = 聚已二醇(polyethylene glycol) Kpi = 磷酸钾 DX = 葡聚糖(dextran)
2、双水相萃取的原理
• 是生物物质在双水相体系中的选择性分配,当物 质进入双水相体系后,由于表面性质、电荷作用 和各种作用力(如憎水键、氢键和离子键等)的 存在和环境的影响,使其在上、下相中的浓度不 同,即分配系数不同。
❖ 反之.如pH大于PI,蛋白质在微胶团的溶解 度将很低或不溶。
❖ 但如pH过低。蛋白质会变性,溶解度也下降。
AOT体系中,三种低分子量的在较低PH时,几乎能完 全溶解于反胶团相。不过,PH过低时,蛋白质变性, 溶解度随之降低。显然,对于多中蛋白质自混合物的 分离,只要它们的PH有差异,就可以通过控制溶液的 PH是他们达到分离。
表面活性剂在溶液中开始形成胶团时的浓度称为临 界胶束浓度,简称CMC。当溶液中表面活性剂浓度 低于CMC时,它主要以单体形式,即分子或离子形 式存在。 表面活性剂形成胶团后,溶液的许多物理化学质, 如表面张力、摩尔电导率、渗透压、密度、增溶性 能等,在一个很窄的浓度范围内呈现不连续变化。
水
胶团分为正(向)胶 团和反(向)胶团。
四、 反胶团萃取的应用
❖ 分离蛋白质混合物; ❖ 浓缩α-淀粉酶; ❖ 从发酵液中提取胞外酶 ; ❖ 直接提取胞内酶; ❖ 用于蛋白质复性。
反胶团萃取在生物样品分离中的应用
表示核糖核酸酶、溶菌酶和细胞色素C 蛋白质混合溶液约分离过程。在pH =9时.核糖核酸酶不溶.而其他两种酶可溶,故在pH=9,[KCl]= 0.1mol/L时.核糖核酸酶只留在水相中.而溶菌酶和细胞色素C则完全溶 于反相微胶团中。再将含有溶菌酶和细胞色素C有机相与0.5mol/LKCl的水 相接触.细胞色素C转入水相。最后将含有溶茵酶的有机相与含有 2.0mol/LKCl.pH=11.5的水溶液混合,就可将溶菌酶转入到水相中,这样 就达到了三种蛋白质分离约目的。
第三节 双水相萃取
❖ 双水相体系的形成与分配机理 ❖ 双水相的相图 ❖ 双水相萃取体系的影响因素 ❖ 双水相萃取的应用
3.1双水相体系的形成与分配机理
双水相萃取?
利用物质在互不相溶的两水相间分配系数的 差异来进行萃取的方法。
双水相的形成
将两种不同的水溶性聚合物的水溶液混合时,当聚合 物浓度达到一定值,体系会自然的分成互不相溶的两相, 这就是双水相体系。这种含有不同聚合物分子的溶液发生 分相的现象叫聚合物的不相容性。
(2) 盐类
盐的种类和浓度对分配系数的影响主要反 映在对相间电位和蛋白质疏水性的影响。
①盐的种类
❖ 在双聚合物系统中,无机离子具有各自的分配系 数,不同电解质的正负离子的分配系数不同,从 而产生不同的相间电位。由于各相要保持电中性, 使得带电生物大分子,如蛋白质和核酸等分别向 两相移动分配。
②盐的浓度
萃取过程
第五章 萃取分离法
第五章 萃取分离法
影响超临界流体萃取的因素 压力:压力大,密度大,溶解力强; 温度:复杂,先升高后降低。 超临界流体的性质和被萃取物的极
性:CO2极性小,对于极性大的物质的萃 取,必须加入添加剂,称为提携剂或改 性剂。 流量:扩散慢的溶质流量不宜大。
第五章 萃取分离法
❖ 盐的浓度不仅影响蛋白质的表面疏水性, 而且扰乱双水相系统,改变各相中成相物 质的组成和相体积比。
❖ 例如,PEG/磷酸盐体系中上下相的PEG和磷酸盐 浓度及Cl-在上下相中的分配平衡随添加NaCl浓 度的增大而改变,这种相组成即相性质的改变直 接影响蛋白质的分配系数。
❖ 离子强度对不同蛋白质的影响程度不同,利用这 一特点,通过调节双水相系统的盐浓度,可有效 地萃取分离不同的蛋白质。
❖ 目前研究中常用的AOT反胶束体系和其他体系有许 多不足:如不能用于分子量较大的蛋白质的萃取和 往往在两相界面上形成不溶性的膜状物等等。为克 服这些不足,可通过在单一表面活性剂中加入具有 亲和作用的生物表面活性剂或另一种非离子型表面 活性剂的方法来改善萃取性能。
2、水相pH值对萃取的影响
❖ 蛋白质是一种两性物质,具有确定的等电点 (pI).
3、离子强度
❖ 水相盐浓度(离子强度)决定了带电荷的反胶 团的内表面以及带电荷的蛋白质分子表面被静 电屏蔽的程度。离子强度增加时,增大了离子 向反胶束内“水池”的迁移并取代其中蛋白质 的倾向,使蛋白质从反胶束内被盐析出来.因此, 低的离子强度有利于蛋白质的萃取,高的离子 强度有利于蛋白质的反萃取。
形成原因:由于高聚物之间的不相溶性,即高聚物分子 的空间阻碍作用,相互无法渗透,不能形成均一相,从而 具有分离倾向,在一定条件下即可分为二相。
常用的双水相体系
高聚物/高聚物体系:聚乙二醇(简称PEG) / 葡聚糖(简称Dextran) 高聚物/无机盐体系: 硫酸盐体系。常见的高聚物/ 无机盐体系: PEG/ 硫酸盐或磷酸盐体系。
持活性。
二、反胶团萃取原理
由于周围水层和极性基团的保护,保持了蛋白 质的天然构型,不会造成失活。
(a)水壳模型;(b)插入模型
反
(c)吸附模型;(d)溶解模型
胶
团
的
溶
解
模
型
❖ 蛋白质进入反胶团溶液是一协同过程。在有 机溶剂相和水相两宏观相界面间的表面活性 剂层 ,同邻近的蛋白质分子发生静电吸引而变 形 ,接着两界面形成含有蛋白质的反胶团 ,然 后扩散到有机相中 ,从而实现了蛋白质的萃取。 (可能机理)
原料颗粒的粒度:原料的颗粒度小,利于 萃取,但太小会出现堵塞或结块造成沟 流等不利现象;
萃取时间:增加萃取强度,可以缩短时间。 可能的机理是组分之间的“溶解互助” 效应,即先萃取出来的物质起到改性剂 的作用,增加了溶解能力。
第五章 萃取分离法
超临界流体萃取的应用
中药有效成分的提取。植物原料,生物碱、黄酮、 有机酸、皂苷、萜类、挥发油、糖类、油脂、氨 基酸、色素、鞣质、蛋白质、酶等,传统方法复 杂,流程长,SPE简单快速效率高。
【表面活性剂】在水或有机溶剂中自发形
成的聚集体。
胶团的形成——当向水溶液中加入表面活
性剂达到一定浓度时就会形成表面活性剂 聚集体,即胶团。
❖ 表面活性剂——是由亲水憎油的极性基团 和亲油憎水的非极性基团两部分组成的两 性分子。
❖ 表面活性剂的分类:
阴离子表面活性剂;阳离子表面活性剂; 非离子型表面活性剂。
(3)在贵金属分离中的应用
例如采用PEG2000-硫酸铵-偶氮胂双水相体系可以 分离Ti和Zr。
第五章 萃取分离法
5.4 超临界流体萃取
压力增大,P(Mpa)
supercritical fluid
纯
liquid
流动相密
物
度增加,
solid
质
溶剂力增
gas
大
的
相
T(oC)
图
临界点附近温度和压力的微小变化会引起密 度的显著变化,即溶解能力的显著变化。
正胶团是在极性溶液中形成的,
其亲水性的极性端向外指向极
性(如水)溶液,疏水性的非
极性“尾”向内相互聚集在一
起。
非极性的
“核”
极性“头” 非极性“尾”
非极性有 机溶剂
反胶团 是两性表面活性剂
在非极性有机溶剂中亲Βιβλιοθήκη 性基团自发地向内聚集而成的,
内含微小水滴。其疏水性的
非极性尾部向外,指向非极
性溶剂,而极性头向内,与
(5)低分子量化合物 (6)双水相体系的性质
黏度、两相密度差、表面张力、相间电势差、相分离 时间。
双水相萃取的应用
(1)在生物工程领域的应用
主要应用于生物物质,如酶、核酸、生长激素、 病毒等的分离纯化。常用的是PEG-葡聚糖双水相 体系。
(2)在中草药有效成分分离中的应用
例如采用PEG6000-K2HPO4双水相体系分离中草药 中的黄岑苷和黄岑素。
胶团萃取
一、基本概念
胶团萃取——是被萃取物以胶团或者胶体形式从
水相被萃取到有机相的溶剂萃取方法。它既可用于 无机物的萃取,也可用于有机物的萃取。 ❖ 在无机物的方面:金属或其无机盐可以形成疏水胶 体粒子粒子进入有机相。 ❖ 被萃取物主要限于金、银、硫酸钡等, 溶剂主要限于氯仿、四氯化碳和乙醚等。
胶团——是双亲(即亲水又亲油)物质
双节线:把均相区和两相区域分隔开。 系线:连接双节线上两点的直线。
两相区
均相区
在同一条系线上的各点分成的两相具有相同的组成, 但体积比不同
临界点:当系线长度趋向于零时,即在图中的C点, 两相差别消失,任何溶质在两相中的分配系数均为 1,成为单相体系。
ATPS相图
双节线(bi-nodal):
图中的曲线。双节线以下的区域为均相区, 以上的区域为两相区,即ATPS 。
双水相萃取体系的影响因素
(1)高聚合物的分子量和浓度
A、高聚合物分子量
对于PEG/Dextran所形成的双水 相体系中,若降低PEG相对分子质量, 则生物分子分配于富含PEG的上相中, 使分配系数增大;而降低Dextran相 对分子质量,则分配系数减小。
若想在上相获得较高的蛋白质收 率,对于PEG聚合物,应降低它的平 均分子量,相反,若想在下相获得较 高的蛋白质收率,则平均分子量应增 加。
