化工原理:4液体的精馏
化工原理精馏知识点总结

化工原理精馏知识点总结一、精馏原理概述精馏是一种通过升华和凝华的方法来分离液体混合物组分的技术,通过升华和凝华的过程可以使组分分离,最终获得纯净的组分产品。
精馏是一种重要的分离技术,在化工生产中得到广泛应用。
精馏的基本原理是依靠物质的汽化、冷凝和重新汽化等过程来实现组分的分离。
混合物在加热后,其中的易挥发成分首先汽化,形成蒸汽,然后在冷凝器中冷凝成液体,从而获得纯净的组分。
通过将蒸汽重新加热、汽化和冷凝,可以进行多次分离,提高分离效果。
二、精馏塔结构和工作原理1. 精馏塔结构精馏塔是进行精馏操作的设备,其结构一般由一种或多种填料、提升子、冷凝器和再沸器等组成。
填料是用来增大塔内表面积和混合物与液体之间的接触面积,提升子是用来提高温度场,从而使混合物更容易汽化。
冷凝器则是用来将蒸汽冷凝成液体,再沸器是用来将再次汽化的液体加热成蒸汽。
2. 精馏塔工作原理精馏塔是通过在填料层内和填料层与液体流动层之间的传质作用实现气液两相的接触混合。
填料层利用填料表面积大、气液接触面积大和液膜传质效果高的特点,以实现气液两相的有效滞留和有效接触,从而提高气相和液相之间的传递速率。
从而实现混合物组分的分离。
三、精馏操作过程及控制方法1. 精馏操作过程(1)进料进料是指将需要分离的混合物输入到精馏塔中。
进料的温度、压力和流量等参数对分馏操作的影响很大,需要注意调节。
(2)加热加热是将混合物中易挥发成分加热至其汽化温度的过程。
通常使用蒸汽加热或电加热等方式来进行加热。
(3)蒸馏蒸馏是指将加热后的混合物通过精馏塔,在填料层内和填料层与液体流动层之间进行传质过程,以实现组分的蒸发和再凝结的过程。
(4)冷凝冷凝是指将产生的蒸汽通过冷凝器使之冷却成液体,从而得到纯净的组分。
冷凝器通常采用水冷或风冷等方式来进行冷却。
2. 精馏操作控制方法(1)温度控制保持适当的加热温度是进行精馏操作的关键,通过合理控制加热温度,可以使易挥发组分蒸发,而留下不易挥发组分。
化工原理实验—精馏

化工原理实验—精馏1. 概述精馏是一种常用的分离技术,广泛应用于化工工艺中。
它通过将混合液加热至蒸发,然后在冷凝器中冷却并凝结回液体,从而实现混合物中组分的分离。
本实验旨在通过精馏实验,掌握精馏原理、操作步骤和相关设备的使用方法。
2. 实验原理2.1 精馏原理精馏是基于液体混合物中各组分的不同沸点而进行的分离过程。
在加热的作用下,沸点较低的组分会先蒸发,经过冷凝器冷却后变为液体回流,而沸点较高的组分则会滞留在容器中。
通过收集冷凝后的液体,我们可以分离出混合物中的不同组分。
2.2 实验设备在精馏实验中,主要使用以下设备:•加热设备:电热板、油浴等;•冷凝器:通常采用水冷型冷凝器,通过循环冷却水实现液体冷凝;•分馏柱:用于增加接触面积,提高分离效果;•采样装置:用于采集样品,检测组分浓度等。
2.3 操作步骤精馏实验的基本步骤如下:1.准备实验设备:包括加热设备、冷凝器、分馏柱等;2.准备混合液:按照实验要求,将需要分离的混合液制备好;3.装配设备:将冷凝器安装在分馏柱上方,连接好相应的管道和热源;4.开始加热:逐渐加热混合液,将其中的沸点较低组分蒸发出来;5.冷却和回流:通过冷凝器使蒸发的组分冷却并凝结成液体,回流到容器中;6.收集液体:将回流液体收集,并记录途中温度和时间等相关数据;7.结束实验:实验完成后,及时关闭加热设备和冷凝器,整理实验装置。
3. 实验操作及数据记录3.1 实验设备准备首先,确保实验室环境安全,检查仪器设备是否齐全,并找到精馏实验所需的各种设备:•电热板:用来提供加热源;•分馏柱:用来增加接触面积,提高分离效果;•冷凝器:通常为水冷型冷凝器,确保冷却效果良好。
3.2 实验样品准备按照实验要求,取出需要分离的混合液样品。
注意记录样品的成分和浓度等信息。
3.3 装配设备将冷凝器安装在分馏柱上方,并连接好相应的管道和热源。
确保连接紧密,无泄漏。
3.4 开始实验1.打开电热板,设置适当的加热温度;2.将混合液置于分馏烧瓶中,放入加热设备中;3.监测温度变化:通过温度计等工具,记录样品温度的变化。
化工原理课件 9.4 精馏

q [rF cP (tb tF )] rF
b. 饱和液体进料(泡点进料) 饱和液体温度等于泡点
iF i
q 1
V V
0 q 1
L LF
c.汽液混合物进料 汽液混合物的温度介于泡点和露点之间
i iF I
V V
LL
q=x(液相分率) 已知进料中汽相与液相的摩尔数之比为2:1,轻组分的摩尔分 数为0.55,则q=_____. A. 1/3 B. 0.55 C.不能确定
传质单元高度
精 馏
实 际 塔 板 数
理论板数
反映分离任务的难易, 与设备型式无关
反映设备效能的高低
全塔效率
④塔板物料、热量衡算及传递速率的最终简化 引入理论板的概念及恒摩尔流假设使塔板过程的物料衡 算、热量衡算及传递速率最终简化为 物料衡算式
Vy n1 Lxn1 Vy n Lxn
相平衡方程
LL q F 以1kmol/h进料为基准,提馏段中的液体流量较精馏段的液 体流量增大的kmol/h数即为q值
L L qF
V V (1 q)F
I iF q I i
iF i I
q 1
L L qF
V V, L L
V V (1 q)F
a. 过冷液体进料 过冷液体温度低于泡点
I iF q I i
L L qF
V V (1 q)F
d.饱和蒸汽进料(露点进料) 饱和蒸汽的温度等于露点
iF I
q0
V V F
LL
e.过热蒸汽进料(过热蒸汽的温度高于露点)
iF I
q0
V V, L L
q cP (tF td ) rF
化工原理精馏实验

化工原理精馏实验化工原理精馏实验是化工工程中的一项重要实验内容,它主要用于分离和提纯混合物中的组分。
本文将介绍化工原理精馏实验的基本原理、实验步骤以及实验中需要注意的事项。
1. 实验目的化工原理精馏实验的主要目的是通过温度差异,利用液体蒸汽和凝结的原理,将混合物中的组分分离并得到纯净的产品。
通过这个实验,我们可以了解精馏作为一种分离技术的原理和应用。
2. 实验原理化工原理精馏实验的基本原理是利用混合物中各组分的不同沸点,通过升温使其中具有较低沸点的组分先蒸发,然后通过冷凝使其变为液体,从而实现分离。
在实验过程中,我们需要使用精馏塔,该塔内部设置有填料,用于增加混合物和蒸汽之间的交流面积,并实现更充分的分离。
3. 实验步骤(1) 准备实验所需设备和药品,包括精馏装置、混合物、填料等。
(2) 将混合物加入精馏瓶中,并将瓶塞密封。
(3) 将冷凝管和进料管连接到精馏瓶上,确保连接牢固。
(4) 将精馏瓶放入加热设备中,逐渐升温。
(5) 观察精馏瓶内的液体是否开始蒸发,当温度上升到某一点时,开始收集冷凝液。
(6) 根据实验需要,调整加热温度和收集冷凝液的时间,以实现所需组分的分离和提纯。
4. 实验注意事项(1) 在进行化工原理精馏实验前,需先对所需设备进行检查和清洁,确保实验过程的安全性。
(2) 在实验操作中,热量的传递速度会影响分馏过程的效果,因此需要掌握合适的加热速率。
(3) 为了避免精馏烧坏填料或其他设备,需要控制温度,确保温度在安全范围内。
(4) 实验结束后,应将设备进行清洗和消毒,防止残留物对下次实验的影响。
5. 实验结果分析通过化工原理精馏实验,可以得到分离出的纯净组分,并进行定量分析。
根据实验结果,可以进一步探讨精馏的分离效果、提纯效率等指标,并对所得纯净组分进行性质分析。
总结:化工原理精馏实验是一项重要的实验内容,通过实验可以了解精馏作为一种分离技术的原理和应用。
在实验过程中,需要注意设备的清洁和安全操作,合理控制加热温度和加热速率,以达到较好的分馏效果。
化工原理复习必看 第9章_液体精馏(定稿)
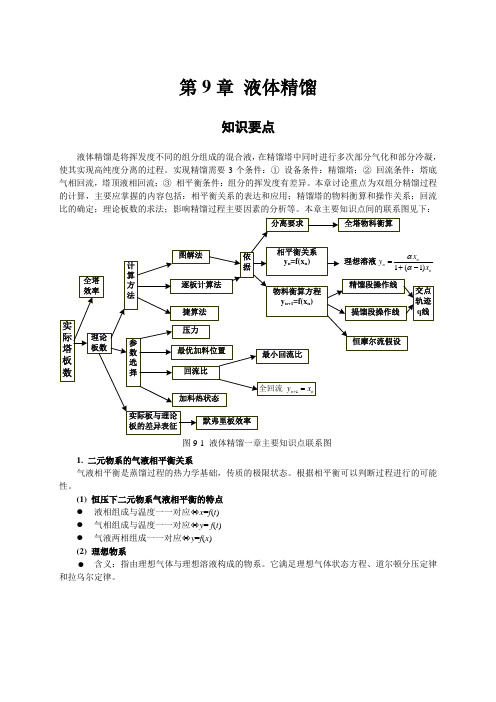
第9章液体精馏知识要点液体精馏是将挥发度不同的组分组成的混合液,在精馏塔中同时进行多次部分气化和部分冷凝,使其实现高纯度分离的过程。
实现精馏需要3个条件:①设备条件:精馏塔;②回流条件:塔底气相回流,塔顶液相回流;③相平衡条件:组分的挥发度有差异。
本章讨论重点为双组分精馏过程的计算,主要应掌握的内容包括:相平衡关系的表达和应用;精馏塔的物料衡算和操作关系;回流比的确定;理论板数的求法;影响精馏过程主要因素的分析等。
本章主要知识点间的联系图见下:图9-1 液体精馏一章主要知识点联系图1. 二元物系的气液相平衡关系气液相平衡是蒸馏过程的热力学基础,传质的极限状态。
根据相平衡可以判断过程进行的可能性。
(1) 恒压下二元物系气液相平衡的特点●液相组成与温度一一对应⇔x=f(t)●气相组成与温度一一对应⇔y= f(t)●气液两相组成一一对应⇔y=f(x)(2) 理想物系含义:指由理想气体与理想溶液构成的物系。
它满足理想气体状态方程、道尔顿分压定律和拉乌尔定律。
拉乌尔定律相对挥发度/1/1A A A B B B p x y xp x y xναν-===⋅- (9-1)11y xy xα-=⋅- (气相服从道尔顿分压定律) 相对挥发度α愈是大于1 ,则y 愈是大于x ,物系愈容易分离。
● 泡点方程x -toB ooA Bp p x p p -=- (9-2) ● 露点方程y -to A BA A Bp p p y p p p -=⋅- (9-3) ● 相平衡方程y-x()11xy xαα=+- (9-4)● t -y (x )相图两端点A 与B :端点A 代表纯易挥发组分A(x =1),端点B 代表纯难挥发组分B(x =0)。
两线:t -x 线为泡点线,泡点与组成x 有关;t-y 线为露点线,露点与组成y 有关。
3区:t -x 线以下为过冷液体区;t-y 线以上为过热蒸汽区;在t-x 与t -y 线之间的区域为气液共存区,只有体系落在气液共存区才能实现一定程度的分离。
化工原理精馏实验数据处理

化工原理精馏实验数据处理1. 引言化工原理精馏实验是化工专业中非常重要的实验之一。
在精馏实验中,通过分离液体混合物中的组分,得到纯净的产品。
实验过程中需要收集大量的实验数据,并对这些数据进行处理和分析。
本文将详细探讨化工原理精馏实验数据处理的方法和技巧。
2. 实验目的化工原理精馏实验的目的是通过精馏过程将液体混合物中的组分分离出来。
实验数据处理的目的是对实验数据进行整理、分析和解释,以得到有关精馏过程的关键信息和结果。
3. 实验数据处理方法在化工原理精馏实验中,我们需要收集的实验数据包括温度、压力、流量等参数的变化情况。
为了对这些数据进行处理,我们可以采用以下方法:3.1 数据的整理和筛选首先,我们需要对收集到的实验数据进行整理和筛选。
将不符合要求或有误差的数据排除,确保数据的准确性和可靠性。
3.2 数据的统计和分析接下来,我们可以对整理后的数据进行统计和分析。
可以计算平均值、标准差、方差等统计指标,以了解数据的分布情况和稳定性。
3.3 数据的可视化为了更直观地展示数据的变化趋势和关系,我们可以将数据进行可视化处理。
可以使用图表、曲线图、散点图等方式来展示数据,以便更好地理解和解释实验结果。
4. 实验数据处理的意义和应用实验数据处理在化工原理精馏实验中具有重要的意义和应用。
通过对实验数据的处理,我们可以得到以下信息和结果:4.1 组件的分离效果通过对实验数据的分析,我们可以判断精馏过程中组分的分离效果。
可以通过计算馏分的组分含量、回收率等指标来评估分离效果的好坏。
4.2 工艺参数的优化实验数据处理还可以帮助我们优化精馏过程中的工艺参数。
通过分析数据,我们可以找到影响分离效果的关键因素,并对工艺参数进行调整和优化,以提高产品的纯度和产量。
4.3 实验结果的验证实验数据处理还可以用于验证实验结果的准确性和可靠性。
通过对实验数据的处理和分析,我们可以判断实验结果是否符合预期,从而对实验方法和操作进行改进和优化。
化工原理精馏PPT课件
D,xD
•
(xD,xD)
3
(二) 提馏段操作线方程
总物料衡算:L=V+W
m Lxm V ym+1
m+1
易挥发组分衡算 :Lxm= Vym+1+ WxW
yN
ym 1LL Wxm LW WxW 或 ym 1V Lxm V WxW
N xN
V
LxN
W,xw
提馏段操作 线方程
•(xW,xW)
4
【例1】在连续精馏塔中分离某理想二元混合物。已知原料液流量 为100kmol/h,组成为0.5(易挥发组分的摩尔分率,下同),提馏 段下降液体量与精馏段相等,馏出液组成为0.98,回流比为2.6。若 要求易挥发组分回收率为96%,试计算: (1) 釜残液的摩尔流量; (2) 提馏段操作线方程。
IV IL
(1)饱和液体进料——泡点进料
LV F
此时,IF=IL
q=1
原料液全部与精馏段下降液体汇合进入 提馏段。
L V
饱和液体
L =L+F
V =V
11
(2)饱和蒸汽进料
IF=IV
q=0
q IV IF IV IL
原料全部与提馏段上升气体汇合进入 精馏段。
L =L V=V +F
(3)冷液进料
内容回顾
一、精馏原理
(1)无中间加热及冷凝器的多次部分气化和多次部分冷凝 (2)顶部回流及底部气化是保证精馏过程稳定操作的必不可 缺少的条件。 (3)精馏操作流程 (4)相邻塔板温度及浓度的关系
tn1tntn1 xn1xnxn1 yn1ynyn1
1
二、理论塔板
三、恒摩尔流假定 四、全塔物料衡算
《化工原理》气液平衡 _液体精馏
第7章 液体精馏
7.4.2 物料衡算-操作线方程
1.全塔的物料衡算 对图7-8所示的间接 蒸汽加热的连续精馏塔 作全塔物料衡算,并以 单位时间为基准,源自图7-7 精馏塔的物料衡算
16
第7章 液体精馏
则总物料 易挥发组分 F=D+W FxF=DxD+WxW (7-12) (7-12a)
式中 F-原料液流量(kmol/s); D-塔顶产品(馏出液)流量(kmol/s); W-塔底产品(釜残液)流量(kmol/s); xF-原料液中易挥发组分的摩尔分率; xD-馏出液中易挥发组分的摩尔分率; xW-釜残液中易挥发组分的摩尔分率。
18
第7章 液体精馏
图7-8 精馏段操作线方程的推导
19
第7章 液体精馏
将式7-15代入式7-15a,并整理得:
y n +1 L D = xn + xD L+D L+D
(7-16)
若将上式等号右边的两项的分子和分母同时除以D,可得:
y n +1 = L/D 1 xn + xD L / D +1 L / D +1
13
第7章 液体精馏
7.4 双组分连续精馏的计算
精馏过程的计算可分为设计型和操作型两类。本章重点 讨论板式塔的设计型计算。精馏过程设计型计算,通常已知 原料液流量、组成及分离程度,需要计算和确定的内容有: ①选定操作压强和进料热状态等; ②确定产品流量和组成; ③确定精馏塔的理论板数和加料位置; ④选择精馏塔的类型,确定塔径、塔高和塔板结构尺寸,并 进行流体力学验算; ⑤计算冷凝器和再沸器的热负荷,并确定两者的类型和尺寸。
14
第7章 液体精馏
7.4.1 理论板的概念及恒摩尔流的假定
化工原理第九章液体精馏
FiF Li V I Li VI
由恒摩尔假定,不同温度和组成的饱和液体焓i和汽 化潜热均相等。
20
联立上二式,得 定义:
L L I iF F I i
q
I iF分子:1kmol原料变成饱和蒸气所需的热 I i 分母:原料的摩尔汽化热
可得
L L qF
V V (1 q)F
q为加料热状态参数 q=0,饱和气体(露点);q=0,饱和液体(泡点) q<0,过热蒸气;0<q<1,气液两相,q>1,冷液
不管加料板上状态如何,离开加料板的两相温度相
等,组成互为平衡。
V,I,ym
L,i,xm-1
物料衡算式
F,iF,xF
FxF V ym1 Lxm1 Vym Lxm 相平衡方程
ym f (xm )
3)精馏段和提馏段流量的关系
V’,I,ym+1
L’,i,xm
列加料板物料和热量衡算式
F LV LV
临界压强时,气液共存区 缩小,分离只能在一定范 围内进行,不能得到轻组 分的高纯度产品。
8
9.3 平衡蒸馏和简单蒸馏
D
9.3.1 平衡蒸馏
令W q, F
则D 1q F
物料衡算:F xF D y W x
F
F DW
xF
联立得:y q x xF q 1 q 1
热量衡算:忽略组成对比热影响,
2)对理想物系
A / B
pA / xA pB / xB
p
0 A
xA
/
xA
pB0 xB / xB
pA0
pB0
3)对物系相对挥发度 1和相差2 不大
m
1 2
(1
《化工原理精馏》课件
精馏流程图
• 流程图:精馏流程图展示了精馏 操作的全过程,包括原料的预处 理、加热、蒸发、冷凝、回流等 步骤。通过流程图可以直观地了 解精馏操作的过程和原理,有助 于更好地理解和掌握精馏技术。
02 精馏塔设备
精馏塔类型
板式塔
塔内装有多层塔板,液体在塔板上完成汽化与回流,实现分 离。
填料塔
塔内装有填料,液体沿填料表面流下,与上升气体进行接触 传质。
低温余热利用
利用低温余热驱动精馏过程,减少对新鲜能源的依赖 。
废气处理技术
采用吸附、吸收、催化燃烧等方法处理废气,降低污 染物排放。
新型精馏技术
分子蒸馏
利用高蒸气压下分子间的平均自由程大于蒸馏 器结构尺寸的特点,实现高效分离。
反应精馏
在精馏过程中进行化学反应,实现产物的高效 分离和转化。
膜分离技术
据具体工艺要求进行选择和控制。
苯精馏案例
总结词
苯精馏是石油化工中重要的分离过程,其工 艺流程和操作条件较为复杂。
详细描述
苯精馏的目的是从石油裂解气中分离高纯度 的苯产品。原料经过预处理后进入精馏塔, 在塔内通过多次汽化和冷凝操作,将苯与其 他组分分离。操作过程中需严格控制温度、 压力、进料位置和回流比等参数,以保证苯 产品的质量和收率。
精馏操作优化
04
操作参数优化
01
塔板数优化
根据物料性质和分离要求,合理选择塔板数,以提高分 离效率和产品质量。
02
进料位置优化
通过调整进料位置,改善物料在塔内的分布,提高传热 和传质效率。
03
回流比优化
根据操作条件和分离要求,合理调整回流比,以平衡能 耗和分离效果。
节能减排技术
热集成精馏
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、拉乌尔定律 (Raoult's Law)
实验表明,理想溶液的气液平衡关系遵循拉乌尔定律,
即: 在一定温度下,气相中任一组分的分压等于此
纯组分在该温度下的饱和蒸汽压与它在溶液中的摩
尔分率的乘积。
pA
p
0 A
x
A
pB pB0 xB pB0 1 xA
道尔顿分压定律 pA PyA
越往上易挥发组分含量越高,越往下难挥发组分含量越高。
鞍环填料 阶梯环填料
鲍尔环填料
第四节 双组分连续精馏的分析和计算
一、理论板的概念及恒摩尔流假定 1、理论板:离开这块板的气液两相互成平衡,而且塔板上 的液相组成也可视为均匀一致。
yn f xn
2、恒摩尔流假定
(1)恒摩尔汽化:在精馏塔的精馏段内每层塔板的上升 蒸汽摩尔流量都是相等的,提馏段亦然。但两段的上 升蒸汽摩尔流量不一定相等。
吸收:利用混合气体中各组分在液体中溶解度 差异,从而实现混合气体的分离。
蒸馏:利用液体混合物中各组分挥发性的不同, 把液体混合物中各组分达到某种程度分离的单 元操作。
三、蒸馏依据
原理:将液体混合物部分气化,利用混合物中各组分的挥发度不同 使各组分得以分离。 其中沸点低的组分为易挥发组分(轻组分)
泡点:一定组成的液体,在恒压下加热的过程中, 出现第一个气泡时的温度
p p0
xA
PA0
B
PB0
用途:(1)已知泡点,计算液相组成。 (2)已知液相组成求泡点。 X=f(pt)
2、露点方程-总压一定时汽相组成与温度(露点)的关系式
露点:在压力一定的情况下,开始从气相中分离出第 一滴液滴的V2’=V’3=…=V’n=V’
(2)恒摩尔溢流:在塔的精馏段内,每层塔板下降的液
体摩尔流量都是相等的,提馏段亦然。但两段的液体
摩尔流量不一定相等。
L1 =L2 =…=Ln=L
L1’=L2’=L3’=…=Ln’=L’
3、恒摩尔流假定成立的条件:
(1) 各组分的摩尔气化潜热相等。
馏 段
精馏塔
V 回馏液L
全凝器
馏出液D Distillate
进料板 蒸气V
F,D,V,L,W均为摩尔流量
[mol/s] [mol/h]
再沸器
馏残液W Waster
精馏塔
冷却器
精馏段
精馏是多次而且同时运用部分气 化和部分冷凝的方法,使混合液 较完全分离,获得接近纯组分的 单元操作。
提馏段
精馏设备由精馏塔、冷却 器和再沸器等构成;加料 板;精馏段;提馏段
2. 气液相平衡图(y—x图)
t—x—y 图
y —x 图
y2
t1
y1
t2
x x y1 y2
xx
对相于浓大度多 ,1 数故溶平2液衡,线达 位到于平对衡角时线,上气方相。轻平组衡1 分线的偏浓离度对2 总角大线于愈液远,
该溶液愈易分离。
六、 挥发度及相对挥发度
1. 挥发度ν:
表示某种溶液易挥发的程度。若为纯液体时,通常用其当时 温度下饱和蒸气压来表示,如PA0。若为溶液时,各组分的挥发 度,则用它在一定温度下蒸气中的分压和与之平衡的液相中该组 分的 摩尔分率之比来表示,
2. 传质分离 被分离物为均相混合物,设法将均相变为非均相, 利用物系中不同组分间某种物性的差异来分离, 如蒸馏、吸收等。
3. 速控分离 对均相混和物,通过控制各组分的传递速率来分 离,如膜分离等。
二、传质分离
传质过程——物质以扩散的方式,从一相转移 到另一相的相界面的转移过程,称为物质的传 递过程,简称传质过程。
缺点:设备庞大,只适合大规模生产。
精馏塔
1、分类: 板式塔:泡罩塔、浮阀塔、筛板塔。 填料塔:塔内充填一定高度的填料。
2、塔板的作用:气液两相传质,传 热的场所。
板式塔
①、组成:
塔体、塔板(填料)、再沸器、冷凝器。
②、温度分布规律:
塔底温度最高,越往上温度越低,塔顶温度最低。
③、气液组成的变化规律;
A pA / xA
B
pB / xB
压力不太高时
p yA / xA
p yB / xB
yA xA
yB
xB
理 想 溶 液
p
0 A
/
pB0
3. 气液相平衡方程(用
相对挥发度表示):
可求得 x-y 关系的方程,称
为气液平衡方程。
yA xA
1 yA
1 xA
y x 1 ( 1)x
在外压不变(一般为常压)时,设双组分(A, B)溶 液中:
A : 沸点低,易挥发,称为轻组分; B :沸点高, 难挥发,称为重组分; xA, xB : 分别为液相中A,B 的摩尔分率; yA, yB : 分别为气相中A,B 的摩尔分率;
pA, pB : 分别为纯A,B的饱和蒸气压;
pA, pB : 分别为平衡分压。
总物料流衡算: . Vi1 Li1 Vi Li (c)
(c )
易挥发组分衡算:Vi1 yi1 Li1xi1 Vi yi Li xi (d)
c、d两式可以同时满足,称为稳定操作
3、精馏塔与提馏塔
4、中间进料现代化精馏塔
精馏流程图:
塔板1
精
2
馏
段
进料F Feed
提
习惯上以 x 表示液相中易挥发组分的摩尔分率,以(1-x)表 示难挥发组分的摩尔分率;以y表示气相中易挥发组分的摩尔 分率,以(1-y)表示难挥发组分的摩尔分率。
四、泡点方程与露点方程
1、泡点方程-总压一定时液相组成与温度(泡点)的关系式
pA =pA0xA pB = pB0xB
p = pA+ pB =pA0xA+ pB0 xB = PA0xA+PB0(1-xA)
第一节 概述
典型的化工生产装置包括: 反应器;原料、中间产物和产品的分离设备;泵、换热器;
原料 预处理 反应 分离 粗产品 精制 产品
分离工程
三废处理
分离贯穿化工过程,占有十分重要的地位。 分离过程的费用占总投资的50~90%。
一、分离过程
1. 机械分离 被分离物为非均相混合物(两相或三相) 可用机械来进行分离,如过滤、离心等。
精馏塔各截面的 α变化不大可视为常数,计 算可取平均值 当α=1时,y=x ,不能用普通精馏方法分 离该混合物。 当α>1时,y>x ,能用普通精馏方法分离该 混合物, α越大,越易分离。
【例4-1】已知正戊烷(A)及正己烷(B)在不同温 度下的饱和蒸汽压,求平均相对挥发度。正戊烷及正 己烷的沸点分别为36.1 ℃和68.7 ℃。(50℃:pA0 =159.16 kPa pB0=54.04 kPa; 55℃: pA0 = 185.18 kPa pB0 = 64.44 kPa )
2.87
内插法求52.4 ℃时的相对挥发度
t1 =50℃ α1 = 2.95
t2 = 55℃ α2 = 2.87
t = 52.4℃
1
2 1
t
(t
t1 )
2.95 2.87 2.95 (52.4 50) 5
2.9084
相平衡方程
y x 2.9084 x 1 ( 1)x 11.9084 x
(2) 气液接触因温差交换的显热可以忽略。
(3) 塔设备保温良好,热损失可以忽略。
二、全塔物料衡算
1、物料衡算式:总物料衡算 F=D+W
易挥发组分衡算 FxF Dx D WxW
本章主要讨论常 压下双组分连续 精馏
制酒作坊装置
y A ——蒸汽中乙醇所占的摩尔分率
乙醇的摩尔数 yA 乙醇的摩尔数 水的摩尔数
xA ——液相中乙醇所占的摩尔分率
yA xA
第二节 双组分溶液的气液相平衡
一、理想溶液的概念 根据溶液中同分子间的与异分子间的作用力的
差异,可将溶液分为理想溶液和非理想溶液两 种。
【例4-2】总压为101.3kPa时正庚烷和正辛烷的饱和蒸汽压 和温度的关系数据如下表所示。试求出该体系的平均相对 挥发度。
t K
371.4
正庚烷
p
o A
kPa
101.3
378 125.3
383 140.0
388 160.0
393 180.0
398.6 205.0
正辛烷
p
o B
kPa
回流作用:塔顶液体回流和塔底 汽相回流为塔板上汽液两相进行
再沸器 部分冷凝和部分汽化提供需要的
热量和冷量,是保证精馏操作的 必要条件
连续精馏操作特点
优点:操作条件稳定不变,便于控制,产品质 量稳定,容易实现自动化;可以节省辅助时间, 设备利用率高,生产能力大;利用换热设备可 以回收塔顶和塔底带出的热量,节约能量减少 损耗。
解:理想溶液的平均相对挥发度可用平均温度下 的饱和蒸汽压求取,
平均温度 t = ( 36.1+ 68.7) / 2 =52.4 ℃
50℃ pA0 =159.16 pB0=54.04 α1 = pA0 / pB0=159.16 / 54.04 =2.95
55℃ pA0 = 185.18 pB0 = 64.44 α2 = pA0 / pB0 =185.18 / 64.44 =
νA = pA / xA
νB = pB / xB
νA 、νB — 组分A、B 的挥发度。
对理想溶液,符合拉乌尔定律
νA = pA / xA = pA0 xA / xA = pA0
νB = pB0 ** 理想溶液中, 各组分的挥发度等于其饱和蒸汽压.
