武强县一中2018-2019学年高二9月月考化学试题解析
武强县高级中学2018-2019学年高二上学期第一次月考试卷化学

武强县高级中学2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是()A.锌片为正极,且锌片逐渐溶解B.铜片为负极,且铜片上有气泡C.溶液中的H+移向铜极D.该电池工作的过程中溶液的酸性始终不变2.【2017届四川省成都市高三第二次模拟】某化学小组欲通过实验探究:I.苯与液溴发生取代反应;Ⅱ.苯与液溴在催化剂作用下的反应机理。
所用装罝如图所示。
已知:MnO2+2NaBr+2H2SO4Br2↑+MnSO4+Na2SO4+2H2O(1)实验室制备溴苯的化学方程式为___________________;仪器X的名称为___________。
(2)制取溴苯的实验操作步骤如下:①连接装罝,其接口顺序为(填字母):d接____,_____接_____,______接c;②检査装置气密性;③C中加入固体药品,_______,再打开D处开关K,点燃C处酒精灯;插入铁丝于混合液中,一段时间后,D中液体沸腾,原因是_________ ;④关闭C中活塞。
(3)A中对广口瓶进行热水浴的目的是_______________。
(4)若B中有淡黄色沉淀生成,能否确定苯与液溴发生了取代反应?_____(答“能”或“否”)。
(5)査阅文献:苯与液溴在FeBr3催化下的反应机理共分三步:I Br2+FeBr3Br++FeBr4-Ⅱ①请完成第三步反应:Ⅲ__________________________;②该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能原因是__________。
3.乙醇分子中不同的化学键如下图所示,对乙醇在各种反应中应断裂的键说明错误的是()A.和金属钠作用时,键①断裂B.在Cu的催化作用下和O2反应时,键①和③断裂C.与乙酸、浓硫酸共热发生酯化反应时,键②断裂D.与乙酸、浓硫酸共热发生酯化反应时,键①断裂4.有4种有机物:④CH3-CH=CH-CN,其中可用于合成结构简式为的高分子材料正确的是()A.①③④B.①②③C.①②④D.②③④5.设N A为阿伏加德罗常数值,下列有关叙述正确的是A.1.8gH2O与CH2D2的混合物中所含质子数为N AB.1mol甲烷或白磷(P4)分子中所含共价键数均为4N AC. 1mol CH3COOC2H5在稀硫酸溶液中水解可得到乙醇分子数为N AD.25℃时,l L pH=1的H2SO4溶液中含有的H+数为0.2N A6.下列对反应热的描述中,正确的是()A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H =-890.3 kJ·mol-1B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H =-2a kJ·mol-1C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l)=2H2(g)+O2(g)△H =+571.6 kJ·mol-1D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量为57.3kJ7.有一铁的氧化物样品,用50mL5mol/L的盐酸恰好完全溶解,所得溶液还能与通入的0.56L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O78.下列说法不正确的是()A.光照下,1 mol甲烷和氯气完全取代需要2 mol氯气B.在一定条件下苯与液溴、浓硫酸、浓硝酸分别发生取代反应能生成溴苯、苯磺酸和硝基苯C.CH3COOCH2CH3和CH3CH2OOCCH3具有相同的沸点D.CH3CHO、HCOOH、HCOOCH3都能发生银镜反应9.现有一组有机物,其转化关系如图所示,转化关系中部分反应物和产物省略,涉及的化学反应均源于教材。
武强县一中2018-2019学年高二上学期第一次月考试卷化学(1)

武强县一中2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.【2017年浙江省高三“超级全能生”3月联考】下列说法正确的是()A.淀粉溶液和蔗糖溶液都有丁达尔现象B.天然高分子化合物如糖类、油脂、纤维素都是人类重要的营养来源C.酶是具有催化作用的蛋白质,在光、热、酸、碱、重金属离子、乙醇等作用下会失去活性D.一定条件下,等物质的量的乙醇和乙酸分别与足量的Na反应,乙酸产生的氢气体积多2.在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)3Z(g),反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
下列推断正确的是()A.Q点时,Y的转化率最大B.W点X的正反应速率等于M点X的正反应速率C.升高温度,平衡常数增大D.温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大3.下列气体溶解于水,发生氧化还原反应的是A.Cl2溶解于水B.SO3溶解于水C.SO2溶解于水D.CO2溶解于水4.下图是某有机物分子的简易球棍模型,该有机物中含C、H、O、N四种元素。
下列关于该有机物的说法中错误的是()A.分子式为C3 H7O2N B.能发生取代反应C.能通过聚合反应生成高分子化合物D.不能跟NaOH溶液反应5.下列叙述不正确的是A.甲苯分子中所有原子在同一平面上B.苯、乙酸、乙醇均能发生取代反应C.分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)D.可用溴的四氯化碳溶液区别和6.下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是A.乙组操作时,C2做正极B.乙组操作时,C1上发生的电极反应为I2+2e-═2I-C.甲组操作时,电流表(G)指针发生偏转D.甲组操作时,溶液颜色变深7.【2017新课标1卷】已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是()A.b的同分异构体只有d和p两种B.b、d、p的二氯代物均只有三种C.b、d、p均可与酸性高锰酸钾溶液反应D.b、d、p中只有b的所有原子处于同一平面8.2017年春节期间,一种“本宝宝福禄双全”的有机物刷爆朋友圈,其结构简式如下:(-CHO,一种官能团,其名称为醛基),该物质的同分异构体中具有“本宝宝福禄双全”谐音且两个醛基位于苯环间位的有机物有()A.4种B.6种C.7种D.9种9.下列说法中正确的是()。
武陵源区高级中学2018-2019学年高二9月月考化学试题解析
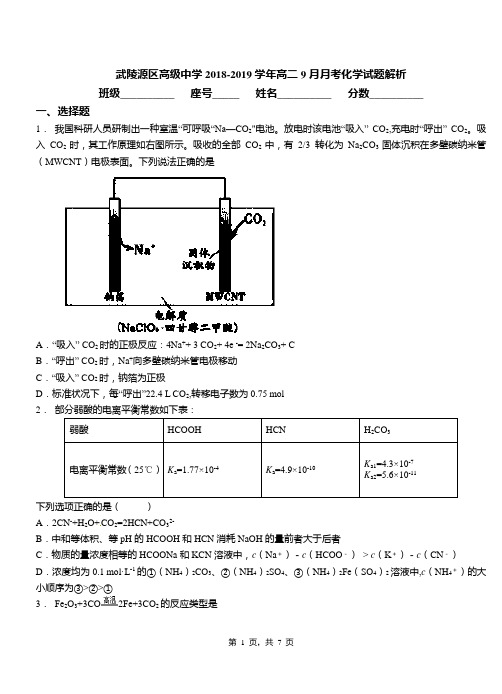
武陵源区高级中学2018-2019学年高二9月月考化学试题解析班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.我国科研人员研制出一种室温“可呼吸“Na—CO2"电池。
放电时该电池“吸入” CO2,充电时“呼出” CO2。
吸入CO2时,其工作原理如右图所示。
吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。
下列说法正确的是A.“吸入” CO2时的正极反应:4Na++ 3 CO2+ 4e -= 2Na2CO3+ CB.“呼出” CO2时,Na+向多壁碳纳米管电极移动C.“吸入” CO2时,钠箔为正极D.标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol2.部分弱酸的电离平衡常数如下表:A.2CN-+H2O+CO2=2HCN+CO32-B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)> c(K+)-c(CN-)D.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①3.Fe2O3+3CO2Fe+3CO2的反应类型是A .化合反应B .置换反应C .氧化还原反应D .复分解反应4. 某一有机物A 可发生下列变化:已知C 为羧酸,且C 、E 不发生银镜反应,则A 的可能结构有(不考虑立体异构) A .4种 B .3种 C .2种 D .1种5. 下列实验能达到实验目的且符合安全要求的是( )6. 用一种试剂能鉴别苯酚溶液、己烯、己烷、乙醇四种无色透明液体,这种试剂是( ) A .酸性KMnO 4溶液 B .饱和溴水 C .紫色石蕊溶液 D .FeCl 3溶液7. T K 时,向2.0L 恒容密闭容器中充入0.10molCOCl 2,发生反应 ()()()2211COC g C g CO g +,经过一段时间后反应达到平衡。
河北高二高中化学月考试卷带答案解析

河北高二高中化学月考试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.下列叙述错误的是( )A .乙烯和苯都能使溴水褪色,褪色的原因相同B .乙烯和甲烷可用酸性高锰酸钾溶液鉴别C .煤油可由石油分馏获得,可用作燃料和保存少量金属钠D .乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na 2CO 3溶液除去2.N A 为阿伏加德罗常数,下列说法正确的是( ) A .标准状况下,11.2L 的戊烷所含的分子数为0.5N A B .28g 乙烯所含共用电子对数目为4N AC .标准状况下,11.2 L 二氯甲烷所含分子数为0.5 N AD .现有乙烯、丙烯、丁烯的混合气体共14g ,其原子数为3N A3.下列各组中的反应,属于同一反应类型的是( ) A .由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 B .由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸C .由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷D .由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇4.下列最简式中,没有相对分子质量也可以确定分子式的是( ) ①CH 3 ②C 2H 5 ③C 2H 6O ④CH 2 A .①②③④ B .①②③ C .①②④D .②③5.含有一个三键的炔烃,氢化后的产物结构简式为:此炔烃可能有的结构简式为( ) A .1种 B .2种C .3种D .4种6.1999年,在欧洲一些国家发现饲料被污染,导致畜禽类制品及乳制品不能食用,经测定饲料中含有剧毒物质二恶英,其结构为,已知它的二氯代物有10种,则其六氯代物有( ) A .15种B .11种C .10种D .5种7.最近美国宇航局(NASA )马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C 3F 8),并提出用其“温室化火星”使其成为第二个地球的计划。
2018_2019学年高二化学上学期第二次月考试题(1)word版本

2018-2019学年度第一学期高二年级第二次月考化学试题可能用到的原子量:H:1 C:12 N:14 O:16 Al:27 Fe:56 Zn:65 第I部分选择题(共54分)一、选择题(每小题只有一个选项符合题意,每小题3分,共 54分)1.( )2.反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。
下列说法正确的是( ) A.a、c两点的反应速率:a>cB.a、c两点气体的颜色:a深、c浅C.a、b两点气体的平均相对分子质量:a>bD.b、c两点化学平衡常数:b<c3.用1.0mol· L-1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示。
原硫酸溶液的物质的量浓度和反应后溶液的总体积是( )A.1mol·L-1, 60mLB.0.5mol·L-1, 80mLC.0.5mol·L-1, 40mLD.1mol·L-1, 80mL4.图中C%表示某反应物在体系中的百分含量,v 表示反应速率,p表示压强,t表示反应表示时间。
图Ⅰ为温度一定时压强与反应速率的关系曲线;图Ⅱ为压强一定时,在不同时间C%与温度的关系曲线。
同时符合两个图像的反应是( )A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0B.N2O3(g) NO2(g)+NO(g);ΔH>0C.3NO2(g)+H2O(l) 2HNO3(aq)+NO(g);ΔH<0D.2CO(g) CO2(g)+C(s);ΔH<05.分别将下列物质:①Al2(SO4)3②NaHCO3③KCl④CuCl2⑤FeSO4溶于水中,对其溶液加热蒸干,仍能得到原物质的是( )A.①③④⑤ B.②④ C.①③ D.①③⑤6.稀氨水中存在着下列平衡:NH3·H2O NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是()①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
武陵源区第一中学校2018-2019学年高二9月月考化学试题解析

武陵源区第一中学校2018-2019学年高二9月月考化学试题解析 班级__________ 座号_____ 姓名__________ 分数__________一、选择题1. 某温度下HF 的电离常数Ka=3.3×10-4 ,CaF 2的溶度积常数Ksp=1.46×10-10。
在该温度下取浓度为0.31 mol·L -1的HF 与浓度为0.002 mol·L -1的CaCl 2溶液等体积混合。
下列说法正确的是 A .该温度下,0.31 mol·L -1的HF 溶液的pH=2 B .升高温度或增大浓度,HF 的电离平衡常数都将增大 C .两溶液混合不会产生沉淀D .向饱和的CaF 2溶液中加入少量CaCl 2固体后,溶度积常数Ksp 一定比之前减小2. 标准状况下VL 氨气溶解在1L 水中,所得溶液的密度为ρ g/ml ,质量分数为ω,物质浓度为c mol/L ,则下列关系中正确的是( )A .c=B .ω=C .ω=D .ρ=3. 关于苹果酸(2OHHOOC |CH COOH CH------)说法正确的是( )A .苹果酸不易溶于水而易溶于有机溶剂B .和苹果酸具有相同官能团的同分异构体只有1种C .1mol 苹果酸与足量NaOH 溶液反应时,最多消耗3mol NaOHD .1mol 苹果酸与足量NaHCO 3溶液反应时,最多可得44.8L CO 2(标准状况下) 4. 垃圾的再生利用是垃圾资源化的最佳途径。
某垃圾箱上贴有如右图所示标志, 应向此垃圾箱中丢弃的垃圾是A .废旧电池B .厨余垃圾C .危险废物D .可回收物5. 不论以何种比例混合,将甲和乙两种混合气体同时通入丙溶液中,一定能产生沉淀的组合是( )A .②③④B .②④C .①③D .②④⑤ 6. 下列物质中,既有离子键,又有共价键的是A.NaCl B.Ca(OH)2C.H2O D.CH47.下列说法正确的是A.葡萄糖制镜利用了葡萄糖的氧化性B.室温下,在水中的溶解度:乙醇> 苯酚> 乙酸乙酯C.酯在碱性条件下水解生成对应的酸和醇D.甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼8.一定条件下存在反应C(s)+H2O(g)CO(g) +H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化A.甲容器中,反应在前15 min的平均速率v(H2)=0.1mol·L-1·min-1B.丙容器的体积V>0.5 LC.当温度为T1 ℃时,反应的平衡常数K=4.5D.乙容器中,若平衡时n(H2O)=0.4 mol,则T2< T19.【新课标Ⅱ卷理综化学】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为()A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O510.一种合成某药物中间体Z的方法如下。
河北高二高中化学月考试卷带答案解析

河北高二高中化学月考试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.下列物质不属于有机物的是 :2.下列有机物在 H-NMR(核磁共振氢谱) 上只给出一组峰的是: A .HCHO B .CH 3OH C .HCOOHD .CH 3COOCH 33.燃烧等物质的量有机物A 和乙醇,消耗等量的氧气。
此时乙醇反应后生成的H 2O 是A 的1.5倍,而有机物A 反应后生成的CO 2是乙醇的1.5倍。
则有机物A 的分子式为( ) A .C 3H 4O B .C 2H 6O C .C 3H 4O 2 D .C 3H 6O 24.下列物质属于同系物的是 A .CH 3CH 2CH 2OH 与CH 3OH B .与C .乙酸与HCOOCH 3D .CH 3CH 2Cl 与CH 3CH 2CH 2Br5.A 、B 两种有机物组成的混合物,当其质量相等时,无论A 、B 以何种比例混合,完全燃烧时产生H 2O 的量均相等,符合这一条件的组合是①同分异构体 ②同系物 ③最简式相同 ④含氢质量分数相同 ⑤分子中氢原子数相同 ⑥分子中氢、氧原子数分别相同A .①②③B .①③④C .①⑤⑥D .②④⑥ 6.下列有机物不是同一种物质的是( ) A .和B .CH 2=CH —CH=CH 2和C .C(CH 3)3C(CH 3)3和CH 3(CH 2)3C(CH 3)3D .和7.可以准确判断有机化合物含有哪些官能团的分析方法是 A .质谱法 B .核磁共振氢谱法 C .元素分析仪D .红外光谱法8.现有乙酸、乙烯和丙烯(C 3H 6)的混合物,其中氧的质量分数为a,则碳的质量分数是: A .B .C .D .9.某有机物链状分子中含a 个甲基,n 个亚甲基(—CH 2—),m 个次甲基(),其余为羟基。
则羟基的个数为A .2n +3m -aB .n +m +aC .m +2-aD .m +2n +2-a10.新鲜水果、蔬菜、乳制品中富含的维生素C 具有明显的抗衰老作用,但易被空气氧化。
2018-2019学年度第一学期高二化学试题及答案(K12教育文档)

2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改) 2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改)的全部内容。
第1页共16 页2018-2019学年度第一学期高二化学试题及答案本试卷分第Ⅰ卷选择题和第Ⅱ卷非选择题,共100分,考试时间70分钟。
第I卷(选择题)一、选择题(本题共20道小题,每小题3分,共60分)1.下列说法不正确的是( )A. 人类在远古时代就通过燃烧植物的方式开始利用生物质能B。
氢能是理想的绿色能源,但人们只能将氢气的化学能转化为热能C。
煤中含有硫元素,大量的直接燃烧煤会引起酸兩等环境问题D。
太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热2.据报道,科学家开发出了利用太阳能分解水的新型催化剂.下列有关水分解过程的能量变化示意图正确的是()A.B.C.D .3.常温下,1mol化学键分解成气态原子所需要的能量用E表示.根据表中信息判断下列说法不正确的是()共价键H﹣H F﹣F H﹣F H﹣ClH﹣I E(kJ•mol﹣1)436157568432298 A.432 kJ•mol﹣1>E(H﹣Br)>298 kJ•mol﹣1B.表中最稳定的共价键是H﹣F键C.H2(g)→2H (g)△H=+436 kJ•mol﹣1第2页共16 页D.H2(g)+F2(g)=2HF(g )△H=﹣25 kJ•mol﹣14.下列热化学方程式,正确..的是()A。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武强县一中2018-2019学年高二9月月考化学试题解析班级__________ 座号_____ 姓名__________ 分数__________一、选择题1. 下列实验操作不能..达到实验目的的是A.①②B.①③C.③④D.②④2. 标准状况下VL 氨气溶解在1L 水中,所得溶液的密度为ρ g/ml ,质量分数为ω,物质浓度为c mol/L ,则下列关系中正确的是( ) A .c= B .ω=C .ω=D .ρ=3. N 2O 5是一种新型硝化剂,在一定温度下可发生下列反应:2N 2O 5(g )4NO 2(g ) + O 2(g ) △H =+Q kJ/mol O A .500s 内N 2O 5分解速率为6×10-3mol/(L·s ) B .该温度下的平衡常数K =125 C .反应达平衡时,吸收的热量为5Q kJD .其他条件不变,若开始时c (N 2O 5)=10mol/L ,则达平衡后c (N 2O 5)=5mol/L 4. 通过以下反应均可获取H 2。
下列有关说法正确的是①太阳光催化分解水制氢:2H 2O (l )=2H 2(g )+O 2(g ) △H 1=+571.6kJ·mol -1 ②焦炭与水反应制氢:C (s )+H 2O (g )=CO (g )+H 2(g ) △H 2=+131.3kJ·mo1-1③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ·mol-1A.反应①中电能转化为化学能B.反应②为放热反应C.反应③使用催化剂,△H3减小D.反应②中,反应物的键能大于生成物的键能5.工业上可由乙苯生产苯乙烯:,下列说法正确的是()A.该反应的类型为消去反应B.乙苯的同分异构体共有三种C.可用Br2/CCl4鉴别乙苯和苯乙烯D.乙苯和苯乙烯分子内共平面的碳原子数均为76.下列有关有机物的结构说法不正确的是()A.溴苯中的所有原子处于同一平面中B.氯乙烯中所有原子不可能处于同一平面中C.3-甲基戊烷的一氯代产物有4种(不考虑立体异构)D.分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)7.将16.8 g铁和0.3 mol Br2充分反应,加水溶解后过滤,向滤液中通入a mol Cl2。
下列叙述不正确的是A.当a=0.1时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-B.当a=0.45时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-C.若溶液中Br-有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)8.Cl2有毒,常用于自来水和游泳池的消毒杀菌。
已知硫氰[(SCN)2]的化学性质与Cl2的类似,被称为“拟卤素”,例如(SCN)2+2NaOH===NaSCN+NaSCNO+H2O,阴离子的还原性顺序为I->SCN->Br->Cl-。
下列说法中不正确的是()A.若Cl2、(SCN)2发生泄漏,均可喷洒石灰水进行处理B.KSCN与FeCl3溶液通常不发生氧化还原反应C.Cl2与KSCN溶液发生反应的离子方程式为Cl2+2SCN-===(SCN)2+2Cl-D.(SCN)2可以与KBr溶液发生反应:(SCN)2+2KBr===2KSCN+Br29.下列除杂或检验的方法正确的是A.向溶液中加入稀硝酸再加入氯化钡溶液产生白色沉淀说明有SO42-B.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+C.向溶液中加入过量的氨水先产生白色胶状沉淀后沉淀溶解说明有Al3+D.灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无法确定是否含K+10.五种常见物质的转化关系如图所示(部分反应物及产物略去),其中Q 、M 、N 含有某种相同的元素。
下列说法不正确的是A .若Q 为N 2,则X 可能为氢气B .若Q 为A1(OH )3,则Y 可能为稀硫酸C .若Q 为Fe,则Y 可能为稀硝酸D .若Q 为NaHCO 3,则X 可能为氢氧化钠溶液11.废水脱氮工艺中有一种方法是在废水中加入过量NaClO 使NH 4+完全转化为N 2,该反应可表示为4222NH 3ClO N 3Cl 2H 3H O +--++=+++。
下列说法中,不正确的是A .反应中氮元素被氧化,氯元素被还原B .还原性NH 4+< Cl -C .反应中每生成1 mol N 2,转移6 mol 电子D .经此法处理过的废水不可以直接排放 12.下列关于各图像的解释或结论不正确...的是A. 由甲可知:使用催化剂不影响反应热B. 由乙可知:对于恒温恒容条件下的反应,A 点为平衡状态C. 由丙可知:同温度、同浓度的HA 溶液比HB 溶液酸性强D. 由丁可知:将℃的A 、B 饱和溶液升温至℃时,A 与B 溶液的质量分数相等13.用一种试剂能鉴别苯酚溶液、己烯、己烷、乙醇四种无色透明液体,这种试剂是( ) A .酸性KMnO 4溶液 B .饱和溴水 C .紫色石蕊溶液 D .FeCl 3溶液14.现要配制0.1 mol/L 的Na 2CO 3溶液,下列操作导致所配溶液浓度偏高的是 A .称量时,左盘高,右盘低 B .定容时俯视容量瓶刻度线C .原容量瓶洗净后没有干燥D .摇匀后见液面下降,再加水至刻度线15.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是A. 反应混和物的浓度B. 反应物的转化率C. 正、逆反应速率D. 反应混和物的压强16.常温下,有甲、乙两份体积均为1L、浓度均为0.1mol·L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释到100L时,溶液的pH变为x;②乙与等体积、浓度为0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。
x、y的正确答案组合为A. 3<x<5、0.2B. 3<x<5、0.1C. 3、0.1D. 5、0.217.下列有关热化学方程式的叙述正确的是A.已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2B.已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=﹣890.3 kJ/molC.已知中和热为△H=﹣57.3 kJ/mol,则含0.5molH2SO4稀硫酸和足量稀Ba(OH)2溶液反应的放出57.3kJ的热量D.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定18.下列溶液中:①澄清石灰水②氯化钡溶液③KMnO4溶液④溴水⑤酸化的Ba(NO3)溶液⑥品红溶液⑦湿润的蓝色石蕊试纸⑧三氯化铁溶液⑨浓硫酸,不能用来区别SO2和CO2气体的是A.①②⑦⑨B.①③⑧C.①④⑤D.③④⑤⑥19.某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
的是下列说法不正确...A.必须在①②间添加吸收HCl的装置B.④的作用是防止空气中的气体影响实验的精确度C.通入空气的作用是保证②中产生的气体完全转移到③中D.称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度20.在一密闭容器中,充入一定量的反应物A ,反应达平衡后,保持温度不变,将容器体积缩到一半,当达到新的平衡时,B 的浓度是原来的1.6倍,则 A. 平衡向正反应方向移动了 B. 物质A 的转化率降低 C. 物质B 的质量增加D.二、填空题21.为了探究实验室制氯气过程中反应物与生成氯气之间量的关系,设计了如右图所示的装置。
(1)装置A 的名称是 。
(2)该实验装置检查气密性的方法是 。
(3)如果将过量二氧化锰与20mL 12mol/L 的盐酸混合加热, 充分反应后收集到的氯气少于0.06mol ,其可能原因有 c .烧瓶中残留有氯气 d .装置B 中液面高于A a .加热使浓盐酸挥发出大量HCl b .盐酸变稀后不发生该反应22.黄铜灰渣(含有Cu 、Zn 、CuO 、ZnO 及少量的FeO 、Fe 2O 3)生产氯化铜晶体的流程如下:3 完全沉淀后,用含Fe 示剂,用0.2000 mol·L -1的KSCN 标准溶液滴定剩余的AgNO 3。
使剩余的Ag +以AgSCN 白色沉淀的形式析出。
①②23.AB固态物质的物质的量/m o l4321焙烧温度/℃图1磷石膏(主要成分是CaSO 4·2H 2O )是磷酸及磷肥类工业在生产过程中产生的一种废渣,我国每年排放的磷石膏大约2000万吨以上,开发利用磷石膏,保护资源和环境,符合持续发展的观念。
下图所示为对磷石膏进行综合利用的路径之一。
(1)过程Ⅰ中CaSO 4·2H 2O 脱水反应相关的热化学方程式为:CaSO 4·2H 2O (s )=CaSO 4·12H 2O (s )+32H 2O (g ) ΔH 1=+83.2 kJ·mol -1CaSO 4·2H 2O (s )=CaSO 4(s )+2H 2O (l ) ΔH 2=+26 kJ·mol -1 H 2O (g )=H 2O (l ) ΔH 3=-44 kJ·mol -1则反应CaSO 4·12H 2O (s )=CaSO 4(s )+ 12H 2O (g )的ΔH 4= kJ·mol -1。
(2)过程Ⅱ用合适的还原剂可以将CaSO 4还原,所得SO 2可用于工业生产硫酸。
① CO 作还原剂,改变反应温度可得到不同的产物。
不同温度下所得固体成分的物质的量如右图1所示。
在低于800 ℃时还原产物为 ;1200 ℃时主要发生的反应的化学方程式为 。
② 高硫煤作还原剂,焙烧 2.5小时,测不同温度下硫酸钙的转化率,如右图2所示。
CaCl 2的作用是 ;当温度高于1200 ℃时,无论有无CaCl 2,CaSO 4的转化率趋于相同,其原因是 。
③以SO 2为原料,工业生产硫酸的化学方程式是 。
(3)过程III 将CaSO 4投入(NH 4)2CO 3溶液中,发生反应的离子方程式是 。
1015S O 2体积分数/%20C a S O 4转化率/%(NH 4)2CO 3 CaSO 4·2H 2O 脱水 还原 ⅡⅠCaSO 4SO 2H 2SO 4(NH 4)2SO 4Ⅲ24.如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
