三大还原剂复习
三大还原剂的性质与运用
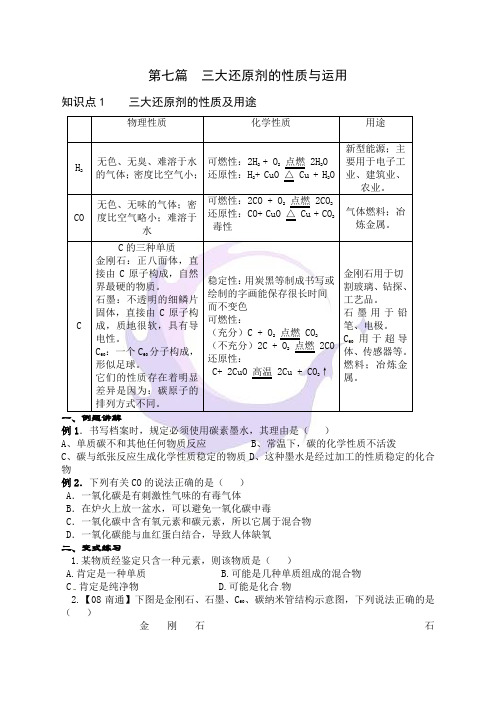
第七篇三大还原剂的性质与运用知识点1 三大还原剂的性质及用途例1.书写档案时,规定必须使用碳素墨水,其理由是()A、单质碳不和其他任何物质反应B、常温下,碳的化学性质不活泼C、碳与纸张反应生成化学性质稳定的物质D、这种墨水是经过加工的性质稳定的化合物例2.下列有关CO的说法正确的是()A.一氧化碳是有刺激性气味的有毒气体B.在炉火上放一盆水,可以避免一氧化碳中毒C.一氧化碳中含有氧元素和碳元素,所以它属于混合物D.一氧化碳能与血红蛋白结合,导致人体缺氧二、变式练习1.某物质经鉴定只含一种元素,则该物质是()A.肯定是一种单质B.可能是几种单质组成的混合物C.肯定是纯净物D.可能是化合物2.【08南通】下图是金刚石、石墨、C、碳纳米管结构示意图,下列说法正确的是60()金刚石石墨 C碳纳米管60A.这四种物质都很软,可作润滑剂B.这四种物质碳原子的排列方式相同C.这四种物质完全燃烧后的产物都是CO2D.这四种物质的结构中都是每个碳原子连接3个碳原子知识点2 三大还原剂还原CuOCO还原剂还原Fe2O3例1.(2011•武汉)实验室里,用如下图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是()A.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成B.实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁C.反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成D.为了减少空气污染,应增加尾气处理装置例2.(2012•株洲)早在春秋战国时期,我国就开始生产和使用铁器.工业上炼铁的原理是利用一氧化碳和氧化铁的反应.某化学兴趣小组利用下图装置进行实验探究,请按要求填空:(1)写出CO还原Fe2O3的化学方程式;(2)实验中盛澄清石灰水的试管中可观察到的现象是;(3)右边导气管口放置点燃的酒精灯的目的是;(4)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸.检验装置中的空气已排尽的方法是.二、变式练习1.【08连云港】将CO通入盛有12 g Fe2O3的试管内,加热反应一段时间后,停止加热,继续通入CO至试管冷却,此时试管内残留固体的质量为9.6g,则反应生成铁的质量为()A.2.4 gB.5.6 gC.8.4 gD.9.6 g2.(07年河北中考)已知A 、B 为两种黑色粉末,D 为红色单质。
高考一轮复习必修123氧化剂与还原剂

C.0.1 mol·L-1
D.0.05 mol·L-1
1.(2009 年宿迁质检)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气 中的 NO2。其反应原理为:
C3N3(OH)3==△===3HNCO 8HNCO+6NO2==△===7N2+8CO2+4H2O 下列说法正确的是( ) A.C3N3(OH)3 与 HNCO 为同一物质 B.HNCO 是一种很强的氧化剂 C.1 mol NO2 在反应中转移的电子为 4 mol D.反应中 NO2 是还原剂
B.Z2 在①③反应中为还原剂 C.氧化性强弱的顺序为:XO-4 >Z2>B2>A3+ D.X2+是 XO-4 的还原产物
解析:关于氧化性:由①得 XO-4 >Z2,由②得 B2 >A3+,由③得 Z2>B2,综上知 C 对,可推得 A 对;由 XO-4 →X2+知 X 元素化合价降低,X2+是还原产物,D 对; ③中 Z2 作氧化剂,B 错。
+
+……
(4)纺织工业中常用氯气作漂白剂,Na2S2O3 可作为漂白后布匹的“脱氯剂”,Na2S2O3 和 Cl2 反应的产物是 H2SO4、NaCl 和 HCl,则还原剂与氧化剂物质的量之比为________。
【解析】 Au2O3 转化为 Au2O 时,Au 元素的化合价降低, 说明在反应中 Au2O3 是氧化剂,在 Na2S4O6 中硫元素的平均化合 价为+2.5 价,Na2S2O3 中硫元素的平均化合价为+2 价,所以 Na2S2O3 应是还原剂,Na2S4O6 是氧化产物。在(4)中 1 mol Na2S2O3 转化为 H2SO4 时失去 8 mol e-,而 1 mol Cl2 转化为 Cl-时得 到 2 mol e-,所以还原剂与氧化剂的物质的量之比为 1∶4。
三大还原剂还原氧化铜

碳、一氧化碳、氢气还原氧化铜实验【知识点的认识】碳、一氧化碳、氢气还原氧化铜实验是初中化学中三个非常重要的典型实验.它们的具体实验情况如下:1.化学反应方程式分别是、和.2.实验装置如图所示:3.操作及注意事项分别是:(1)碳还原氧化铜时,要把刚烘干的碳粉和氧化铜粉末要均匀混合后,平铺在试管底部,试管口略向下倾斜(防止有水倒流到试管底部,使其炸裂),在酒精灯的灯焰上最好加一个网罩(以使火焰集中并提高温度,或者使用酒精喷灯来加热);实验结束时,要先撤出导气管,再移走并熄灭酒精灯,待试管冷却后再把试管内的粉末倒在纸上(防止石灰水倒吸到试管里,炸裂试管;也为了使粉末冷却,防止还原出来的铜再次被氧化).(2)一氧化碳还原氧化铜时,反应前,先通一段时间一氧化碳,然后再加热(目的是为了尽可能的排净玻璃管内的空气,防止一氧化碳与其中的空气混合后,被点燃发生爆炸);反应后,先撤走并熄灭酒精灯,等固体冷却后再停止通一氧化碳(目的是防止石灰水倒吸到玻璃管内,使其炸裂;也为了使固体冷却,防止刚还原出来的铜再次被氧化);并且,由于一氧化碳有毒,如果直接排放到空气中,会造成污染,所以还要用点燃或收集的方法等来处理尾气.(3)氢气还原氧化铜时,反应前,试管口略向下倾斜(防止有水倒流到试管底部,使其炸裂;同时,也有利于氢气在试管底部聚集参与反应),将氢气验纯后先通一段时间氢气,然后再加热(目的是为了尽可能的排净玻璃管内的空气,防止氢气与其中的空气混合后,被点燃发生爆炸);反应后,继续通入氢气,直到试管及其中的固体冷却后,再停止通氢气(目的是为了使固体冷却,防止刚还原出来的铜再次被氧化).4.实验现象分别是:(1)碳还原氧化铜时,试管中的固体由黑色逐渐变成亮红色,澄清的石灰水变浑浊.(2)一氧化碳还原氧化铜时,玻璃管中的固体由黑色逐渐变成亮红色,澄清的石灰水变浑浊,并且有气泡从中不断地溢出.(3)氢气还原氧化铜时,试管中的固体由黑色逐渐变成亮红色,同时管口有水滴生成.下面是实验室制取氧气、氢气、二氧化碳的装置图.根据装置图回答下列问题.(1)写出装置图中标有①、②序号的仪器名称:①是______ ②是______(2)实验室制取氧气选用的装置是______.由于氧气不易溶于水,故可选用______装置收集.(3)实验室收集氢气可选用的装置是______和______.(4)装置B是实验室制取______和______的发生装置.如图是初中化学常见气体(氧气、氢气、二氧化碳)的制取和收集的实验装置,请按要求回答下面问题:(1)若装置A、B组合,可以制取和收集的气体是______(填化学式,下同);若装置A、C组合,可以制取和收集的气体是______;若装置A、D组合,可以制取和收集的气体是______.(2)有的同学认为装置E可以代替装置B、C、D收集气体,欲收集具备下面性质的气体,应如何使用装置E?收集比空气密度大的气体:进气口为______(填“a”或“b”,下同);(3)装置E还可以作为洗气瓶用于干燥某些气体,若干燥氧气,洗气瓶中应装入的试剂是______,进气口为______.下图所示的实验可用于研究可燃物燃烧的条件。
高考氧化还原反应考点汇总(下)

【例1】进行实验。甲:B中大量白色沉淀;乙:B中少量白色沉淀。检验白 色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同 的原因: ___________________________________________________________ ___________________________________________________________。 (5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产 生白色沉淀,由此得出的结论是 __________________________________________________。
Na 性质:还原性 38. 碱金属+H2O 39. Na+CuSO4溶液 40 Na+O 40. N +O2→NaO N O 41 Na+O 41. N +O2→Na N 2O2 09北京选择12 推断题 活泼金属与水反应
13全国II选择10 钠与溶液的反应 12北京选择7 12北京选择7 N 的缓慢氧化 Na Na的剧烈氧化
【例4】 (3)震荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过 量,能观察到的现象是 __________________________________; W的单质与氢氟酸反应生成两 种无色气体,该反应的化学方程式是__________________。
(1)W位于元素周期表第 素 期表第 周期第 期第 族 W的原子半径比 族; 的 半 X的 (填“大”或“小”)。 (2)Z的第一电离能比 的第 电离能比W的 (填“大”或“小”); (填 大 或 小 ); XY2由固态变 为气态所需克服的微粒间作用力是 ;氢元素、X 、Y 的原 子 共同形成多种分子,写 其中 种 形成同种分子间 键 子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名 质 称 。
高三化学氧化剂和还原剂复习PPT教学课件

•(6)依据反应中能量变化判断
•H2+X2===2HX ΔH1<0
•H2+Y2===2HY ΔH2<0 ••(若7)Δ其H它1<因ΔH素2,则X2的氧化性比Y2 •的①氧浓化度性:强浓;度越大,氧化性(或还原性)越 强。 •X-的还原性比Y-的还原性弱。
• 1.在常温下,溶液中发生下列几个反应:
反应;①中 是氧化剂,X2+是还原产物,
• 2. 下列标明电子转移的方向和数目的化 学方程式中正确的是( )
•解析:在氧化还原反应中得失电子守恒, 用双线桥法表示电子转移情况时由反应物
• 3.将SO2通入CuSO4和NaCl的浓溶液中, 溶液颜色变浅,析出白色沉淀,取该沉淀
分析,知其中含Cl:35.7%,Cu:64.3%。
还原
• 在反应中表现
性。 F2、Cl2、Br2、I2、O2
MnO2、NO2
硫酸、硝酸
•
2
.还原剂
FeCl3、KMnO4
是
所
含
元 素 化 合 Na2O2、H2O2
价
或
( 电子)的反应物,在反应中
• 4.常见的还原剂有:Na、活Zn泼的金属单质C、H2
CO
HCl、H2S、H2SO3
等F,eCl某2、N些a2S非O3 金属单质
• 【例1】(2009·潍坊统考)根据反应:2H2S+ O2===2S↓ + 2H2O,4NaI + O2 + 2H2SO4===2I2 +2Na2SO4+2H2O,Na2S+I2===2NaI+S↓, 下列物质的氧化性强弱判断正确的是( )
• A.O2>I2>S
B.H2S>NaI>H2O
• 1.氧化还原反应的表示方法 • (1)双线桥法 • 用箭头表示氧化还原反应中同一元素的
初中化学必背知识点归纳

初中化学必背知识点归纳有关初中化学必背知识点归纳1、构成物质的三种微粒是:分子、原子、离子。
2、还原氧化铜常用的三种还原剂:氢气、一氧化碳、碳。
3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。
4、构成原子一般有三种微粒:质子、中子、电子。
5、溶液的特征有三个(1)均一性;(2)稳定性;(3)混合物。
6、收集气体一般有三种方法:排水法、向上排空法、向下排空法。
7、水污染的三个主要原因:(1)工业生产中的废渣、废气、废水;(2)生活污水的任意排放;(3)农业生产中施用的农药、化肥随雨水流入河中。
8、固体物质的溶解度随温度变化的情况可分为三类:(1)大部分固体物质溶解度随温度的升高而增大;(2)少数物质溶解度受温度的影响很小,如NaCl;(3)极少数物质溶解度随温度的升高而减小,如Ca(OH)2。
9、CO2可以灭火的原因有三个:不能燃烧、不能支持燃烧、密度比空气大。
10、当今世界上最重要的三大矿物燃料是:煤、石油、天然气。
11、氢气和碳单质有三个相似的化学性质:常温下的稳定性、可燃性、还原性。
12、过滤操作中有“三靠”:(1)漏斗下端紧靠烧杯内壁;(2)玻璃棒的末端轻靠在滤纸三层处;(3)盛待过滤液的烧杯边缘紧靠在玻璃捧引流。
过滤失败的三个原因:(1滤纸被捅破;(2)滤液高于滤纸边缘;(3)承接容器不干净。
13、三大气体污染物:SO2、CO、NO2。
14、酒精灯的火焰分为三部分:外焰、内焰、焰心,其中外焰温度。
15、取用药品“三不”原则:(1)不用手接触药品。
(2)不把鼻子凑到容器口闻气体气味。
(3)不尝药品的味道。
16、可以直接加热的三种仪器:试管、坩埚、蒸发皿(另外还有燃烧匙)。
17、质量守恒解释的原子三不变:原子种类不改变、数目不增减、质量不变化。
18、三大有机合成材料:合成纤维、塑料、合成橡胶。
19、溶液配制的三步骤:计算、称量(量取)、溶解。
20、原子中的三等式:核电荷数=质子数=核外电子数=原子序数。
高考化学一轮复习--氧化剂-还原剂

第 3 节氧化剂和还原剂【基础知识梳理】一、氧化还原反应1.元素化合价在化学反应中的变化(1)化合价:化合价是认识氧化还原的前提与基础。
Ⅰ规则:①在化合物中,正负化合价的代数和为零;②单质中,元素的化合价为零。
Ⅱ本质:a 化合价的正与负:失去电子或共用电子对偏离呈正价;得到电子或共用电子对偏向呈负价。
b 化合价的数值:化合价的数值等于得、失电子(或共用电子对)的数目。
c 化合价的变动:元素在氧化还原反应中,得到电子,化合价降低;失去电子,化合价升高。
Ⅲ有关规律:a 金属元素一般没有负化合价,除零价外,只显正价,因为在反应中只能失去电子。
b 非金属元素(除氧、氟外)在反应中既可得到电子,亦可失去电子,故既可呈正价,也能显负价。
c 氧、氟的非金属性很强,在反应中一般不失去电子,故一般没有正化合价。
d 显最高化合价的元素,在反应中只能得电子而不能失电子,故发生氧化还原反应化合价只能降低。
相反,显最低化合价的元素,在反应中化合价只能升高。
(2)基本概念①氧化反应和还原反应:反应物所含元素化合价升高(或者说是物质失去电子)的反应称为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。
②氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学反应叫做氧化还原反应。
说明:氧化反应和还原反应是一对对立的反应,而又统一存在于一个反应中,不能分割,所以人们把这两种同时存在的一个化学反应叫做氧化还原反应。
四种基本反应类型和氧化还原反应的关系反应类型氧化—还原反应非氧化—还原反应化合反应2Na+Cl2=2NaCl(有单质参加)CaO+H2O=Ca(OH)2(没有单质参加)分解反应2H2O2=2H2O+O2↑(有单质生成)H2CO3=H2O+CO2↑(没有单质生成)置换反应Zn+2HCl=ZnCl2+H2↑复分解反应H2SO4+Ba(OH)2=BaSO4↓+2H2O2.氧化还原反应的实质(1)研究表明,所有的氧化还原反应中都存在着电子的转移,电子的转移是氧化还原反应的实质。
九年级上化学知识点总结(推荐15篇)

九年级上化学知识点总结第1篇1、构成物质的三种微粒是:分子、原子、离子。
2、还原氧化铜常用的三种还原剂:氢气、一氧化碳、碳。
3、氢气作为燃料有三大优点:资源丰富、发热量高、燃烧后的产物是水不污染环境。
4、构成原子一般有三种微粒:质子、中子、电子。
5、黑色金属只有三种:铁、锰、铬。
6、通常使用的灭火器有三种:泡沫灭火器;干粉灭火器;液态二氧化碳灭火器。
7、酒精灯的火焰分为三部分:外焰、内焰、焰心,其中外焰温度最高。
8、空气污染的危害、保护:危害:严重损害人体健康,影响作物生长,破坏生态平衡.全球气候变暖,臭氧层破坏和酸雨等。
保护:加强大气质量监测,改善环境状况,使用清洁能源,工厂的废气经处理过后才能排放,积极植树、造林、种草等。
9、水的净化效果由低到高的是静置、吸附、过滤、蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭。
10、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
九年级上化学知识点总结第2篇1、“观”即观察,观察一般应遵循“反应前──反应中——反应后”的顺序进行,反应前观察反应物的颜色、状态、气味产生的各种现象;反应中观察反应条件及反应过程中的各种现象;反应后观察生成物的颜色、状态、气味。
最后针对观察到的各种现象在老师的引导下进行分析、判断、综合、概括,得出科学结论,观察后要用最准确的语言表达出来,达到理解、掌握知识的目的。
2、“动”“动”即积极动手实验。
俗话说:“百闻不如一见,百看不如一验”,亲自动手实验不仅能培养自己的动手能力,而且能加深我们对知识的认识、理解和巩固,成倍提高学习效率。
例如,实验室制氧气的原理和操作步骤,动手实验比只凭看老师做和自己硬记要掌握得快且牢得多。
做实验前一定要了解,最后认真分析,分析实验结果和结论。
3、“记”化学在同学们脑中;“记’即记忆。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C还原CuO:
原理:
高温 C+CuO====Cu+CO 2
装置:
丙
固固加热型 试管口略向下
。
现象:
黑 色CuO变成 红 色,澄清石灰水变 浑浊
步骤: 反应后:先将导管从石灰水中取出,再熄灭酒精灯
目的:防止石灰水倒吸,使试管破裂
金属的冶炼
比一比,议一议:三个装置的相同点和不同点
加热 1、三个装置都要_________ ; 检验反应产物CO2 乙、丙装置中,澄清石灰水的作用都是______________ 。
碳还可以在高温下与CO2反应,生成CO 除杂:
CO(CO2)?
C CO2 CO
CO2(CO)?
干燥的CO
1.有下列实验现象可知,黑色粉末是(
)
A.CuO
B. C
C.CuO和C
D.Fe2O3和C
2、某学生在实验室还原8g氧化铜,需消耗氢气 的质量为( B) A 8g B 大于0.2g C 小于0.2g D 0.2g
金属的冶炼
高炉炼铁
H2还原CuO反应: △ 原理: H2+CuO===Cu+H2O 装置: 甲
验纯→通H2→加热
现象: 黑色CuO变成红色,试管口有水珠。
步骤:
装置要点:
实验前:先通H2,再加热CuO (排完试管内的空气,防止爆炸) 实验后: 先停止加热,继续通H2至试管冷却 (防止灼热的铜,被空气中的O2重新氧化) (目的:防止小水珠倒流,使试管破裂)
略向下倾斜 , 2、甲、丙装置中,试管口都______________ 试管口的区别是_____________ 。 甲不能用橡皮塞,丙有橡皮塞 尾气处理 装置。 3、乙装置有___________ 燃烧法 、气囊收集法 (原因:CO______ ) 有毒;处理方法:_________________
。
克。
习题e百P37 第13题
FeCl3
① ④
⑤
Fe3O4
⑥ ⑨ ⑩
Fe
② ③ ⑧
⑦
Fe2O3
FeCl3
⑾
Fe(OH)3
FeCl2
FeS
反应前 玻璃管和氧化铁的 A组 质量43.7克 氧化铁完全反应后 玻璃管和剩余固体 的质量41.3克
烧杯和澄清石灰水 的质量180克 试回答:
B组
烧杯和烧杯中物质 的质量186.2克
__ 组的实验数据来计算样品中氧化铁 。
(1)你认为:应当选择
的质量分数,计算的结果为
(2)该实验装置的不足之处是
(3)完全反应后,生成碳酸钙为
3、下图为CO还原氧化铜的装置 ①实验过程中观察到的现象是: CuO变成红色的固体 在(a)玻璃管内黑色的 ________________________ 、 在(b)管内 澄清的石灰水变浑浊 。 ②点燃(b)管中导出CO气体的优点是: 既处理了尾气,又利用了尾气燃烧产 。 生的热量来加热。
4、为了测定样品中氧化铁的质量 CO 分数,某同学称取样品10克,进行 实验,得到如下两组数据:
1、试管口略向下倾斜
2、导管通到试管底部 (目的:将试管内的空气排尽,防止爆炸)
CO还原CCuO====Cu+CO2
燃烧法
后面的酒精灯先点燃, 后熄灭
澄清石灰水
现象: 黑色CuO变成红色,澄清石灰水变浑浊。 步骤: 实验前-- 先通CO,再加热CuO
(目的:排尽空气,防止爆炸) 实验后—先停止加热,再继续通CO至试管冷却, (防止灼热的铜,被空气中的O2重新氧化)
