各类有机物的转化关系图
高三有机化学中有机物间相互转化关系图

高三有机化学中有机物间相互转化关系图高三有机化学中有机物间相互转化关系图Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑸ 天然橡胶(聚异戊二烯) 2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐)⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2 ⑷ Zn 、Mg 等单质如⑸ -1价的I (氢碘酸及碘化物)变色⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;变色Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃(烯烃、炔烃、二烯烃等)⑵不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)⑶石油产品(裂化气、裂解气、裂化汽油等)⑷醇类物质(乙醇等)⑸含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑹天然橡胶(聚异戊二烯)⑺苯的同系物2、无机物:⑴氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物)⑵ + 2价的Fe(亚铁盐及氢氧化亚铁)⑶-2价的S(硫化氢及硫化物)⑷ + 4价的S(二氧化硫、亚硫酸及亚硫酸盐)⑸双氧水(H2O2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A)官能团:无;通式:C n H2n+2;代表物:CH4B) 结构特点:键角为109°28′,空间正四面体分子。
高三有机化学中有机物间相互转化关系图全解
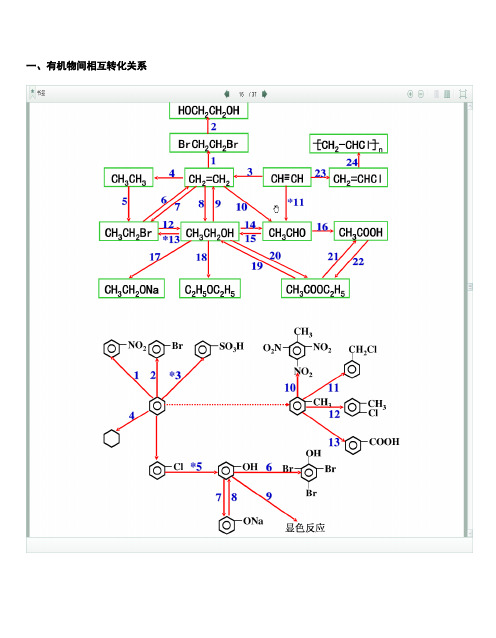
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
初中化学物质转化关系图 (2)

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O↘MgO HClKClO3↗↓↘Al2O3Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡↗BaCl2→ BaSO4↓(白)BaO → Ba(OH)2↗↘ + CuS O4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO2↙↘ Ca(HCO3)2 →CaCO3→CaO;..;.. CuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2ONaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 28、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2 CaCO 3 ⑸ ⑹ ⑺ ⑻ CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 32 NaOH NH 4ClNH 3 ⑼ ⑽ ⑾ ⑿。
常见物质的转化关系网络图

常见物质的转化关系网络图一、钠及其化合物之间的相互转化SO2(20)HCl(13)/Cl2(19) CO2(12)H2O(10)C a(O H)2(11)NaOHH2O(8)H2O(9)O2 (1)O2(2)CO2(3)CO2(6)Na Na2O Na2O2Na2CO3NaHCO3NaOH/△(7)O2点燃(4)HCl(14)HCl(15)Cl2(17)CO2(5)NaCl电解(18)先通NH3再通CO2 (16)粗盐提纯(含有泥沙、Ca2+、Mg2+、SO42-)涉及的化学方程式:(1)4Na+O2=2Na2O(白色固体)(2)2Na2O+O2=2Na2O2(淡黄色固体)(3)2Na2O2+2CO2=2Na2CO3+O2(作为潜水艇供氧剂的原理)(4)2Na+O2Na2O2(5)Na2O+ CO2= Na2CO3(6)Na2CO3+CO2+H2O=2NaHCO3(除去NaHCO3溶液中的少量Na2CO3)(7)NaHCO3+NaOH=Na2CO3+H2O(除去Na2CO3溶液中...的少量NaHCO3)2 NaHCO3Na2CO3+ CO2 +H2O(除去Na2CO3固体中...的少量NaHCO3)(俗名:碳酸钠—纯碱碳酸氢钠-小苏打)(8)Na2O+H2O= 2NaOH(9)2Na2O2+2H2O =4NaOH +O2(10)2Na+2H2O=2NaOH+H2 [现象:浮、熔、游、响、红(滴加酚酞的溶液)](11)Na2CO3+C a(O H)2=CaCO3 +2NaOH(土法炼碱原理)(12) 2NaOH+CO2(少量)= Na2CO3+H2O(13)NaOH+HCl=NaCl+H2O(14) Na2CO3+2HC l(足量)=2NaCl+CO2 +H2O 可用互相滴加的方法鉴别(15) NaHCO3+HCl(少量)=NaCl+CO2 +H2O 盐酸和碳酸钠溶液(16)NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3( 2 NaHCO3Na2CO3+ CO2 +H2O ) (侯氏制碱法原理)(17)2Na+Cl22NaCl(现象:白烟)(18)2NaCl(熔融)2Na+Cl2 (工业制金属钠的方法)(19)Cl2+2NaOH=NaCl+NaClO+H2O(氯气的尾气处理原理)(20)SO2+2NaOH=Na2SO3+H2O(二氧化硫尾气的处理原理)二、镁及其化合物之间的转化(6)CO2MgO(5)O2(7)HCl (8)△(10)N2 (1)HCl (3) Ca(OH)2Mg3N2Mg MgCl2Mg(OH)2 (11)H2O (2)通电(4)HCl(9)H2O、△涉及的化学方程式:(1)Mg+2HCl=MgCl2+H2 (典型的放热反应)(2) MgCl2Mg+Cl2 (工业上制取金属镁的方法)(3)MgCl2+Ca(OH)2=Mg(OH)2 +CaCl2(从海水中提取镁的第一步反应)(4) Mg(OH)2 +2HCl= MgCl2+2H2O(5) 2Mg+O22MgO(现象:耀眼的白光用途:提供光照条件)(6)2Mg+CO22MgO+C(说明二氧化碳也可以支持燃烧)(7) MgO+2HCl=MgCl2+H2O(8) Mg(OH)2MgO+H2O(9) Mg+2H2O Mg(OH)2 +H2(2Na+2H2O=2NaOH+H2 剧烈反应Al+H2O不反应,利用三者与水反应的差异比较金属性强弱)(10)3Mg+N2Mg3N2(说明氮气也可以支持燃烧)(11) Mg3N2+6H2O=3Mg(OH)2 +2NH3三、硫及其化合物之间的相互转化(16)O2(13)SO2Na2SO43NaOH (5)O2 (6)H2OSO3(1)H2(2)O2(9)Na2SO3H2S S SO2H2SO4(3)O2(10)Cu(11)C(14)CaO H2SO3(19)H2SO4(18)Fe (17)Hg (18)O2CaCO3 (7)H2O (8O2(15)O2CaSO423涉及到的化学方程式(1)S+H2H2S(2)S+O2SO2(现象:空气中—淡蓝色火焰;纯氧中-蓝紫色火焰)(3)2H2S+O2(不足) 2S+2H2O(4)2H2S+SO2=3S +2H2O(体现二氧化硫氧化性的)(5)2SO2+O22SO3(空气中催化剂可以为灰尘,工业上采用V2O5作为催化剂)(6)SO3+H2O=H2SO4(7)SO2+H2O=H2SO3 酸雨形成的两条途径(8)H2SO3+O2= H2SO4(9)Na2SO3+H2SO4Na2SO4+SO2 +H2O(实验室制SO2的方法,由于SO2的溶解度较大,所以使用Na2SO3固体和浓硫酸在加热条件下反应,体现硫酸的强酸性)(10)Cu+2H2SO4(浓)CuSO4+SO+2H2O(硫酸体现酸性和强氧化性)思考一:1、实验现象?2、如何检验产物(CuSO4和SO2))3、硫酸体现什么性?4、被还原和未被还原硫酸的物质的量之比为多少?5、含溶质2mol的浓硫酸与足量的铜反应,被还原的硫酸为多少?(11)C+2H2SO4(浓)CO2 +2SO2 +2H2O(硫酸体现强氧化性)思考二:1、如何设计实验依次检验出此反应的产物?2、蔗糖里加浓硫酸,再加少量水,不断的搅拌,现象?体现硫酸的什么性质? (12)SO2(少量)+2NaOH= Na2SO3+H2O(含二氧化硫尾气的处理方法)(13)Na2SO3+SO2+H2O=2NaHSO3(14)SO2+CaO CaSO3(15)2CaSO3+O2=2CaSO4 (钙基固硫原理,将二氧化硫最终变为石膏)(16)2Na2SO3+O2= 2Na2SO4思考三:1、暴露在空气中亚硫酸钠固体可能含有什么杂质?2、如何检验亚硫酸钠是否变质?3、如何设计定量测定已部分变质的亚硫酸钠固体的纯度?(17)S+Hg=HgS(实验室处理洒落水银的方法)(18)S+Fe Fe+2S 说明氯气的氧化性比硫单质强(3Cl2+2Fe2Fe+3Cl3)(19)FeS+H2SO4(稀)=FeSO4+H2S (实验室制备H2S的方法,体现硫酸的强酸性) (20)4FeS2+11O22Fe2O3+8SO2(2SO2+O22SO3 SO3+H2O=H2SO4))工业制硫酸的原理。
高中高三有机化学中有机物间相互转化关系图.docx

一、有机物间相互转化关系二、能与澳水发生化学反应而使澳水褪色或变色的物质1、有机物:(1)不饱和姪(烯炷、烘桂、二烯姪等)(2)不饱和坯的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)(3)石油产品(裂化气、裂解气、裂化汽油等)(4)含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)(5)天然橡胶(聚异戊二烯)2、无机物:(1)一2价的S (硫化氢及硫化物)(2)+4价的S (二氧化硫、亚硫酸及亚硫酸盐)(3)+ 2 价的Fe6FeSO4 4- 3Br2 = 2Fe2(SO4)3 + 2FeBrrj6FeCl + 3Br 二4FeCl + 2FeBr L 变色2FeI + 3Br = 2FeBr + 21 ' J2 23 2 △(4)Zn、Mg等单质女fl Mg + Br 2 === MgBr 2 (其中亦有Mg与H + . Mg与HBrO的反应)(5)-1价的I (氢碘酸及碘化物)变色(6)NaOH 等强碱、N32CO3 和AgNO 3 等盐Br2 + H2O = HBr + HBrO2HBr + Na2COs = 2NaBr + CO2 t + H2OHBrO + Na2CO3 = NaBrO + NaHCOs三、能萃取澳而使澳水褪色的物质上层变无色的(P >1):卤代桂(CC14、氯仿、澳苯等)、CS2等;下层变无色的(p VI):直徭汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷桂、液态饱和桂(如己烷等)等四、能使酸性高镭酸钾溶液褪色的物质1、有机物:(1)不饱和桂(烯坯、块桂、二烯坯等)(2)不饱和桂的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)(3)石油产品(裂化气、裂解气、裂化汽油等)(4)醇类物质(乙醇等)(5)含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)(6)天然橡胶(聚异戊二烯)(7)苯的同系物2、无机物:(1)酸及化物(漠酸、碘酸、酸、漠化物、碘化物) ⑵+ 2价的Fe (及氧化)(3) -2价的S (硫化及硫化物)⑷+ 4价的S (二氧化硫、硫酸及硫酸) ⑸双氧水(H2O2)五、常的各有机物的官能,构特点及主要化学性(1)A ) 官能:无;通式:CnH2n+2;代表物:CH4B )构特点:角109° 28, z 空正四面体分子。
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
高三有机化学中有机物间相互转化关系图

高三有机化学中有机物间相互转化关系图(共9页)-本页仅作为预览文档封面,使用时请删除本页-一、有机物间相互转化关系23二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 3 2FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应) △42、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
o有机物转化关系图

将下列19种有机化合物设计成物质转化关系图。CH3CH3、CH2=CH2、CH≡CH、CH3CH2Br、BrCH2CH2Br、C2H5OH、HOCH2CH2OH、
CH3CHOOHCCHO、CH3COOH、HOOCCOOH、CH3COOCH2CH3、CH3CH2ONa
已知:乙炔在一定条件下能三聚成苯;溴苯在高温、高压条件下,可以与氢氧化钠溶液反应得到苯酚钠。
要求:1、字迹工整、版面美观、创意新颖;2、物质间只允许用直箭头或可逆符号。不允许用折线箭头,更不能交叉;
3、在箭头上或下用①、②、③、④、⑤……标清序号;4、按序号在下面写出两种物质之间转化关系对应的反应方程式,写清反应条件。
重要有机化合物转化关系图
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
用于备课的资料
各类有机物的转化关系图:
1. 常见官能团与性质
官能团结构性质
碳碳双键易加成、易氧化、易聚合
碳碳三键易加成、易氧化、易聚合
卤素(X=Cl、Br等)
易取代(如溴乙烷与NaOH水溶液共热生成乙醇)、易消去(如
溴乙烷与NaOH醇溶液共热生成乙烯)
醇羟基易取代、易消去(如乙醇在浓硫酸、170℃条件下生成乙烯)、易催化氧化(如乙醇在酸性K2Cr2O7溶液中被氧化为乙醛甚至乙酸)
酚羟基极弱酸性(酚羟基中的氢与NaOH溶液反应,但酸性极弱,不能使指示剂变色)、易氧化(如无色的苯酚晶体易被空气中的氧气氧化为粉红色)、显色反应(如苯酚遇FeCl3溶液呈紫色)、苯酚遇浓溴水产生白色沉淀
醛基易氧化(如乙醛与银氨溶液共热生成银镜)
羰基
易还原(如在Cu/Ag 催化加热条件下还原为)羧基
酸性(如乙酸的酸性强于碳酸,乙酸与NaOH溶液反应)、易取
代(如乙酸与乙醇在浓硫酸、加热条件下发生酯化反应) 酯基
易水解(如乙酸乙酯在稀硫酸、加热条件下发生酸性水解,
乙酸乙酯在NaOH溶液、加热条件下发生碱性水解)
烷氧基如环氧乙烷在酸催化下与水一起加热生成乙二醇
硝基还原(如酸性条件下,硝基苯在铁粉催化下还原为苯胺)
2. 有机反应类型与重要的有机反应
反应类型重要的有机反应
取代反应烷烃的卤代:CH4+Cl2CH3Cl+HCl
烯烃的卤代:
卤代烃的水解:CH3CH2Br+NaOH CH3CH2OH+NaBr
皂化反应:+3NaOH3C17H35COONa+
酯化反应:+C2H5OH+H2O 糖类的水解:
122211
C H O
蔗糖+H2O
6126
C H O
果糖+
6126
C H O
葡萄糖
二肽的水解:+H2O
取代反应
苯环上的卤代:+Cl2+HCl
苯环上的硝化:++H2O
苯环上的磺化:++H2O
(续表)
反应类型重要的有机反应
加成反应
烯烃的加成:+HCl
炔烃的加成:+H2O
苯环的加氢:+3H2
消去反应
醇分子内脱水生成烯烃:C2H5OH+H2O
卤代烃脱HX生成烯烃:CH3CH2Br+NaOH+NaBr+H2O
加聚反应单烯烃的加聚:
n
共轭二烯烃的加聚:
(此外,需要记住丁苯橡胶、氯丁橡胶的单体)
缩聚反应
二元醇与二元酸之间的缩聚:
n+nHOCH2CH2OH+2nH2O 羟基酸之间的缩聚:+nH2O
缩聚
反应
氨基酸之间的缩聚:
苯酚与HCHO的缩聚:n+nHCHO+nH2O
氧化反应催化氧化:2CH3CH2OH+O22CH3CHO+2H2O
醛基与银氨溶液的反应:
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O(注意配平)
醛基与新制氢氧化铜的反应:CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
还原
反应
醛基加氢:CH3CHO+H2CH3CH2OH
硝基还原为氨基:。
